促红细胞生成素对血管紧张素Ⅱ诱导的系膜细胞增殖及Ⅰ/Ⅳ型胶原和纤维连接蛋白表达的影响研究
季 芬,徐玉音,范亚平,王 锋,杨 斌
·论著·
促红细胞生成素对血管紧张素Ⅱ诱导的系膜细胞增殖及Ⅰ/Ⅳ型胶原和纤维连接蛋白表达的影响研究
季 芬,徐玉音,范亚平,王 锋,杨 斌
目的 探讨促红细胞生成素(EPO)对血管紧张素Ⅱ(Ang Ⅱ)诱导的系膜细胞增殖及Ⅰ型胶原(ColⅠ)、Ⅳ型胶原(Col Ⅳ)和纤维连接蛋白(FN)表达的影响。方法 将体外培养大鼠肾小球系膜细胞分为4组:对照组,AngⅡ组(0.1、1.0、10.0 μmol/L),EPO组(1、10、100 U/L),AngⅡ+EPO组(EPO 1、10、100 U/L预处理1 h后加AngⅡ 1.0 μmol/L)。各组处理0、24、48 h时,CCK-8法检测系膜细胞增殖情况,免疫印迹法检测系膜细胞ColⅠ、Col Ⅳ和FN蛋白表达水平,ELISA法检测系膜细胞培养上清液中ColⅠ、Col Ⅳ和FN蛋白水平。结果 单独给予AngⅡ或EPO均可刺激系膜细胞增殖,AngⅡ组亚组和EPO组亚组24、48 h时系膜细胞增殖水平均高于对照组,且48 h时高于24 h时,24 h时高于0 h时,差异均有统计学意义(P<0.05);单独给予AngⅡ或EPO均可促进系膜细胞合成及分泌ColⅠ、Col Ⅳ和FN,除EPO 1 U/L亚组Col Ⅰ蛋白表达水平与对照组间差异无统计学意义(P>0.05)外,AngⅡ组亚组和EPO组其他亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均高于对照组,差异有统计学意义(P<0.05)。与AngⅡ1.0 μmol/L+EPO 1 U/L亚组比较,AngⅡ1.0 μmol/L+EPO 10 U/L亚组和AngⅡ1.0 μmol/L+EPO 100 U/L亚组在24、48 h时系膜细胞增殖水平及ColⅠ、Col Ⅳ和FN蛋白表达水平均下降,差异有统计学意义(P<0.05),但与对照组及同浓度单纯EPO亚组比较,AngⅡ1.0 μmol/L+EPO组各亚组24、48 h时系膜细胞增殖水平及ColⅠ、Col Ⅳ和FN蛋白表达水平均增高,差异有统计学意义(P<0.05)。结论 Ang Ⅱ能刺激系膜细胞增殖,促进系膜细胞合成及分泌ColⅠ、Col Ⅳ和FN,EPO亦有一定程度类似作用,但两者同时存在时,EPO可拮抗AngⅡ诱导的系膜细胞增殖及ColⅠ、Col Ⅳ和FN的合成及分泌,提示EPO除可纠正肾性贫血外,可能对AngⅡ诱导的肾小球硬化具有抑制作用而保护肾功能。
促红细胞生成素;血管紧张素Ⅱ;肾小球系膜细胞;胶原Ⅰ型 ;胶原Ⅳ型;纤连蛋白类
季芬,徐玉音,范亚平,等.促红细胞生成素对血管紧张素Ⅱ诱导的系膜细胞增殖及Ⅰ/Ⅳ型胶原和纤维连接蛋白表达的影响研究[J].中国全科医学,2015,18(26):3177-3181.[www.chinagp.net]
Ji F,Xu YY,Fan YP,et al.Effects of erythropoietin on ang Ⅱ-induced mesangial cell proliferation and the expression levels of col Ⅰ,Col Ⅳ and FN[J].Chinese General Practice,2015,18(26):3177-3181.
促红细胞生成素(EPO)是哺乳动物调节红细胞生成的主要因子,出生后主要产生于肾脏,基本生理功能是刺激骨髓红细胞生成和释放;重组EPO是慢性肾衰竭贫血治疗的重大进展,目前已在临床广泛应用。近来研究显示,EPO可通过减轻足细胞损伤及改善肾小球内皮细胞功能而减轻或延缓肾小球硬化[1-2]。系膜细胞是肾小球固有细胞,其增殖及Ⅰ型胶原(Col Ⅰ)、Ⅳ型胶原(Col Ⅳ)、纤维连接蛋白(FN)等系膜细胞外基质(ECM)成分的过度合成和积聚在肾小球硬化过程中具有重要的病理作用,但鲜有EPO与肾小球系膜细胞及肾小球硬化相关的研究报道。本研究拟采用体外培养肾小球系膜细胞分别予不同浓度血管紧张素Ⅱ(AngⅡ)或EPO单用及共同刺激,观察肾小球系膜细胞增殖、ECM有关成分合成与分泌的改变,探讨EPO对AngⅡ刺激所致肾小球系膜细胞增殖与ECM聚积的影响。
1 材料与方法
1.1 材料 大鼠肾小球系膜细胞株HBZY-1由中国典型培养物保藏中心提供,DMEM培养基购自美国Gibco BRL公司,胎牛血清购自美国Invitrogen公司,胰蛋白酶购自美国Sigma公司,AngⅡ购自美国Enzo公司,EPO购自山东阿华生物药业有限公司,兔抗鼠ColⅠ抗体购自美国Santa Cruz公司,兔抗鼠Col Ⅳ抗体、兔抗鼠FN抗体购自美国Immunoway公司,兔抗鼠β-actin抗体、辣根过氧化物酶标记的羊抗兔IgG二抗购自上海碧云天生物技术研究所,大鼠ColⅠ、Col Ⅳ及FN ELISA检测试剂盒购自美国R&D公司。
1.2 细胞培养与分组干预 DMEM培养液(含10%胎牛血清)培养大鼠系膜细胞;待80%融合予无血清培养24 h使细胞同步化后分为4组:对照组,AngⅡ组(0.1、1.0、10.0 μmol/L),EPO组(1、10、100 U/L),AngⅡ+EPO组(EPO 1、10、100 U/L预处理1 h后加AngⅡ 1.0 μmol/L)。
1.3 CCK-8法检测大鼠系膜细胞增殖 系膜细胞以每孔5×104的密度接种于96孔板,贴壁生长至80%融合后分组予干预处理48 h,于0、24、48 h时加CCK-8 10 μl /孔,37 ℃避光孵育2 h,采用酶标仪于450 nm波长测定各孔吸光度(A)值。
1.4 免疫印迹法检测系膜细胞合成ColⅠ、Col Ⅳ和FN蛋白的水平 系膜细胞培养至80%融合按上述分组予干预处理48 h,4 ℃ 0.01 mmol/L PBS洗涤3次,弃上清液;加细胞裂解液冰上孵育30 min,离心后取上清液测定蛋白浓度,取等量蛋白SDS-PAGE电泳并转移至PVDF膜,5% BSA封闭2 h,TBST洗涤3次,分别加入兔抗鼠ColⅠ、Col Ⅳ、FN抗体(1∶1 000)4 ℃孵育过夜。TBST洗涤3次,用辣根过氧化物酶标记的羊抗兔IgG(1∶1 000)室温孵育2 h,TBST洗涤3次,BIO-RAD显影仪显影,用Image J图像分析软件扫描并测定灰度值,以目的蛋白灰度值与β-actin灰度值的比值与对照组灰度比值的百分比表示。
1.5 ELISA法检测细胞培养上清液中ColⅠ、Col Ⅳ和FN蛋白水平 取对数生长期系膜细胞以每孔1×105的密度接种于6孔板,分组予干预处理48 h,提取上清液,按照ELISA试剂盒说明书测定ColⅠ、Col Ⅳ和FN蛋白水平,采用酶标仪于450 nm波长测定各孔吸光度(A)值。
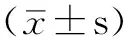
2 结果
2.1 AngⅡ或EPO对大鼠系膜细胞增殖的影响 单独给予AngⅡ或EPO均可刺激系膜细胞增殖,AngⅡ组和EPO组各亚组24、48 h时系膜细胞增殖水平均高于对照组,且48 h时高于24 h时,24 h时高于0 h时,差异均有统计学意义(P<0.05)。
与AngⅡ1.0 μmol/L亚组比较,AngⅡ1.0 μmol/L+EPO 10 U/L亚组和AngⅡ1.0 μmol/L+EPO 100 U/L亚组在24、48 h时系膜细胞增殖水平均下降,差异有统计学意义(P<0.05);与同浓度EPO亚组比较,AngⅡ+EPO组各亚组24、48 h时系膜细胞增殖水平增高,差异有统计学意义(P<0.05,见表1)。
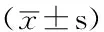
Table 1 Comparison of mesangial cell proliferation level among all groups at different times
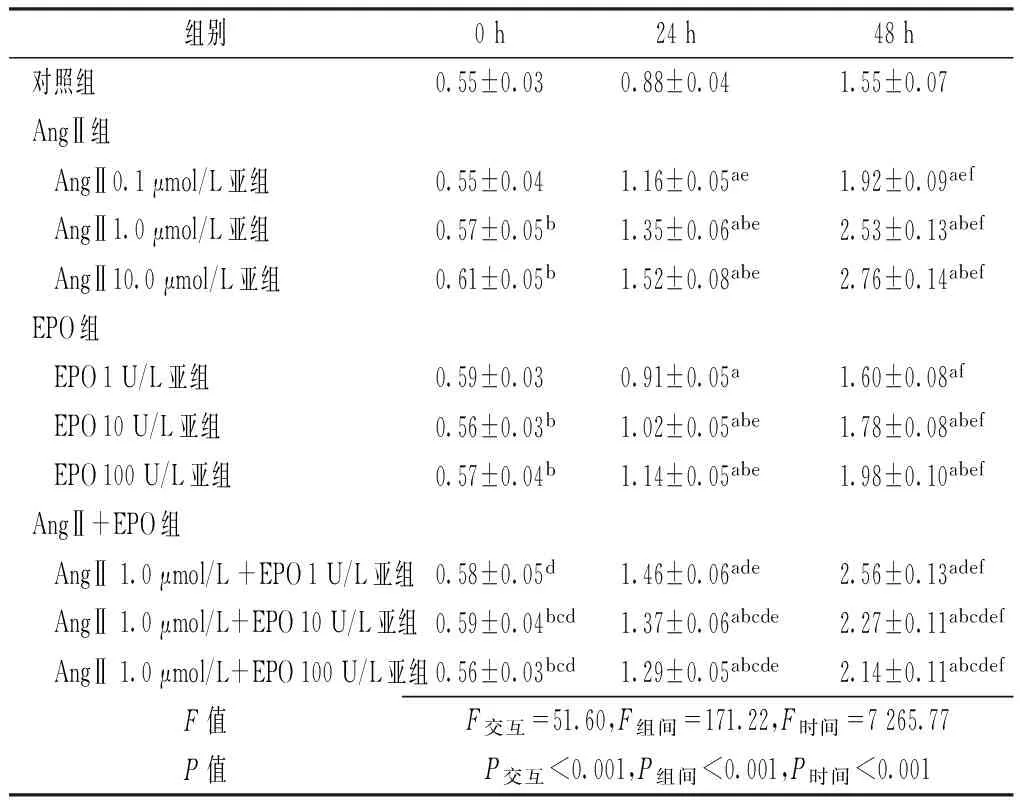
组别0h24h48h对照组0.55±0.030.88±0.041.55±0.07AngⅡ组 AngⅡ0.1μmol/L亚组0.55±0.041.16±0.05ae1.92±0.09aef AngⅡ1.0μmol/L亚组0.57±0.05b1.35±0.06abe2.53±0.13abef AngⅡ10.0μmol/L亚组0.61±0.05b1.52±0.08abe2.76±0.14abefEPO组 EPO1U/L亚组0.59±0.030.91±0.05a1.60±0.08af EPO10U/L亚组0.56±0.03b1.02±0.05abe1.78±0.08abef EPO100U/L亚组0.57±0.04b1.14±0.05abe1.98±0.10abefAngⅡ+EPO组 AngⅡ1.0μmol/L+EPO1U/L亚组0.58±0.05d1.46±0.06ade2.56±0.13adef AngⅡ1.0μmol/L+EPO10U/L亚组0.59±0.04bcd1.37±0.06abcde2.27±0.11abcdef AngⅡ1.0μmol/L+EPO100U/L亚组0.56±0.03bcd1.29±0.05abcde2.14±0.11abcdefF值F交互=51.60,F组间=171.22,F时间=7265.77P值P交互<0.001,P组间<0.001,P时间<0.001
注:AngⅡ=血管紧张素Ⅱ,EPO=促红细胞生成素;与同时间点对照组比较,aP<0.05;与同时间点、同组前一浓度亚组比较,bP<0.05;与同时间点单用AngⅡ1.0 μmol/L亚组比较,cP<0.05;与同时间点、同浓度单用EPO亚组比较,dP<0.05;与同亚组0 h比较,eP<0.05;与同亚组24 h比较,fP<0.05
2.2 免疫印迹法检测大鼠系膜细胞ColⅠ、Col Ⅳ和FN蛋白表达 单独给予AngⅡ或EPO均可刺激系膜细胞合成ColⅠ、Col Ⅳ和FN,除EPO 1 U/L亚组Col Ⅰ 蛋白表达水平与对照组间差异无统计学意义(P>0.05)外,AngⅡ组亚组和EPO组其他亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均高于对照组,差异均有统计学意义(P<0.05,见表2)。
与AngⅡ1.0 μmol/L+EPO 1 U/L亚组比较,AngⅡ 1.0 μmol/L+EPO 10 U/L亚组和AngⅡ 1.0 μmol/L+EPO 100 U/L亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均下降,差异有统计学意义(P<0.05)。与同浓度单用EPO亚组比较,AngⅡ+EPO组各亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均增高,差异有统计学意义(P<0.05,见表2、图1)。
2.3 ELISA法检测细胞培养上清液中ColⅠ、Col Ⅳ和FN蛋白水平 单独给予AngⅡ或EPO均可刺激系膜细胞分泌ColⅠ、Col Ⅳ及FN,除EPO 1 U/L亚组FN表达水平与对照组间差异无统计学意义(P>0.05)外,AngⅡ组亚组和EPO组其他各亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均高于对照组,差异有统计学意义(P<0.05,见表3)。
与AngⅡ1.0 μmol/L+EPO 1 U/L亚组比较,AngⅡ 1.0 μmol/L+EPO 10 U/L亚组和AngⅡ 1.0 μmol/L+EPO 100 U/L亚组ColⅠ、Col Ⅳ和FN蛋白表达水平均下降,差异有统计学意义(P<0.05)。与同浓度单用EPO亚组比较,AngⅡ+EPO组各亚组系膜细胞合成ColⅠ、Col Ⅳ和FN蛋白水平均增高,差异有统计学意义(P<0.05,见表3)。
Table 2 Comparison of the expression levels of ColⅠ,Col Ⅳ and FN in mesangial cells among all groups

组别ColⅠ/β-actinColⅣ/β-actinFN/β-actin对照组0.04±0.000.08±0.000.20±0.01AngⅡ组 AngⅡ0.1μmol/L亚组0.05±0.00a0.12±0.01a0.25±0.01a AngⅡ1.0μmol/L亚组0.08±0.00ab0.23±0.01ab0.38±0.02ab AngⅡ10.0μmol/L亚组0.09±0.00ab0.27±0.01ab0.43±0.02abEPO组 EPO1U/L亚组0.04±0.000.11±0.01a0.21±0.01 EPO10U/L亚组0.05±0.00ab0.12±0.01ab0.23±0.01ab EPO100U/L亚组0.05±0.00a0.14±0.01ab0.26±0.01abAngⅡ+EPO组 AngⅡ1.0μmol/L+EPO1U/L亚组0.08±0.00ad0.23±0.01ad0.37±0.02ad AngⅡ1.0μmol/L+EPO10U/L亚组0.07±0.00abcd0.18±0.01abcd0.32±0.02abcd AngⅡ1.0μmol/L+EPO100U/L亚组0.06±0.00abcd0.16±0.01abcd0.29±0.01abcdF值106.67138.63125.26P值<0.001<0.001<0.001
注:与对照组比较,aP<0.05;与同组前一浓度亚组比较,bP<0.05;与单用AngⅡ1.0 μmol/L亚组比较,cP<0.05;与同浓度单用EPO亚组比较,dP<0.05
3 讨论
EPO是调节哺乳动物红细胞生成的一种30.4 kD酸性糖蛋白激素,成人主要由肾脏肾小管周围的间质细胞产生,通过与EPO受体(EPOR)结合发挥生理作用,临床已广泛应用于治疗慢性肾脏病所致贫血。近年发现EPO具有促进红细胞生成以外的组织脏器保护作用,对心血管、肾脏、脑和神经系统损伤等均有明显的保护作用,在许多非造血组织中证实存在EPOR,EPO与其结合相互作用可诱导一系列的细胞保护效应,包括促有丝分裂、抗氧化应激、抑制凋亡以及通过动员骨髓内皮祖细胞促进血管修复等[3]。已有研究表明多种肾脏实质细胞包括肾小球系膜细胞、肾小管和集合管上皮细胞等亦有EPOR表达[4-6],可能是EPO肾脏保护作用的生理基础。有研究发现EPO可减轻缺血再灌注、5/6肾切除、环孢素肾毒性等动物模型中的肾小管损伤和肾间质纤维化,显示EPO具有肾脏保护作用[7-8]。

注:1=对照组,2=EPO 1 U/L亚组,3=EPO 10 U/L亚组,4=EPO 100 U/L亚组,5= AngⅡ 0.1 μmol/L亚组,6= AngⅡ1.0 μmol/L亚组,7=AngⅡ10.0 μmol/L亚组,8=AngⅡ1.0 μmol/L+EPO 1 U/L亚组,9=AngⅡ1.0 μmol/L+ EPO 10 U/L亚组,10=AngⅡ1.0 μmol/L+ EPO 100 U/L亚组
图1 各组大鼠系膜细胞ColⅠ、Col Ⅳ和FN蛋白表达水平
Figure 1 Expression levels of ColⅠ,Col Ⅳ and FN in mesangial cells of all groups

Table 3 Comparison of expression levels of ColⅠ,Col Ⅳ and FN in cell culture supernatant of all groups

组别ColⅠColⅣFN对照组9.07±0.3712.34±0.5928.04±1.23AngⅡ组 AngⅡ0.1μmol/L亚组12.53±0.50a15.96±0.73a35.59±1.65a AngⅡ1.0μmol/L亚组16.68±0.86ab21.78±1.26ab63.71±3.09ab AngⅡ10.0μmol/L亚组17.67±0.93ab23.49±1.20ab73.64±3.93abEPO组 EPO1U/L亚组10.09±0.31a13.64±0.67a30.49±1.68 EPO10U/L亚组11.39±0.36ab14.56±0.73ab32.10±1.64ab EPO100U/L亚组12.95±0.43ab16.02±0.89ab40.16±2.45abAngⅡ+EPO组 AngⅡ1.0μmol/L+EPO1U/L亚组16.31±0.75ae21.98±1.33ad64.44±3.71ad AngⅡ1.0μmol/L+EPO10U/L亚组14.87±0.66abcd20.38±1.33abcd59.38±2.90abcd AngⅡ1.0μmol/L+EPO100U/L亚组13.96±0.46abcd18.57±0.94abcd49.36±2.88abcdF值137.1590.62231.90P值<0.001<0.001<0.001
注:与对照组比较,aP<0.05;与同组前一浓度组比较,bP<0.05;与单用AngⅡ1.0 μmol/L亚组比较,cP<0.05;与同浓度单用EPO亚组比较,dP<0.05
肾小球系膜细胞增殖、ECM合成和分泌增加与异常积聚是各种原发或继发性肾脏疾病导致肾小球硬化的共同病理特征,也是造成肾功能进行性减退的重要病理基础,AngⅡ在此病理过程中处于中心环节,可通过血流动力学因素作用于肾脏小血管加重高压力、高灌注、高滤过以及血管切应力作用,间接促进系膜细胞增殖和ECM积聚,亦可由非血流动力学因素直接诱导系膜细胞增殖或刺激转化生长因子 β、结缔组织生长因子、成纤维细胞生长因子及白介素6等因子产生,进而促进系膜细胞增殖以及ECM合成增加与降解减少[9]。本研究显示,AngⅡ可促进大鼠肾小球系膜细胞增殖以及系膜细胞合成与分泌ColⅠ、Col Ⅳ和FN,随AngⅡ水平增加,系膜细胞增殖及合成与分泌ColⅠ、Col Ⅳ和FN更加明显,与文献研究结果一致[10],证实AngⅡ是肾小球硬化病理过程的重要因子。同时本研究亦显示,单用EPO刺激也可在一定程度上诱导系膜细胞增殖及合成分泌ColⅠ、Col Ⅳ和FN;但进一步发现两者同时使用时,EPO对AngⅡ刺激所致系膜细胞增殖、ECM成分ColⅠ、Col Ⅳ及FN的高表达具有明显的拮抗作用,并呈剂量相关,表明临床上慢性肾脏病患者应用EPO除可纠正肾性贫血外,还可能对AngⅡ诱导的肾小球硬化病理过程发挥抑制作用而保护肾功能。本研究目前仅有体外实验,相关机制和细胞信号途径仍有待进一步深入研究明确。
作者声明:文章为原创作品,数据准确,内容不涉及泄密,无一稿两投,无抄袭,无内容剽窃,无作者署名争议,无与他人课题以及专利技术的争执,内容真实,文责自负。
本文要点:
本研究结果显示,AngⅡ可促进大鼠肾小球系膜细胞增殖以及系膜细胞合成与分泌ColⅠ、Col Ⅳ和FN,单用EPO也可在一定程度上诱导系膜细胞增殖及合成分泌ColⅠ、Col Ⅳ和FN,两者同时使用时,EPO对AngⅡ刺激所致系膜细胞增殖及ColⅠ、ColⅣ、FN的高表达有明显的拮抗作用,并与剂量相关。本研究结果对于肾小球硬化机制以及应用EPO进行防治具有一定的理论指导价值和实践意义,为进一步研究EPO除纠正贫血外的器官保护、延缓肾脏纤维化作用奠定了基础。本研究选题较为新颖,国内外相关研究很少;但研究方法较为简易,进行了体外实验,仅测定了系膜细胞增殖及蛋白表达,有待于进一步行动物实验探索具体作用机制及信号途径。
[1]Tanaka T,Nangaku M.Recent advances and clinical application of erythropoietin and erythropoiesis-stimulating agents[J].Exp Cell Res,2012,318(9):1068-1073.
[2]Nasri H.Renal cell protection of erythropoietin beyond correcting the anemia in chronic kidney disease patients[J].Cell J,2014,15(4):378-380.
[3]Nangaku M.Tissue protection by erythropoietin:new findings in a moving field[J].Kidney Int,2013,84(3):427-429.
[4]Jacobson LO,Goldwasser E,Fried W,et al.Studies on erythropoiesis.Ⅶ.The role of the kidney in the production of erythropoietin[J].Trans Assoc Am Physicians,1957,70:305-317.
[5]Fisher JW,Schofield R,Porteous DD.Effects of renal hypoxia on erythropoietin production[J].Br J Haematol,1965,11:382-388.
[6]Koury ST,Bondurant MC,Koury MJ.Localization of erythropoietin synthesizing cells in murine kidneys by in situ hybridization[J].Blood,1988,71(2):524-527.
[7]Wu Y,Zhang J,Liu F,et al.Protective effects of HBSP on ischemia-reperfusion and cyclosporine a induced renal injury[J].Clin Dev Immunol,2013,2013:758159.doi:10.1155/2013/758159.Epub 2013 Oct 27.
[8]Tanaka T,Nangaku M.Recent advances and clinical application of erythropoietin and erythropoiesis-stimulating agents[J].Exp Cell Res,2012,318(9):1068-1073.
[9]Rüster C,Wolf G.Angiotensin Ⅱ as a morphogenic cytokine stimulating renal fibrogenesis[J].J Am Soc Nephrol,2011,22(7):1189-1199.
[10]Wilson HM,Haites NE,Booth NA.Effect of angiotensinⅡon plasminogen activator inhibitor-1 production by cultured human mesangial cells[J].Nephron,1997,77(2):197-204.
(本文编辑:赵跃翠)
Effects of Erythropoietin on Ang Ⅱ-induced Mesangial Cell Proliferation and the Expression Levels of Col Ⅰ,Col Ⅳ and FN
JIFen,XUYu-yin,FANYa-ping,etal.
DepartmentofNephrology,AffiliatedHospitalofNantongUniversity,Nantong226001,China
Objective To investigate the effects of erythropoietin on Ang Ⅱ-induced mesangial cell proliferation and the expression levels of Col Ⅰ,Col Ⅳ and fibronectin (FN).Methods Rat mesangial cells were cultured in virto and were divided into 4 groups:control group,Ang Ⅱ group (0.1,1.0,10.0 mol/L),EPO group (1,10,100 U/L),and Ang Ⅱ+ EPO group(mesangial cells were pretreated with EPO 1,10,100 U/L for 1 h,then AngⅡ 1.0 μmol/L was added).After 0 h,24 h,48 h treatment,mesangial cell proliferation was assayed by CCK-8; the expression levels of Col Ⅰ,Col Ⅳ and FN protein were detected by ELISA; the expression levels of Col Ⅰ,Col Ⅳ and FN in cell culture supernatant were detected by ELISA.Results Either Ang Ⅱ or EPO alone could stimulate mesangial cell proliferation; AngⅡ group and EPO subgroups were higher than control group in cell proliferation levels at 24 h and 48 h,and the cell proliferation levels at 48 h were higher than 24 h,and those at 24 h were higher than 0 h (P<0.05).Either Ang Ⅱ or EPO alone could stimulate the synthesis of mesangial cells and the secretion of Col Ⅰ,Col Ⅳ and FN;apart from EPO 1 U/L subgroup which was not significantly different from control group in the expression of ColⅠ(P>0.05),AngⅡ group and other EPO subgroups were all higher(P<0.05) than control group in the expression levels of ColⅠ,Col Ⅳ and FN.Compared with AngⅡ1.0 μmol/L+EPO 1 U/L group,AngⅡ1.0 μmol/L+EPO 10 U/L group and AngⅡ1.0 μmol/L+EPO 100 U/L group were lower in 24 h and 48 h mesangial cell proliferation levels and the expression levels of ColⅠ,Col Ⅳ and FN (P<0.05),while compared with control group and EPO subgroups of the same concentrations,AngⅡ1.0 μmol/L+EPO(1,10,100 U/L) subgroups were higher in 24 h and 48 h mesangial cell proliferation levels and the expression levels of ColⅠ,Col Ⅳ and FN(P<0.05).Conclusion Ang Ⅱ can increase the mesangial cell proliferation and promote the synthesis and secretion of Col Ⅰ,Col Ⅳ and FN.EPO has the similar effects in some extent.But when the cells were treated by EPO and Ang Ⅱ together,EPO can inhibit the AngⅡ-induced mesangial cell proliferation and decrease the synthesis and secretion of Col Ⅰ,Col Ⅳ and FN induced by AngⅡ.The result indicated that EPO not only curbs renal anemia,but also protects renal function by inhibiting glomerulosclerosis induced by Ang Ⅱ.
Erythropoietin;Angiotensin Ⅱ;Glomerular mesangial cells;Collagen type Ⅰ;Collagen type Ⅳ;Fibronectins
国家自然科学基金资助项目(81170689);南通市社会事业科技创新与示范计划项目(HS2011029)
226001江苏省南通市,南通大学附属医院肾内科(季芬现工作单位为南通市第二人民医院肾内科)
范亚平,226001 江苏省南通市,南通大学附属医院肾内科;E-mail:fanyp19107@medmail.com.cn
R 322.61
A
10.3969/j.issn.1007-9572.2015.26.013
2015-03-25;
2015-07-15)

