埃索美拉唑联合早期肠内生态免疫营养对重症急性胰腺炎患者肠黏膜屏障功能的影响
田笑笑 ,杜 浩,白艳丽,朱晶晶,张 瑜,张亚历
·膳食与营养·
埃索美拉唑联合早期肠内生态免疫营养对重症急性胰腺炎患者肠黏膜屏障功能的影响
田笑笑 ,杜 浩,白艳丽,朱晶晶,张 瑜,张亚历
目的 探讨埃索美拉唑联合早期肠内生态免疫营养(EIN)治疗对重症急性胰腺炎(SAP)患者肠黏膜屏障功能的影响。方法 选择河南科技大学第一附属医院消化内科及ICU于2012年1月—2014年6月收治的68例SAP患者为研究对象,依据不同营养方法将患者分为全肠外营养组(TPN组,n=21)、EIN组(n=24)和埃索美拉唑联合EIN组(E+EIN组,n=23),检测并对比分析3组治疗前后肠黏膜屏障指标,包括血浆内毒素、D-乳酸、二胺氧化酶(DAO)水平及尿乳果糖与甘露醇比值(L/M)的差异。结果 治疗后第7、14天,3组患者各黏膜屏障指标均低于治疗前,差异有统计学意义(P<0.05),EIN组、E+EIN组患者治疗后血浆内毒素、D-乳酸、DAO水平及尿L/M低于TPN组,E+EIN组低于EIN组,差异有统计学意义(P<0.05)。结论 埃索美拉唑联合EIN可有效保护肠黏膜屏障,维护肠道黏膜屏障的完整性,疗效优于单纯EIN和TPN。
胰腺炎;肠道营养;埃索美拉唑;肠黏膜
田笑笑 ,杜浩,白艳丽,等.埃索美拉唑联合早期肠内生态免疫营养对重症急性胰腺炎患者肠黏膜屏障功能的影响[J].中国全科医学,2015,18(20):2471-2474.[www.chinagp.net]
Tian XX,Du H,Bai YL,et al.Effects of esomeprazole combined with early enteral ecoimmunonutrition on intestinal mucosal barrier function in patients with severe acute pancreatitis[J].Chinese General Practice,2015,18(20):2471-2474.
重症急性胰腺炎(SAP)早期肠道通透性增加及肠黏膜萎缩,其引发的肠道黏膜屏障受损、细菌和内毒素易位是胰腺炎继发感染、全身炎症反应综合征的根源,严重时可导致多脏器功能衰竭,其病死率高达36%~50%[1-2]。目前,临床强调以非手术为主的综合治疗,早期肠内生态免疫营养(EIN)即在传统肠内营养基础上添加谷氨酰胺(Gln)、益生菌等有免疫调节及改善肠道菌群失调作用的特殊营养素,利用肠道内有益菌群的生物拮抗作用减少致病菌的过度生长,保护肠黏膜屏障,减轻全身炎症反应,最终达到减少多脏器功能衰竭发生的目的。SAP的综合治疗中抑酸剂的应用非常重要,可以显著减少胃酸对胰液分泌的刺激,同时能有效预防应激性溃疡。本研究选用目前公认的抑酸作用较强的质子泵抑制剂(PPI)——埃索美拉唑联合早期EIN治疗SAP,并与单纯EIN、全肠外营养(TPN)的效果进行对比,探讨3种方式对SAP患者肠黏膜屏障功能的影响。
1 资料与方法
1.1 一般资料 选择河南科技大学第一附属医院消化内科、ICU于2012年1月—2014年6月收治的68例SAP患者为研究对象,其中男39例,女29例。纳入标准:首次诊治,临床表现、实验室检查和影像学检查符合中华医学会外科学分会胰腺外科学组制定的《重症急性胰腺炎诊治指南》诊断标准[3]。排除标准:(1)既往有急性或慢性胰腺炎病史者;(2)发病至入院超过48 h者;(3)内镜逆行性胰胆管造影(ERCP)术后发生胰腺炎者;(4)恶性肿瘤患者;(5)因肠道功能障碍等无法行肠内营养者;(6)妊娠期妇女。本研究经本院伦理委员会批准并取得患者知情同意。
1.2 分组 根据治疗方法将患者分为TPN组、EIN组和埃索美拉唑联合EIN组(E+EIN组),3组患者的性别、年龄、发病时间和急性生理与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分比较,差异均无统计学意义(P>0.05,见表1)。
1.3 方法
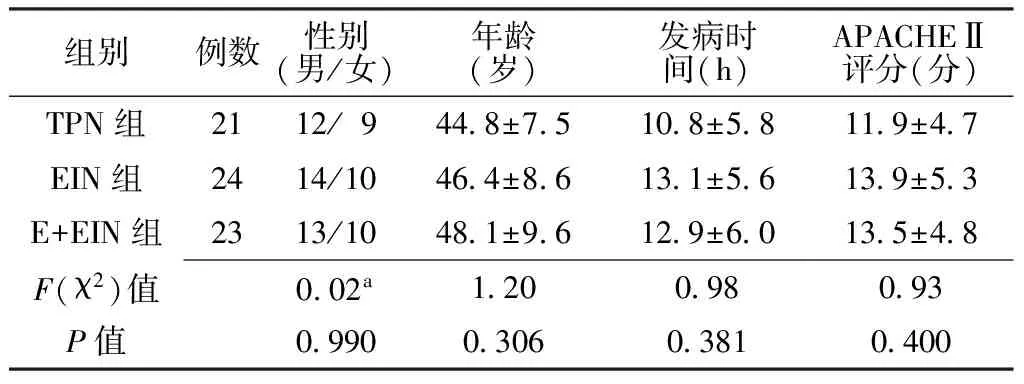
表1 3组患者入院一般资料比较
注:a为χ2值;APACHEⅡ=急性生理与慢性健康状况评分系统Ⅱ;TPN=全肠外营养,EIN=肠内生态免疫营养,E+EIN=埃索美拉唑联合EIN
1.3.1 基础治疗 3组患者入院后均严格按照《重症急性胰腺炎诊治指南》[3]进行治疗,包括胃肠减压、抑制胰酶分泌、抗感染、早期液体复苏补充容量、维持水电解质及酸碱平衡、有手术指征者及时手术等,同时给予科学的护理,并严密观察患者的生命体征、相关生化指标、营养指标、中心静脉压(CVP)等。
1.3.2 营养方法 在发病48 h内,患者生命体征较为稳定的情况下,按Harris-Benedict公式计算总热量,分别给予等热量、等氮量的营养液,热量25~30 kcal·kg-1·d-1,氮量0.15~0.20 g·kg-1·d-1。
TPN组:通过中心静脉置管采用肠外营养输注泵22~24 h持续输入营养液,其中脂肪制剂采用20%中长链脂肪乳剂,糖脂供能比为1∶1~2∶1,葡萄糖、胰岛素比为4∶1~5∶1,注意保持氮平衡及检测血糖,补足各种维生素及人体必需的微量元素。
EIN组:患者入院48 h内采用经鼻胃镜放置肠内营养管达Treitz韧带以下30 cm,并行X线透视证实鼻空肠管位置正确,固定外端,床头抬高至30°~45°。首日先给予等渗氯化钠溶液500 ml缓慢滴入,次日经肠内营养输注泵22~24 h持续输注肠内营养混悬液百普力(Peptison,荷兰纽迪希亚无锡有限公司),添加谷氨酰胺颗粒(安凯舒,重庆药友制药有限责任公司)0.3 g·kg-1·d-1,双歧杆菌乳杆菌三联活菌片(金双歧,内蒙古双奇药业股份有限公司)6 g/d。百普力用量由少到多,输注速度由20~50 ml/h开始,以后以每天25 ml/h的速度递增,逐步过渡到氨基酸、水解蛋白制剂和整蛋白制剂,热量供应逐渐达到目标剂量104.7~125.6 kJ·kg-1·d-1[25~30 kcal·kg-1·d-1],每天用0.9%氯化钠溶液冲洗管道防止堵塞,密切关注患者进食后的反应。
E+EIN组:在EIN营养治疗基础上加用质子泵抑制剂埃索美拉唑(耐信,阿斯利康制药无锡有限公司)40 mg+0.9%氯化钠溶液100 ml静脉滴注,1次/12 h。
1.4 检测指标 3组患者在营养支持治疗前及治疗后7、14 d抽取静脉血离心后置于-20 ℃保存待检。血浆内毒素检测采用鲎试剂比浊法(鲎试剂购自厦门市鲎试剂实验厂有限公司),D-乳酸、二胺氧化酶(DAO)检测采用酶学分光光度法。尿中乳果糖与甘露醇比值(L/M)采用高效液相色谱法(HPLC)检测,检测方法为禁食水10 h后营养管注入乳果糖、甘露醇混合液50 ml(含乳果糖10 g,甘露醇5 g),6 h留取尿液20 ml防腐保存。均由本院中心实验室专业人员严格按照说明书进行操作。
2 结果
3组患者营养支持治疗前血浆内毒素、D-乳酸、DAO水平及尿L/M比较,差异均无统计学意义(P>0.05),治疗后第7、14天,3组患者各黏膜屏障指标均低于治疗前(P<0.05),EIN组、E+EIN组患者治疗后血浆内毒素、D-乳酸、DAO水平及尿L/M低于TPN组,E+EIN组低于EIN组,差异均有统计学意义(P<0.05,见表2)。
3 讨论
3.1 近年研究显示,肠道是SAP急性应激反应的中心器官及多脏器功能衰竭的始动器官[4-5],肠道是体内最大的细菌、内毒素库,肠黏膜屏障的完整性对抵抗肠源性细菌易位具有重要作用。SAP早期即出现肠黏膜屏障破坏,导致肠道通透性增加,目前公认的评价肠黏膜屏障功能的主要指标有:(1)血浆内毒素:肠黏膜屏障破坏时导致严重革兰阴性菌感染,大量内毒素释放入血并超过机体自身的清除能力;(2)血D-乳酸:肠道细菌产生大量的D-乳酸,通过通透性增加的肠黏膜进入血循环;(3)血DAO水平:肠黏膜脱落时,仅存在于哺乳动物小肠黏膜和纤毛上皮细胞中的DAO进入肠细胞间隙淋巴管和血液,使血DAO水平升高;(4)尿L/M:肠道黏膜屏障损伤导致上皮细胞间紧密连接部分分离、通透性增加,肠道吸收乳果糖增加,而经细胞膜吸收的甘露醇无明显变化,L/M升高。本研究选择这4个较为常用的指标来观察不同治疗方法对SAP患者肠黏膜屏障功能的影响。
3.2 目前SAP的营养模式正在发生变化,国内外学者均推荐对SAP患者在肠道条件许可的情况下尽早行肠内营养(发病48h内)[6-7],即在血流动力学和内环境稍稳定后,立即建立空肠通道开始营养治疗。同TPN比较,早期肠内营养能够防止肠道黏膜萎缩,增加肠道血流,减少肠道细菌易位,保护肠道黏膜的代谢、免疫功能。本研究采用短肽为主的百普力为主要EIN制剂,其氮源为短肽链的蛋白水解产物,可直接通过肠上皮细胞低聚肽运输系统被吸收,吸收完全,肠道耐受性较好。EIN中添加的Gln既是蛋白质合成的前体物质、肠上皮的主要能量来源,又是还原型谷胱甘肽(GSH)的前体,而GSH是细胞内抗氧化防御系统的重要组成部分。Gln能促进肠黏膜细胞的更新和再生,保持其超微结构的完整性,防止细菌易位和肠道毒素入血[8],同时增强肠黏膜的抗氧化能力。EIN中添加的双歧杆菌乳杆菌三联活菌是长型双歧杆菌、乳杆菌和嗜热链球菌合成的活菌制剂,可直接降低肠道内的pH值,产生细菌素和抗菌物质抑制致病菌的定植和生长,还可减少肠上皮细胞凋亡,降低肠黏膜的通透性、预防氧化应激[9];另外益生菌还可通过增加自然杀伤细胞(NK)数量和细胞毒性发挥非特异性免疫调节作用,从而减轻SAP的损伤。本研究也发现,应用含有Gln和双歧杆菌三联活菌的EIN组,血浆内毒素、D-乳酸、DAO水平及尿L/M均较TPN组显著降低,提示早期肠内生态免疫营养能改善重症急性胰腺炎患者的肠黏膜屏障功能,恢复肠内正常菌群,刺激免疫系统提高肠道免疫力,通过维持肠道黏膜的完整性和减少肠道的通透性等多种不同机制[10]来减轻SAP全身炎性反应,降低SAP继发感染率。
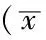
表2 3组患者治疗前后肠黏膜屏障指标变化±s)
注:与治疗前比较,aP<0.05;与TPN组比较,bP<0.05;与EIN组比较,cP<0.05;DAO=二胺氧化酶,L/M=乳果糖与甘露醇比值
埃索美拉唑作为全世界第一个S-异构体的PPI,因其独特的代谢途径、高效持久的抑酸效果、不良反应少等优势在相关疾病中受到普遍公认,近年来其在炎症相关性疾病中的作用及疗效也正受到越来越多的关注。SAP病程中重要脏器组织(包括肠黏膜组织)可产生大量的氧自由基,直接造成脂质过氧化反应导致肠黏膜损伤,相继被多种因素激活的中性粒细胞通过呼吸爆发释放大量的氧自由基及其他炎性递质,进一步造成各脏器组织的严重损伤。有研究发现埃索美拉唑不仅可以抑制中性粒细胞的趋化、削弱中性粒细胞与内皮细胞黏附反应、抑制细胞内外活性氧化物的产生和清除羟自由基从而提高肠黏膜的抗氧化能力[11],还可以通过诱导产生的HO-1发挥抗感染、抗凋亡、抗氧化和舒血管活性[12],从而可拮抗各种因素导致的肠黏膜损伤。本研究也发现,应用埃索美拉唑联合EIN较单独应用EIN时,血浆内毒素、D-乳酸、DAO水平降低得更快,尿L/M更低,说明埃索美拉唑可能通过抗氧化作用和抑制炎性细胞因子活性改善SAP引起的肠黏膜损伤。另外,黏膜细胞凋亡几乎存在于所有SAP患者的肠黏膜损伤中,DNA损伤和断裂是黏膜细胞凋亡的征象,而埃索美拉唑可显著减少应激性DNA断裂以及羟自由基介导的氧化性DNA损伤,更进一步发挥了改善肠黏膜损伤的作用。
综上所述,3组不同治疗方法患者的血浆内毒素、D-乳酸、DAO水平及尿L/M比较,埃索美拉唑联合EIN较TPN、单独EIN能明显改善SAP患者的肠黏膜屏障功能,二者联用有协同治疗作用,具有较高的推广应用价值。
[1]中华医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会,中华消化杂志编辑委员会.中国急性胰腺炎诊治指南(2013年,上海)[J].中国实用内科杂志,2013,7(33):530-535.
[2]Tenner S,Baillie J,DeWitt J,et al.American College of Gastroenterology guideline:management of acute pancreatitis[J].Am J Gastroenterol,2013,108(9):1400-1415.
[3]中华医学会外科学分会胰腺外科学组.重症急性胰腺炎诊治指南[J].中华外科杂志,2007,45(11):727-720.
[4]Zou ZD,Zhang ZZ,Wang Y,et al.N-acetylcysteine prevents intestine barrier functional disturbance and second attack following sodium taurocholate-induced severe acute pancreatitis in rats[J].Chinese Journal of Experimental Surgery,2009,26(2):64-66.(in Chinese) 邹忠东,张再重,王瑜,等.N-乙酰半胱氨酸对重症急性胰腺炎大鼠肠道屏障功能与二次打击的保护作用[J].中华实验外科杂志,2009,26(2):64-66.
[5]Gao XY.influence of enteral nutrition and total parenteral nutrition on clinical efficacy and immune function of patients with severe acute pancreatitis[J].Chinese General Practice,2013,16(10):3486-3487.(in Chinese) 高晓燕.空肠内营养与全胃肠外营养对重症急性胰腺炎患者临床疗效及免疫功能的影响[J].中国全科医学,2013,16(10):3486-3487.
[6]Mirtallo JM,Forbes A,McClave SA,et al.International consensus guidelines for nutrition therapy in pancreatitis[J].J Parenter Enteral Nutr,2012,36(3):284-291.
[7]贾尚琼,何培生,李冠华,等.肠内营养治疗重症急性胰腺炎临床效果分析[J].中国医刊,2013,48(5): 49.
[8]Han T,Li X,Cai D,et al.Effect of glutamine on apoptosis of intestinal epithelial cells of severe acute pancreatitis rats receiving nutritional support in different ways[J].Int J Clin Exp Pathol,2013,6(3):503-509.
[9]Hooijmans CR,de Vries RB,Rovers MM,et al.The effects of probiotic supplementation on experimental acute pancreatitis:a systematic review and meta-analysis[J].PLoS One,2012,7(11):e48811.
[10]Zou XP,Chen M,Wei W,et al.Effects of enteral immunonutrition on the maintenance of gut barrier function and immune function in pigs with severe acute pancreatitis[J].JPEN J Parenter Enteral Nutr,2010,34(5):554-566.
[11]Fornai M,Colucci R,Antonioli L,et al.Effects of esomeprazole on healing of nonsteroidal anti-inflammatory drug (NSAID)-induced gastric ulcers in the presence of a continued NSAID treatment:characterization of molecular mechanisms[J].Pharmacol Res,2011,63(1):59-67.
[12]Hu Y,Wu Q,Liu ZX,et al.Protective effect and molecular mechanism of esomeprazole on Human gastric epithelial cells caused by oxidative injury[J].Chinese General Practice,2014,17(15):1731-1734.(in Chinese) 胡杨,吴清,刘朝霞,等.埃索美拉唑对人胃上皮细胞抗氧化损伤的保护作用及分子机制研究[J].中国全科医学,2014,17(15):1731-1734.
(本文编辑:赵跃翠)
Effects of Esomeprazole Combined With Early Enteral Ecoimmunonutrition on Intestinal Mucosal Barrier Function in Patients With Severe Acute Pancreatitis
TIANXiao-xiao,DUHao,BAIYan-li,etal.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofHenanUniversityofScienceandTechnology,Luoyang471003,China
Objective To analyze the effects of esomeprazole combined with early enteral ecoimmunonutrition on intestinal mucosal barrier function in patients with severe acute pancreatitis (SAP).Methods We enrolled 68 SAP patients who were admitted into the Department of Gastroenterology and the ICU of the First Affiliated Hospital of Henan University of Science and Technology from January 2012 to June 2014.According to different nutrition methods,the subjects were divided into three groups:TPN group (n=21),EIN group (n=24) and E+EIN group (n=23).The indicators of intestinal mucosal barrier function after intervention were examined and analysed,including the levels of plasma endotoxin,D-lactate,diamine oxidase(DAO) and lactulose/mannitol(L/M) in urine.Results On Day 7 and 14,the three groups were higher (P<0.05) in the indicators than before intervention.The EIN group and E+EIN group were lower than TPN group in the levels of plasma endotoxin,D-lactate,DAO and L/M in urine (P<0.05),and the E+EIN group was lower (P<0.05) than the EIN group in the indicators.Conclusion Esomeprazole combined with early enteral ecoimmunonutrition could effectively protect intestinal mucosal barrier and maintain its integrity.The effect is better than simply using EIN or TPN.
Pancreatitis;Enteral nutrition;Esomeprazole;Intestinal mucosa
471003 河南省洛阳市,河南科技大学第一附属医院消化内科(田笑笑,白艳丽,朱晶晶,张瑜),骨外科(杜浩);南方医科大学南方医院消化内科(张亚历)
田笑笑,471003河南省洛阳市,河南科技大学第一附属医院消化内科;E-mail:xxtian1011@163.com
R 576
A
10.3969/j.issn.1007-9572.2015.20.027
2014-12-10;
2015-04-15)

