多发性骨髓瘤小鼠注射重组鼠源促红细胞生成素后对免疫功能的影响
汤海玲,范丽梅
(云南省第二人民医院:1.预防保健科;2.门诊部,云南昆明 650021)
多发性骨髓瘤(multiple myeloma,MM)是由B细胞起源的浆细胞在骨髓中异常增殖形成一种常见的恶性肿瘤,引起患者出现贫血、免疫力下降和肾功损伤等症状[1]。近年来,MM的发生率呈明显上升趋势,并且多发于中老年人,一般患者的中位生存期仅为3~4年,严重威胁了人类的生命安全。传统的治疗方案主要是联合化疗,但仅能让25%的患者生存期超过5年,因此探寻新的药物延长患者生命并提高患者生活质量具有十分重要的意义[2]。目前,重组人红细胞生成素(recom-binant human erythropoietin,rhEPO)应用在多发性骨髓瘤治疗受到极大重视,但是大部分研究集中在改善贫血症状[3-4],而关于rhEPO免疫调节作用的报道甚少。因此,本研究通过构建多发性骨髓瘤小鼠模型,体内研究rhEPO对多发性骨髓瘤小鼠免疫细胞的影响。
1 材料与方法
1.1 动物与仪器 SPF级别6周雌性Balb/c-nu小鼠购自上海斯莱克动物实验中心;人源多发性骨髓瘤细胞系RPMI8226购自中国科学院上海细胞库;RPMI 1640培养基和FBS购自Gibco公司;CO2细胞培养箱和全波长酶标仪购自Thermo Fisher公司;小鼠TNF-αELISA试剂盒购自美国Peninsula Laboratories公司。
1.2 多发性骨髓瘤小鼠模型的构建及治疗 人源多发性骨髓瘤细胞系RPMI 8226培养于含0.1mL/mL FBS、2mmol/L谷氨酰胺和100u/mL青链霉素的RPMI 1640培养基中,置于细胞培养箱中,待细胞长至对数期时取出,用胰酶消化并洗涤2次,调整细胞密度为2×108个/mL,按每只小鼠100μL接种于左后肢背部皮下,将接种后的小鼠置于SPF环境中饲养,每日观察肿瘤体积,待体积达到100~150mm3时,将60只小鼠随机分为4组,即对照组和高、中、低剂量治疗组,治疗组分别给予尾静脉注射rhEPO 10、5、2.5mg/kg,容量为100μL,对照组给予尾静脉注射等体积生理盐水。连续给药30d,每天给药1次。所有小鼠在SPF级动物房正常饲养。
1.3 小鼠脾脏T淋巴细胞和B淋巴细胞增殖能力的测定(MTT法)[5]小鼠取血后处死,于无菌下取出脾脏,轻轻碾磨并通过200μm尼龙滤网上离散细胞,加入EDTA胰酶消化,用PBS洗涤细胞2次,向沉淀加入红细胞裂解液,再用PBS洗涤细胞2次,然后用RPMI-1640(含0.1mL/mL FBS,100u/mL青霉素和100mg/mL链霉素)培养基调细胞数为2×106个/mL悬液,按每孔100μL加入到96孔培养板中,再向各孔加入脂多糖(LPS,终质量浓度15mg/L)或刀豆蛋白(Con A,终质量浓度2mg/L)。将培养板置于37℃CO2培养箱66h后,向每孔加入 MTT(1mg/L)20μL,继续培养4h,取出,弃去培养液,每孔加入二甲基亚砜100μL,用酶标仪在570nm下测定各孔A值。
1.4 腹腔巨噬细胞吞噬能力的测定(中性红实验)[5]各组小鼠处死前1h,每只小鼠腹腔内注射0.04mL/mL绵羊红细胞(SRBC)0.5mL,处死小鼠后,于无菌下向小鼠腹腔内注入5mL RPMI-1640培养液,轻揉数下,剖腹吸取渗出液,用PBS洗涤细胞2次,然后向沉淀加入红细胞裂解液,再用PBS洗涤细胞两次,最后用RPMI-1640(含0.1mL/mL FBS,100u/mL青霉素和100mg/mL链霉素)培养基调细胞数为1.2×106个/mL悬液,按每孔100μL加入到96孔培养板中,放入37℃CO2培养箱中孵育3h,弃去培养液,向每孔加入100μL 0.72g/L中性红溶液,继续培养3h,用RPMI 1640培养液清洗3遍,每孔加入细胞溶解液(乙醇∶0.1mol/L乙酸=1∶1)100μL,用酶标仪在540nm下测定各孔A值。
1.5 小鼠血清中TNF-α含量的测定 采用眼球取血法获得小鼠血液,离心取上清,参照小鼠ELISA试剂盒说明书测定小鼠血清中TNF-α的含量。
1.6 统计学分析 所有数据均采用SPSS 16.0软件分析,计量数据均采用±s的方式表达,P<0.05表示具有统计学差异。
2 结 果
2.1 不同剂量rhEPO对多发性骨髓瘤小鼠B、T淋巴细胞增殖能力的影响 实验采用MTT法测定不同剂量rhEPO对多发性骨髓瘤小鼠B、T淋巴细胞增殖能力的影响。结果与对照组相比,rhEPO各剂量组对T淋巴细胞(图1A)和B淋巴细胞(图1B)增殖能力的影响均有统计学差异(P<0.05)。
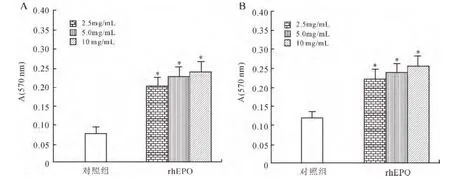
图1 MTT法不同剂量rhEPO对多发性骨髓瘤小鼠脾淋巴细胞增殖能力的影响Fig.1 Effects of different doses of rhEPO on the spleen lymphocyte proliferation in mice with multiple myeloma by MTT assay(n=15)
2.2 不同剂量rhEPO对多发性骨髓瘤小鼠巨噬细胞吞噬能力的影响 实验采用中性红法测定不同剂量rhEPO对多发性骨髓瘤小鼠巨噬细胞吞噬能力的影响。结果与对照组相比,rhEPO各剂量组对多发性骨髓瘤小鼠巨噬细胞吞噬能力的影响均有统计学差异(P<0.05,图2)。

图2 不同剂量rhEPO对多发性骨髓瘤小鼠巨噬细胞吞噬能力的影响Fig.2 Effects of different doses of rhEPO on phagocytosis of macrophages in mice with multiple myeloma by neutral red uptake assay(n=15)
2.3 不同剂量rhEPO对多发性骨髓瘤小鼠血清TNF-α含量的影响 实验采用ELISA试剂盒测定不同剂量rhEPO对多发性骨髓瘤小鼠血清TNF-α的含量影响。结果与对照组相比,rhEPO各剂量组对多发性骨髓瘤小鼠血清中TNF-α的含量影响均有统计学差异(P<0.05,图3)。
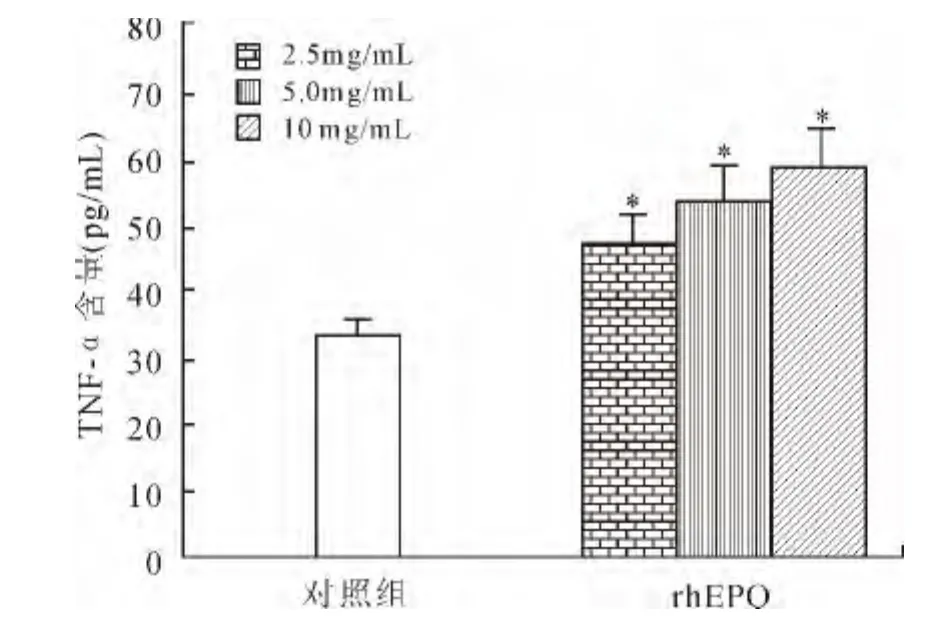
图3 不同剂量rhEPO对多发性骨髓瘤小鼠血清TNF-α含量的影响Fig.3 Effects of different doses of rhEPO on secretion of TNF-α by macrophages in mice with multiple myeloma(n=15)
3 讨 论
多发性骨髓瘤是在血液系统中发病率第2高的恶性肿瘤。贫血是多发性骨髓瘤的主要临床症状,其不仅影响了患者的生活质量,而且也降低了患者临床化疗的耐受性。调查显示,多发性骨髓瘤发病率约为3/10万,男女比例为1.6∶1,大多患者年龄>40岁[6]。目前,该病尚不能治愈,并且预后差,仍然是不可避免的医学难题。传统的治疗方法主要依靠输血改善患者的贫血,但是疗效短暂,且安全性越来越受到关注。因此,亟待寻找能够有效治疗多发性骨髓瘤的药物,对于改善多发性骨髓瘤患者的生活质量具有重要的临床意义。
红细胞生成素是一种热和酸稳定的酸性糖蛋白激素,由166个氨基酸组成,研究显示其能够显著改善不同疾病所致的贫血,被广泛应用于临床[7]。为了满足临床需要,以基因工程技术生产的重组人促红细胞生成素应运而生,其结构和生物学特性与天然红细胞生成素相同。目前,rhEPO在治疗MM展现出巨大潜力。研究发现,rhEPO不仅具有显著的免疫调节能力[8],而且在治疗肿瘤引起的贫血方面具有良好疗效[4]。目前临床数据显示肿瘤并发贫血患者采用重组人促红细胞生成素治疗后血红蛋白水平显著升高,输血量减少,生活质量明显提高[9-11]。
免疫系统是机体抵御外界病原入侵的重要防御系统,主要分为非特异性免疫和获得性免疫。非特异性免疫是机体固有的,能够迅速与入侵病原体反应,主要包括巨噬细胞、树突状细胞、NK细胞、γδT细胞和免疫分子等,其中巨噬细胞是机体对抗肿瘤细胞的第一道防线[12-13]。实验中,我们考察rhEPO对多发性骨髓瘤小鼠体内巨噬细胞的影响,发现rhEPO能显著增强多发性骨髓瘤小鼠巨噬细胞吞噬能力,并且刺激巨噬细胞分泌TNF-α。TNF-α是重要的细胞因子,参与肿瘤坏死反应[14]。获得性免疫是机体后天经抗原刺激形成的,主要包括以B淋巴细胞介导的体液免疫和以T淋巴细胞介导的细胞免疫[15]。实验中,我们采用有丝分裂原LPS和Con A分别诱导多发性骨髓瘤小鼠脾淋巴细胞向B、T淋巴细胞分化,然后考察各组B、T淋巴细胞增殖情况,结果表明rhEPO能显著促进B、T淋巴细胞增殖。综上所述,rhEPO可显著提高多发性骨髓瘤小鼠的免疫调节能力。
[1]孙莹,方美云,刘越坚.多发性骨髓瘤免疫表型特征及其意义[J].中国实验血液学杂志,2010,18(2):381-384.
[2]克晓燕,王艳芳,杨玉花,等.多发性骨髓瘤的过去,现在及未来[J].中国实验血液学杂志,2008,16(2):231-239.
[3]丁于海,舒颖,曾华,等.重组人促红细胞生成素治疗肿瘤相关性贫血的研究[J].实用临床医学(江西),2011,12(4):32-33.
[4]傅爱林,沈文香,汪小葛.重组人促红细胞生成素治疗肿瘤相关性贫血及其与血清促红细胞生成素,转铁蛋白受体关系的临床研究[J].中国血液流变学杂志,2014,24(1):77-80.
[5]JIANG J,MENG FY,HE Z,et al.Sulfated modification of longan polysaccharide and its immunomodulatory and antitumor activity in vitro[J].Int J Biol Macromol,2014,67(6):323-329.
[6]KUMAR S.Maintenance therapy in multiple myeloma[J].Clin Adv Hematol Oncol,2014,12(2):133-134.
[7]ZHANG H,QIN T,XU Z,et al.Clinical efficacy analysis of recombinant human erythropoietin in the treatment of lowerrisk myelodysplastic syndromes[J].Zhonghua Xue Ye Xue Za Zhi,2014,35(1):18-23.
[8]WANG KC,TSAI CP,LEE CL,et al.Alpha-lipoic acid enhances endogenous peroxisome-proliferator-activated receptorgamma to ameliorate experimental autoimmune encephalomyelitis in mice[J].Clin Sci,2013,125(7):329-340.
[9]MILANO M,SCHNEIDER M.EPO in cancer anemia:benefits and potential risks[J].Crit Rev Oncol Hematol,2007,62(2):119-125.
[10]SULKOWSKA M,WINCEWICZ A,CHABOWSKA A,et al.To give or not to give recombinant EPO to anemia endangered cancer patients[J].Prague Med Rep,2006,107(3):281-289.
[11]MILANO M,SCHNEIDER M.EPO in cancer anemia:benefits and potential risks[J].Crit Rev Oncol Hematol,2007,62(2):119-25.
[12]ADEREM A,ULEVITCH RJ.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-787.
[13]柳爱华,宝福凯.近年来固有免疫研究中的一些重要进展[J].自然杂志,2009,31(4):218-222.
[14]COMARMOND C,PLAISIER E,DAHAN K,et al.Anti TNF-αin refractory Takayasu's arteritis:cases series and review of the literature[J].Autoimmun Rev,2012,11(9):678-684.
[15]IWASAKI A,MEDZHITOV R.Regulation of adaptive immunity by the innate immune system[J].Science,2010,327(5963):291-295.

