东祁连山7种禾草根际溶磷菌筛选及其溶磷特性
马文文,姚 拓,蒲小鹏,卢 虎,张玉霞,王国基(甘肃农业大学草业学院 草业生态系统教育部重点实验室,甘肃 兰州 730070)
东祁连山7种禾草根际溶磷菌筛选及其溶磷特性
马文文,姚 拓,蒲小鹏,卢 虎,张玉霞,王国基
(甘肃农业大学草业学院 草业生态系统教育部重点实验室,甘肃 兰州 730070)
采用PKO无机磷和蒙金娜有机磷选择性培养基,从东祁连山(甘肃省天祝县及周边地区)天然草地上的7种禾草根际分离出溶解无机磷菌株109株,溶解有机磷菌株143株。各菌株生长速度及形态特征差异较大。7种禾草根际溶解无机和有机磷菌株数量,除醉马草(Achnatheruminebrians)溶解无机磷呈根表土壤>根系表面>根内的分布趋势外,其他均呈现出根系表面>根表土壤>根内的分布趋势。大部分溶解无机磷菌株在10 d时溶磷圈直径(D)与菌落直径(d)的比值(D/d)不再增大,而溶解有机磷菌株则在14 d时不再增大。利用钼蓝比色法测定菌株溶磷能力,结果表明,109株溶解无机磷菌株培养液中有效磷含量在0.47~582.46 μg·mL-1,最大为菌株PCRP5;143株溶解有机磷菌株培养液中有效磷含量在0.07~14.76 μg·mL-1,最大为菌株MCMRS4;蒙金娜培养基pH与有机磷菌株有效磷含量无显著相关性(P>0.05),PKO培养基pH与无机磷菌株有效磷含量之间呈极显著负相关(P<0.01)。
禾草;无机溶磷菌;有机溶磷菌;溶磷性能
磷是植物生长所需的大量、重要营养元素。目前,我国农牧业生产中,磷肥的主要来源是化肥,化肥在作物、蔬菜、牧草的产量提高方面起到了巨大作用,同时出现了不少弊端[1]。如随着化肥使用量的增加,土壤结构遭到破坏,环境受到污染,微生物多样性下降等。我国耕地土壤74%缺磷,但土壤中95%的磷为无效形式,很难被植物直接吸收与利用,且施入磷肥中的大部分磷和土壤中的Fe2+、Fe3+、Ca2+及Al3+结合形成难溶性磷酸盐[2-4]。因此,开发利用新兴肥料替代化肥已是当务之急,微生物肥料的开发与研究在提高土壤的养分利用率、改善土壤状况及调节土壤肥力方面起着巨大作用[5]。而溶磷微生物通过释放有机酸等,溶解难溶性磷酸盐或者分泌磷酸酶以降解有机磷,从而提高土壤中可溶性磷的浓度,使之有效地被植物吸收与利用[6]。
溶磷菌自被发现以来,很多学者进行了大量研究。前苏联学者Mehknha于1935年首次从黑钙土壤中分离出一株形态与巨大芽孢杆菌(Bacillusmegaterium)相似的解磷细菌,能够分解核酸和卵磷脂,施入土壤后使P2O5提高了15%以上[7]。近些年,国内外有关溶磷菌研究的报道很多[8-13],多集中在菌株对植物的促生作用,如郜春花等[14]利用溶磷菌株B2和B67研制的菌剂,通过盆栽试验发现,施用了溶磷菌剂后,玉米(Zeamays)株高、干质量和鲜质量较对照有较大幅度的增加;张英等[15]采用溶磷复合接种剂处理红三叶(Trifoliumpratense)种子发现,处理后红三叶的株高和根长较对照增加了33.62%和46.20%。因此,从不同植物根际筛选高效的溶磷菌对植物的生长有重要作用。
目前,植物根际溶磷菌研究涉及到很多植物,如燕麦(Avenasativa)[16]、小麦(Triticumaestivum),玉米、甘蔗(Saccharumofficinarum)[17],水稻(Oryzasativa)[18],国外有雀稗(Paspalumspp.)[19]、玉蜀黍[20]等,但对东祁连山天然草地禾草,如高原早熟禾(Poaalpigena)、垂穗披碱草(Elymusnutans)、醉马草(Achnatheruminebrians)、赖草(Leymussecalinus)、冰草(Agropyroncristatum)、紫花针茅(Stipapurpurea)、糙毛鹅观草(Roegneriahirsuta)等根际溶磷菌资源的研究尚未见报道。这7种禾草是东祁连山天然草地中常见的植物,其中高原早熟禾适应性强、耐寒、耐旱、绿期长,经培育后,可作为适宜高寒气候条件的草坪草种。垂穗披碱草具很强的可塑性,耐瘠薄,适应北方各种类型的土壤,耐牧性强,产草量高。赖草耐旱、耐寒,耐轻度盐渍化土壤,而且适应范围广,从暖温带、中温带的森林草原到干草原、荒漠草原、草原化荒漠。冰草、紫花针茅及糙毛鹅观草都有丰富的营养价值,家畜都喜食。醉马草虽是有毒植物,但其营养价值高,若使用新疫苗免疫动物,可使动物安全地利用醉马草,从而减少人工挖除醉马草与化学除草等造成的环境污染、草地退化和水土流失等现象。本研究从东祁连山天然草地主要禾草根际分离筛选高效溶磷菌并研究其溶磷特性,以期为高寒地区研制高效复合接种剂提供菌种,同时丰富促生菌资源库。
1 材料与方法
1.1 研究区自然概况
东祁连山天然草地,以甘肃省天祝县高寒草地为主,辐射周边地区,位于37°11′-37°13′ N,102°29′-102°33′ E。平均海拔2 700~3 300 m,气候潮湿阴冷,空气稀薄且紫外线辐射强烈。该区年降水量416 mm,且多为地形雨,集中于7、8和9月,年蒸发量1 592 mm;年平均温度-0.1 ℃,1月均温-18.3 ℃,7月均温12.7 ℃,>0 ℃年积温为1 380 ℃·d;水热同期,年日照时数为2 600 h;没有绝对无霜期,只有冷、热两季,春季常出现旱象,且有暴风雪。
1.2 研究材料与方法
2012年9月在放牧强度小的围栏内天然草地上采样。在7种禾草(高原早熟禾、垂穗披碱草、醉马草、赖草、冰草、紫花针茅和糙毛鹅观草)样地类型内采用“S”型取样法,设1 m×1 m样方5个,在每个样方内用75%乙醇消毒后的土铲,挖取各植物根际(根系和土壤)样品。7种禾草的5份样品分别装入无菌聚乙烯袋中,放入标签,封口,置于冰筒中带回实验室立即进行溶磷菌分离、筛选[21]。
1.2.1 溶磷菌的筛选
1)培养基。分离溶解无机磷菌用PKO培养基[22];分离溶解有机磷菌用蒙金娜培养基[23-24];保存用LB培养基[25]。
2)溶磷圈法筛选溶磷菌。将采集的7种禾草根系上的虚土抖掉后,按常规细菌分离法[22]涂布样品悬液于PKO和蒙金娜培养基上,待菌落长出后,挑取PKO、蒙金娜培养基上菌落大、生长快、具有明显溶磷圈的单个菌落,划线法接种于对应的培养基上,直至获得纯的单个菌落,再点接种于含难溶性磷酸钙的PKO和含蛋黄卵磷脂的蒙金娜固体培养基上进行溶磷菌株筛选[22]。最后保存于LB斜面培养基中(4 ℃)。
1.2.2 溶磷菌溶磷能力测定
1)按常规法制作磷标准曲线[21]。
2)定性测定。将保存于LB斜面培养基中的菌株,活化后用接菌针挑取单个菌落点接种于PKO无机磷和蒙金娜有机磷平板培养基上,28 ℃恒温培养,分别在5、7、10、14和16 d时测量每个菌株形成的溶磷圈大小。根据溶磷圈直径(D)与菌落直径(d)的比值(D/d)初步确定各菌株是否有溶磷能力。
3)定量测定。将50 mL液体PKO无机磷(或蒙金娜有机磷)培养基装入150 mL三角瓶,121 ℃灭菌30 min,冷却后,分别将0.5 mL各待测菌株悬浮液(108 cfu·mL-1)接种于装有培养基的三角瓶中。每菌株分别设3个重复,以不接菌的基础培养基为对照。将上述三角瓶于28 ℃、160 r·min-1摇床上培养10 d后,用酸度计测定各个培养液pH值。接着将培养液在转速为10 000 r·min-1的离心机上于4 ℃离心15 min,取上清液5 mL转入150 mL三角瓶中。用钼蓝比色法测定扣除对照后各个菌株有效磷增量(μg·mL-1)[26],其计算公式如下。
式中,ρ为从标准曲线上查得有效磷的浓度(μg·mL-1),Ts为分取倍数,V0为测定发酵液的体积(mL),V为显色时定容体积(mL)。
1.3 数据处理
基本数据分析和绘图采用Microsoft Excel 2003软件,方差分析和相关性分析采用SPSS软件,成对比较采用One-way ANOVA和LSD法,菌株溶磷能力与pH之间的相关性采用Pearson相关分析。所有数值以平均值表示。
2 结果与分析
2.1 不同植物根际溶磷菌株数量及分布特征
2.1.1 禾草根际溶解无机磷菌株的数量及分布特征 采用PKO选择性培养基从7种供试禾草根际分离出生长较快、菌落较大、有明显溶磷透明圈的溶解无机磷菌109株(表1),其中,紫花针茅根际分离到的菌株最多,占总无机磷菌株的19.27%;糙毛鹅观草根际分离到的菌株仅次于紫花针茅,占16.51%;从垂穗披碱草根际分离的菌株与糙毛鹅观草相近,占15.60%左右;高原早熟禾分离到的菌株较少,占12.84%;醉马草、赖草和冰草根际分离到的菌株数量相同,各占总无机磷菌株的11.93%。7种禾草根际溶解无机磷菌株数量,除醉马草呈根表土壤>根系表面>根内的分布趋势,冰草根表土壤和根内数量相同外,其他均呈现出根系表面>根表土壤>根内的分布趋势。
2.1.2 禾草根际溶解有机磷菌株的数量及分布特征 采用蒙金娜选择性培养基从7种供试植物根际分离得到具有生长较快、菌落较大、有明显溶磷透明圈的溶解有机磷菌143株(表2),其中,高原早熟禾根际分离得到的菌株数量最多,占总有机磷菌株的19.58%;分离自紫花针茅和糙毛鹅观草根际的菌株数量相同,仅次于高原早熟禾,各占16.78%;垂穗披碱草根际分离到的菌株居中,占13.27%;醉马草根际分离到的菌株数量仅比垂穗披碱草少1株,占12.59%;从赖草根际分离的菌株较少,占11.19%;冰草根际分离到的菌株数量最少,占9.79%。7种禾草根际溶解有机磷菌株数量均呈现出根系表面>根表土壤>根内的分布趋势。
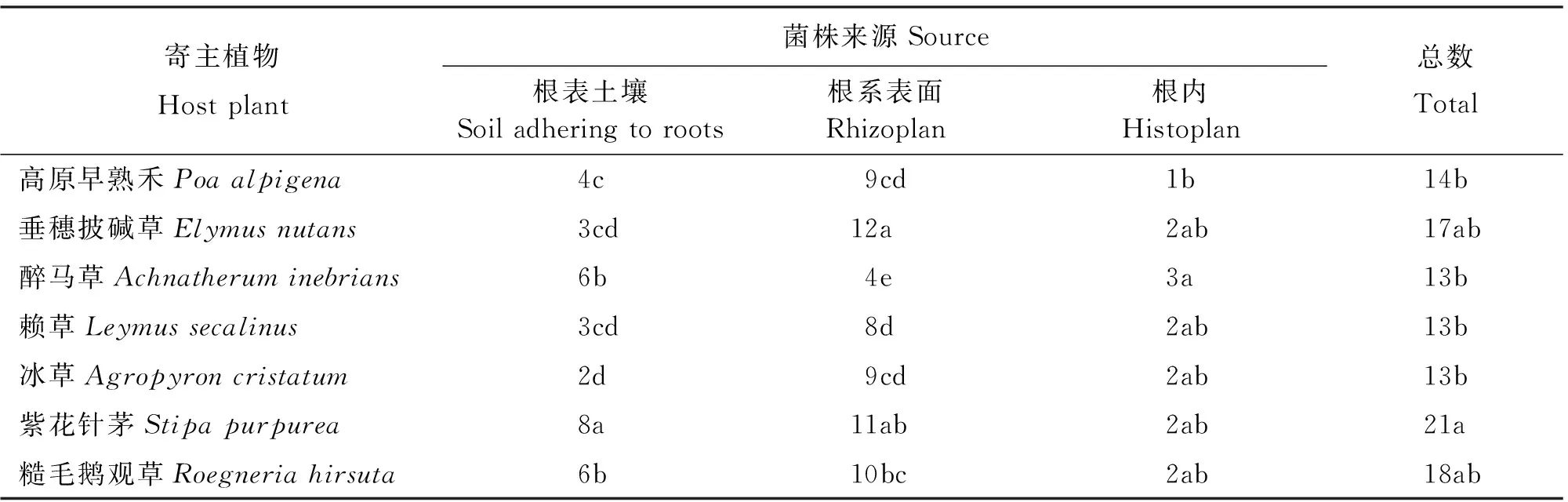
表1 溶解无机磷菌株来源及数量Table 1 Sources and numbers of inorganic phosphate-solubilizing bacteria
注:同列不同小写字母表示差异显著(P<0.05)。表2、表4、表5同。
Note: Different lower case letters within the same column mean significant difference at 0.05 level. The same in Table 2, Table 4 and Table 5.
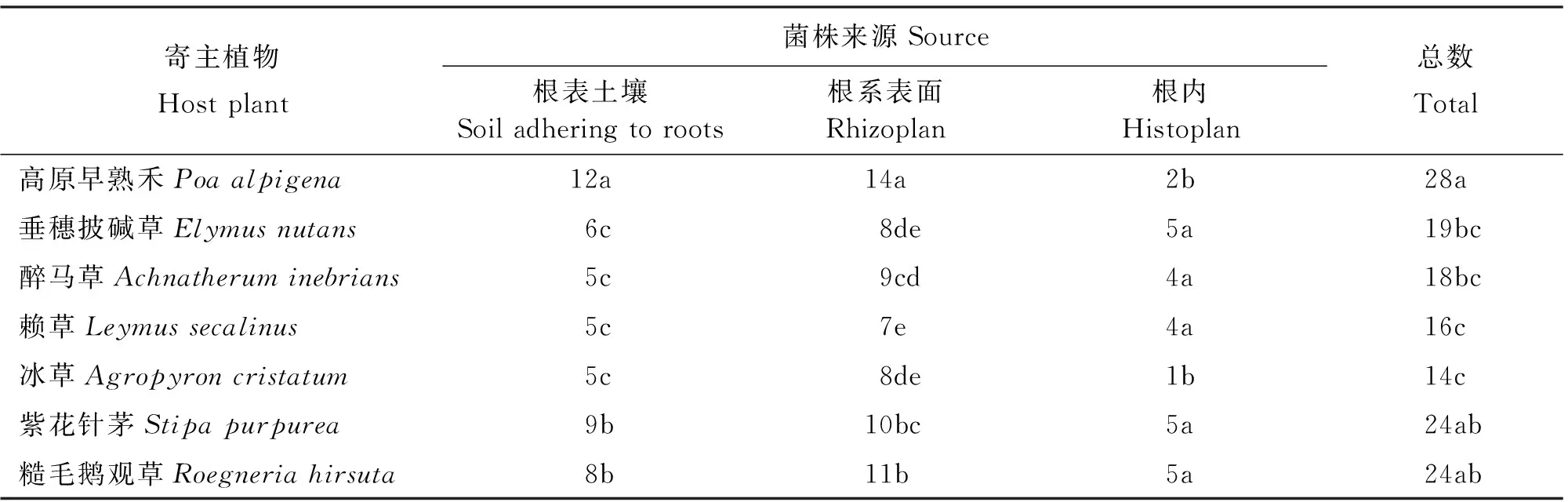
表2 溶解有机磷菌株来源及数量Table 2 Sources and numbers of organic phosphate-solubilizing bacteria
2.2 菌株溶磷特征
2.2.1 分离获得的菌株 将109株溶解无机磷菌逐一进行编号,每个编号前加大写字母“P”,同理,将143株溶解有机磷菌编号前加大写字母“M”(表3);“P”和“M”后的字母“G”为高原早熟禾首字母,“C”为垂穗披碱草首字母,“Z”为醉马草首字母,“L”为赖草首字母,“B”为冰草首字母,“ZH”为紫花针茅前两字首字母,“CM”为糙毛鹅观草前两字首字母;“RS”代表根表土壤,“RP”代表根系表面,“HP”代表根内。大于3个以上的用“-”表示(表3)。
2.2.2 菌株溶磷能力的时间动态特征 利用平板溶磷圈法对平板培养基中培养的供试菌株的溶磷能力进行了测定,结果表明,溶解无机磷菌和有机磷菌溶磷圈大小各异。分别在5、7、10、14、16 d时测量各菌株形成的溶磷圈直径(D)与菌落直径(d)大小,计算其比值(D/d)。测得从糙毛鹅观草中分离出的61.11%溶解无机磷菌株D/d值在10 d时不再增大(图1),从高原早熟禾中分离出的64.29%溶解无机磷菌株D/d值在10d时也不再增大(图2),从垂穗披碱草、醉马草、赖草、冰草、紫花针茅中分别分离出52.94%、69.23%、61.54%、53.85%、61.90%的溶解无机磷菌株的D/d值都在10 d时不再增大,其余少数溶解无机磷菌株D/d值在10 d以后继续增长,14 d后不再增大;从赖草中分离出的93.75%溶解有机磷菌株的D/d值在14 d时不再增大(图3),从垂穗披碱草中分离出的73.68%溶解有机磷菌株的D/d值在14 d时也不再增大(图4),从醉马草、高原早熟禾、冰草、紫花针茅、糙毛鹅观草中分别分离出的61.11%、82.35%、64.29%、79.17%、83.33%的溶解有机磷菌株的D/d在14 d时不再变大,其余少数溶解有机磷菌株的D/d值在14 d以后继续变大。
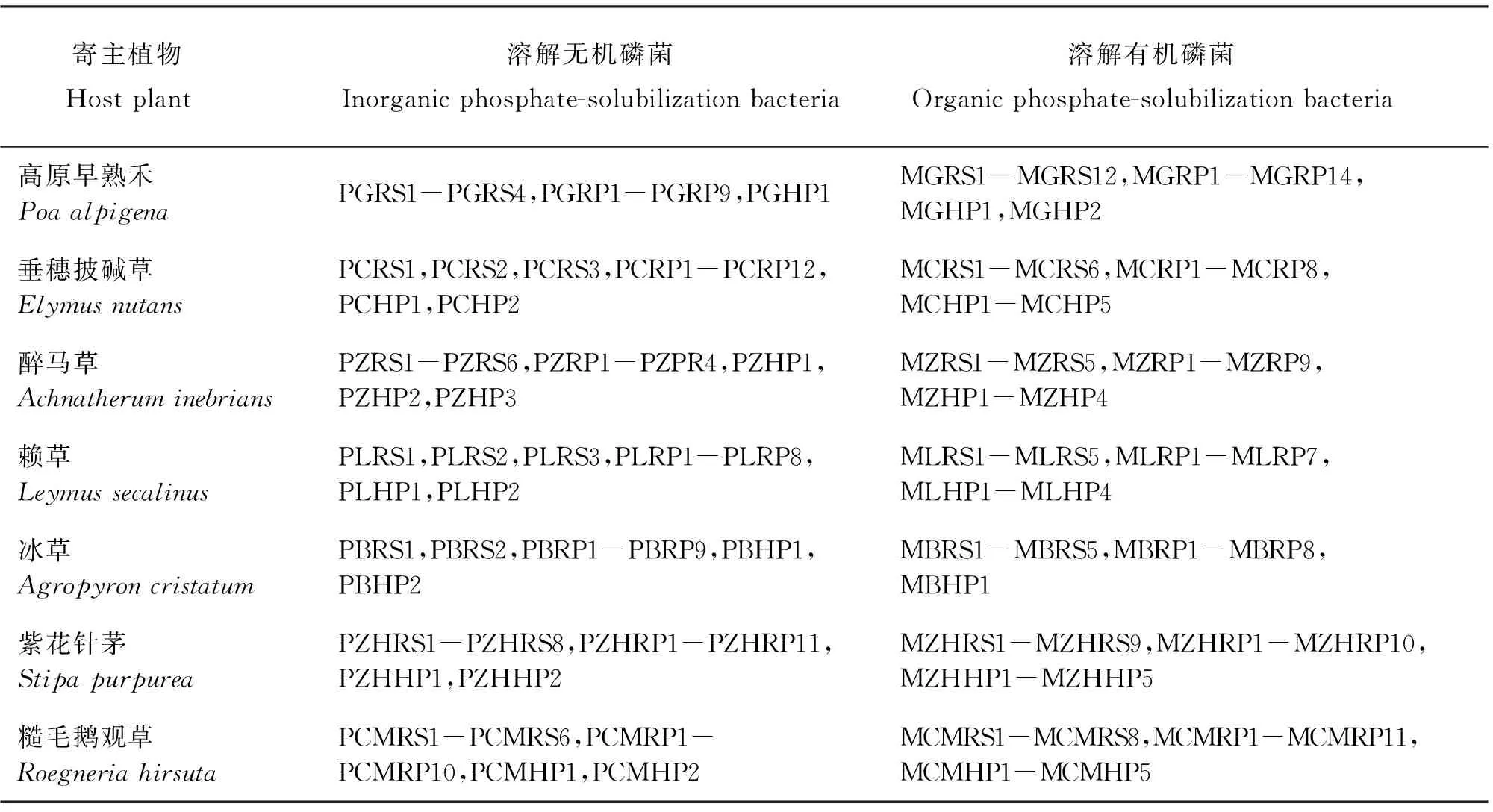
表3 分离获得的菌株编号Table 3 Code of the ioslated strains
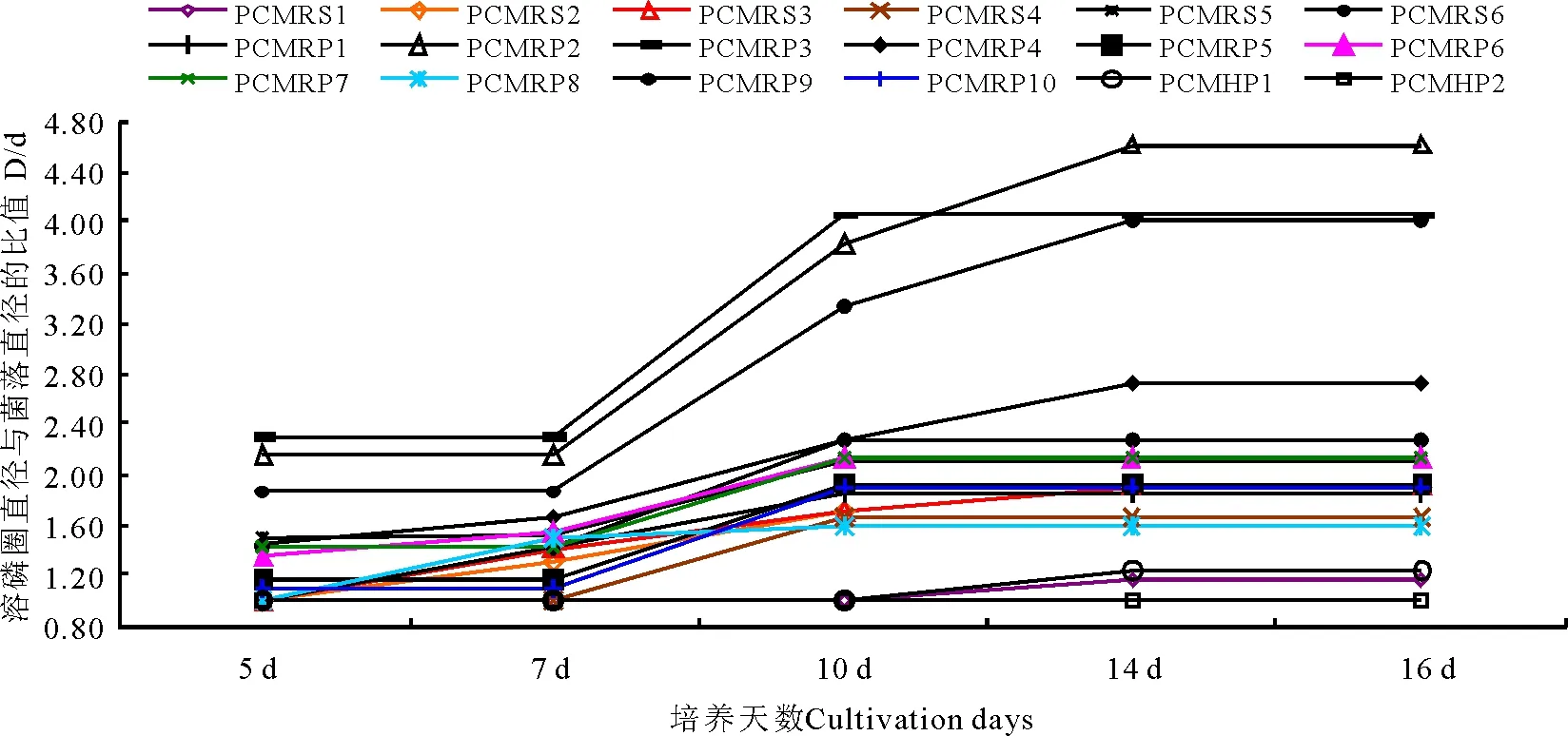
图1 糙毛鹅观草中溶解无机磷菌株溶磷动态变化Fig.1 Changes of the inorganic phosphate-solubilization inRoegneriahirsute
2.2.3 菌株溶磷能力特征 运用钼蓝比色法对菌株的溶磷能力进行了测定,结果表明,109株溶解无机磷菌培养液中有效磷含量变化较大,在0.47~582.46 μg·mL-1;大于50 μg·mL-1菌株占总溶解无机磷菌株的15.60%,且菌株间差异显著(P<0.05),菌株PCRP5培养液中有效磷含量最大(表4)。143株溶解有机磷菌培养液中有效磷含量较低,但各菌株间差异较大,范围在0.07~14.76 μg·mL-1;大于5 μg·mL-1菌株只占总溶解有机磷菌株的9.09%,除MGRS5和MCMRS1无显著差异外(P>0.05),其余菌株之间差异显著,其中含效磷含量最高的菌株为MCMRS4(表5)。
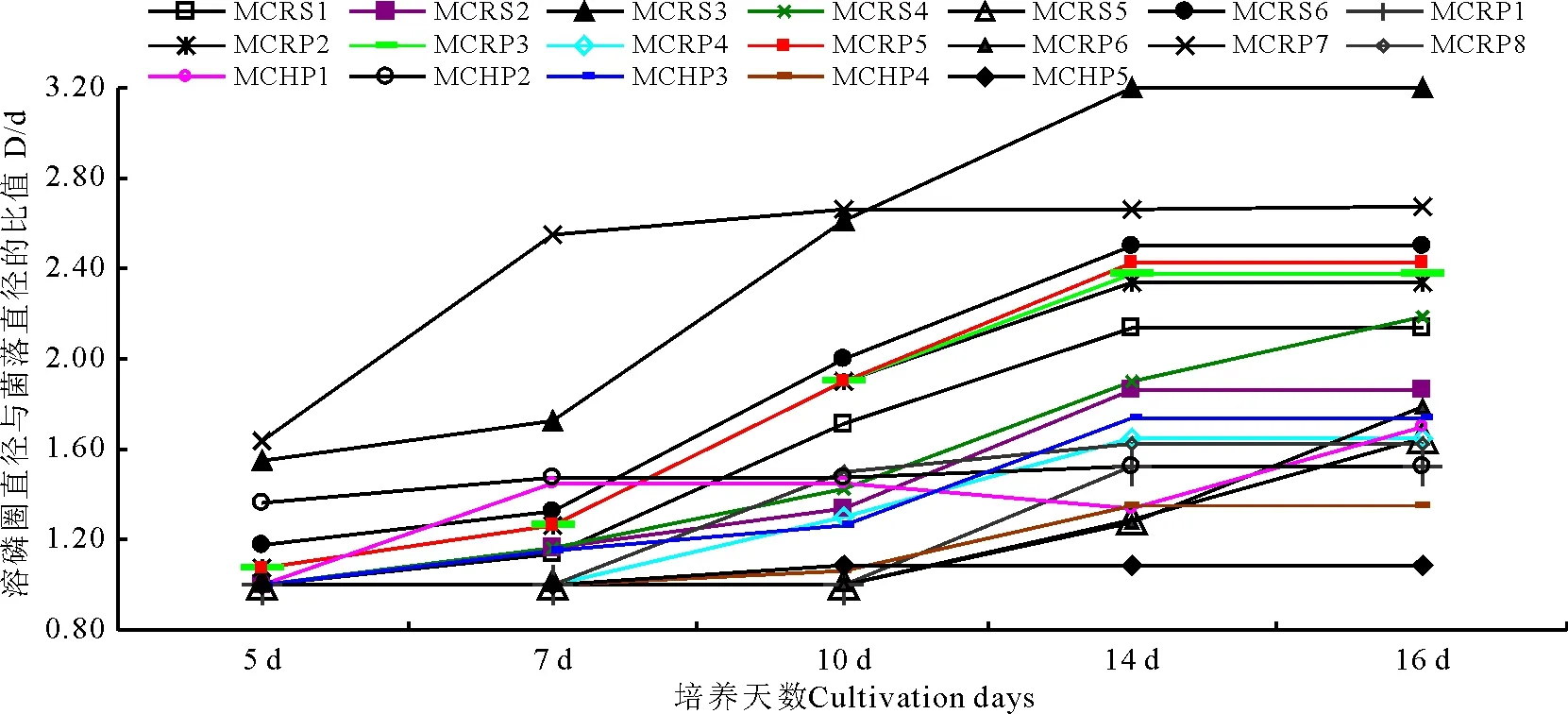
图3 赖草中溶解有机磷菌株溶磷动态变化Fig.3 Changes of the organic phosphate-solubilization inLeymussecalinus

图4 垂穗披碱草中溶解有机磷菌株溶磷动态变化Fig.4 Changes of the organic phosphate-solubilization inElymusnutans
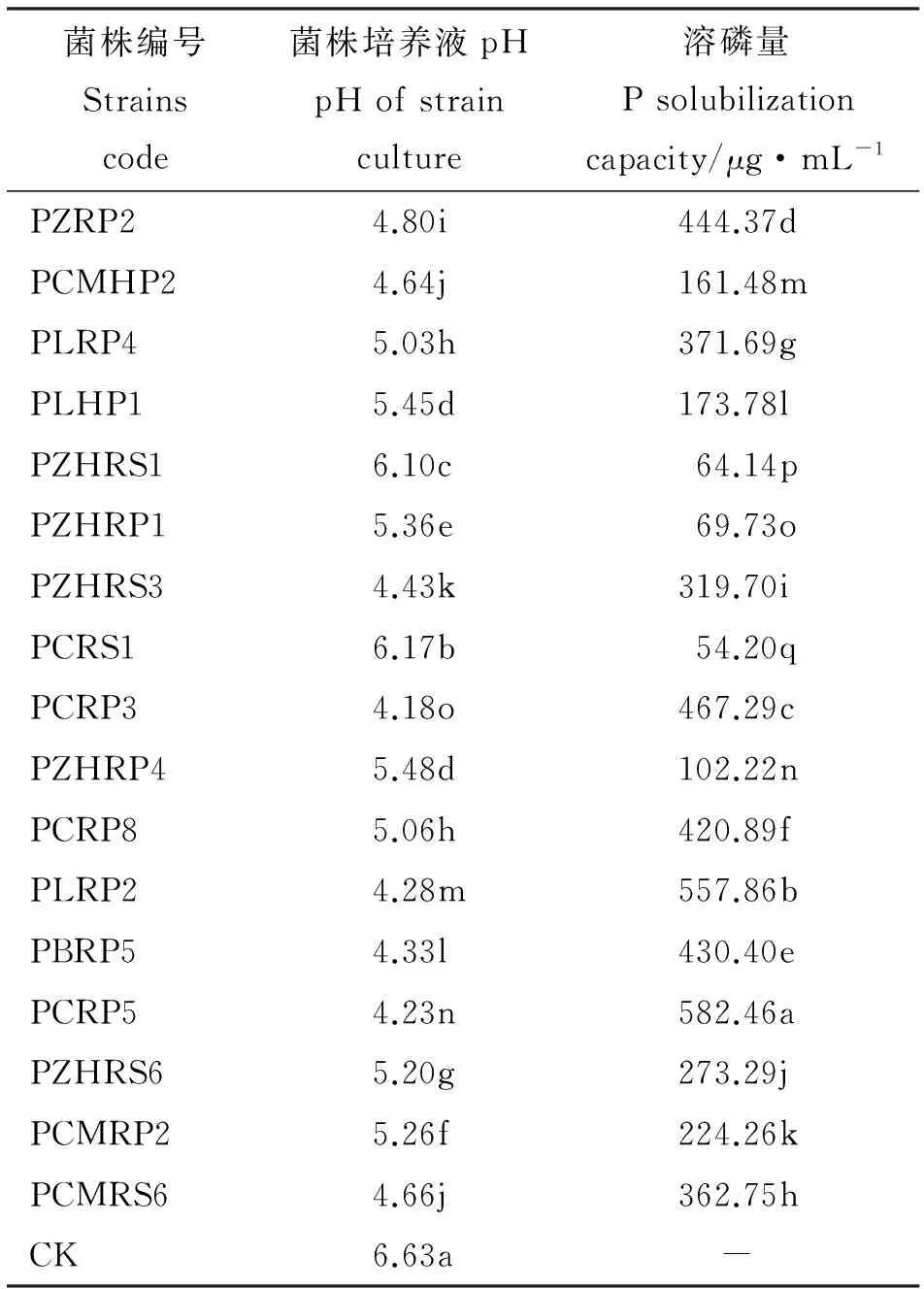
表4 部分菌株处理溶磷量与pH值(PKO)Table 4 P solubilization and pH of some strains(PKO)
2.2.4 菌株溶磷能力与pH的相关性 溶解无机磷和溶解有机磷菌株培养液中pH较对照(不接菌的基础培养液)都有所降低,运用相关性回归分析培养液中有效磷含量与pH的相关性,发现蒙金娜培养基中pH与有机磷菌株有效磷含量无显著相关性(P>0.05),PKO培养基中pH与无机磷菌株有效磷含量之间呈极显著负相关(P<0.01),线性回归方程为:y=-285.76x+1 768.03,R2=0.734。
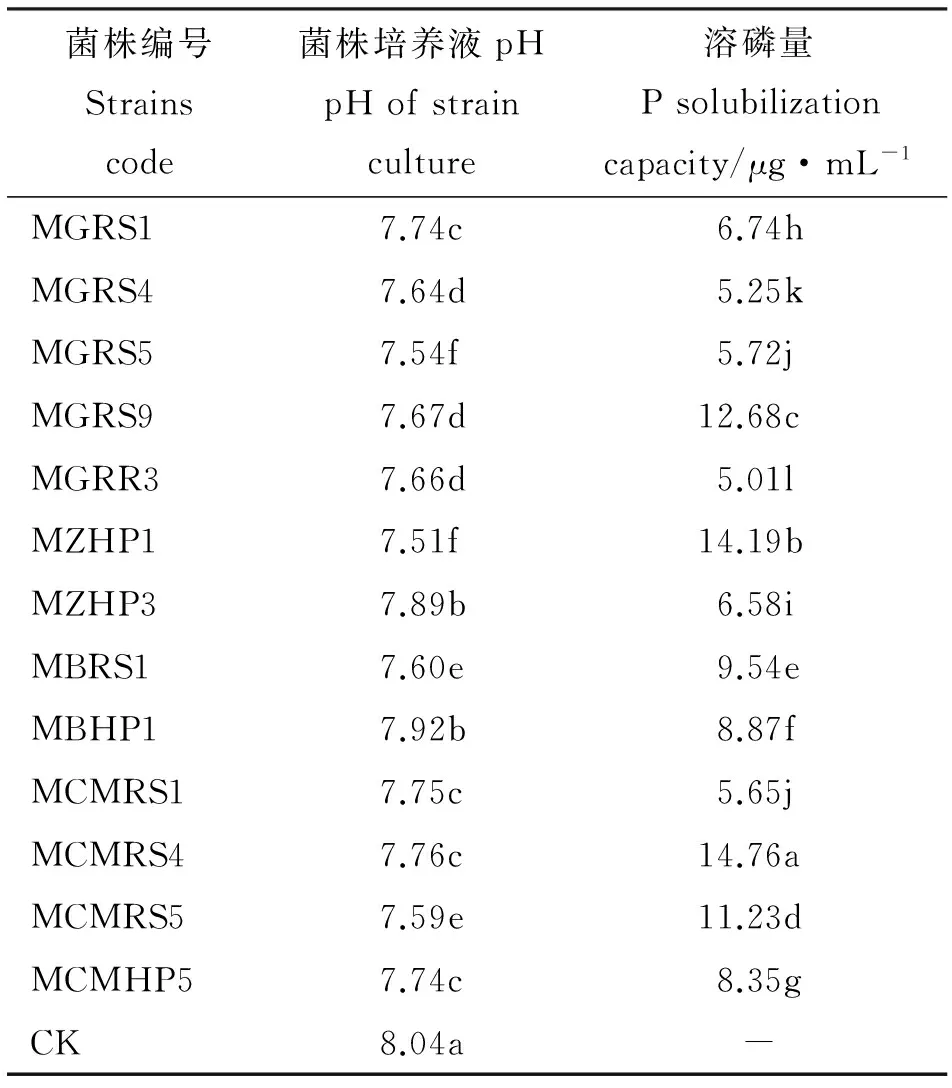
表5 部分菌株处理溶磷量与pH值(蒙金娜)Table 5 P solubilization and pH of some strains(Mehknha)
2.3 优良溶磷菌株的菌落特征
通过溶磷圈法和钼蓝比色法筛选出具有明显溶磷圈且溶磷能力较高的优良菌株在LB培养基上纯培养,观察、记录菌落的特征发现,各个菌株特性生长速度、颜色、形状、边缘完整度、隆起度以及表面状况表现出不同的差异性。菌株颜色除PCRP8为黄色、PBRP5为栗色外,其他基本为米黄色、灰白色及乳白色3种颜色;表面状况除PLRP2微干外,其他菌株大体保持湿润状;菌落形状为圆形、近圆形和椭圆形;边缘大都为完整、波浪状或锯齿状3种类型;隆起度也仅为凸起、微凸和平坦。
3 讨论与结论
3.1 不同植物根际溶磷菌数量及分布
7种禾草根际溶解无机和有机磷菌株数量差异较大,与各植物所处区域土壤肥力、水热状况及植物本身有关[27]。细菌所需营养主要来源于植物残体,不同的植物必然导致细菌在各植物中分布的不均一性[28]。从7种禾草根际分离出的溶解无机和有机磷菌株的数量,除醉马草根际溶解无机磷菌呈根表土壤>根系表面>根内,冰草根表土壤和根内数量相同外,其他均呈现根系表面>根表土壤>根内的分布趋势,这与张英等[15]、姚拓[16]的研究结果大体一致,在土壤表层和植物根系表层土壤细菌分布密集,积累的枯枝落叶和根系分泌物也多,可为细菌生长提供丰富的营养[29]。醉马草中分离出的溶解无机磷菌的数量在根表土壤中分布最多,可能与根表土壤中微生物分泌的有机酸(如甲酸、醋酸、羟基乙酸、丙酸、乙醇酸、延胡索酸、乳酸、丁二酸等)种类、数量有关,有机酸可与土壤中的Ca、Mg、Fe、Al等元素的阳离子进行螯合作用,从而减少了可固定磷酸根的阳离子,增加了土壤磷酸根离子的活性,使难溶性磷酸盐溶解。具体原因有待进一步的研究。
3.2 不同植物根际溶磷特征
平板溶磷圈法测定菌株的溶磷能力,发现溶解无机磷和有机磷菌株的溶磷圈大小各异。溶磷圈与菌落直径大小的比值(D/d)随着时间变化而变化,大多数溶解无机磷菌株的D/d值在10 d 时处于稳定状态,绝大多数溶解有机磷菌株的在14 d 时趋于稳定,出现这种结果的原因,一方面与培养基中所含的磷酸钙和蛋黄卵磷脂多少有密切关系[30-31],另一方面可能与试验中无法保证每个培养皿中均含有相同体积的培养基有关。钼蓝比色法测得不同菌株的溶磷能力差异较大,与菌株自身分泌物质的多少有关[30-31]。
该研究中大部分无机磷可被转化成可溶性磷被植物吸收,而绝大部分有机磷不能完全被转化为有效磷被植物吸收利用。这可作为今后研究的重点之一,因为土壤中不仅有无机磷的存在,还有大量的有机磷,如果不能被植物充分利用,相当于丢弃了大量的磷资源。筛选高效溶解磷能力的菌株为今后微生物肥料的制作提供了优势菌株资源。
溶磷微生物在呼吸过程中释放出大量的CO2,CO2溶于水中变为碳酸,使溶解无机磷菌和溶解有机磷菌的培养液中pH 值较对照(不接菌的基础培养液)降低。蒙金娜培养基pH 与溶解有机磷菌株培养液中有效磷含量无显著相关性(P>0.05),该结果与林启美等[32]的研究一致;而PKO培养基pH 与溶解无机磷菌株培养液中有效磷含量之间极显著负相关(P<0.01),这与张英[33]的测定结果一致。说明培养液中pH值的下降,并不是溶磷菌溶磷的唯一条件。
本研究从7种供试植物根际分离出溶解无机磷菌109株和溶解有机磷菌143株。其中109株无机磷菌株培养液中有效磷含量在0.47~582.46 μg·mL-1,最大有效磷含量菌株为PCRP5;143株溶解有机磷菌株培养液中有效磷含量较低,在0.07~14.76 μg·mL-1,最大有效磷含量菌株为MCMRS4;溶解无机磷菌株相对于溶解有机磷菌株,有效磷含量较大。菌株溶磷特征差异较大。筛选出的部分菌株具有较大研究和开发潜力。
[1] 李凤霞,姚拓,张德罡.生长促生菌浸种对高寒地区燕麦生长及固氮的效应[J].草业科学,2005,23(1):22-25.
[2] 王光华,周可琴,金剑,潘相文,赵英.不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J].生态学杂志,2004,23(2):32-36.
[3] 赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001,5(3):7-11.
[4] Kabznelson H,Peterson E A,Rouatt J W.Phosphate-dissolving microorganisms on seed and in the root zone of plants[J].Canadian Journal of Botany,1962,40(9):1181-1186.
[5] 冯月红,姚拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003(1):3-7.
[6] 黄静,盛下放,何琳燕.具溶磷能力的植物内生促生细菌的分离筛选及其生物多样性[J].微生物学报,2010,50(6):710-716.
[7] 李繁.土壤中有机磷细菌的分离鉴定及解磷突变体的筛选[D].北京:中国农业大学,2004.
[8] Paul N B,Sundara Rao W V B.Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes[J].Plant and Soil,1971,35:127-132.
[9] 陈廷伟.微生物对不溶性无机磷化合物的分解能力及其接种效果[J].微生物,1995,2(5):210-215.
[10] Illmer P,Schinner F.Solubilization of inorganic calcium phosphates solubilization mechanisms[J].Soil Biology & Biochemistry,1995,27(3):257-263.
[11] 刘荣昌.生物钾肥在农业生产中的作用[A].95全国微生物肥料专业会议论文集[C].北京:中国农业科技出版社,1995:121-125.
[12] 蔡磊,李文鹏,张克勤.高效解磷菌株的分离、筛选及其对小麦苗期生长的促进作用研究[J].土壤通报,2002,33(1):44-46.
[13] Hariprased P,Niranjana S R.Isolation and characterization of phosphate solubilizing rhisobacteria to improve plant health of tomato[J].Plant and Soil,2009,316:13-24.
[14] 郜春花,王岗,董云中,张乃明.解磷菌剂盆栽及大田施用效果[J].山西农业科学,2003,31(3):40-43.
[15] 张英,姚拓,朱颖.复合接种剂对三叶草生长特性和品质影响研究[J].植物营养与肥料学报,2012,18(5):1277-1285.
[16] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[17] 何福恒,童锦秋,金士芳,姜秋菊.水稻、玉米、甘蔗根系联合固氮菌的分离和鉴定[J].微生物学通报,1986,13(1):2-6.
[18] 张福星,刘永正,龙崇杓,林敏,方宣钧,卢婉芳,陈苇.环境因子变化对水稻氮素吸收及接种效益的影响[J].农业生物技术学报,1995,3(1):93-98.
[19] Döbereinor J,Day P J,Dart P J.Nitrogenase activity and oxygen sensitivity of thepaspalumnotatum-ozotobacter paspali association[J].Microbiology,1972,71(1):103-116.
[20] Okon Y,Cohen E,Kigel J.Increase in dry weight and total nitrogen content inZeamaysandSetariaitalicaassociated with nitrogen-fixing azospirillum spp.[J].Plant Physiology,1980,66:746-749.
[21] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[22] Hafeez F Y,Malik K A.Manual on bio-fertilizer technology[M].Pakistan:NIBGE,2000.
[23] 陈俊,陆俊馄,康丽华,杨振德.红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J].微生物学通报,2009,36(8):1183-1188.
[24] 李凤霞,姚拓,张德罡.燕麦根际促生菌特性研究[J].草业学报,2005,14(1):58-62.
[25] 李凤霞,姚拓,张德罡.高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报,2004,39(6):316-320.
[26] Smith K P,Goodman R M.Host variation for interactions with beneficial plant associated microbes[J].Annal Review of Phytopathology,1999,96:4786-4790.
[27] 赵勇斌,胡美蓉,邵煜庭.甘肃天祝永丰滩高山草原土壤肥力状况及微生物生态的研究[J].中国草原,1984(3):65-73.
[28] 郭继勋,祝廷成.羊草草原土壤微生物的数量和生物量[J].生态学报,1997,17(1):78-82.
[29] 韩玉竹,陈秀蓉,王国荣,杨成德,徐长林.东祁连山高寒草地土壤微生物分布特征初探[J].草业科学,2007,24(4):14-18.
[30] Chen Y P,Rekha P D,Arun A B.Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J].Applied Soil Ecology,2006,34:33-41.
[31] Agnihotri V P.Solubilization of insoluble phosphates by some soil fugi isolated from nursery seedbeds[J].Canadian Journal of Microbiology,1970,16(9):877-880.
[32] 林启美,王华,赵小蓉,赵紫鹃.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30.
[33] 张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D].兰州:甘肃农业大学,2013.
(责任编辑 王芳)
Screening and characteristics of phosphate-solubilizing bacteria in rhizosphere of 7 grasses on eastern Qilian Mountains
MA Wen-wen, YAO Tuo, PU Xiao-peng, LU Hu, ZHANG Yu-xia, WANG Guo-ji
(Pratacultural College, Gansu Agricultural University; Key Laboratory of Grassland Ecosystem, Ministry of Education, Lanzhou 730070, China)
Phosphate dissolving bacteria had been isolated from rhizosphere of 7 kinds of grasses based on PKO and Mehknha culture media. The results showed that there were different colony characteristics in growth rate, color, shape, edge integrity, as well as the surface condition of the ridge in different bacteria strains. The number of inorganic phosphate solubilizing strains from rhizosphere ofAchnatheruminebriansshowed that soil adhering to roots>rhizoplan or surface of roots>histoplan or interior of roots, strains from others grasses were rhizoplan or surface of roots>soil adhering to roots>histoplan or interior of roots distribution trend. In the first 10 days, most of the dissolved inorganic phosphorus strain’s D/d stabilized, but most of the dissolved organic phosphorus strain stabilized in the first 14 d. Phosphorus solubilizing capability of the strains were determined by the molybdenum blue spectrophotometry, the results indicated that there were lager differences in 109 phosphate-dissolving microorganisms capability, phosphate concentration was between 0.47~582.46 μg·mL-1, of which strain PCRP5 had the highest phosphate solubilization capacity. For the 143 strains organic phosphate dissolving bacteria, the ability to dissolve organic phosphorus was large (concentration was 0.07~14.76 μg·mL-1), the highest P concentrations was strains MCMRS4. There were no obvious relationship between the organic phosphorus strains solubilization capacity and pH (P>0.05), however pH of PKO showed significant negative relationship with the organic phosphorus strains P concentration (P<0.01).
grasses; inorganic phosphate solubilizing bacteria; organic phosphate solubilizing bacteria; capacity of dissolving phosphate
YAO Tuo E-mail:yaotuo@gsau.edu.cn
10.11829j.issn.1001-0629.2014-0163
2014-04-09 接受日期:2014-10-27
国家自然基金(31360584);国家科技支撑计划(2012BAC01B02-4)
马文文(1988-),女,甘肃甘谷人,在读硕士生,主要从事草地微生物生态研究。E-mail:834582161@qq.com
姚拓(1968-),男,甘肃镇原人,教授,博士,主要从事草地微生物生态和草地微生物资源利用研究。E-mail:yaotuo@gsau.edu.cn
S544.01;Q945.12
A
1001-0629(2015)04-0515-09*
马文文,姚拓,蒲小鹏,卢虎,张玉霞,王国基.东祁连山7种禾草根际溶磷菌筛选及其溶磷特性[J].草业科学,2015,32(4):515-523.
MA Wen-wen,YAO Tuo,PU Xiao-peng,LU Hu,ZHANG Yu-xia,WANG Guo-ji.Screening and characteristics of phosphate-solubilizing bacteria in rhizosphere of 7 grasses on eastern Qilian Mountains[J].Pratacultural Science,2015,32(4):515-523.

