65Mn、35Cr2Ni3MoV和AF1410在模拟海洋环境中的耐蚀性
李冬冬,邓尼丝,许佳宁,张三平
(1.武汉材料保护研究所,武汉430030;2.材料表面保护技术湖北省重点实验室,武汉430030;3.日本京都大学,京都6158540;4.武汉理工大学 材料复合新技术国家重点实验室,武汉430070)
随着人口快速增长、资源短缺以及环境日益恶化等问题的出现,人类对海洋资源的开发与利用已经迫在眉睫[1]。现代科学技术的迅猛发展促进了海洋开发规模的不断扩大,金属及合金材料被广泛应用于船舶、海上平台、临海工业、人工岛、码头、石油输送管道等设施[2]。金属材料在海洋环境中使用会受到强烈日光、盐雾、海水、海生物等因素的影响从而造成严重的腐蚀问题,影响海洋装置的正常使用,甚至造成灾难性的后果[3-5]。目前,金属实海试验和室内模拟研究是研究金属海洋环境腐蚀行为最常用的两种方法。实海试验是一种可靠的试验方法,同时也存在着试验周期长、试验参数不可控、试验数据不具普遍性等问题;室内模拟研究则可以通过对试验方法和参数的调整,对不同海洋大气环境中金属的腐蚀行为、规律和机理进行快速研究,为合理构建金属海洋设施及针对不同海洋环境采取恰当的防腐蚀方案提供依据[6-7]。
本工作选取某海洋设施设计采用的65Mn、35Cr2Ni3MoV、AF1410三种金属材料进行室内模拟海洋环境的人造海水全浸试验、盐雾/干/湿交替循环试验和腐蚀电化学试验,分析了三种材料在各模拟环境中的腐蚀行为,为三种材料在实际海洋环境中的使用和防护提供依据。
1 试验
试验材料采用某海洋设施设计采用的65Mn、35Cr2Ni3MoV和AF1410三种金属板材,材料均为供货状态,其主要化学成分如表1所示。
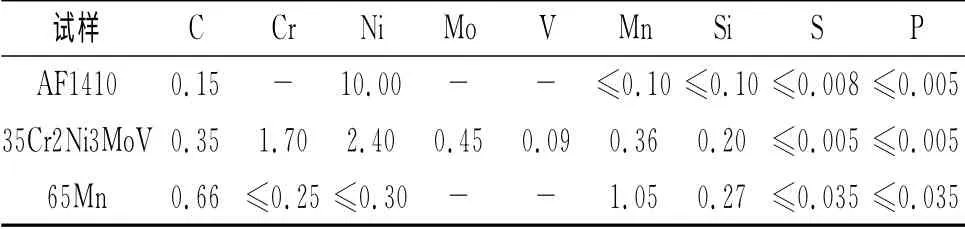
表1 三种金属材料的主要化学成分Tab.1 Main chemical components of the three metal materials
1.1 电化学试验
将三种材料分别切割为10mm×10mm的试样,焊接导线后用环氧树脂进行封装,抛光后用酒精擦洗后置于干燥器中备用。
电化学试验在PARSTAT 2273电化学工作站上完成,采用标准的三电极体系,辅助电极为石墨电极,参比电极为饱和甘汞电极(SCE),工作电极为待测试样,试验介质为3.5%NaCl溶液,试样工作面积为1cm2。文中电位若无特指,均相对于SCE。动电位极化曲线测试扫描区间为-250~+250mV(相对于开路电位),扫描速率为0.333 3mV/s。电化学阻抗谱测试频率范围为0.1~1.0×105Hz,正弦波激励信号幅值为10mV。测试结果利用ZSimpWin软件进行拟合和分析。
1.2 人造海水全浸试验
将外形尺寸约为(50~100)mm×50mm×5mm的三种金属板材用120号水砂纸研磨后及时用水、丙酮、酒精等洗净,迅速干燥后放于干燥皿内,置于室温后测量其尺寸和质量。
试验试样参照GB/T 10124-1988《金属材料实验室均匀腐蚀全浸试验方法》,将试样置于人造海水(化学组成如表2所示)中在室温下进行240h、480h、720h和1000h的全浸试验。试验过程中按照要求约7d更换一次人造海水,试验结束后记录外观并参照GB/T 16545-1996《金属和合金的腐蚀 腐蚀试样上腐蚀产物的清除》清除腐蚀试样上的腐蚀产物,称量并观察、记录外观,计算腐蚀速率。
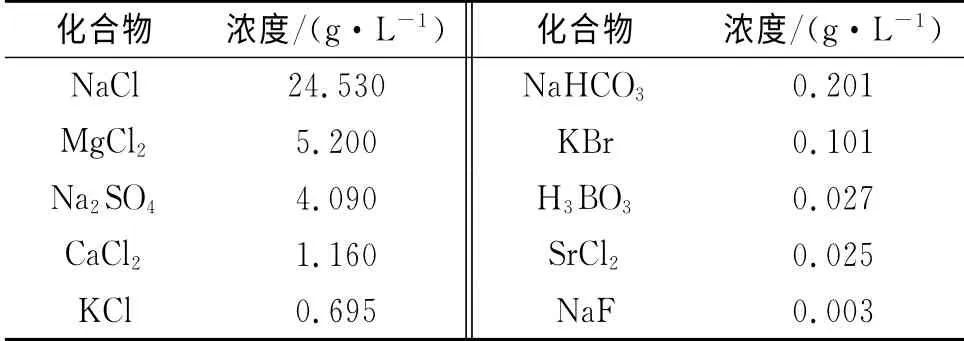
表2 人造海水化学组成Tab.2 Chemical components of the artificial seawater
腐蚀速率R计算公式如下:
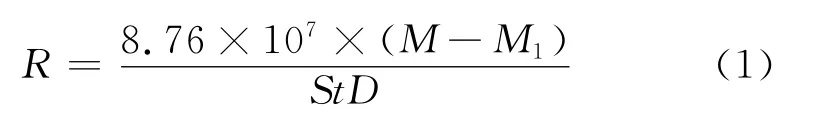
式中:R为腐蚀速率,mm/a;M为试验前试样质量,g;M1为试验后试样质量,g;S为试样总面积,cm2;t为试验时间,h;D为材料密度,kg/m3。
1.3 盐雾/干/湿交替循环腐蚀试验
盐雾/干/湿交替循环腐蚀试验用试样的制备过程与人造海水全浸试验一致。
盐雾-干-湿交替循环腐蚀试验在Q-FOG循环腐蚀试验箱中进行,参照GB/T 20854-2007《金属和合金的腐蚀 循环暴露在盐雾、“干”和“湿”条件下的加速试验》进行试验和仪器参数设置,试验时间分别为240h、480h、720h和1 000h。单次循环中:喷雾2h,5%NaCl溶液,温度(35±2)℃;干燥4h,温度(60±2)℃,相对湿度<30%RH;潮湿2h,温度(50±2)℃,相对湿度>95%RH。试验箱中试样固定于试验架上,正面朝上,与竖直方向成约20°夹角。试验进行过程中观察试样腐蚀情况。试验取出的试样参照GB/T 16545-1996《金属和合金的腐蚀 腐蚀试样上腐蚀产物的清除》清除腐蚀试样上的腐蚀产物,称量并观察、记录外观,计算腐蚀速率。
2 结果与讨论
2.1 电化学腐蚀行为
2.1.1 动电位极化曲线
图1所示为三种材料在3.5%NaCl溶液中的动电位极化曲线,表3为三种材料的相关电化学参数拟合结果。其中点蚀电位Eb100为腐蚀电流密度为10-4A·cm-2时对应的阳极电位值,如图1中虚线所示。点蚀电位越大表明材料耐点蚀性能好,自腐蚀电位越高表明材料越难阳极极化,自腐蚀电流密度越小表明材料的腐蚀速率越小。从表中数据可知,三种金属裸材点蚀电位和自腐蚀电位的大小排序均为AF1410>35Cr2Ni3MoV>65Mn,而自腐蚀电流密度的大小排序为AF1410<35Cr2Ni3MoV<65Mn。综合以上三种参数可以初步知道这三种材料在3.5%NaCl溶液中耐蚀性能,AF1410较优,35Cr2Ni3MoV次之,65Mn较差。
同时,由图1可以看出,三种材料均无明显的钝化区,腐蚀电流密度会随着极化电位的升高而迅速增加。因此,总的来说该三种材料的耐蚀性能均较差,这三种材料在海洋环境中使用均应采取必要的防护措施。
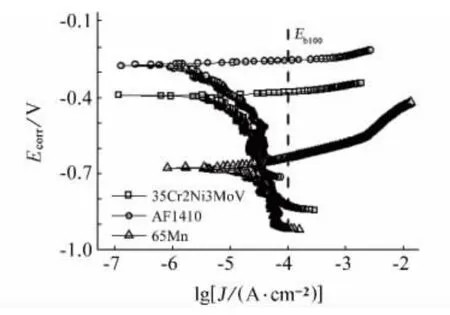
图1 三种金属在3.5%NaCl水溶液中的动电位极化曲线Fig.1 Potentiodynamic polarization curves of the three metal materials in 3.5%NaCl aqueous solution

表3 三种金属的腐蚀电位和自腐蚀电流密度Tab.3 The free corrosion potential and the corrosion current density of the three metal materials
2.1.2 电化学阻抗谱
图2为三种材料在3.5%NaCl溶液中的电化学阻抗谱。由图2可见,AF1410的Nyquist曲线在低频区与65Mn、35Cr2Ni3MoV有较明显的差别,主要是由于材料表面双电层特性存在差异[8]。
采用ZSimpWin对图2进行拟合,65Mn、35Cr2Ni3MoV采用的等效电路如图3(a)所示,而AF1410采用的等效电路如图3(b)所示。模拟采用的等效电路图中,Rs为溶液的等效电阻,Qd、Rd分别为氧化膜的等效常相位角元件CPE以及等效电阻,Ct、Rct分别为双电层的等效电容以及电荷转移的等效电阻,Qct则为双电层的等效常相位角元件,具体拟合数据如表4所示。
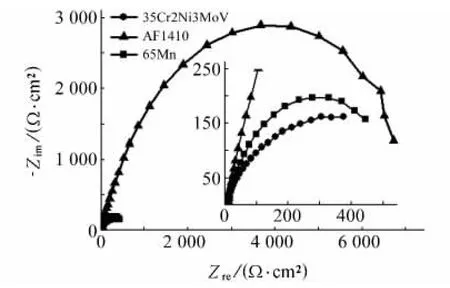
图2 三种金属在3.5%NaCl水溶液中的Nyquist曲线Fig.2 Nyquist plots of the three metal materials in 3.5%NaCl aqueous solution
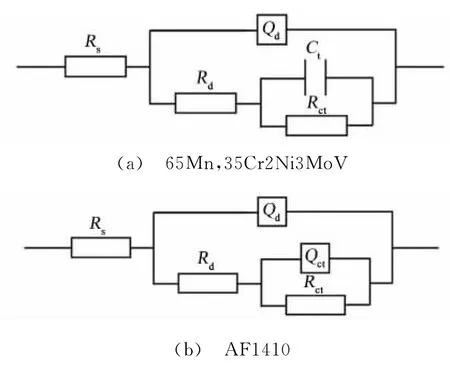
图3 3种材料的电化学阻抗图谱模拟的等效电路Fig.3 Simulated electrical equivalent circuits of EIS for three materials
通常认为在电化学阻抗谱的拟合过程中当表面出现弥散效应时,常相位角元件比电容能够更准确地获得拟合数据[9-10]。对比AF1410与6 5Mn、35Cr2Ni3MoV的氧化膜CPE的n值可以发现AF1410的n值明显要小,说明其氧化膜表面比另两种材料的微观更不均匀,导致双电层的弥散效应也越大,所以用常相位角元件Qct模拟AF1410的双电层电容,而65Mn、35Cr2Ni3MoV的双电层电容则采用电容Ct模拟。同时,对比三种材料的等效电路图可以发现,只有双电层的电容等效元件Ct和Qct不同,说明AF1410与65Mn、35Cr2Ni3MoV的双电层电容特性存在明显区别,这就是上述三种材料Nyquist曲线在低频区不同的原因。
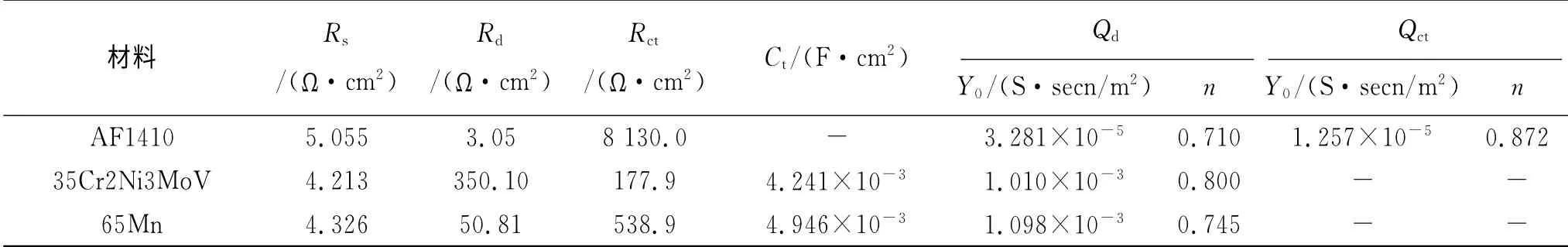
表4 电化学阻抗谱拟合数据Tab.4 Electrochemical impedance spectroscopy simulation data
35Cr2Ni3MoV的氧化膜电阻比65Mn的大一个数量级、Y0值也略小,说明35Cr2Ni3MoV表面产生氧化膜的量相对要多且相对致密,n值较大则弥散效应较低说明其氧化膜比较平整、性能较为单一,材料阻挡腐蚀的能力也要更好。
AF1410的氧化膜电阻较65Mn的要小一个数量级、氧化膜CPE的Y0值却也比65Mn的小两个数量级、同时n值相对较小,说明AF1410较65Mn产生的氧化膜数量要少且平整性要差,但是氧化膜的致密程度却要高得多。
AF1410的氧化膜电阻比35Cr2Ni3MoV的小两个数量级,说明35Cr2Ni3MoV产生的氧化膜数量要远大于AF1410;AF1410氧化膜CPE的Y0要比35Cr2Ni3MoV的小两个数量级、n值也较小,说明产生的氧化膜致密性要好得多,但是平整性较差,所产生的弥散效应较强。同时,电荷转移电阻AF1410要比35Cr2Ni3MoV大一个数量级,结合后续试验可以发现,AF1410的耐蚀性能明显优于35Cr2Ni3MoV,说明在这两种金属腐蚀过程中双电层电荷转移电阻大小比氧化膜电阻更能衡量其耐蚀性。
综合以上分析,在电化学测试中三种金属表面氧化膜多少排序为35Cr2Ni3MoV>65Mn>AF1410,氧化膜的致密性排序为AF1410>35Cr2Ni3MoV>65Mn,氧化膜的平整性排序为35Cr2Ni3MoV>65Mn>AF1410,材料耐蚀性排序为AF1410>35Cr2Ni3MoV>65Mn。
2.2 人造海水全浸耐蚀性能研究
经不同时间人造海水全浸试验后三种材料的宏观形貌分别如图4~6所示。

图4 经不同时间人造海水全浸试验后65Mn的宏观形貌Fig.4 Macro-morphology of 65Mafter full immersion experiment in artificial sea water for different times

图5 经不同时间人造海水全浸试验后35Cr2Ni3MoV的宏观形貌Fig.5 Macro-morphology of 35Cr2Ni3MoV after full immersion experiment in artificial sea water for different times
由图4~6可见,三种金属材料均形成了覆盖整个试样表面的锈层,均无明显的点蚀现象出现,都发生均匀腐蚀,且随着全浸时间的增加,锈层的厚度越来越厚,颜色也明显加深。图4中65Mn和图6中AF1410试样编号孔处腐蚀明显,主要因为试样在加工过程中可能产生的应力、热影响、掺杂等缺陷,从而容易产生腐蚀。三种材料表面锈层均不多,因为全浸过程中有一大部分的腐蚀产物进入到溶液中去,65Mn材料表面存在明显的锈层脱落痕迹,也说明了65Mn产生的锈层比较疏松。同时,三种材料腐蚀产物均呈现黄、红、黑等多种颜色,腐蚀产物的颜色与各材料的物相有关。

图6 经不同时间人造海水全浸试验后AF1410的宏观形貌Fig.6 Macro-morphology of AF1410after full immersion experiment in artificial sea water for different times
取出的试样除锈后称量,计算各阶段腐蚀速率结果如表5所示。由表5可见,AF1410在人造海水中的耐蚀性明显优于35Cr2Ni3MoV和65Mn,而35Cr2Ni3MoV的耐蚀性则优于65Mn,该结果与电化学试验结果相同。
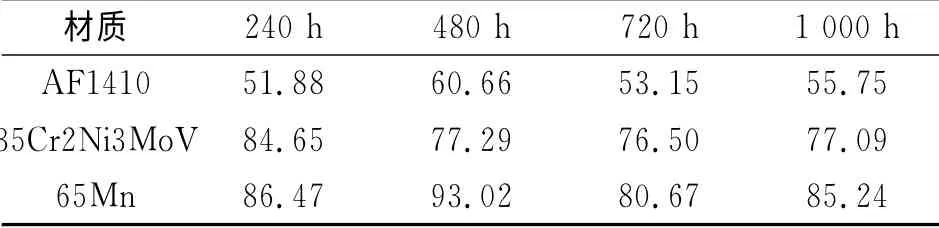
表5 三种金属人造海水全浸试验平均腐蚀速率Tab.5 Average corrosion rates of the three metal materials in the artificial seawater μm/a
由表5可见,AF1410的腐蚀速率呈先增大后减小的现象,这是因为AF1410的耐蚀性能最好,在0~240h内形成锈层厚度和致密度都较小,对腐蚀的阻碍作用不强,腐蚀速率在240~480h内继续增大;在480h时已经形成足够厚且致密的锈层,对腐蚀的进一步发展起到较强的保护作用,所以腐蚀速率会下降,直至锈层的阻挡保护作用与试样腐蚀发展趋于平衡,腐蚀速率也变得相对稳定。35Cr2Ni3MoV在240h内就已经形成对腐蚀阻碍作用足够强的锈层,所以之后腐蚀速率都比240h时低,且因为锈层的保护与试样腐蚀发展达到平衡,所以腐蚀速率变得稳定。65Mn耐蚀性能最差,本来在240h内就可以形成阻碍作用较强的锈层,但是由于形成的锈层较为疏松,容易脱落且易于进入人造海水溶液中,故而在240h时仍没有形成阻碍作用较强的锈层,见图4(a),所以浸泡在240~480h后腐蚀速率会继续增大;待形成具有较强保护作用的锈层后,65Mn的腐蚀速率在480~720h内会有所下降,但是产生的锈层又会发生大面积脱落,见图4(d),导致保护作用减弱,所以在1 000h的腐蚀速率又有所上升。
2.3 盐雾/干/湿交替循环耐蚀性能研究
盐雾/干/湿交替循环腐蚀试验是一种较为有效的加速腐蚀试验方法,试验中有海盐离子、湿度、温度等条件的影响,是一种常用的快速评价金属耐蚀性的方法。
加速试验在240h、480h、720h和1 000h时分别取试样,三种金属材料的宏观形貌如图7~9所示。
由图7~9可见,三种金属材料在相同试验时间里均形成了较之全浸试验要厚的均匀锈层,试样无点蚀现象,说明盐雾/干/湿交替循环试验环境比人造海水全浸要严苛的多,65Mn加速21.6倍以上,35Cr2Ni3MoV加速15.7倍以上,AF1410加速4.5倍以上,对模拟金属腐蚀加速效果明显,也说明了较不耐蚀的金属腐蚀的加速倍率更高。随着试验时间的延长,锈层厚度明显加厚,锈层颜色也发生明显变化,说明腐蚀在不断进行,同时腐蚀产物的物相组成也会随着时间的增加而发生变化。AF1410形成的锈层明显比65Mn和35Cr2Ni3MoV要致密,锈层保护作用好,这是它比另外两种金属耐蚀的一个原因。
取出的试样除锈后称量,计算阶段腐蚀速率,试验结果见表6。由表6可见,三种材料腐蚀速率依次为:AF1410<35Cr2Ni3MoV<65Mn,结果与前述试验结果保持一致。
由表6可知,AF1410、35Cr2Ni3MoV在0~720h试验时间内腐蚀速率不断增大,在720~1 000h内腐蚀速率降低;65Mn腐蚀速率先减小、略微增大后又减小的趋势。在盐雾/干/湿交替循环环境中,腐蚀机理复杂,但主要与材料腐蚀后生成的腐蚀产物有关,其对腐蚀的阻挡作用又由其微观形貌和物相等因素而决定。

图7 65Mn盐雾/干/湿交替循环腐蚀宏观形貌Fig.7 Macro-morphology of 65Mn after salt fog/wet/dry alternate circulation experiment for different times

图8 35Cr2Ni3MoV盐雾/干/湿交替循环腐蚀宏观形貌Fig.8 Macro-morphology of 35Cr2Ni3MoV after salt fog/wet/dry alternate circulation experiment for different times

图9 AF1410盐雾/干/湿交替循环腐蚀宏观形貌Fig.9 Macro-morphology of AF1410after salt fog/wet/dry alternate circulation experiment for different times

表5 三种金属盐雾/干/湿交替循环试验平均腐蚀速率Tab.5 Average corrosion rates of the three metal materials in salt fog/wet/dry alternate circulation experiment μm/a
3 结论
(1)3种金属在模拟海洋环境中的腐蚀速率AF1410<35Cr2Ni3MoV<65Mn。
(2)AF1410的双电层电容弥散效应比65Mn、35Cr2Ni3MoV的大,电化学反应界面的容抗值用CPE进行模拟,而65Mn、35Cr2Ni3MoV的则用电容模拟。三种金属表面氧化膜多少排序为35Cr2Ni3MoV>65Mn>AF1410,氧化膜的致密性排序为AF1410>>35Cr2Ni3MoV>65Mn,氧化膜的平整性排序为35Cr2Ni3MoV>65Mn>AF1410。
[1]夏兰廷,黄桂桥,张三平,等.金属材料的海洋腐蚀与防护[M].北京:冶金工业出版社,2003.
[2]KAZUAKI Z.Corrosion and life cycle management of port structures[J].Corrosion Science,2005,10(47):2353-2360.
[3]丰卫东.海洋环境对金属材料的腐蚀及其评价方法[J].装备环境工程,2005,2(6):86-89.
[4]赵炯,邱日,柴丰涛,等.船舶用低合金钢在模拟海水中的腐蚀行为研究[J].浙江理工大学学报:自然科学版,2014,31(4):488-490.
[5]冯立超,贺毅强,乔斌,等.金属及合金在海洋环境中的腐蚀与防护[J].热加工工艺,2013,42(24):14-17.
[6]江旭,柳伟,路民旭.钢铁海洋大气腐蚀试验方法的研究进展[J].腐蚀科学与防护技术,2007,19(4):282-286.
[7]焦淑菲,尹艳镇,梁金禄,等.海洋环境中的钢铁腐蚀模拟研究[J].化工技术与开发,2013,42(8):48-50.
[8]JUTTNER K.Electrochemical impedance apectroscopy(EIS)of corrosion processes on inhomogeneous surfaces[J].Electrochimica Acta,1990,35(10):1501-1508.
[9]ZHAO H J,LIU L,WU Y T,et al.Investigation on wear and corrosion behaviour of Cu-graphite composities prepared by electroforming[J].Composities Science and Technology,2007,67(6):1210-1217.
[10]LIU C,BI Q,LEYLAND A,et al.An electrochemical impedance spectroscopy study of the corrosion behaviour of PVD coated steels in 0.5NNaCl aqueous solution:PartⅡ.Eis interpretation of corrosion behavior[J].Corrosion Science,2003,45(6):1257-1273.

