口腔微生物对钛及其合金的腐蚀影响研究进展
何 玥,屈 庆,李 蕾
(1.云南大学 化学科学与工程学院,昆明650091;2.云南大学 生物资源保护与利用重点实验室,昆明650091)
口腔作为人体的开放性器官,其中所含的微生物种类繁多、数目庞大。正常口腔微生物群包括细菌、真菌、原虫和病毒。现有的检测数据表明,口腔中的细菌多达600种,常见的有血链球菌、白色念珠菌、牙龈卟啉菌、变形链球菌等[1]。这导致了口腔环境的复杂性,给研究工作带来了很多困难。
钛及其合金是牙科领域常用的口腔材料,以其良好的耐腐蚀性、适宜的机械性能和极佳的生物相容性而备受关注。钛及其合金的强耐蚀性是由于其表面钝化膜的形成,然而,处于钝态的钛及其合金仍有一定的反应能力,即钝化膜的溶解和修复(再钝化)处于动态平衡状态,此时,外界环境的改变很容易破坏其动态平衡,对其溶解起到加速作用[2-3]。
钛及其合金在口腔环境中的溶解会导致唾液成分发生变化,可能对人体产生危害[4-5]。研究口腔环境中钛材的腐蚀特点和机理,开发新型、绿色、无毒副作用的钛材料对保证人体健康有重要意义。因此,近几十年来,国内外越来越多的学者致力于钛材在口腔中的腐蚀影响研究,但由于口腔环境的复杂性和检测手段的局限性,牵涉到口腔微生物的研究相对较少,且多数研究都只停留在对单一口腔微生物腐蚀的研究和模拟口腔水平。目前,有关口腔微生物对钛及其合金的腐蚀研究虽然也取得了一些进展,但其影响机理尚不清楚。本工作拟通过对几种常见口腔微生物对钛及其合金的腐蚀研究现状进行综述,探讨口腔微生物在钛材腐蚀中的作用与机理,展望口腔微生物对钛材的腐蚀研究趋势。
1 微生物腐蚀
微生物腐蚀(Microbiologically Influenced Corrosion,简称MIC)是指受微生物影响的金属及合金的腐蚀。微生物腐蚀并非微生物本身对金属的腐蚀,而是指在微生物生命活动参与下,由微生物引发和催化的电化学反应。微生物腐蚀研究由来已久,1910年,R.H.Gaines发现并提出微生物腐蚀,1934年,荷兰学者C.A.H.Kuhr等[4]首先提出硫酸盐还原菌(SRB)参与金属腐蚀的阴极去极化理论。此后,人们越来越重视并参与到微生物腐蚀研究中,Postgate[6]系统研究了硫酸盐还原菌的生理、生态和生化特征及营养需求,为微生物腐蚀研究奠定了基础。但由于微生物腐蚀较为复杂,影响因素较多,故对微生物的腐蚀机理尚无一致看法。
2 钛及其合金作为口腔材料的运用
2.1 钛及其合金作为口腔材料的发展简史
钛自1965年开始正式作为牙科材料应用在医学领域至今已有近50年的历史。1965年,Branemark[7-8]首次将纯钛制成的人工牙根种植于无牙颌患者。20世纪80年代初,用纯钛铸造的冠桥材料开始在口腔中使用。同时Ti-6Al-4V成为最早也是最常用的牙科材料。到20世纪80年代中期,科学家们陆续发现Ti-6Al-4V在口腔中会溶解释放出有毒的铝离子和钒离子,对人体有害,这一问题引起医学界的高度关注,于是科学家们开始致力于无毒副作用的新型口腔材料的开发[9]。这一时期最典型的是钛镍合金(也称形状记忆合金)在牙科领域的应用,直到现在这种材料在牙科材料都还占有一席之地[10]。现阶段人们愈发重视口腔材料的综合性能,一方面致力于绿色、无毒副作用的口腔材料的开发;另一方面尝试在纯钛中掺杂其他金属,制成合金,使钛材的机械性能得以提高,耐腐蚀性能得以增强,生物相容性得以改善。
2.2 钛及其合金作为口腔材料的优越性
表1列举了常用的生物医用钛合金,表中S代表瑞士,G代表德国,J代表日本,U代表美国。这些口腔材料各有优缺点,麻健丰等[12]通过粗糙度试验对比了纯钛、钴铬合金和镍铬合金的耐腐蚀性,研究发现三种材料的耐腐蚀性由大到小排列为:纯钛>钴铬合金>镍铬合金。袁俊等[13]研究了不同pH的人工唾液对经过烤瓷工艺处理的金合金、纯钛、钴铬合金、镍铬合金的耐腐蚀性能的影响,结果显示四种材料在酸性人工唾液中的自腐蚀电流密度、自腐蚀电位负值均比在中性人工唾液中大,且发现金合金和纯钛在酸性环境中的耐腐蚀性能优于钴铬合金和镍铬合金。张玉梅等[14]采用细胞毒性试验,溶血试验及口腔黏膜刺激试验对Ti-Zr合金的生物安全性进行了初步评价。结果显示:Ti-Zr合金细胞毒性试验评级为0级,溶血程度为0.15%,口腔黏膜刺激试验未见异常组织反应。从张玉梅的试验结果可以初步认为Ti-Zr合金是一种理想的生物材料。孙平等[15]选择临床常用烤瓷合金,采用MTT法检测乳酸脱氢酶活性,通过测定合金析出离子对体外培养细胞的影响,比较不同合金对细胞增殖的作用,从而了解细胞毒性。结果发现,镍铬烤瓷合金抑制细胞增殖最明显,含钛的镍铬烤瓷合金、钴铬烤瓷合金次之。综合以上研究结果可认为:钛及其合金具有良好的耐腐蚀性、适宜的机械性能和极佳的生物相容性。然而,钛材在口腔中仍有一定的溶解能力,主要是由于处于钝态的钛及其合金仍有一定的反应能力,即钝化膜的溶解和修复(再钝化)处于动态平衡状态,外界环境的改变会破坏其动态平衡,对溶解起到加速作用,从而导致钛材的溶解腐蚀。钛材在口腔中的轻微腐蚀不仅会造成口腔修复材料的损失,而且可能导致人体的不适[4-5]。因此,研究钛材在口腔中的腐蚀行为和腐蚀机理对减小钛材损失和保证人民生命安全有深远意义。

表1 生物医用钛合金Tab.1 Biomedical titanium alloys
3 口腔微生物对钛及其合金腐蚀研究现状
口腔环境是一个非常复杂的电解质环境,细菌是口腔环境中不可避免的微生物,而细菌对口腔植入材料有着不可忽视的腐蚀作用。口腔微生物研究表明,健康口腔不是无菌环境,是需氧菌、少量厌氧菌和某些霉菌的生长平衡,每个人的口腔都是一个菌群平衡的环境,这些共生的正常菌群对宿主一般无影响,但是,一旦这种平衡被打破,机会菌就会增生繁殖,引起一些口腔乃至全身的疾病。
鉴于口腔环境的复杂性,越来越多的学者认为有必要先研究单种微生物对口腔材料的腐蚀行为,Screenivas等[16]研究了牙种植体周围微生物的聚集情况,发现种植体的腐蚀与微生物菌群有关。Willershausen等[17]用扫描电镜观察细菌对口腔材料的影响,发现材料变化与材料性质和细菌均有关,并证明口腔细菌对材料变化有重要影响。为进一步弄清钛及其合金在口腔中的腐蚀机理。近几年来,人们开始着重研究常见口腔微生物(血链球菌、白色念珠菌、牙龈卟啉菌和远缘链球菌g型等)对钛及其合金的腐蚀作用。
3.1 血链球菌(Streptococcus sanguis)
口腔链球菌是口腔中的常驻菌,是口腔正常菌中的主要菌群,占微生物种类的50%以上[18]。血链球菌属口腔链球菌,是一种兼性厌氧革兰氏阳性菌,呈球形或椭圆形,是典型的产酸菌,它是最先定植到牙齿表面的"先锋军",也是拮抗牙周可疑致病菌的重要有益菌之一[19]。
Wilson等[20]研究了血链球菌对口腔材料的腐蚀影响,结果表明血链球菌的存在对口腔材料的影响非常大。他们认为可能是血链球菌能在材料表面形成微生物膜并分泌胞外基质生成凝胶相,凝胶相的形成阻碍了酸性代谢产物乳酸的向外扩散,同时血链球菌的生命活动会消耗微生物膜内的氧气,在无氧的情况下,钝化膜无法修复,随着浸泡时间的延长,最终会导致了口腔材料的溶解。国内,陈亚军[25]通过试验也证实了这一点。实际上,细菌的新陈代谢产物(包括有机酸和无机酸)也会通过影响口腔材料表面或界面的pH和介质组成的变化,进而影响金属的电化学反应过程。到目前为止,已有很多报道认为乳酸会引起钛的腐蚀[21-23]。Philip等[24]首先针对性地对血链球菌的代谢产物进行了研究,发现血链球菌的代谢产物主要为有机酸,分别为乳酸、甲酸、醋酸等,其中乳酸的含量最大。Mabilleau等[20]通过试验证明纯钛在乳酸与氟离子共存环境中的腐蚀程度比在只有氟离子的环境中严重。陈亚军[25]在含有不同pH乳酸的人工唾液中进行试验,从SEM图上发现,随着溶液pH的降低,钛表面点蚀的半径逐渐增大,Tafel极化数据显示了血链球菌及乳酸共同存在时钛发生了严重的腐蚀,电化学阻抗谱显示随着浸泡时间的延长,腐蚀加重,说明乳酸的存在加速了点蚀。
3.2 白色念珠菌(Candida albicans)
白色念珠菌,属念珠菌属,又称白色假丝酵母菌,属革兰阳性菌,卵圆形,有芽并有假菌丝。白色念珠菌是一种条件致病菌,通常存在于正常人体口腔、上呼吸道、肠道等部,当机体免疫功能或一般防御能力降低,或正常寄居的微生物间相互作用失调,就容易引起念珠菌病。同时,作为假丝酵母中的一员,白色念珠菌是最常见的酵母,可从龋洞中分离出来,与口腔真菌感染心内膜炎和败血症密切相关。
P.C.Tatiana等[26]研究了变形链球菌和光滑念珠菌对白色念珠菌生物膜形成的影响,得出结论:念珠菌生物膜的形成与有无唾液、基底类型和有无其他微生物存在有密切关系。宋应亮等[27]用色度计对白色念珠菌引起金属的失泽腐蚀问题进行研究,结果显示:镍铬合金、钴铬合金、铸钛修复体的失泽范围主要集中在黄绿区域内,并且白色念珠菌对镍铬合金和铸钛修复体的腐蚀失泽影响较对钴铬合金大。宋应亮等的研究结果证明了白色念珠菌对口腔材料具有明显的失泽腐蚀影响,但是其腐蚀机理及腐蚀规律尚不清楚,有待进一步研究。富丹丽等[28]运用金属表面粗糙度试验进一步对口腔白色念珠菌引起金属腐蚀的问题进行研究,结果发现白色念珠菌对钴铬合金的耐腐蚀性能影响较钛合金明显,但也没有提出具体的腐蚀机理。
3.3 牙龈卟啉菌(Porphyromonas gingivalis)
牙龈卟啉菌为革兰氏阴性厌氧球杆菌,是牙周病的重要病原菌,流行病学[29]表明,牙龈卟啉菌与牙周炎的发生显著相关,其中蛋白酶是重要的毒力因子。目前,牙龈卟啉单胞菌已成为口腔微生物学中少数几个作为重点研究的厌氧菌之一。
宋应亮等[30]研究了牙龈卟啉菌381对纯钛及钛75合金种植体表面的失泽腐蚀影响,结果表明,牙龈卟啉菌381对纯钛(钝化)、钛75合金(钝化、非钝化)引发肉眼可见的表面失泽,且不受钛75合金表面钝化膜形成方式不同影响。由色度计分析知三种类型试件表面颜色由绿黄区域向红黄区域移动。但对钛及其合金腐蚀失泽原因并不清楚。有人认为可用“硫化物作用理论”[31]来解释这一现象,因为牙龈卟啉菌381可以产生硫化氢[32],但这种解释是否合理仍有待验证。
3.4 远缘链球菌g型(Streptococcus Sobrinus,type g)
远缘链球菌g型是变形链球菌的一种,属革兰阳性菌,是人类牙菌斑中最常检出的致龋菌,在口腔中喜居于牙面和义齿表面,在酸性环境中继续降低pH的能力和产酸总量较高,具有很强的粘附能力和耐酸性[33]。
宋应亮等[34]在研究远缘链球菌g型对铸钛、钴铬合金、镍铬合金修复体腐蚀失泽作用时发现,远缘链球菌g型对铸钛、钴铬合金、镍铬合金色泽均有影响,但未超出黄绿区域。D.Steinberg等[35]研究发现远缘链球菌g型在很多口腔修复材料表面均可形成微生物膜,微生物的吸附能力与材料类型、材料的表面粗糙度等有关,但未能提出具体的微生物膜形成机理。
4 口腔微生物对钛及其合金的腐蚀机理初探
同其他微生物一样,口腔微生物的腐蚀机理也较为复杂,目前尚无一致的看法,但一般认为生物膜的形成和代谢产物在腐蚀过程中起着很大的作用。
4.1 微生物膜机理
不同类型的附着菌种互相接近,互相协作,形成混合菌群,导致了微生物膜的逐渐形成,这是一种具有种和属多样性和相对稳定性的生物膜。微生物膜的主要成分是水(70%~90%)和细菌粘液物质(由高聚糖、蛋白质、糖蛋白和脂蛋白组成,又称为胞外高聚物,简称EPS)[36-38]。微生物膜的形成是一个高度自发的过程,是生长和消亡交替进行,且随环境不断变化的动态过程。图1为生物膜的形成和增长过程示意图。
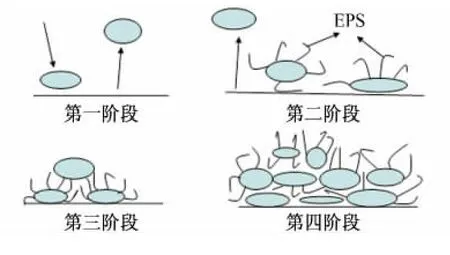
图1 微生物膜的形成和增长过程Fig.1 The formation and growth of microbial film
陈亚军[25]观察血链球菌在钛材表面的吸附情况,在扫描电镜下清晰地看到血链球菌在钛材表面吸附。通过荧光显微镜观察发现细菌首先吸附至钛材表面,然后经多次吸附后形成不均一的微生物膜。由于微生物膜的“扩散屏障”作用,导致乳酸等酸性代谢产物的局部累积,同时制造了生物膜内的缺氧环境,为宏观点蚀提供了更有利的条件。S.L.Percival[39]认为微生物腐蚀的关键是生物膜的形成及其与金属基底间的相互作用,控制微生物腐蚀的有效途径是控制微生物膜的形成和生长过程。
4.2 代谢产物机理
4.2.1 酸腐蚀机理
金属及其合金在pH降低时会加速腐蚀,释放出更多的金属阳离子。细菌代谢产生的有机酸特别是乳酸,被认为会引起钛的腐蚀[21-23]。经研究发现随着pH的降低,金属的腐蚀速度明显增加,这是因为H+浓度的增加使氢的平衡电位向正方向移动,在腐蚀电位不变的情况下,腐蚀动力增大了,因而腐蚀加剧[37]。而且介质中增加的H+使金属材料的氧化膜不易形成,钝化速度减慢,即使有氧化膜生成也容易溶解成为溶解度大的金属盐。Mabilleau等[40]的试验结果表明纯钛在乳酸与氟离子共存的环境中腐蚀程度比在只有氟离子的环境中严重。Koike[21]也发现纯钛在37℃,乳酸溶液的pH为1.0~8.5间均发生了溶解,且在低pH条件下腐蚀严重。陈亚军[25]通过试验证明血链球菌的主要代谢产物(乳酸)对钛材具有很强的腐蚀作用,并提出了以下机理:
钛及其合金的强耐蚀性是由于其表面钝化膜的形成,然而,处于钝态的钛及其合金仍有一定的反应能力,即钝化膜的溶解和修复(再钝化)处于动态平衡状态:
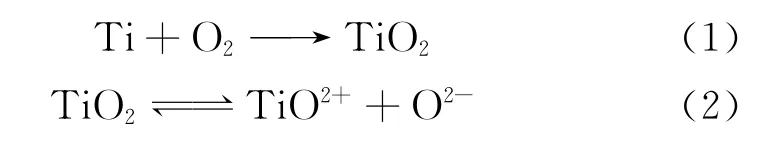
由于分子中存在范德华力,会使乳酸吸附至钛表面并富集,形成乳酸分子膜[21]。吸附至钛表面的乳酸会发生电离,产生H+和L-:
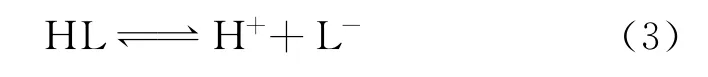
一方面,在水溶液中乳酸电离的L-会跟[Ti(OH)3]+络合形成稳定的络合物,使(2)、(4)中的反应右移;另一方面,乳酸电离出的H+也会和TiO2发生反应,二者的共同作用加速了钝化膜的溶解。其反应如下:
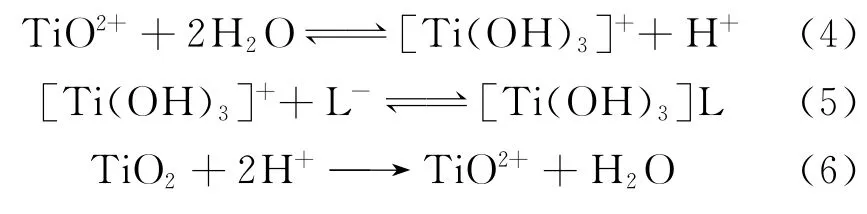
4.2.2 硫化氢(H2S)机理
牙龈卟啉菌381可以产生硫化氢,有人猜想正是H2S的产生导致了钛材的腐蚀,但是根据“硫化物作用理论”我们知道这一猜想只能适用于含有铁元素的钛合金。“硫化物作用理论”[31]认为细菌对金属的腐蚀作用在于提供了硫化物,硫化物降低了金属表面的氧化还原电位,从而加速了金属的腐蚀。具体表现为:首先H2S在水中发生离解:
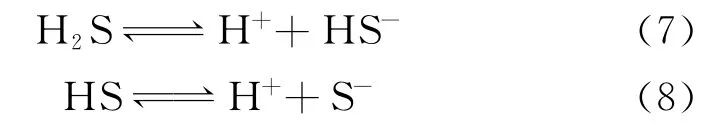
释放出的氢离子是强去极化剂,极易在阴极夺取电子,促进阳极铁溶解反应而造成腐蚀。
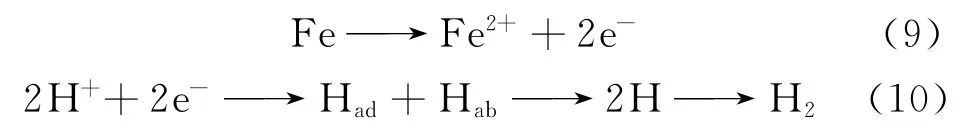
(Had:钢表面吸附的氢原子Hab:钢中吸收的氢原子)。
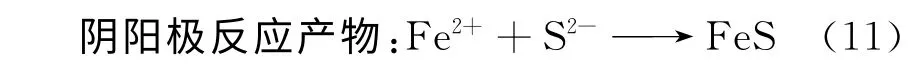
生成的硫化物具有很强的腐蚀性,加速了材料的腐蚀。
4.2.3 过氧化氢(H2O2)机理
Mabilleau等[40]发现,H2O2对钛材有破坏作用,且在前三天尤为严重。研究发现血链球菌和白细胞在炎症反应时会产生H2O2,由于H2O2具有强的氧化性,所以被认为对钛材有腐蚀作用[21]。
4.3 协同机理
随着研究的不断深入,越来越多的研究者认为单一的机理无法解释复杂的口腔微生物腐蚀过程,因此,有人提出微生物腐蚀是生物膜的形成及其代谢产物综合作用的结果。他们认为生物膜与代谢产物协同作用共同影响腐蚀过程具体表现为:(1)二者共同影响电化学腐蚀的阴极或阳极反应;(2)代谢产物改变了膜下的腐蚀环境;(3)微生物新城代谢过程产生的侵蚀性物质改变了金属表面膜电阻;(4)由微生物生长和繁殖所建立的"屏蔽层"导致了金属表面的浓差电池。现在越来越多的研究结果证实了这一点,如Wilson等[20]认为血链球菌能在钛的表面形成微生物膜并分泌胞外基质生成凝胶相。凝胶相的形成会阻碍酸性代谢产物(乳酸)的向外扩散,同时血链球菌的生命活动会消耗微生物膜内的氧气,在无氧的情况下,钝化膜无法修复,随着浸泡时间的延长,最终会导致了钛的溶解。
5 展望
口腔环境的复杂性决定了研究的艰巨性,长期以来科学家们一直停留在单种口腔微生物对钛及其合金的腐蚀研究水平,虽然也取得的很多进展,但是微生物腐蚀机理尚不清晰,规律性也尚未揭示。实验发现了口腔微生物容易在金属表面形成生物膜,但对生物膜的研究也仅停留在宏观层面。为了探明钛材在口腔环境中的腐蚀机理,进而为开发耐腐蚀性能、机械性能和生物相容性更好的钛材料奠定基础,有必要从以下几个角度来开展钛材在口腔环境中的腐蚀行为研究:(1)从单种口腔微生物腐蚀向多种口腔微生物腐蚀方向过渡;(2)运用生物学手段研究生物膜的形成机理及其在腐蚀过程中的作用;(3)分析微生物代谢产物及生物膜对腐蚀过程的综合影响;(4)从模拟口腔研究向原位研究转移;(5)从电化学动力学理论层面揭示微生物腐蚀的机理和规律。
[1]AAS J A,PASTER B J,STOKES L N,et al.Defining the normal bacterial flora of the oral cavity[J].Clinical Microbiology,2005,43(11):5721-5732.
[2]魏宝明主编.金属腐蚀理论及应用[M].第一版.北京:化学工业出版社,1984.
[3]HANAWA T,ASAMI K,ASAOKA K.Repassivation of titanium and surface oxide film regenerated in simulated bio-liquid[J].J Biomedical Mater Res,1998,40(4):530-538.
[4]TIAN B,XIE D B,WANG F H.Corrosion behavior of TiN and TiN/Ti composite films on Ti-6Al-4Valloy in Hank′s solution[J].J Applied Electrochemistry,2009,39(3):447-453.
[5]TAMILSELVI S,RAMAN V,RAJENDRAN N.Corrosion behaviour of Ti-6Al-7Nb and Ti-6Al-4VELI alloys in the simulated body fluid solution by electrochemical impedance spectroscopy[J].J Electrochemical Acta,2006,52(3):839-846.
[6]POSTGATE J R.The sulfate reducing bacteria[M].2ndEdition.Cambridge,England:Camb Univ Press,1979,9-23.
[7]李乐乐,刘丽.牙科合金的口腔微生物腐蚀[J].生物医学工程学杂志,2004,21(5):864-866.
[8]BAHIJIE L,BENYAHIA H.Behavior of Ni-Ti in the presence of oral bacteria:Corrosion by Sreptococcus mutans[J].International Orthodontics,2011,9(1):110-119.
[9]冯颖芳,康浩芳,张震.钛合金医用植入物材料的研究及应用[J].稀有金属,2001,25(5):349-354.
[10]汪大林,江中明.牙科合金材料应用研究现状[J].特种铸造及有色合金,1998,3:42-44.
[11]梁芳慧.生物医用钛合金的新进展[J].稀有金属快报,2001,7:3-4.
[12]麻健丰,刘劲松,张大风,等.3种牙科铸造金属模拟唾液浸泡后粗糙度的变化[J].上海口腔医学,2007,16(3):307-310.
[13]袁俊,蔡玉惠.pH对烤瓷工艺处理后的合金耐腐蚀性能的影响[J].口腔医学,2009,29(15):260-262.
[14]张玉梅,王勤涛,郭天文.牙科用Ti-Zr合金的生物安全性评价[J].生物医学工程学杂志,2001,18(1):9-11.
[15]孙平,盛祖立,张正仪,等.4种临床用烤瓷合金材料细胞毒性研究[J].口腔医学,2004,24(6):344-346.
[16]SCREENIVAS K,MICHAEL E R,THOMAS J B,et al.Microbial colonization of dental implants in partially edentulous subjects[J].Prosthet Dent,1993,70(2):141-145.
[17]WILLERSHAUESN B,CALLAWAY A,ERNST C P,et al.Influence of oral bacteria on the surface morphology of various dental materials under in vitro conditions[J].J International Dental,1995,45(5):298-301.
[18]LEONHARDT A,OLSSON J,DAHLEN G.Bacterial colonization on titanium,hydroxyapatite,and amalgam surface in vivo[J].Dent Res,1995,74:1607-1615.
[19]章锦才,潘亚萍,张蕴惠,等.血链球菌拮抗可疑牙周致病菌机制探讨Ⅱ:细菌素的产生及影响因素[J].中国微生态学杂志,1995,7(4):179-181.
[20]WILSON M,KPENDEMA H,NOAR J H,et al.Corrosion of intra-oral magnets in the presence and absence of biofilms of streptococcus sanguis[J].Biomaterials,1995,16(9):721-724.
[21]KOIKE M,FUJII H.The corrosion resistance of pure titanium in organic acids[J].Biomaterials,2001,22(21):2931-2936.
[22]KEDICI S P,AKSUT A,KILICARSLAN M A,et al.Corrosion behaviour of dental metals and alloys in different media[J].Oral Rehabilitation,1998,25:800-808.
[23]SCHIFF N,GROSGOGEAT B,LISSAC M,et al.Influence of fluoride content and PH on the corrosion resistance of titanium and its alloys[J].Biomaterials,2002,23(9):1995-2002.
[24]HAI K,SAWASE T,MATSUMURA H,et al.Corrosion resistance of magnetic stainless steel ion-plated with titanium nitride[J].Oral Rehabilitation,2000,27(4):361-366.
[25]陈亚军.血链球菌及乳酸对钛的腐蚀行为研究[D].昆明:云南大学硕士学位论文,2012:5-190.
[26]TATIANA P C,DENG M D.The effect of streptococcus mutans and candida glabrata on candida albicans biofilms formed on different surfaces[J].Archives of Oral Biology,2008,53(8):755-764.
[27]宋应亮,徐君伍,马轩祥,等.白色念珠菌对铸钛、Co-Cr合金、Ni-Cr合金修复体失泽腐蚀的影响[J].实用口腔医学杂志,2000,16(2):111-115.
[28]富丹丽.白色念珠菌对钛合金,钴铬合金腐蚀的影响[D].杭州:浙江大学硕士学位论文,2009:5-36.
[29]倪龙兴,史俊南.牙龈卟啉菌的粘附和凝聚作用及其有关成份的研究[J].国外医学口腔医学分册,1992,19(5):195-197.
[30]宋应亮,徐君伍,马轩祥,等.牙龈卟啉菌381对纯钛及钛75合金种植体表面失泽的腐蚀[J].第四军医大学学报,2000,21(8):915-918.
[31]BOOTH G H,TILER A K.Cathodic characteristics of mild steel in suspensions of sulfate-reducing bacteria[J].Corrosion Science,1968,8(8):583-600.
[32]SHAN H N,COLLINS M D.Proposal for reclassification of bacteroides asaccharolyticus,bacteroides gingivalis and bacterioides endodontalis in a new genus porphyromon[J].International Journal of Systematic and Evolutionary Microbiology,1988,38(1):128-131.
[33]LILJEMARK W F,BLOOMQUIS C.Human oral microbial ecology and dental caries and periodental diseases[J].Crit Reviews in Oral Biology and Medicine,1996,7(2):80-198.
[34]宋应亮,徐君伍,马轩祥,等.远缘链球菌对铸钛、钴铬合金、镍铬合金修复体腐蚀失泽的研究[J].华西口腔医学杂志,2002,2(1):14-18.
[35]STEINBERG D,EYAL S.Early formation of streptococcus sobrinus biofilm on various dental restorative materials[J].Journal of Dentisty,2002,30(11):47-51.
[36]CARPENTIER B,CERF O.Biofilms and their consequences,with particular reference to hygiene in the food industry[J].Applied Bacteriology,1993,75(6):499-511.
[37]BRADING M G,JASS J,LAPPIN-SCOTT H M.Dynamics of bacterial biofilm formation[M].London:Cambridge University Press,1995:46-63.
[38]COSTERTON J W,MARRIE T J,CHENG K J.Phenomena of bacterial adhesion.In:Savage DC,Fletcher M(eds)Bacterial adhesion:Mechanisms and physiological significance[M].New York:Plenum Press,1985:650-654.
[39]PERCIVAL S L.Review of protable water biofilms in engineered systems[J].British Corrosion Journal,1998,32(2):130-138.
[40]MABILLEAU G,BOURDON S,GUILLOU M L,et al.Influence of fluoride,hydrogen peroxide and lactic acid on the corrosion resistance of commercially pure titanium[J].Acta Biomaterialla,2006,2(1):121-129.

