锂硫电池充电过程的影响因素
刘景东
(福州大学化学学院,福建 福州 350116)
锂硫电池理论能量密度虽然高达2600 W·h/kg,但是其容量衰减快,阻碍了其实用化进程[1]。归纳其容量衰减快的原因有:①飞梭效应,认为由充电产生的高阶多硫离子会迁移至负极与锂反应,发生自放电现象[2];②硫及多硫离子的溶解,复合于碳基体中的硫溶于电解液导致活性物质损失,从而导致容量衰减[3];③电极的钝化,深度放电时会生成不溶性的Li2S2和Li2S 覆盖在电极表面生成钝化 膜[4]。但哪一种原因为主要,仍没有一种统一的 看法。
目前解决容量衰减的方法集中在合成掺杂具有多孔结构的碳材料,或硫化物复合的碳材料上,认为碳材料的微孔具有吸收(吸附)电解液的作用,减小或抑制多硫离子向负极迁移[5-9];硫电极是液体电极,放电过程是单质硫溶于电解液中,在多孔碳表面逐步得电子,生成高阶多硫离子,高阶多硫离子再得电子同时S—S 链断裂生成低阶多硫离子,最后生成Li2S;充电过程是Li2S 逐步转化为S8的过程[10],但上述说法未涉及多硫离子在电解液中的沉淀-溶解反应。Cheon 等[11]用SEM 研究极片表面产物,发现充电过程是Li2S 减少的过程,认为充电过程不产生单质硫。Fronczek 等[12]基于多步骤硫还原模型讨论了硫的充放电行为,认为充放电速率被正极上固态物质(硫或Li2S)的生成速率所控制。综上可见,充电过程是否产生硫,各研究者说法不一,多硫离子在碳表面的氧化过程机理未被充分认识,多数研究结果未讨论电解液中的总硫浓度对电池性能的影响,且大部分研究结果是在极片硫负载量较低下获得的[13]。因此要想提高正极片的硫负载量,必须注意硫浓度对正极氧化峰电流的影响。
本文作者组装了低总硫浓度的三电极模拟电池和高总硫浓度的两电极扣式模拟电池,三电极模拟电池的电解液体积约是两电极模拟电池的电解液体积的10倍。比较了两者的循环伏安(CV)曲线和充放电曲线,发现两者的CV 曲线和充放电曲线有很大的不同。论文还比较了硫/碳复合正极在不同比表面积的碳表面、电解液体系的氧化峰电流的大小,以期达到对锂硫二次电池容量衰减机理的更进一步的认识。
1 实验材料与方法
1.1 硫碳复合材料的合成
采用文献[14]的方法合成介孔碳。硫和介孔碳按质量比1︰1 混合后,密封于试管中,试管口熔封,于管式炉中在氮气气氛下先200 ℃加热6 h,后于300 ℃加热3 h。待试管冷却至室温后,打破试管,研磨均匀后将产物在60 ℃真空干燥箱中干燥12 h,得到硫碳复合材料,记作S/MC;所用碳材料有3种,比表面积分别为1024 m2/g、519 m2/g 和82 m2/g。
1.2 极片的制备和电解液配制
按文献[15]的方法制备极片。将S/MC 和聚偏氟乙烯按质量比9︰1 在玛瑙碾钵中混匀,以1-甲基-2-吡咯烷酮(NMP)为分散剂制成浆液,均匀涂敷在铝片上。在60 ℃下真空干燥12 h,制得的正极片厚约0.1 mm,活性物质含量约为5 mg/cm2。
采用两种电解液,一种是醚类电解液,使用LiCF3SO3(99%,质量分数)或者LiClO4溶于乙二醇二甲醚和二乙二醇二甲醚(体积比1︰1),浓度1mol/L;另一种是碳酸酯电解液,1 mol/L 的LiPF6/EC+PC+DMC(EC︰PC︰DMC=1︰1︰1)购自江苏国泰集团,直接使用。
1.3 电池的组装及性能测试
扣式电池的组装:以S/MC 为工作电极,金属锂片为对电极,聚丙烯多孔膜为隔膜,以上述电解液在充满氩气的手套箱内组装 CR2025 型扣式 电池。
三电极电池的组装:以S/MC 为工作电极,金属锂片为对电极,硬质碳棒为参比电极(使用前经400号砂纸打磨),按图2所示组装。
用CT2001A 电池测试系统(武汉蓝和)对电池进行恒流充放电测试。电压范围为1. 5~3.0 V,电流为100 mA/ g。在CHI660D(上海辰华)电化学工作站上进行循环伏安测试,测试的扫描速率为1 mV/s,扣式电池扫描电压为 0.5~3.0V(vs. Li+/Li),三电极电池扫描电压为-2.5~1.0 V(vs. GC)。
2 结果与讨论
2.1 硫浓度对充电过程的影响
由于硫电极具有液体电极的特性,在使用三电极体系测CV 曲线时,锂片会与电解液中的多硫化锂反应,不适宜于用作参比电极,但在硫含量较低、使用的电解液体积较少时,使用二电极(即把锂片对电极和参比电极短接)测CV 曲线是合适的[16]。图1(a)是以两电极测得的CV 曲线图,电解液用量是0.15 mL。从图中可观察到3个还原峰(2.17 V、1.87 V、1.45 V)和2个氧化峰(2.20 V 和2.57 V)。应该指出的是,在不同次测试时,这些峰的具体位置会略有变化。还原峰分别对应放电曲线的两个放电平台,其中2.17 V 对应于电池的第一个放电平台,放电容量为418 mA·h/g,相当于每个硫原子得到0.5个电子,对应于S8被还原成S42-;1.87 V 对应于电池的第二个放电平台,放电容量为836 mA·h/g,相当于每个硫原子得到1个电子,对应于S42-被还原成Li2S2和Li2S[2]。在2.57 V 处的氧化峰峰形对称,同时在2.20 V 处有一个肩峰,对应于Sn2-被氧化生成S8。
硫在疏质子溶剂中还原时会产生多种含不同数目硫原子的多硫链离子[16],按此推论,充电时应该产生多个氧化峰,但事实上,主要在2.6 V 附近出现一个氧化峰,偶尔会观察到一个或两个肩峰[17-18]。在氧化失电子过程中,伴随着化学过程。具体过程可用式(1)~(4)表示
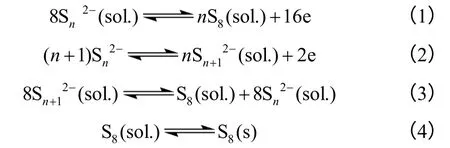
式中,Sn2-中的n 是4~8 的整数,式(1)、式(2)是失电子过程,是充电过程的主要反应;而式(3)和式(4)是化学过程,伴随充电过程进行。
图1(b)是以玻碳电极为参比电极测得的三电极CV 曲线,电解液用量是3 mL。可观察到在充电时在-2.5~0 V vs. GC 处不出现氧化峰。这是由于硫在醚类电解液中的溶解度为0.019 mol/L(20 ℃),在图1(b)中,初始硫浓度为0.025 mol/L,且硫在多硫离子的溶液中溶解度大大增加[19],这种情况下硫未达到饱和,一旦生成即溶解于电解液中失去活性;在0.5 V(vs. GC)观察到尖锐的氧化峰,对应式(1),证明提高充电电压,硫电极在充电过程中可产生硫。而在图1(a)中,初始总硫浓度为0.125 mol/L,生成的硫以式(3)和式(4)与溶液中的多硫离子保持平衡而维持活性。这些事实说明维持硫的适当过饱和度,对硫电极的充电过程的进行是很有必要的。图1(d)是对应图1(a)条件下的充放电曲线。可看到,充电开始时,有一个明显的电压降,证明式(1)的发生,生成不导电的单质硫。随着充电的进行,电压缓慢上升,式(1)~(4)持续进行,在多孔碳表面累积硫,使充电过程得以完成。在完成充电后静置,可看到电压下降至2.44 V;完成放电后静置,可看到电压上升至2.13 V[图1(d)上画圈处],证明生成的多硫离子是不稳定的中间产物,可自发发生式(3)和 式(4),最终生成稳定的单质硫。
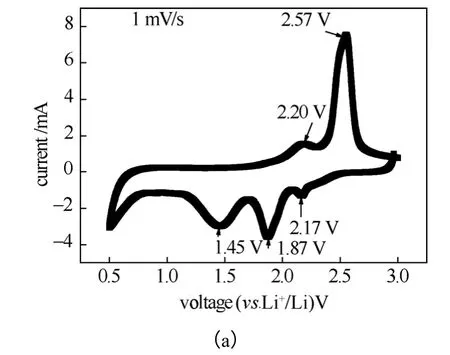
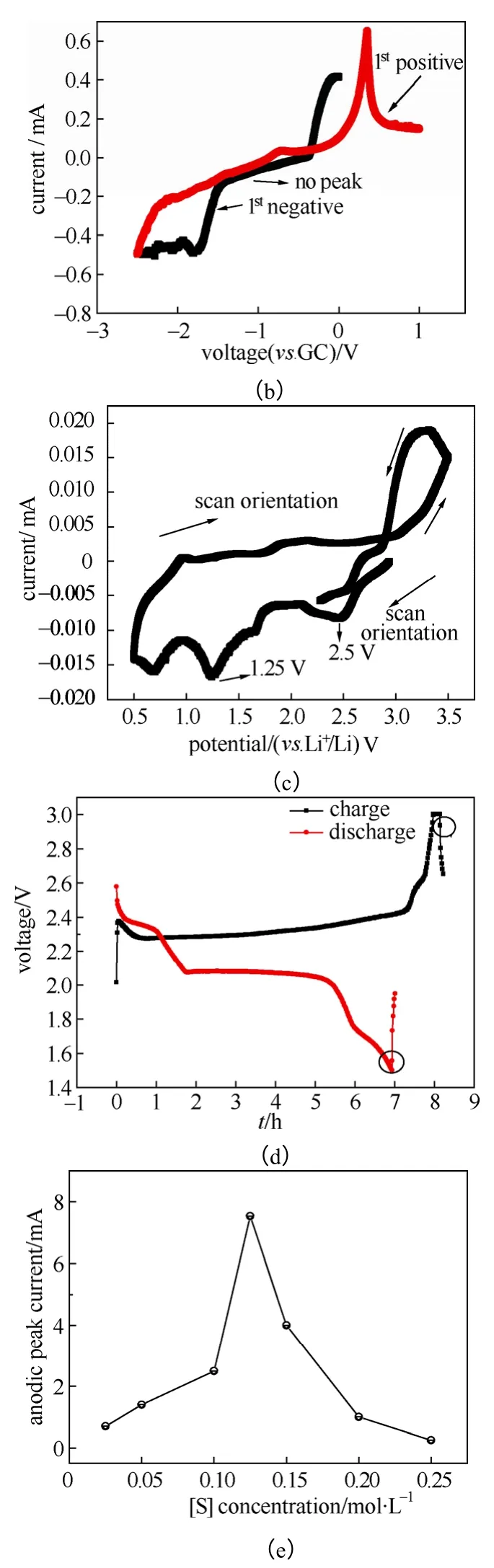
图1 S/C 复合正极的循环伏安曲线和充电曲线。(a)醚类电解液,总硫浓度0.125 mol/L,电解液用量0.15 mL;(b)醚类电解液,总硫浓度0.025 mol/L,电解液用量3 mL;(c)碳酸酯电解液,总硫浓度0.125 mol/L,电解液用量0.15 mL;(d)a 条件下的充电曲线;(e)2.6 V 处的氧化峰电流随总硫浓度的变化Fig.1 CV curves of S/MC. (a) [S]=0.125 mol/L, ether electrolyte, volume of electrolyte: 0.15 mL;(b) [S]=0.025 mol/L, ether electrolyte, volume of electrolyte: 3 mL;(c) [S]=0.125 mol/L , carbonate electrolyte, volume of electrolyte: 0.15 mL;(d) charge curves of S/MC at condition a;(e) variation of anodic peak current (2.6 V) upon total [S] concentration in electrolytes
图1(e) 比较了2.6 V 处氧化峰电流大小随总硫浓度的变化,可看出当硫浓度增大时,其氧化峰电流也随之增大,但超过0.125 mol/L 时,其氧化峰电流反而快速下降。多次实验证明,总硫浓度越过0.125 mol/L 时,将很容易使硫在正极上沉积,从而造成电极钝化。
2.2 电解液种类对充电过程的影响
图1(a)和图1(c)比较了两电极体系在醚类电解液和碳酸酯电解液的CV 曲线,可发现:这两者曲线有较大的差别。S/MC 在碳酸酯电解液中的氧化峰电流和还原峰电流均比在醚类电解液中的小;氧化峰呈现不规则的峰形。碳酸酯类电解液被认为不适合用于锂硫电池[20],从实验结果可看出,S/MC之所以在碳酸酯类电解液中充电容量小,是由于硫在碳酸酯电解液中的溶解度很低[19],在充放电开始时,过程强烈偏向过程(4),以至于在充电过程中生成较多的单质硫,这些硫在碳复合电极中是随机沉积的,因为沉积而与碳基体失去良好的接触,从而造成活性的丧失。图2的结果可看出这一点,图2是在充放电过程中电解液颜色的变化,从图2(a)中可看出醚类电解液对单质硫和硫放电的中间产物多硫化锂都有较好的溶解性,所以电解液呈现明显的褐色,而碳酸酯类电解液对单质硫和多硫化锂的溶解性均较差,充放电后,电解液仍然为无色。图2(a)中的极片仍然是黑色,而在图2(b)和图2(c)中可观察到极片呈现黄色,这些黄色物质是单质硫;在图2(b)和图2(c)中原先的极片由于硫与碳的良好复合,呈黑色,但在放电进行中[图2(b)]和充放电循环后[图2(c)],极片由于硫的析出呈黄色,证明多硫化锂是不稳定的中间产物,即使在放电进行中,也可进行式(3)和式(4)的反应而析出硫。

2.3 碳比表面积对充电过程的影响
图3(a)是比表面积为1024 m2/g 的碳制备的S/MC 复合正极的两电极CV 曲线。与图1(a)(S/MC复合电极中多孔碳比表面积为519 m2/g)比较,氧化峰峰形更宽,肩峰更不明显;同时2.7 V vs. Li+/Li 处的峰高增大,1.7~1.8 V 处的峰高减小,1.3 V 处的峰高更小,同时更加宽化。当进行式(3)和式(4)反应时,如果硫析出,与碳基体脱离接触,则硫不再进行式(2)反应而失去活性;当碳比表面积增大时,硫虽从溶液中析出,但仍有可提供的碳表面进行式(1)和(2)反应,注意到式(2)反应是多硫链硫原子数增大的过程,所以氧化峰峰形展宽。

图3 S/MC(碳比表面积为1024 m2/g)电极的两电极 CV 曲线 Fig.3 CV curves of S/MC in a two electrode set (coin cell), the specific area of carbon matrix: 1024 m2/g
表1 比较了S/MC 复合正极在不同条件下的氧化峰电流大小。可发现,碳比表面积对氧化峰电流影响较大,碳比表面积增大时,氧化峰电流也增大,大的碳比表面积还能减弱硫的沉积造成的电极 钝化;而碳酸酯类电解液由于对硫溶解度小,氧 化峰电流比同等条件下使用醚类电解液的小10倍 以上。
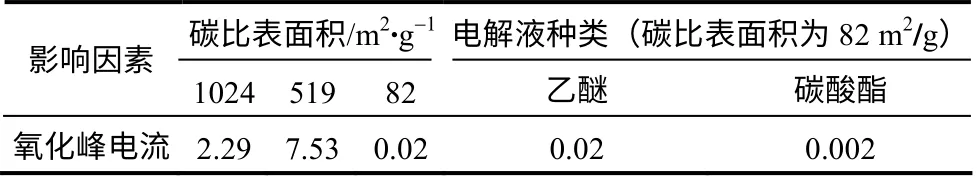
表1 影响2.6 V 处氧化峰电流大小的因素Table 1 Factors that affect anodic peak current
3 结 论
充电过程中产生的多硫化锂是不稳定的中间产物,能自发反应生成单质硫。不论是在醚类电解液中,还是在碳酸酯电解液中,硫碳复合正极在充电过程中都会产生单质硫。
适当的总硫浓度对充电过程的完成起重要作用,硫在醚类电解液中的合适浓度为0.125 mol/L。
[1] Hu Jingjing(胡菁菁),Li Guoran(李国然),Gao Xueping(高学平). Current status, problems and challenges in lithium-sulfur batteries[J]. Journal of Inorganic Materials(无机材料学报),2013,28(11):1181-1185.
[2] Mikhaylik Yuriy V,Akridge James R. Polysulfide shuttle study in the Li/S battery system[J]. Journal of the Electrochemical Society,2004,151(11):A1969-A1976.
[3] Zhang S S. New insight into liquid electrolyte of rechargeable lithium/sulfur battery[J]. Electrochimica Acta,2013,97(5):226-230.
[4] Cheon Sang-Eun,Choi Soo-Seok,Han Ji-Seong,et al. Capacity fading mechanism on cycling a high-capacity secondary sulfur electrode[J]. Journal of the Electrochemical Society,2004,151(12):A2067-A2073.
[5] Ji X L,Lee KT,Linda F. Highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nazar. Nat. Mater. A,2009,8:500-506.
[6] Ma Guoqiang,Wen Zhaoyin,Jin Jun,et al. Enhanced performance of lithium sulfur battery with polypyrrole warped mesoporous carbon/sulfur composite[J]. J. Power Source,2014,254(5):353-359.
[7] Zhu Pengyu,Song Jiangxuan,Lv Dongping,et al. Mechanism of enhanced carbon cathode performance by nitrogen doping in lithium-sulfur battery:A X-ray absorption spectroscopic study[J]. Journal of Physical Chemistry C,2014,118(15):7765-7771.
[8] Liu Jingdong,Zheng Xiaoshuang,Shi Zaifa,et al. Sulfur/mesoporous carbon composites combined with γ-MnS as cathode materials for lithium/sulfur batteries[J]. Ionics,2014,20(5):659-664.
[9] Chen Long(陈龙),Liu Jingdong(刘景东), Zhang Shiqun(张诗群). Preparation of mesoporous carbon/sulfur composite loaded with ZnS and its property for lithium-sulfur batteries[J]. Journal of Inorganic Materials(无机材料学报),2013,28(10):1127-1131.
[10] Yin Yaxia,Xin Sen,Guo Yuguo,et al. Lithium-sulfur batteries:Electrochemistry, materials and prospects[J]. Angewande Chemie International Edition,2013,52(50):13186-13200.
[11] Cheon Sang-Eun,Ko Ki-Seok,Cho Ji-Hoon,et al. Rechargeable lithium sulfur battery:I. Structural change of sulfur cathode during discharge and charge[J]. Journal of the Electrochemical Society,2004,150(6):A766-A769.
[12] Fronczek David N,Bessler Wolfgang G. Insight int lithium-sulfur batteries:Elementary kinetic modeling and impedance simulation[J]. Journal of Power Source,2013,244(12):183-188.
[13] Zhang S S. Improved cyclability of liquid electrolyte lithium/sulfur batteries by optimizing electrolyte/sulfur ratio[J]. Energies,2012,5:5190-5197.
[14] Yuan Xun(袁勋),Liu Yuying(柳玉英),Zhou Shuping(禚淑萍),et al. Synthesis of ordered mesoporous carbon and its application in aqueous macromolecular adsorption[J]. Acta Chimica Sinica(化学学报),2007,65(17):1814-1820.
[15] Liu Hui(刘慧),Yue Xin(岳鑫), Liu Jingdong(刘景东). Effect of montmorillonite on the performance of mesoporous carbon/sulfur composite electrode[J]. Battery Bimonthly(电池),2012,42(4):186-188.
[16] Celine Barchasz,Florian Molton,Carole Duboc,et al. Lithium/sulfur cell discharge mechanism:An original approach for intermediate species identification[J]. Analytical Chemistry,2012,84(9):3973-3980.
[17] Kim Hyung-Sun,Jeong Tae-Gyung,Choi Nam-Soon,et al. The cycling performances of lithium-sulfur batteries in TEGDME/DOL containing LiNO3additive[J]. Ionics,2013,19(12):1795-1802.
[18] Nasim Azimi,Wei Weng,Christos Takoudis,et al. Improved performance of lithium-sulfur battery with fluorinated electrolyte[J]. Electrochemistry Communication,2013,37(12):96-99.
[19] Rauh R D,Shuker F S,Marston J M,Brummer S B. Formation of lithium polysulfides in aprotic media[J]. Journal of Inorganic Nuclear Chemistry,1977,39(10):1761-1766.
[20] Gao Jie,Lowe Michael A,Kiya Yasuyuki,et al. Effects of liquid electrolytes on the charge-discharge performance of rechargeable lithium/sulfur batteries:Electrochemical and in-situ X-ray absorption spectroscopic studies[J]. Journal of Physical Chemistry C,2011,115(50):25132-25137.

