醇羟基反应活性与DBU/C3-醇/CO2离子化合物稳定性
富丽娟,刘颖颖,鲁厚芳,唐思扬,梁斌
(1四川大学化工学院,四川 成都 610065;2四川大学新能源与低碳技术研究院,四川 成都 610065)
醇羟基反应活性与DBU/C3-醇/CO2离子化合物稳定性
富丽娟1,2,刘颖颖2,鲁厚芳1,2,唐思扬1,梁斌1,2
(1四川大学化工学院,四川 成都 610065;2四川大学新能源与低碳技术研究院,四川 成都 610065)
利用红外光谱、核磁共振和热重分析表征了1,8-二氮杂环[5,4,0]十一烯-7(DBU)和CO2分别与C3-醇,即正丙醇、异丙醇、1,2-丙二醇、1,3-丙二醇和甘油,反应生成的离子化合物的组成和结构,研究了伯羟基和仲羟基与DBU和CO2反应的活性,以及空间位阻对羟基反应活性和生成的离子化合物的热稳定性的影响。结果表明,DBU+C3-醇+CO2体系中伯羟基比仲羟基具有更高的反应活性,反应产物更稳定。由于空间位阻和电子效应等影响,二元醇中第2个羟基的反应活性远低于第1个羟基。在DBU+甘油+CO2体系中由于空间位阻和电子效应的影响,当DBU和甘油的摩尔比为3:1时,其中1位羟基的转化率可达100%,3位羟基的转化率约为34%,而2位的仲羟基反应很少。
离子化合物;DBU;醇;CO2;活性;稳定性
引 言
以醇和胺混合物为代表的非离子状态溶液在与CO2接触后极性大大增加,转变为离子状态,而加热或通入氮气后又可放出CO2恢复到非离子状态从而实现溶液极性的可逆转变[1-3]。这样的可转极性溶剂在萃取、反应、分离等方面具有广泛的应用前景[4-8]。1,8-二氮杂环[5,4,0]十一烯-7(DBU)是可转极性溶液中使用较多、相对廉价的一种有机碱[9],其与醇形成的溶液在吸收和解吸CO2后也可以实现极性可逆转换[10-11]。作为有机碱,DBU在生物柴油反应体系中具有很好的溶解性,能够高效地催化酯交换反应[12]。反应后又可以通过DBU、醇和CO2反应生成强极性离子化合物,实现催化剂的分离回收以及脂肪酸甲酯产品的精制[7],从而降低生产成本和废水排放[13-15]。因此研究DBU、醇和CO2的反应特性以及生成的离子化合物的稳定性对相关的催化、分离以及CO2捕集过程的开发都具有重要的指导意义。
Phan等[16]将CO2通入摩尔比1:1的DBU和正丙醇混合溶液中,羟基转化率达到92%,且将一级醇、二级醇在相同条件下与DBU、CO2反应对比发现一级醇更易发生反应。Munshi等[8]将CO2分别与DBU/甘油摩尔比3:1、DBU/乙二醇摩尔比2:1和DBU/甲醇摩尔比1:1的溶液反应,结果表明大部分产物只有一个羟基发生反应。Anugwom等[17]将CO2通入DBU/甘油摩尔比3:1的混合溶液中,平衡时甘油中羟基转化率为31.85%,核磁共振分析表明大部分甘油中只有一个伯羟基发生反应。目前研究[1,17-18]认为离子化合物的形成过程首先是DBU夺取甘油中醇羟基的氢,形成[DBUH]+和二羟基-丙基氧负离子,[DBUH]+二羟基-丙基氧负离子再分别以离子键和酯键与CO2结合生成极性的离子化合物(图1),其中DBU夺取醇羟基的氢被质子化为[DBUH]+是最关键的一步[19],因此醇羟基的反应活性对离子化合物的形成有显著影响。
不同醇羟基失去质子的能力可能决定了相应离子化合物形成的难易程度以及所得离子化合物的稳定性。甘油具有两个伯羟基和一个仲羟基,理论上3个羟基均可与DBU和CO2结合,但各个羟基的反应活性和空间位阻不同,因此其反应顺序以及反应的难易可能存在差别。通过研究不同醇羟基的反应活性以及所得离子化合物的稳定性,能够为利用DBU+甘油吸收和解吸CO2进行生物柴油新工艺和二氧化碳捕集新技术的开发[20]提供理论支持。
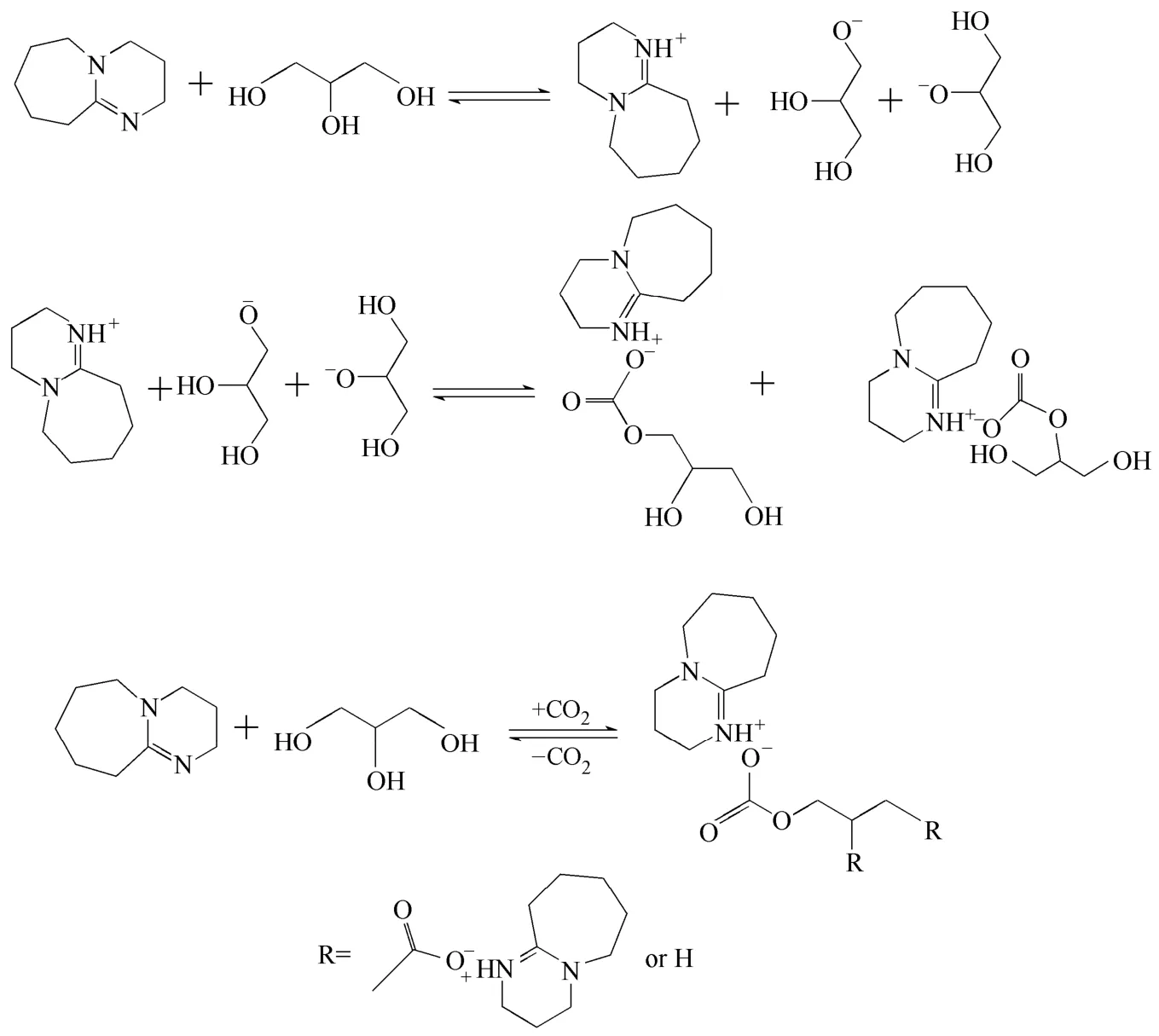
图1 DBU+甘油体系吸收CO2的反应机理[18]Fig.1 Reaction scheme of DBU+glycerol+CO2[18]
本文通过正丙醇、异丙醇、1,2-丙二醇和1,3-丙二醇的不同醇羟基以及醇羟基相对位置对DBU极性转化率、产物结构和稳定性的影响进行研究,并通过与DBU+甘油体系吸收CO2进行比较,确定甘油中羟基反应活性和参与反应的羟基数量。
1 材料与方法
1.1 实验材料
DBU:分析纯,加入CaH2旋蒸除去水分后加入4A分子筛保存;CaH2:市售分析纯;甘油、正丙醇、异丙醇、1,2-丙二醇、1,3-丙二醇、丙酮:市售分析纯,加入4A分子筛干燥;CO2:纯度99.9%,经硅胶管干燥。
1.2 实验仪器
梅特勒托利多ML204/02分析天平;Perkin Elmer Spectrum Two L1600300傅里叶红外光谱仪;Bruker AV II-600 MHz核磁共振谱仪;北京恒久科学仪器厂HTG-2差热分析天平。
1.3 实验方法
将一定量的DBU和醇加入圆底烧瓶中,在50℃、磁力搅拌下连续鼓入干燥的CO2气体,在常压下进行反应。为保证DBU和醇与CO2充分反应,首先以DBU+甘油作为典型反应体系,考察了DBU+甘油+CO2反应时羟基转化率随时间的变化规律(图2)。结果表明DBU+甘油(醇)与CO2反应非常迅速,反应0.5 h后羟基转化率的增加变得非常缓慢接近平衡转化率,确定羟基反应活性实验的反应时间为2 h。反应结束后,经丙酮洗涤、抽滤可得到相应的离子化合物固体。
锡伯族妇女能歌善舞,心灵手巧,她们的传统双面刺绣独具特色,在锡伯民俗博物馆内有展出,得到游客的一致好评。在手工艺品商店,各类手工艺品在旅游旺季十分畅销,增加了当地居民收入。

图2 DBU+甘油+CO2体系羟基转化率与反应时间的关系Fig.2 Hydroxyl conversionvsreaction time in DBU+glycerol+CO2system(molar ratio DBU:OH=1:1; reaction temperature: 50℃)
1.4 计算公式
由于在50℃、常压下CO2在DBU和甘油中的溶解度都非常低,分别为1.14%和0.10%[21],反应过程中CO2的物理吸收部分可以忽略。反应前后体系质量增加量即为反应所吸收的CO2的质量。根据式(1)可计算得到反应体系中羟基的摩尔转化率,进而得到产物的平均组成为DBUnx/C3-醇/CO2(nx),第2个羟基的转化率为x2=nx−1。根据式(2)可计算得到C3-醇中羟基与DBU、CO2反应的平衡常数。

式中,x是羟基摩尔转化率;Δm是反应后体系增加的质量,g;mal是反应物醇的质量,g;n是醇中羟基的个数;alM、2COM分别为醇、CO2的摩尔质量,g·mol−1;K是平衡常数;p是CO2的压力;p⊖是标准大气压。
2 结果与讨论
2.1 红外光谱分析
将CO2分别通入DBU与正丙醇、异丙醇、1,2-丙二醇、1,3-丙二醇、甘油的混合物中使其充分反应,制备得到相应的离子化合物。利用红外光谱对所得离子化合物的结构进行了表征(图3)。其中3100~3400 cm−1为伸缩振动峰,3255 cm−1处的吸收峰表明产物分子中存在[DBUH]+结构[17]。3650~3580 cm−1处为羟基的伸缩振动峰,与伸缩振动(3100~3400 cm−1)发生部分重叠后在3426 cm−1处形成一个很宽的峰[17-18]。1649 cm−1处为的伸缩振动,1270 cm−1和1107 cm−1处为的对称伸缩和非对称伸缩振动峰,表明产物分子中存在碳酸酯结构[18]。因此红外光谱数据表明CO2和DBU、C3-醇所得产物为具有[DBUH]+和碳酸酯结构的离子化合物。1400 cm−1处为DBU分子中的伸缩振动峰。比较不同醇反应得到的离子化合物在1400 cm−1处吸收峰的相对强弱可知其中DBU相对含量的关系为DBU/1,3-丙二醇/ CO2>DBU/甘油/CO2>DBU/1,2-丙二醇/CO2>DBU/正丙醇/CO2≈DBU/异丙醇/CO2。
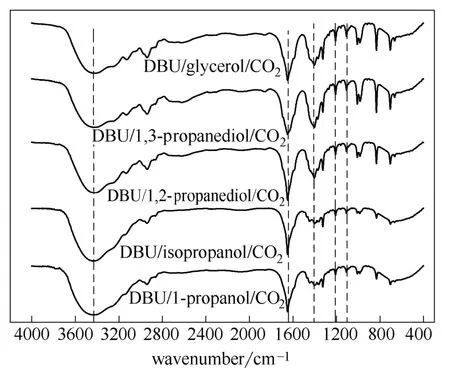
图3 DBU/C3-醇/CO2离子化合物的红外光谱图Fig.3 IR spectra of DBU/C3-alcohol/CO2ionic compounds
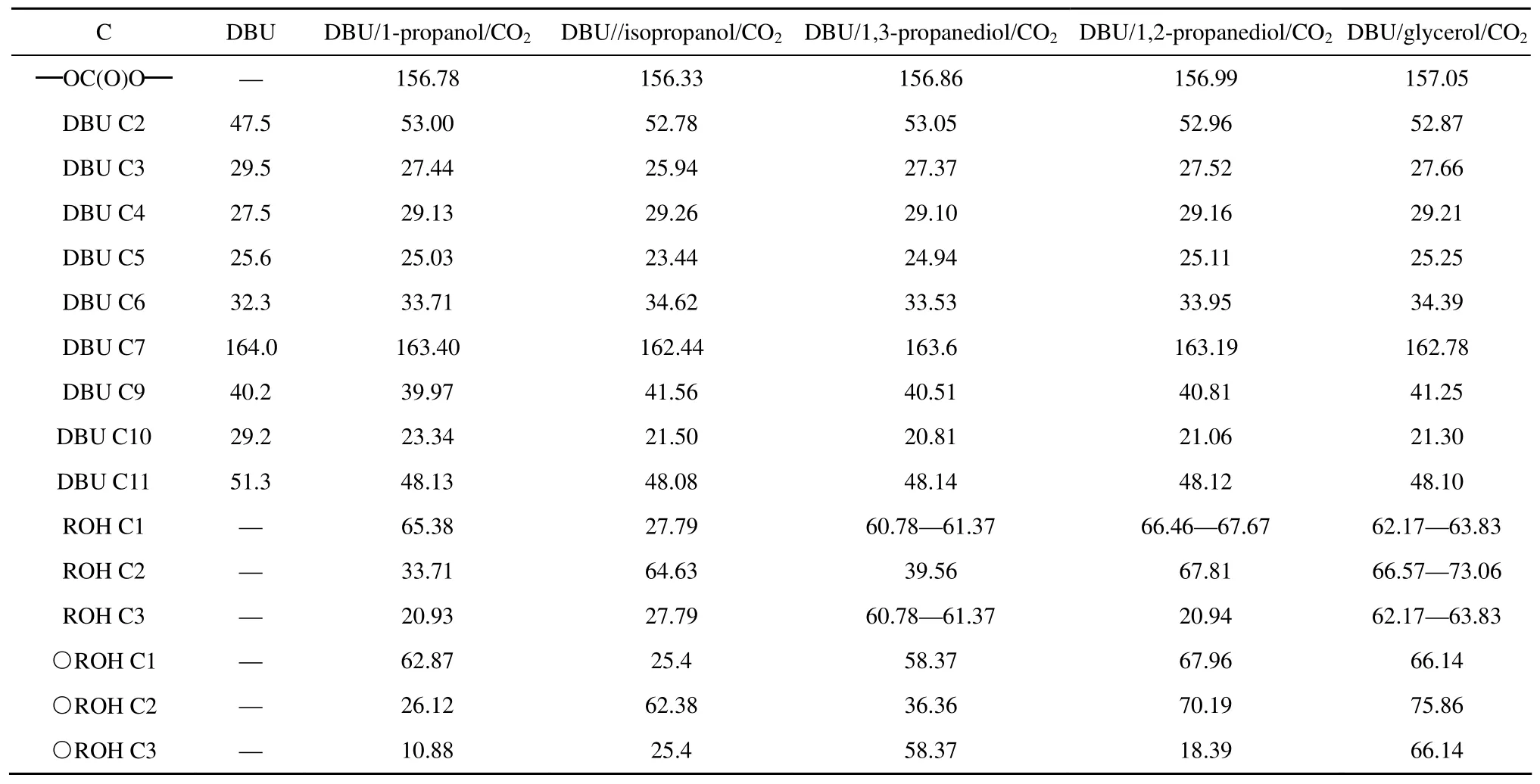
表1 DBU和DBU/醇/CO2离子化合物在DMSO-d6中的13C NMR化学位移Table 113C NMR chemical shifts assignment of DBU and DBU/C3-alcohol/CO2ionic compounds
2.213C NMR分析
进一步以DMSO-d6为参照物,测定了各反应产物的13C NMR谱图,谱图中各峰的归属列于表1中。离子化合物中各碳的编号如图4所示。反应前后醇中碳的化学位移(图5)主要位于57~74。

图4 DBU中碳原子的编号Fig.4 Numbering of carbon atoms in DBU

图5 DBU/C3-alcohol/CO2的13C NMR谱图Fig.513C NMR spectra of DBU/C3-alcohol/CO2ionic compounds
表1给出了5种DUB/C3-醇/CO2化合物中各碳原子的化学位移和未反应的醇中碳原子的化学位移。其中在162~163 处为C7的化学位移,表明存在[DBUH]+结构,同时在156~157处为碳酸酯中羰基碳的化学位移[17-18,21],这说明相应的DBU/C3-醇/CO2化合物为[DBUH]+碳酸盐结构的离子化合物。对于一元醇形成的离子化合物,DBU/异丙醇/ CO2中羰基碳的化学位移(156.33)略小于DBU/正丙醇/CO2中羰基碳的化学位移(156.78)[22]。这是由于异丙醇中两个甲基的供电子能力比正丙醇中乙基的供电子能力更强,使得羰基碳的电荷更集中所致。对于二元醇形成的离子化合物,DBU/1,3-丙二醇/CO2和DBU/1,2-丙二醇/CO2中羰基碳的化学位移也略有差异,分别为156.86 和156.99 。这与丙二醇中两个羟基反应后空间位阻的大小有关,位阻越大电荷趋于平均,电荷密度减小[22],对应的羰基碳的化学位移越大。由于甘油中的位阻更大,所以DBU/甘油/CO2中羰基碳的化学位移也最大,为157.05。同时由于醇中反应后变成了酯基,与其相连的碳原子电荷密度降低,屏蔽效应减弱,也使得化学位移增加。从图5 可以看到,DBU/1,2-丙二醇/CO2中既有反应了的仲羟基(67.81),也有未反应的仲羟基(70.19 ),同时反应了的伯羟基和仲羟基的量的比约为2:1(表2)。与未反应的伯羟基相连的碳的化学位移在67.96处,反应后此峰很弱,因此可认为伯羟基接近完全反应。对于DBU/1,3-丙二醇/CO2,60.78 处为只有伯羟基发生反应后C1的化学位移,61.37 是两个伯羟基均发生反应时C1和C3的化学位移,其比值约为7.4:4.6。DBU/甘油/CO2离子化合物中甘油的伯羟基的化学位移在反应后由66.14变为63。66.57处为与反应后仲羟基相连的碳的化学物位移,其值非常低,说明仲羟基仅有很少部分发生了反应。
2.3 醇羟基的反应活性
DBU夺取醇羟基的氢生成[DBUH]+是DBU/醇/ CO2离子化合物生成过程中最重要的一步。不同的醇羟基由于电子效应、空间效应等不同,与DBU和CO2反应的活性也可能存在较大的差异,并影响所得离子化合物的稳定性。图6表明正丙醇比异丙醇反应更快,转化率也更高(94.01%vs73.43%),由此计算得到相应的平衡常数分别为278.7和14.16。这说明在离子化合物形成过程中正丙醇的伯羟基要比异丙醇中的仲羟基更活泼。这可能与DBU夺取醇羟基的氢后形成的烷氧负离子的稳定性有关。由于仲羟基受两个供电子基团的影响使负电荷更集中于C2和,DBU夺取仲羟基的氢相对困难,形成的烷氧基负离子的稳定性也相对较低。相比之下伯羟基仅受一个供电子效应更弱的乙基基团的影响,所以伯羟基失去一个氢所形成的烷氧基负离子的电荷相对分散,稳定性更高。核磁共振谱中(表1)反应前正丙醇中C1的化学位移为62.87 比异丙醇中C2的化学位移62.38 略高。由于化学位移与电荷密度相关,电荷密度越高屏蔽作用越强,化学位移越小,因此说明伯碳的电荷密度的确比仲碳的电荷密度低,其反应活性更高。由于异丙醇中的仲羟基受两个甲基基团的影响,空间位阻也更大,所以反应也更困难一些。
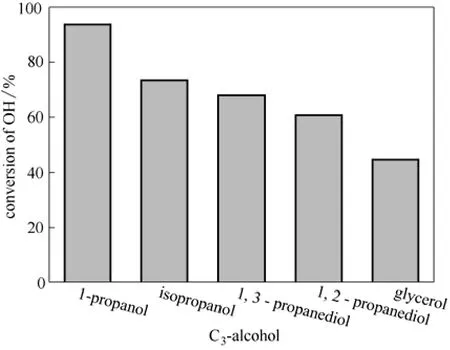
图6 不同C3-醇与DBU和CO2反应的羟基转化率Fig.6 Hydroxyl conversion of various C3-alcohol in reactions(DBU:OH=1:1; reaction temperature: 50℃; reaction time: 2 h)
如图6所示,1,2-丙二醇和1,3-丙二醇的羟基转化率都超过50%,分别为60.80%和67.99%,这表明至少有一部分丙二醇中的两个羟基都同时参与了反应,并且1,3-丙二醇的转化率和反应速率都高于1,2-丙二醇。根据图6中的实验数据分别计算得到DBU+1,2-丙二醇+CO2和DBU+1,3-丙二醇+CO2体系中醇羟基与DBU和CO2反应的平衡常数分别为6.51和9.77,对应产物的平均摩尔组成分别为DBU1.22/1,2-丙二醇/CO2(1.22)和DBU1.36/1,3-丙二醇/CO2(1.36)。这表明丙二醇中两个羟基的反应活性存在差异,醇羟基的相对位置影响醇羟基反应活性。密度泛函数(DFT)理论计算表明多元醇与DBU和CO2反应时,丙二醇中第一个羟基(伯羟基)反应产物的能量远低于两个羟基都反应所得产物的能量,所以其中的第一个羟基(伯羟基)接近完全转化。对核磁数据进行半定量计算得到的离子化合物中参与反应的醇羟基的归一化浓度(表2)也表明1,2-丙二醇以伯羟基为主参与反应,参与反应的仲羟基要少很多。由此可计算得到1,3-丙二醇和1,2-丙二醇中第二个羟基的转化率应分别为36%和22%。同时第二个羟基的低转化率也表明即使是具有对称结构的1,3-丙二醇中两个伯羟基在与DBU和CO2反应时其活性存在较大的差异,两个羟基是分步反应的。这可能是因为丙二醇中第一个醇羟基(伯羟基)与DBU和CO2反应后对第二个醇羟基参与反应构成了较大的空间位阻,所以第二个羟基的反应活性远低于第一个羟基。由于1,3-丙二醇中两个羟基的相对距离较1,2-丙二醇中两个羟基的相对距离大一些,所以1,3-丙二醇中第二个羟基的转化率相对较高(图6)。在DBU+甘油+CO2的反应中,主要是甘油的两个伯羟基参与了反应,参与反应的仲羟基很少(表2)。根据实验数据计算得到DBU+甘油+CO2体系中醇羟基与DBU和CO2反应的平衡常数为3.35,产物的平均组成(DBU1.34/甘油/CO2(1.34))与1,3-丙二醇形成的离子化合物的平均组成(DBU1.36/1,3-丙二醇/CO2(1.36))非常相近。这表明虽然甘油含有两个伯羟基和一个仲羟基,但其反应活性与含有两个伯羟基的1,3-丙二醇相近,形成离子化合物的反应主要发生在两个伯羟基上。进一步采用密度泛函理论(DFT) UB3LYP/6-31G(d,p)方法对甘油与DBU和CO2反应各步产物的稳定性进行了比较,理论计算结果与上述分析和实验结果一致。DFT计算结果表明甘油中只有一个羟基反应时产物的能量远低于同时有两个羟基反应所得产物的能量,所以反应时倾向于所有的甘油都参与反应。同时第一步为伯羟基失去质子所得产物的能量更低,稳定性更高,所以当甘油只有一个羟基参与反应时应以伯羟基为主。进一步反应时,剩余的伯羟基和仲羟基之间存在竞争,但仍然是第二个伯羟基反应结合CO2后的产物能量更低,更稳定。所以可以确定DBU1.34/甘油/CO2(1.34)由两个主要成分构成(图7),其中化合物1约占66%,化合物2约占34%。

表2 各离子化合物中参与反应的醇羟基的归一化浓度Table 2 Normalized concentration of reacted hydroxyl in various DBU/C3-alcohol/CO2ionic compounds

图7 DBU/甘油/CO2离子化合物的主要成分Fig.7 Main ionic compounds formed in DBU/glycerol/CO2
2.4 离子化合物的稳定性
进一步利用热重分析考察了上述反应所得的离子化合物的热稳定性(图8)。结果表明失重分为两个阶段:第1阶段失重主要是离子化合物分解放出CO2,由于DBU/正丙醇/CO2和DBU/异丙醇/CO2两种离子化合物分解生成的正丙醇和异丙醇沸点较低,所以第1阶段的失重也包含了部分醇的挥发;第2阶段应是DBU和醇的挥发、氧化或分解。利用失重曲线以失重5%为标准[17]测定了各离子化合物的分解温度(表3)。从表3可以发现伯羟基与DBU/CO2形成的离子化合物比仲羟基与DBU/CO2形成的离子化合物略为稳定(95.1℃vs94.8℃)。而DBU/1,3-丙二醇/CO2和DBU/1,2-丙二醇/CO2形成的离子化合物的分解温度显著低于正丙醇和异丙醇得到的离子化合物的分解温度,分别为90.5℃和89.0℃。这是因为两种丙二醇中第2个羟基不如第1个羟基活泼,反应形成的化学键也不如相应的一元醇形成的化学键稳定。即使都是作为第2个反应的羟基,由于伯羟基仍然比仲羟基活泼,所以形成化合物也更稳定一些(90.5℃vs89.0℃)。DBU/甘油/CO2离子化合物在86.2℃开始分解(表3),比DBU/1,2-丙二醇/CO2离子化合物的开始分解温度稍低,是因为甘油中未反应羟基吸电子作用和位阻作用共同作用的结果。
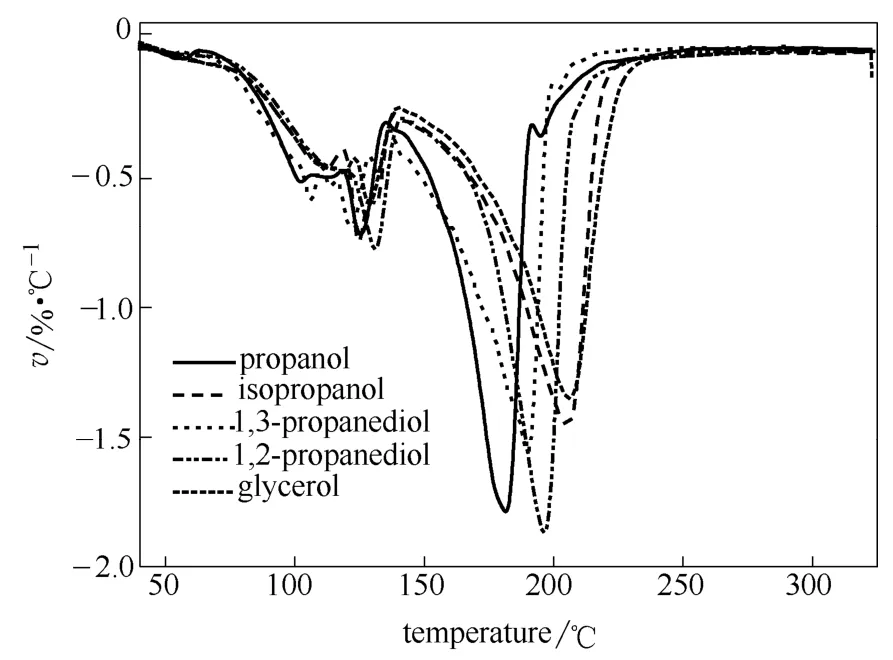
图8 各离子化合物的DTG曲线Fig.8 Differential thermogravimetric curves of ionic compounds

表3 离子化合物分解温度及第1阶段失重率Table 3 Decomposition temperatures and 1st stage mass loss of ionic compounds
3 结 论
DBU/C3-醇体系吸收CO2后形成具有碳酸酯结构的离子化合物。在与DBU和CO2反应时正丙醇中伯羟基比异丙醇的仲羟基的反应活性高。二元醇在形成离子化合物的过程中两个羟基是分步反应的,其中伯羟基比仲羟基优先反应。由于空间位阻和电子效应,二元醇中第2个醇羟基的反应相对困难,反应活性远低于第1个伯羟基。DBU/甘油/CO2中只有一个伯羟基参与反应形成的离子化合物的摩尔分数约为0.66,而甘油中两个伯醇都参与反应形成的离子化合物的摩尔分数约为0.34。
[1] Jessop P G, Heldebrant D J, Wang X L, Eckert C A, Liotta C L. Green chemistry: reversible nonpolar-to-polar solvent [J].Nature, 2005, 436 (7054): 1102.
[2] Heldebrant D J, Jessop P G, Thomas C, Eckert C A, Liotta C L. The reaction of 1,8-diazabicyclo[5.4.0]undec-7-ene (DBU) with carbon dioxide [J].The Journal of Organic Chemistry, 2005, 70 (13): 5335-5338.
[3] Boyd A R, Jessop P G, Dust J M, Buncel E. Switchable polarity solvent (SPS) systems: probing solvatoswitching with a spiropyran (SP)-merocyanine (MC) photoswitch [J].Organic & Biomolecular Chemistry, 2013, 11: 6047-6055.
[4] Phan L, Brown H, White J, Hodgson A, Jessop P G. Soybean oil extraction and separation using switchable or expanded solvents [J].Green Chemistry, 2009, 11 (1):53-59.
[5] Xue D L, Mu Y, Mao Y, Yang T K, Xiu Z L. Kinetics of DBU-catalyzed transesterification for biodiesel in the DBU–ethanol switchable-polarity solvent [J].Green Chemistry, 2014, 16 (6): 3218.
[6] Nowicki J, Muszyński M, Gryglewicz S. Novel basic ionic liquids from cyclic guanidines and amidines—new catalysts for transesterification of oleochemicals [J].Journal of Chemical Technology and Biotechnology, 2014, 89 (1): 48-55.
[7] Cao X F, Xie H B, Wu Z L, Shen H W, Jing B. Phase-switching homogeneous catalysis for clean production of biodiesel and glycerol from soybean and microbial lipids [J].ChemCatChem., 2012, 4 (9): 1272-1278.
[8] Munshi K M, Biradar S P, Gade M S, Rane H V, Kelkar A A. Efficient synthesis of glycerol carbonateglycidol using 1,8-diazabicyclo [5.4.0] undec-7-ene (DBU) based ionic liquids as catalyst [J].RSC Advances, 2014, 4 (33): 17124-17128.
[9] Feng Xiaoqing (冯筱晴), Shen Li (沈力), Wang Ruirui (王瑞瑞), Wang Yanchen (王彦臣), Song Guoqiang (宋国强). Synthesis and application of DBU [J] .Chemical Industry and Engineering Progress(化工进展), 2013, 32 (1): 174-179.
[10] Jessop P G, Mercer S M, Heldebrant D J. CO2-triggered switchable solvents, surfactants, and other materials [J].Energy & Environmental Science, 2012, 5 (6): 7240-7253.
[11] Heldebrant D J, Yonker C R, Jessop P G, Phan L. Organic liquid CO2capture agents with high gravimetric CO2capacity [J].Energy & Environmental Science, 2008, 1 (2): 487-493.
[12] Taylor J E, Bull S D, Williams J M J. Amidines, isothioureas, and guanidines as nucleophilic catalysts [J].Chemical Society Reviews, 2012, 41 (6): 2109-2121.
[13] AtadashiI M, Aroua M K, Abdul Aziz A R, Sulaiman N M N. Refining technologies for the purification of crude biodiesel [J].Applied Energy,2011, 88 (12): 4239-4251.
[14] Isahak W N R W, Ramli Z A C, Ismail M, Jahim J M, Yarmo M A. Recovery and purification of crude glycerol from vegetable oil transesterification [J].Separation and Purification Reviews, 2014, 44 (3): 250-267.
[15] Guo Yan (郭燕), Chen Fuming (陈福明), Jin Yong (金涌). Water washing technique in the alkaline-catalyzed production process of biodiesel [J].China Oils and Fats, 2011, 36 (8): 66-69.
[16] Phan L, Chiu D, Heldebrant D J, Huttenhower H, John E, Li X, Pollet P, Wang R, Eckert C A, Liotta C L, Jessop P G. Switchable solvents consisting of amidine/alcohol or guanidine/alcohol mixtures [J].Industrial & Engineering Chemistry Research, 2008, 47: 539-545.
[17] Anugwom I, Mäki-Arvela P, Virtanen P, Willför S, Damlin P, Hedenström M, Mikkola J P. Treating birch wood with a switchable1,8-diazabicyclo-[5.4.0]-undec-7-ene-glycerol carbonate ionic liquid [J].Holzforschung, 2012, 66 (7): 809 -815.
[18] Anugwom I, Mäki-Arvela P, Virtanen P, Damlin P, Sjöholm R, Mikkola J P. Switchable ionic liquids (SILs) based on glycerol and acid gases [J].RSC Advances, 2011, 1 (3): 452.
[19] Vaidya P D, Kenig E Y. CO2-alkanolamine reaction kinetics: a review of recent studies [J].Chemical Engineering & Technology, 2007, 30 (11): 1467-1474.
[20] Mathias P M, Afshar K, Zheng F, Bearden M D, Freeman C J, Andrea T, Koech P K, Kutnyakov I, Zwoster A, Smith A R, Jessop P G, Nik O G, Heldebrant D J. Improving the regeneration of CO2-binding organic liquids with a polarity change [J].Energy & Enrironmental Science, 2013, 6 (7): 2233-2242.
[21] Ostonen A, Sapei E, Uusi-Kyyny P, Klemelä A, Alopaeus V. Measurements and modeling of CO2solubility in 1,8-diazabicyclo-[5.4.0]-undec-7-ene—glycerol solutions [J].Fluid Phase Equilibria, 2014, 374: 25-36.
[22] Liu Yuxin (刘玉鑫), Wang Feng (王峰), Li Guilan (李桂兰), Yang Lixian (杨丽贤). Spectrum Analysis (波谱分析) [M]. Chengdu: Sichuan University Press, 2004: 210-213.
Reactivity of hydroxyls and stability of DBU/C3-alcohol/CO2ionic compounds
FU Lijuan1,2, LIU Yingying2, LU Houfang1,2, TANG Siyang1, LIANG Bin1,2
(1College of Chemical Engineering,Sichuan University,Chengdu610065,Sichuan,China;
2New Energy and Low-carbon Technology Research Institution,Sichuan University,Chengdu610065,Sichuan,China)
The DBU/C3-alcohol/CO2ionic compounds were synthesized by reacting the C3-alcohols, namely 1-propanol, 2-propanol, 1,2-propanediol, 1,3-propanediol and glycerol with CO2and 1,8-diazabicycloundec-7-ene (DBU), respectively. The composition and structure of them were characterized by FT-IR, NMR and TG. The reactivity of the hydroxyls at different position in C3-alcohol and the steric effect in polyols were studied. The results showed that the reactivity of the primary hydroxyl of 1-propanol was higher than the secondary hydroxyl of 2-propanol in the reaction of DBU+C3-alcohol+CO2. For the diols, the steric hindrance and the electronic effect significantly lowered the activity of the second hydroxyl, and such interaction in 1,2-diols was stronger than that of 1,3-diols. For the DBU+glycerol+CO2system, the main ionic compound was formed by reacting with only one of the primary hydroxyl in glycerol. The second most abundant product was formed by reacting both of the primary hydroxyls in glycerol. However, the complete conversion of all three hydroxyls seemed not possible due to the high steric hindrance effect.
ionic compounds; DBU; alcohol; CO2; reactivity; stability
LIU Yingying, liuyingying@scu.edu.cn
10.11949/j.issn.0438-1157.20150162
TQ 031.2
:A
:0438—1157(2015)10—4163—07
2015-02-02收到初稿,2015-05-26收到修改稿。
联系人:刘颖颖。
:富丽娟(1991—),女,硕士研究生。
国家自然科学基金面上项目(21476150);教育部博士点基金优先发展领域课题(20130181130006)。
Received date: 2015-02-02.
Foundation item: supported by the National Natural Science Foundation of China (21476150) and the Doctoral Fund of Ministry of Education of China (20130181130006).

