低冰镍转炉渣中钴的氧压酸浸行为及其动力学
廖亚龙,黄斐荣,周娟,李冰洁
(昆明理工大学冶金与能源工程学院,云南 昆明 650093)
低冰镍转炉渣中钴的氧压酸浸行为及其动力学
廖亚龙,黄斐荣,周娟,李冰洁
(昆明理工大学冶金与能源工程学院,云南 昆明 650093)
研究了转炉渣中钴氧压硫酸体系选择性浸出过程的行为及其动力学。通过改变搅拌速度、反应温度、硫酸浓度、氧分压、物料粒度以及反应时间等浸出条件,考察钴浸出率的变化及影响,获得转炉渣中钴的浸出动力学规律。结果表明,钴的浸出率随着温度、酸度、氧分压的增加而增加;硫酸质量浓度大于0.4 mol·L-1会导致铁大量溶出;浸出过程符合未反应芯收缩核模型,前期受化学反应控制,然后转变为混合控制,后期受固体产物层扩散控制。化学反应控制和固体产物层扩散控制过程的活化能分别为43.19 kJ·mol-1和10.49 kJ·mol-1。化学反应控制过程对硫酸浓度、氧分压及粒度的反应级数分别为0.79、0.85和 -0.95。
浸取;转炉渣;氧压浸出;动力学;多相反应
引 言
金属钴及其合金、盐类用途广泛,但独立的矿物较少,主要从铜、镍冶炼过程的副产物中回收[1-2]。低冰镍吹炼过程中,60%的钴进入转炉渣[3]。因成分及结构复杂,且含有大量的铁橄榄石,转炉渣中钴的含量相对较低,又因钴、镍与铁的性质相似,渣中钴镍等资源的回收利用极其困难。
用硫酸在常压下直接浸出转炉渣,虽可通过控制浸出条件将渣中的钴浸出,但硫酸的耗量较大,且渣中的铁大量溶出,浸出液过滤和除杂难以实施[4-5]。将转炉渣氧化或者还原焙烧预处理后再用酸浸出,不但酸耗大、铁浸出率高,且焙烧过程能耗高,产生二氧化硫气体也不可避免[6-7]。浸出过程中使用双氧水、重铬酸钾以及氯酸钠等强氧化剂将浸出液中的低价铁氧化为高价铁后,水解沉淀进入浸出残渣,虽可降低浸出液中铁的含量,但酸耗高和钴铁分离的问题并未得到根本解决[8-11],而且浸出率不高,氧化剂的加入增大了处理成本。
利用氧压酸浸工艺浸出缓冷预处理的铜冶炼转炉渣时,渣中铜、镍的浸出率可达98%,铁浸出率小于10%,但铜冶炼缓冷转炉渣中铜镍等有价金属含量高,物相组成主要为金属硫化物[12-13]。镍冶炼渣的研究报道较少,仅见研究镍熔炼渣高压酸性浸出后残留渣特征的报道[14],未见镍吹炼转炉渣氧压酸浸出的相关研究报道,特别是高压酸性浸出过程中金属钴的浸出行为及动力学的研究,国内外皆少见报道。本文采用氧压酸性浸出工艺浸出和分离低冰镍转炉吹炼渣中钴,在充分研究各因素对钴和铁浸出率影响的前提下,研究了转炉渣中钴的浸出行为和影响钴、铁浸出的调控机理,研究获得了钴的浸出动力学规律。
1 实 验
1.1 实验原料
转炉渣取自国内某镍冶炼厂,ICP-AES测定主要的元素含量见表1,X射线衍射分析(XRD)结果见图1。XRD分析结果表明,转炉渣中主要的矿物相为铁橄榄石、磁铁矿,钴以硅酸盐和铁酸盐形式存在。

表1 镍转炉渣的化学成分Table 1 Chemical composition of nickel converter slag/%(mass)
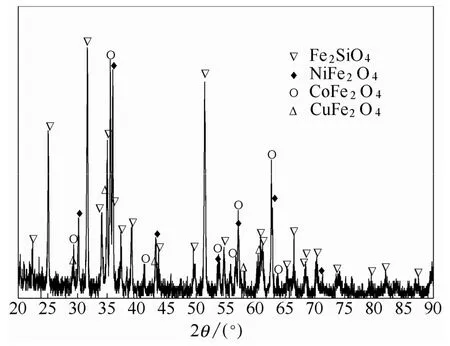
图1 转炉渣的XRD图谱Fig. 1 XRD pattern of converter slag
1.2 浸出实验及分析检测方法
将磨细至一定粒级的转炉渣100 g和800 ml 去离子水加入2 L的钛材高压釜内,温度升至需要的反应温度后,精确注入所需浓硫酸,通入氧气并保持氧分压恒定下反应。每间隔5 min取样一次,直到浸出实验结束。
样品稀释一定倍数后用亚硝基-R盐分光光度法测定钴的浓度,用邻菲啰啉分光光度法测定铁的浓度[15]。钴和铁的浸出率可用式(1)、式(2)计算
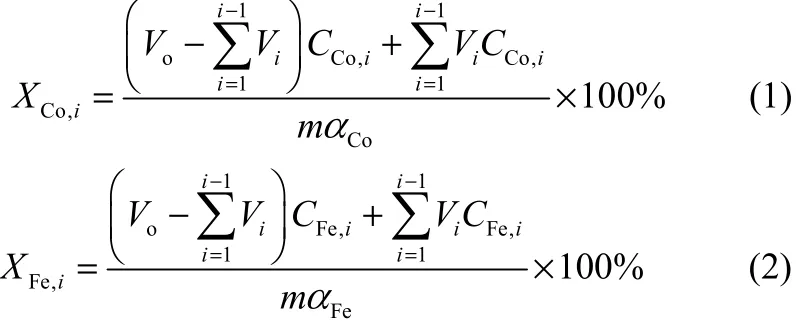
式中,XCo,i、XFe,i分别为Co和Fe的浸出率,%;Vo为浸出液总体积, L;Vi为每i次间隔时间取出的液样体积, L;CCo,i、CFe,i分别为取出液样中钴和铁的浓度,g·L-1;m为实验渣样的质量,g;αCo、αFe分别为实验渣样中相应的钴和铁的质量分数,%。
1.3 浸出原理
氧压浸出过程中,转炉渣中钴和铁矿物主要发生如下反应

同时,渣中存在的少量金属硫化物和氧化物也可能发生下列反应
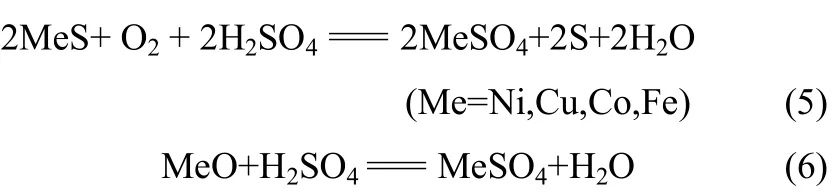
浸出过程中,部分进入浸出液中的二价铁盐被氧化,水解后以赤铁矿的形式留在浸出渣中,反应如下
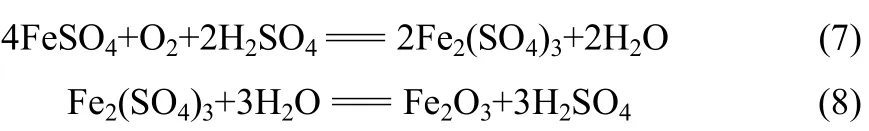
高温以及高酸度有利于钴镍铜等金属的溶出,氧气是金属硫化物溶解,亚铁盐转化成赤铁矿的氧化剂和催化剂。
2 结果与讨论
2.1 搅拌速率对Co浸出率的影响
在硫酸浓度0.4 mol·L−1, 氧分压650 kPa, 温度225℃,粒度−63~+53 μm, 浸出60 min条件下,搅拌速率对钴浸出率的影响如图2所示。可以看出,钴的浸出率随搅拌速率的增加稍有增加,但当搅拌速率超过700 r·min−1时,浸出率基本不变。这表明,当搅拌速率为700 r·min−1或更高时,有利于氧气在浸出液中的扩散以及矿物颗粒的悬浮,通过液体边界层的外扩散影响小[16]。为了消除外扩散的影响,后续实验均在800 r·min−1的搅拌速率下进行。
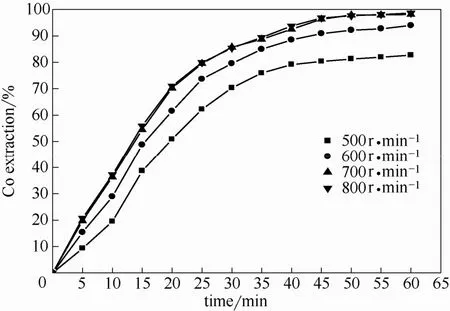
图2 搅拌速率对钴浸出率的影响Fig. 2 Effect of stirring speed on extraction of cobalt
2.2 硫酸浓度对Co浸出率的影响
在氧分压650 kPa, 温度225℃,粒度-53 μm,浸出60 min条件下,硫酸浓度对钴浸出率的影响如图3所示。可以看出,硫酸浓度是转炉渣氧压浸出过程的重要因素,它不仅影响钴的浸出,也影响铁的浸出率。粒度为-63~+53 μm,转炉渣铁浸出率在搅拌速度800 r·min-1浸出60 min,受硫酸浓度、反应温度及氧分压影响结果见表2。提高硫酸浓度,钴的浸出率也不断提高,在酸浓度从0.1 mol·L-1增加到0.4 mol·L-1,钴的浸出率几乎增加了45%。当酸浓度超过0.4 mol·L-1后,钴的浸出率没有明显变化,但铁的浸出率迅速上升,在酸浓度为0.5 mol·L-1时约是 0.4 mol·L-1的3倍(表2)。氧压浸出过程中,由于三价铁的水解会释放出硫酸,酸耗也远远小于常压浸出过程,酸浓度控制在0.4 mol·L-1,能实现浸出钴的同时,抑制铁的浸出。

图3 硫酸浓度对钴浸出率的影响Fig. 3 Effect of sulfuric acid concentration on extraction of cobalt

表2 硫酸浓度、温度及氧分压对铁浸出率的影响Table 2 Effects of sulfuric acid concentration, temperature and oxygen partial pressure on dissolution of iron
2.3 温度对Co浸出率的影响
在硫酸浓度0.4 mol·L-1,氧分压650 kPa, 粒度-63~+53 μm, 浸出60 min条件下,温度对钴的浸出率影响如图4所示。可以看出,在165℃时,钴的浸出率较低(<70%),升高温度明显提高了钴的浸出率,在225℃下浸出45 min,钴的浸出率达到97.7%,而铁的浸出率仅为165℃时的1/5(表2)。这表明温度对增加钴的浸出率和限制铁浸出率极为重要。此外还可发现,浸出时间超过30 min后,钴的浸出速率显著减小。这可能缘于浸出过程中反应控制步骤发生了改变。
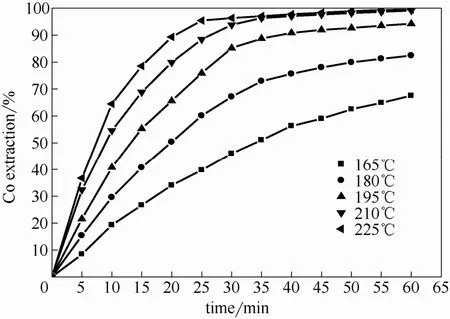
图4 温度对钴浸出率的影响Fig. 4 Effect of temperature on extraction of cobalt
2.4 氧分压对Co浸出率的影响
在硫酸浓度0.4 mol·L-1,温度225℃, 粒度-63~+53 μm, 浸出60 min条件下,氧气分压对钴浸出率的影响如图5所示。钴的浸出率随着氧分压的升高不断增加,但氧分压增加到550 kPa以上后,增加量明显变小。铁的浸出率也从开始的6.5%降低到650 kPa时的2.1%(表2)。这表明,氧分压的增加强化了钴的溶解,氧气作为浸出过程中最主要的氧化剂,它不仅影响金属矿物的溶解,还会影响铁硫酸盐的氧化和水解过程。由于炉渣中金属硫化物较少,故比起硫化矿物的氧压浸出过程耗氧量明显减少,浸出过程中的氧分压维持在650 kPa,钴便具有较高的浸出率,此氧分压下硫酸浸出液中氧气的浓度为10-7~10-4mol·L-1[17],过高的氧分压对钴的浸出率和铁的转化率没有大的意义。

图5 氧分压对钴浸出率的影响Fig. 5 Effect of oxygen partial pressure on extraction of cobalt
2.5 粒度对Co浸出率的影响
在硫酸浓度0.4 mol·L-1,温度225℃, 氧分压650 kPa,浸出60 min条件下,粒度对钴浸出率的影响如图6所示。可以看出,粒度减小到150 μm以下,钴的浸出率有明显增加的趋势,但低于74 μm对钴的浸出率影响不大。用粒度在-63~+53 μm的转炉渣,钴的浸出率为99.1%,高于粒度为-74~+63 μm的转炉渣钴的浸出率(98.6%),也比粒度为-150~+74 μm的结果大7%。这是由于随着粒度的减小,浸出颗粒的比表面积增大,结果浸出率提高[18]。但过小的粒度会增大浸出过程中颗粒之间的碰撞范围,增大颗粒相互的摩擦,从而阻碍了硫酸分子扩散到颗粒表面[19]。此外,粒度太小,磨矿成本及能耗会相应增加。
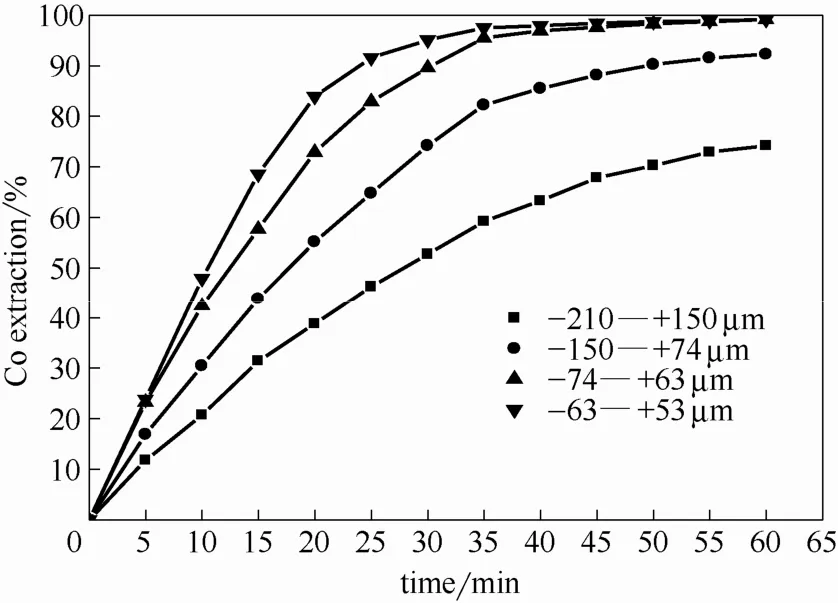
图6 粒度对钴浸出率的影响Fig. 6 Effect of particle size on extraction of cobalt
3 动力学描述与分析
氧压硫酸浸出镍转炉渣的过程涉及固-液-气的多相反应体系,矿物溶解的动力学主要受浸出剂通过固体产物层的扩散控制、固体颗粒表面的化学反应控制以及两者共同作用的混合控制[20]。常用未反应收缩核模型(SCM)、均匀模型(HM)、均匀气孔模型(UPM)以及颗粒模型(GM)等模型表述矿物浸出过程的动力学[21]。由化学反应控制、通过固体产物层的扩散控制以及两者共同作用的混合控制的SCM模型的速率方程如下[22-23]

式中,X为Co的浸出率,%;a含钴化合物与硫酸的反应中硫酸的计量系数;MB为颗粒的摩尔分子质量,g·mol−1;CA为硫酸的浓度, mol·L−1;r0为颗粒初始半径,μm;De为通过固体产物层的扩散系数,μm2·min−1;kc为化学速率常数, min−1;ρB为颗粒的密度, g·L−1;t为反应时间, min;kr、kd、km分别为由化学反应、通过固体产物层以及混合控制的表观速率常数,min−1。
为确定浸出过程中的动力学参数和控制步骤,将图4中不同温度下钴的浸出率数据代入式(9)和式(10)进行拟合,结果如图7所示。

图7 不同温度下1-(1-X)1/3和1-X-(1-X)2/3与t的关系Fig. 7 Plot of 1-(1-X)1/3and 1-X-(1-X)2/3vstfor various reaction temperatures, respectively
由图7可以看出,反应初期实验数据与式(9)拟合性好,而反应后期则与式(10)吻合,表明浸出过程的控制步骤是分阶段的,在前35 min内控制步骤为化学反应控制,之后转变为通过固体产物层的扩散控制。浸出初期,矿物先溶解,固体产物层的产生相对滞后且量很少,主要控制环节是矿物颗粒表面的化学反应;而反应后期,矿物溶解后生成了致密的赤铁矿及二氧化硅固体产物层,对矿物颗粒溶解有阻碍作用,此时控制环节为通过赤铁矿、二氧化硅等固体产物层的扩散控制。 将拟合得到的不同温度下的反应速率常数k代入Arrhenius方程

式中,A为频率因子;Ea是活化能,kJ;R是气体常数,kJ·mol−1;T是热力学温度,K。
以kln对1000/T作图,拟合得到两条直线如图8所示。根据直线的斜率,求出活化能值为43.19 kJ·mol−1和10.49 kJ·mol−1,分别在化学反应控制(>42 kJ·mol−1)和通过固体产物层扩散控制(4~12 kJ·mol−1)的活化能值范围内。另外,浸出过程中的反应控制步骤的转变是逐步过渡的过程,也就是说,从化学反应控制转变为通过固体产物层的扩散控制的过程,还应该经过一个混合控制阶段。将图4中的数据代入混合控制的式(11)作图(图9),发现30~45 min间1−(1−X)1/3−ln(1−X)与时间的线性关系良好,证明了过渡段混合控制确实存在,本研究中混合控制阶段的时间较短,且与化学控制和扩散控制阶段皆有交叉。Dimitrios等[24]在氧压浸出雌黄铁矿时也得出类似的结论。
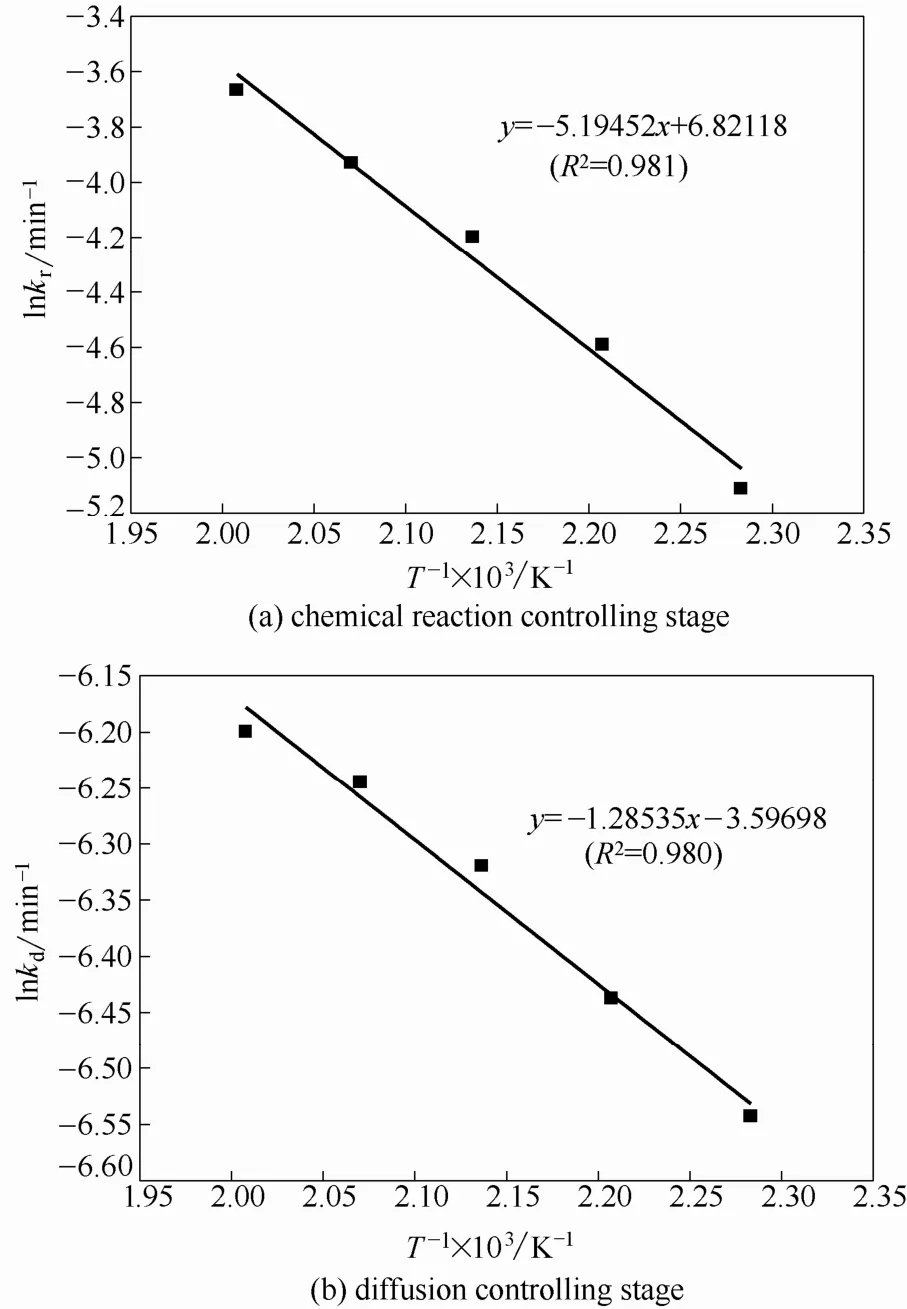
图8 不同控制阶段 Arrhenius方程拟合结果Fig.8 Arrhenius plot for cobalt dissolution in reaction/ diffusion-controlled stage
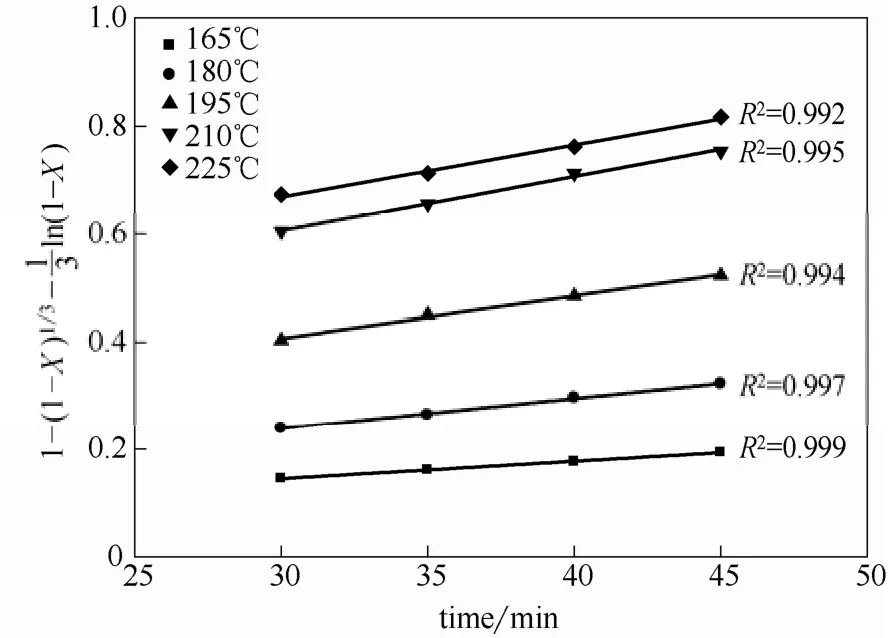
图9 混合控制1− (1−X)1/3−ln(1−X)与时间的关系Fig.9 Plot of mix-controlled 1− (1−X)1/3−ln(1−X)vstime
从各因素对钴浸出率的影响来看,当浸出时间超过35~40 min,即超过化学反应控制期后,钴的浸出率随时间增加变化较小。说明化学反应控制过程是转炉渣浸出过程的最主要过程,混合控制乃至扩散控制阶段对钴浸出率的影响较小。化学反应控制阶段钴的浸出速率常数与各因素的关系可以表示为
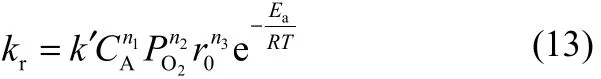
式中,n1、n2、n3分别是硫酸浓度、氧分压以及初始半径的反应级数;对于粒级为−dmax~+dmin的颗粒,其初始半径的估算;k′是与温度有关的速率常数。

图10 不同硫酸浓度下实验数据的拟合结果Fig. 10 Fitting of experimental data for various sulfuric acid concentrations

图11 不同氧分压下实验数据的拟合结果Fig. 11 Fitting of experimental data for various oxygen partial pressures
硫酸浓度对钴浸出率的影响(图3)结果表明硫酸浓度为0.4 mol·L−1或更高时对钴的浸出速率影响很小,表明此条件下硫酸溶解矿物的消耗量与铁离子水解时释放的硫酸量达到动态平衡。因此,选取0.1~0.4 mol·L−1硫酸浓度下钴的浸出率,根据式(9)分别以1−(1−X)1/3与T作图,拟合得到4条线性良好的直线,结果见图10(a)。由直线的斜率可得到不同硫酸浓度下的速率常数kr,用lnkr对lnCA作图,通过直线的斜率求得硫酸浓度的反应级数为0.79,见图10(b)。
相似地,在不同氧分压和粒度条件下得到的钴浸出率在化学反应控制阶段的拟合结果分别如图11(a)和图12(a)所示。拟合直线的相关系数都接近0.99,表明了良好的线性关系,由直线的斜率求得不同条件下的反应速率常数kr。用不同氧分压及不同粒度的lnkr分别对lnPO2和lnr0作图,结果分别如图11(b)和图12(b)所示。由两条拟合直线的斜率,得出氧分压和颗粒初始半径的反应级数分别为0.85和−0.95。根据式(9),化学反应控制的速率常数与r0−1呈正比,而颗粒初始半径的反应级数−0.95与−1非常接近,证实了浸出过程前期受化学反应控制。故可将颗粒初始半径的反应级数视为−1,由图12(b)的截距求得k′为0.15×103。
综上讨论,式(13)可以归纳为

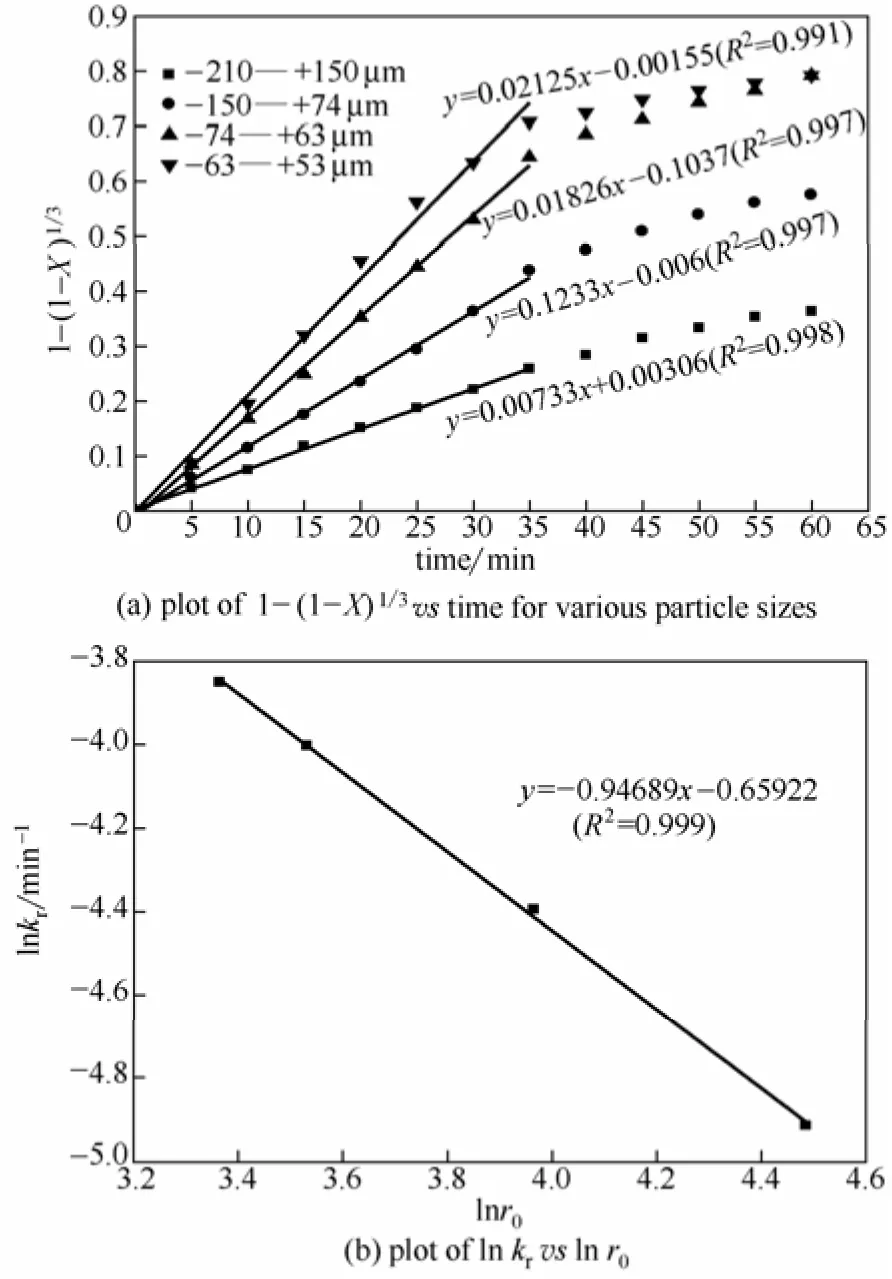
图12 不同粒度下实验数据的拟合结果Fig. 12 Fitting of experimental data for various particle sizes
4 结 论
转炉渣氧压酸性浸出过程中,反应温度和硫酸浓度对渣中钴和铁的浸出率影响显著。温度升高可提高钴的浸出率,同时能促使渣中铁转化为赤铁矿残留于渣中,实现钴浸出的同时抑制铁的浸出。硫酸不仅影响矿物的溶解,还会影响溶液中铁的浓度,需要严格控制在合理范围之内。
氧压浸出过程中钴溶解的动力学符合反应收缩核模型,不同反应阶段的控制步骤不同,反应初期为化学反应控制,中期为混合控制,后期为通过固体产物层的扩散控制。化学反应控制和固体产物层扩散控制过程的活化能分别为43.19 kJ·mol−1和10.49 kJ·mol−1。
化学反应控制阶段是影响钴浸出率的主要过程,硫酸浓度、氧分压及粒度的反应级数分别为0.79、0.85和−0.95,得出了钴浸出率的经验方程。
[1] Yang Kun(杨坤), Zhang Chunsheng(张春生). Research on copper and cobalt removal from cobalt white alloy by using pressure leaching [J].Nonferrous Metals Design(有色金属设计), 2014, 42(2): 38-41.
[2] Yu Zhengjun(喻正军). Study on the theory and technology of recovering cobalt, nickel and copper from nickel converter slag [D]. Changsha: Central South University, 2007.
[3] Gbor P K, Hoque S, Jia C Q. Dissolution behavior of Fe, Co, and Ni from non-ferrous smelter slag in aqueous sulphur dioxide [J].Hydrometallurgy, 2006, 81(2): 130-141.
[4] Anand S, Rao K S, Jena P K. Pressure leaching of copper converter slag using dilute sulphuric acid for the extraction of cobalt, nickel and copper values [J].Hydrometallurgy, 1983, 10(3): 305-312.
[5] Li X, Li B H, Deng J J. Environmental-friendly process for recovering copper and nickel from Jinchuan tailings by silica-based selective adsorbents [J].Industrial & Engineering Chemistry Research, 2014, 53(27): 11137- 11144.
[6] Arslan C, Arslan F. Recovery of copper, cobalt, and zinc from copper smelter and converter slags [J].Hydrometallurgy, 2002, 67(1): 1-7.
[7] Zhai X J, Li N J, Zhang X, Fu Y, Jiang L. Recovery of cobalt from converter slag of Chambishi Copper Smelter using reduction smelting process [J].Trans. Nonferrous Met. Soc. China, 2011, 21(9): 2117-2121.
[8] Banza A N, Gock E, Kongolo K. Base metals recovery from copper smelter slag by oxidizing leaching and solvent extraction [J].Hydrometallurgy, 2002, 67(1): 63-69.
[9] Altundogan H S, Boyrazli M, Tumen F. A study on the sulphuric acidleaching of copper converter slag in the presence of dichromate [J].Minerals Engineering, 2004, 17(3): 465-467.
[10] Anand S, Rao P K, Jena P K. Recovery of metal values from copper converter and smelter slags by ferric chloride leaching [J].Hydrometallurgy, 1980, 5(4): 355-365.
[11] Zhang Y, Man R L, Ni W D, Wang H. Selective leaching of base metals from copper smelter slag [J].Hydrometallurgy, 2010, 103(1-4): 25-29.
[12] Li Y J, Perederiy I, Papangelakis V G. Cleaning of waste smelter slags and recovery of valuable metals by pressure oxidative leaching [J].Journal of Hazardous Materials, 2008, 152(2): 607-615.
[13] Perederiy I, Papangelakis V G, Buarzaiga M, Mihaylov I. Co-treatment of converter slag and pyrrhotite tailings via high pressure [J].Journal of Hazardous Materials, 2011, 194: 399-406.
[14] Li Y J, Papangelakis V G, Perederiy I. High pressure oxidative acid leaching of nickel smelter slag: characterization of feed and residue [J].Hydrometallurgy, 2009, 97(3): 185-193.
[15] Mining and Metallurgy Research Institute of Beijing Analysis Room(北京矿冶研究总院分析室). Analysis Manual of Ore and Non-ferrous Metals(矿石及有色金属分析手册) [M]. Beijing: Metallurgical Industry Press, 1990:70-90.
[16] Qiu S, Wei C, Li M, Zhou X J, Li C X, Deng Z G. Dissolution kinetics of vanadium trioxide at high pressure in sodium hydroxideoxygen systems [J].Hydrometallurgy, 2011, 105(3): 350-354.
[17] Tromans D. Oxygen solubility modeling in inorganic solutions: concentration, temperature and pressure effects [J].Hydrometallurgy, 1998, 50(3): 279-296.
[18] Souza A D, Pina P S, Leão V A. The leaching kinetics of a zinc sulphide concentrate in acid ferric sulphate [J].Hydrometallurgy, 2007, 89(1): 72-81.
[19] Behnamfard A, Salarirad M M, Veglio F. Process development for recovery of copper and precious metals from waste printed circuit boards with emphasize on palladium and gold leaching and precipitation [J].Waste Management, 2013, 33(11): 2354-2363.
[20] Gharabaghi M, Irannajadb M, Azadmehr A R. Leaching kinetics of nickel extraction from hazardous waste by sulphuric acid and optimization dissolution conditions [J].Chemical Engineering Research and Design, 2013, 91(2): 325-331.
[21] Georgious D, Papangelakis V G. Sulphuric acid pressure leaching of a limonitic laterite: chemistry and kinetics [J].Hydrometallurgy, 1998, 49(1): 23-46.
[22] Aydogan S. Dissolution kinetics of sphalerite with hydrogen peroxide in sulphuric acid medium [J].Chemical Engineering Journal, 2006, 123(3): 65-70.
[23] Tian J, Yin J Q, Chi R, Rao G H, Jiang M T, Ouyang K X. Kinetics on leaching rare earth from the weathered crust elution-deposited rare earth ores with ammonium sulfate solution [J].Hydrometallurgy, 2010, 101(3): 166-170.
[24] Dimitrios F, Rao K, George P D. A kinetic study on the acid pressure leaching of pyrrhotite [J].Hydrometallurgy, 1997, 47(1): 1-18.
Kinetics and behavior of cobalt extraction from low nickel matte converter slag by pressure oxidative leaching with sulfuric acid
LIAO Yalong, HUANG Feirong, ZHOU Juan, LI Bingjie
(Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology,Kunming650093,Yunnan,China)
The dissolution kinetics and behavior of cobalt extraction from low nickel matte converter slag by pressure oxidative leaching with sulfuric acid were investigated. The effects of stirring speed, temperature, sulfuric acid concentration, oxygen partial pressure and particle size on extraction rate of cobalt were studied for exploring the kinetics law of cobalt dissolution from the slag. The experimental results showed that the extraction efficiency of cobalt increased with the increases of temperature, sulfuric acid concentration and oxygen partial pressure, but the sulfuric acid concentration above 40 g·L-1can cause an increase of iron extensive dissolving in the solution. The stirring speeding above 700 r·min-1, oxygen partial pressure beyond 650 kPa and particle size of less than 74 μm were found to have no effect on the extraction of cobalt. The dissolution kinetics analysis of the experimental data based on the shrinking core model for various conditions indicated that the reaction rate of leaching was mainly controlled by the chemical reaction during its early stages, then switched to be controlled by mixed chemical-reaction and product-layer diffusion, and finally was controlled solely by diffusion through a surface product layer in the later stage. The activation energy was calculated to be 43.19 kJ·mol-1in the early surface chemical reaction controlled stage and 10.49 kJ·mol-1in the later diffusion controlled stage, respectively. In the chemical reaction controlled stage, the reaction orders with respect to sulfuric acid concentration, oxygen partialpressure and particle size are 0.79, 0.85 and -0.95, respectively.
leaching; converter slag; pressure oxidative leaching; kinetics; multiphase reaction
Prof. LIAO Yalong, liaoylsy@163.com
10.11949/j.issn.0438-1157.20150226
TQ 013.2
:A
:0438—1157(2015)10—3971—08
2015-02-12收到初稿,2015-05-26收到修改稿。
联系人及
:廖亚龙(1966—),男,副教授,博士。
国家自然科学基金项目(21266011)。
Received date: 2015-02-12.
Foundation item: supported by the National Natural Science Foundation of China (21266011).

