WO3/TiO2-ZrO2脱硝催化剂制备及其NH3活化机理
王龙飞,张亚平,郭婉秋,沈凯,郑鹏飞,杨林军
(1东南大学能源与环境学院,能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;2郑州大学化工与能源学院,河南 郑州 450000)
WO3/TiO2-ZrO2脱硝催化剂制备及其NH3活化机理
王龙飞1,张亚平1,郭婉秋1,沈凯1,郑鹏飞2,杨林军1
(1东南大学能源与环境学院,能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;2郑州大学化工与能源学院,河南 郑州 450000)
采用共沉淀法制备了WO3/TiO2-ZrO2脱硝催化剂,并用固定床反应器进行活性评价,采用BET、XRD、TPD、氨气吸附漫反射FT-IR进行表征。结果显示,ZrO2掺杂增强了TiO2的Lewis酸性;负载WO3之后,位于3.1~1.7 nm之间孔隙的稳定性显著增强;NH3的吸附与活化分别由TiO2-ZrO2载体和WO3完成;WO3中W元素强大的电负性,促进了NH3的N—H键由共价键向离子键过渡,进而导致了NH3的活化。脱硝活性结果显示:当WO3含量为9%(质量)时,催化剂脱硝活性最高,并在320~420℃的温度窗口保持94%以上。(9%)WO3/TiO2-ZrO2具有更加稳定的孔隙结构(4.4~1.7 nm),表面Brønsted酸中心数量增加,Lewis酸中心的强度和酸量增加的幅度最大,NH3-SCR过程中的活性中间产物NH2的吸收峰更加明显,这些特征可能是其脱硝活性最好的原因。
催化剂;载体;原位氨气吸附漫反射红外;三氧化钨;活化
引 言
随着我国新一轮火电厂大气污染物排放标准的(GB 13223—2011)实施,新建锅炉(以油为燃料)、燃气轮机组、燃煤锅炉的NOx排放标准要求(以NO2计)≤100 mg·m−3[1],面对NOx减排带来的压力,如何高效降低NOx排放就成了一个重要的环保课题。常用的NOx脱除技术主要包括选择性催化还原法(SCR)和选择性非催化还原法(SNCR)。虽然SNCR技术成本低,但脱硝效率低(50%以下)[2-4]且NOx的最终排放浓度在150 mg·m−3以上[5],无法满足NOx排放标准的要求。而SCR由于其较高的脱硝效率,正受到广泛的应用,目前在建脱硝工程95%以上采用的是SCR技术。
SCR过程中的核心部分是催化剂,工业化应用的脱硝催化剂多为V2O5/TiO2,其温度窗口为370~430℃,脱硝效率大约在80%[6]。然而,V2O5/TiO2(锐钛矿)是一个不稳定的体系,TiO2(锐钛矿)是钛氧化物中的一种亚稳态晶体,比表面积较小,受热时表面极易收缩,在一定温度及压力条件下易转化为热力学状态比较稳定的金红石,进而导致脱硝效率的不可逆下降。
近年来,许多研究将多种金属掺杂到TiO2中形成复合氧化物载体,如将ZrO2掺杂到TiO2中形成连续的固溶体。TiO2-ZrO2固溶体不但保持了TiO2和ZrO2原有的特殊性能,而且克服了二者各自的缺点,使其具有比单独的TiO2和ZrO2更大的比表面积(可达256.01 m2·g−1)[7-8]。因此,国内外对TiO2-ZrO2固溶体进行了大量研究,如利用V2O5/ TiO2-ZrO2[8]催化制甲缩醛和MnOx/TiO2-ZrO2[9]、CeO2/TiO2-ZrO2[10]、K/Pt/TiO2-ZrO2[11]、V2O5/TiO2-ZrO2[7]、V2O5-WO3/TiO2-ZrO2[12]、CeO2-MnOx/ TiO2-ZrO2[13]、MnOx/ZrO2/MWCNTs[14]等TiO2-ZrO2基NH3-SCR脱硝研究证明了ZrO2的掺杂可以提高催化剂的表面酸性、载体的热稳定性以及脱硝效率。
WO3以其强的Brønsted特性和稳定TiO2(锐钛型)载体[15]的能力常用来作为商业脱硝催化剂的助剂,对于WO3和ZrO2同时掺杂国内研究很少,Vannia等[16]对WOx-ZrO2研究认为WOx的掺杂有利于产生Brønsted酸位;Rodney等[17]对于Fe/WO3-ZrO2的研究证明:两者的掺杂导致催化剂具有超强的储存NH3的能力,有利于脱硝反应。鉴于TiO2-ZrO2载体和WO3具有的强酸性特征,本研究将WO3掺杂到TiO2-ZrO2上,研究了催化剂对于NH3的活化机制和酸性特征:如酸中心类型及分别对应的酸量、酸中心的供体、酸量与催化剂脱硝活性之间的关系,以期提高催化剂效率。
本实验通过共沉淀与浸渍法制备了一系列不同WO3含量的TiO2-ZrO2基催化剂记作(x)WO3/TiO2-ZrO2,在固定床反应器上进行脱硝活性的测试,并采用BET、XRD、NH3-TPD和in situDRIFTS analysis等表征技术来研究催化剂的NH3的活化机制及表面酸性特征、内部微观结构,以及催化性能与表面酸性特征之间的关系。
1 实验部分
1.1 催化剂的制备
1.1.1 采用共沉淀法制备TiO2-ZrO2(Ti和Zr摩尔比为1)固溶体载体 冰水浴条件下,将TiCl4(AR,上海凌峰化学试剂有限公司)滴加到含有ZrOCl2·8H2O的去离子水中(AR,国药集团化学试剂有限公司),边滴加边搅拌。滴加完毕,浓氨水(AR,上海中试化工总公司)调节pH至9~10;产生白色沉淀后,静置12 h,倾去上层清液,用去离子水洗涤沉淀,真空抽滤,用0.1 mol·L−1AgNO3溶液检测滤液直至无Cl−出现,将洗净的沉淀在烘箱中110℃条件下干燥12 h,取烘干后固体研磨,放入马弗炉中450℃煅烧4 h后即得到钛锆固溶体。1.1.2 WO3/TiO2-ZrO2催化剂的制备 将TiO2-ZrO2固溶体载体置于烧杯中,加入钨酸铵,25℃油浴4 h,之后85℃直至水分蒸干;然后磁力搅拌条件下浸渍仲钨酸铵,取基本蒸干固体,烘箱中110℃下干燥12 h,碾磨后,放入马弗炉中在450℃下煅烧4 h,即制得一系列WO3质量分数为6%、9%、12%的催化剂,记作(x)WO3/TiO2-ZrO2。1.1.3 TiO2的制备 冰水浴条件下,将TiCl4滴加到去离子水中,边滴加边搅拌。滴加完毕,用浓氨水调节pH至9~10;产生白色沉淀后,静置12 h,洗涤抽滤,用0.1 mol·L−1AgNO3溶液检测滤液直至无Cl−出现,将洗净的沉淀在烘箱中110℃条件下干燥12 h,取烘干后固体研磨,放入马弗炉中450℃煅烧4 h后即得 TiO2
1.2 催化剂表征及性能测试
BET比表面积和孔径由北京金埃谱公司F-sorb 3400比表面积及孔径分析仪测量。样品在真空状态下,150℃预处理30 min,200℃预处理1 h,吸附质为液氮,高纯N2回填充气。
NH3-TPD用来反映催化剂表面的NH3吸附情况,由浙江泛泰仪器FINESORB-3010全自动程序升温化学吸附仪来测试。测试样品量为70 mg,粒径为40~60目,TPD流程200℃预处理1 h,降至室温25℃,NH3吸附1 h,N2吹扫15 min,以10℃·min−1速率程序升温至600℃,TCD热导检测器检测电信号。
XRD分析采用北京PEPSEE-XD-3型衍射仪进行物相分析,Cu靶(λ=0.15406 nm),管电压为35 kV,管电流为20 mA,2θ偶合连续扫描,扫描角度范围为10°~80°。
原位NH3红外分析:利用Nicolet 6700傅里叶原位红外光谱仪(Thermo Electron Corporation)和HARRICK漫反射反应舱,以NH3分子作探针,采集催化剂表面酸位、波长范围为400~4000 cm−1,分辨率4 cm−1,扫描次数32。
脱硝性能测试:取0.3 g 40~60目催化剂于管式固定床反应器中,反应器为内径6 mm的不锈钢管。总烟气流量为100 ml·min−1,进气组分为Φ(NO)=Φ(NH3)=0.08%,Φ(O2)=5%,N2为平衡气,空速为2.0×104h−1。采用testo 330-2LL烟气分析仪测量进出口NO、NO2、O2浓度,据此计算NOx脱除率。
2 实验结果与讨论
2.1 BET表征结果
催化剂的BET比表面积和孔径分布分别如表1和图1所示。TiO2-ZrO2催化剂具有较大的比表面积,随着WO3负载量的增加,催化剂的比表面积呈现逐渐减小的趋势。从图1可以看出,相对于载体,所有负载WO3的催化剂的孔径频率在308.4~13.8 nm、10.3~8.2 nm、5.7~4.9 nm基本无变化,13.8~ 10.3 nm、6.7~5.7 nm明显减小,而在8.2~6.7 nm、3.1~1.7 nm有所增大。这表明催化剂比表面积的减小是由于WO3的负载堵塞了孔径位于13.8~10.3 nm、6.7~5.7 nm的孔隙,WO3/TiO2-ZrO2系列催化剂脱硝活性的整体提高是由于WO3的负载增强了孔隙结构的稳定性(8.2~6.7 nm、3.1~1.7 nm)。而在4.9~4.4 nm和4.4~1.7 nm时(9%)WO3/TiO2-ZrO2达到最小和最大,这表明:WO3对于催化剂孔隙结构的稳定作用是选择性的,(9%)WO3对于4.4~1.7 nm的孔隙稳定作用最强,且在脱硝反应过程中,4.4~1.7 nm的孔隙可能起到了主要作用,这也可能是WO3负载量为9%时催化剂脱硝效率达到最大的原因。

表1 样品的BET比表面积Table 1 BET area of different catalysts
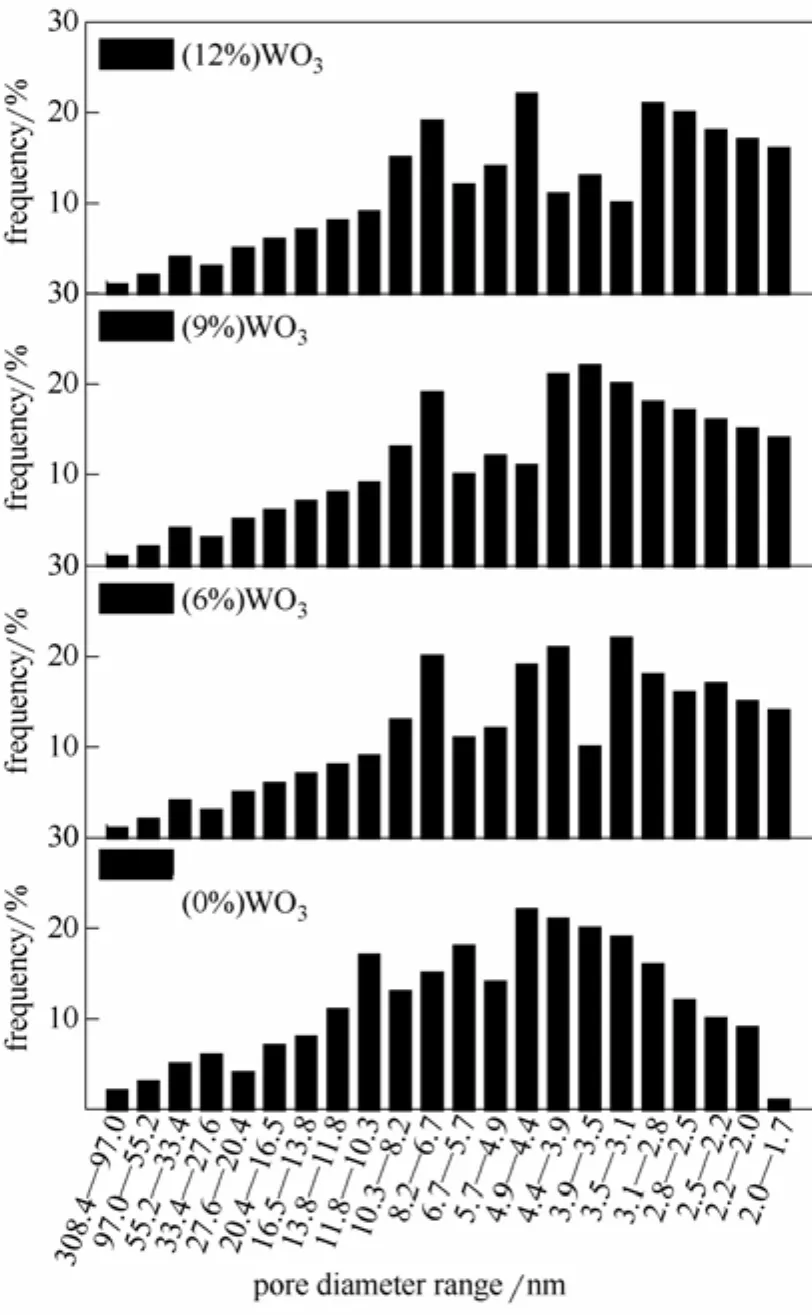
图1 WO3/TiO2-ZrO2系列催化剂的孔径分布Fig.1 Pore diameter range for different catalysts
2.2 NH3-TPD表征结果
图2为不同催化剂的TPD谱图。在200~400℃之间,催化剂只有一个明显的NH3脱附峰;400℃之外NH3的脱附峰强度很低,且已经溢出了脱硝反应的温度区间(200~400℃)。因此,在真实脱硝过程中(300~400℃),起主要作用的是位于200~400℃之间的酸中心。随着WO3负载量的增加,样品NH3脱附峰温度依次是:T3>T4>T1>T2(T为NH3脱附中心温度)。通过TPD仪器(浙江泛泰,FINESORB-3010,标定气:1%NH3与He混合气)脉冲峰标定,样品氨气脱附量为:A9%(111.88ml·g−1)<A0%(116.38 ml·g−1)<A12%(123.10 ml·g−1)<A6%(152.49 ml·g−1)。负载
之后催化剂的脱硝率与负载量的关系为CP9%>CP6%>CP12%>CP0%的态势(CP表示脱硝效率)。可以推断出,脱硝活性的提高与催化剂表面的NH3吸附量和NH3脱附峰温度(脱附峰温度反映了NH3脱附的难易程度)密切相关。对于(9%)WO3/TiO2-ZrO2而言,其NH3脱附峰温度位于脱硝温度区间(>300℃)之内,而其他3种催化剂,其脱附峰温度均低于300℃,即在真实脱硝过程中,NH3容易从催化剂的表面脱附下来,由于脱硝反应依赖催化剂对于NH3的吸附,这可能是造成其活性相对较高的原因;而对于其他3种催化剂,由于各自NH3吸附量的不同:A6%>A12%>A0%,同时NH3均容易从催化剂表面脱附下来,因此,具有较大NH3吸附量的催化剂,脱硝率较高,这可能是造成CP6%>CP12%>CP0%的原因。
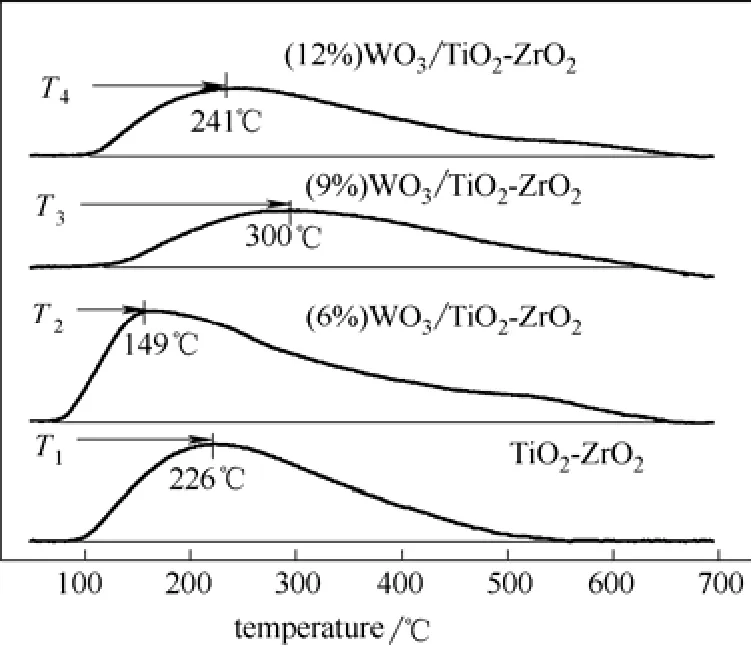
图2 不同催化剂的TPD谱图Fig.2 TPD profles of different catalysts
2.3 XRD表征结果
图3为不同催化剂的XRD图。对照XRD标准卡片库,2θ=33.75° 时,ZrO2以单斜晶系存在;2θ=54.97° 时,TiO2以单斜晶系、锐钛型存在;纯的TiO2(实验室自制,小图所示)显示,在2θ=75.13°处有金红石相出现;这表明在无WO3负载的情况下,ZrO2的掺杂也可能抑制TiO2由锐钛型向金红石型的转变。图3中无ZrTiO4晶相的出现,这是因为TiO2-ZrO2载体的焙烧温度为450℃,而卢熙宁等[13]认为焙烧温度为750℃时才会出现ZrTiO4的衍射峰。此外,图3中也无WO3晶相的出现,这可能是因为WO3结晶度过低,晶粒尺寸过小,没有发生团聚,以无定形态分散于催化剂的表面,或者也可能是由于ZrO2和TiO2的半峰宽较大,峰的宽化极有可能掩盖了WO3晶相。同时随着WO3负载量的逐渐增加,样品的全部衍射峰出现了整体向右偏移的现象,根据布拉格公式:2dsinθ=nλ,θ变大导致晶面间距减小,这也是WO3掺杂的表现。
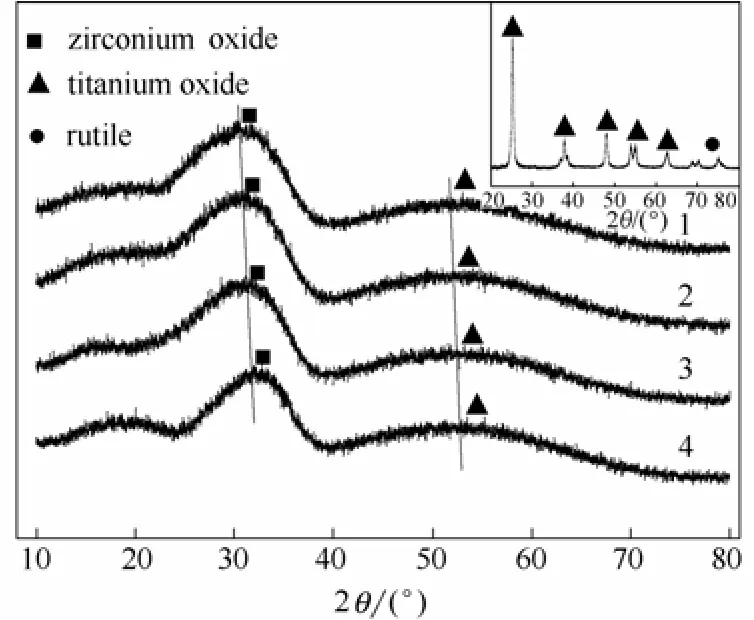
图3 不同催化剂的XRD谱图Fig.3 X-ray powder diffractions of different catalysts1—0%WO3;2—6%WO3;3—9%WO3;4—12%WO3
2.4 氨吸附原位傅里叶变换红外结果
Ting等[18]研究表明,1458 cm−1和1680 cm−1处的吸收峰是由于吸附在Brønsted酸中心的NH+4的非对称δas(NH+4)和对称变形δs(NH+4)振动造成的,而1180 cm−1和1616 cm−1处的吸收峰归属于吸附于Lewis酸中心的NH3的对称伸缩振动δs(NH3)和非对称伸缩振动δas(NH3)[19-21];1560 cm−1左右的吸收峰是由NH2属于的弯曲振动形成的[22]。
对于TiO2-ZrO2载体[图4(a)],在1180 cm−1和1616 cm−1处出现属于Lewis酸中心的吸收峰,在1450 cm−1和1680 cm−1处出现属于Brønsted酸中心的吸收峰。对于负载WO3后的催化剂[图4(b)~(d)],在1180 cm−1和1616 cm−1也出现了属于Lewis酸中心的吸收峰,且峰的强度与面积相较于载体显著增强,1450 cm−1处出现属于Brønsted酸中心的吸收峰,峰的强度相较于载体略微减小,原本在1680cm−1处属于Brønsted酸中心的吸附峰消失,在1475 cm−1处新出现一个属于Brønsted酸中心的吸收峰,这说明WO3的掺杂增加了催化剂表面Brønsted酸中心的数目以及Lewis酸中心的酸量和强度。
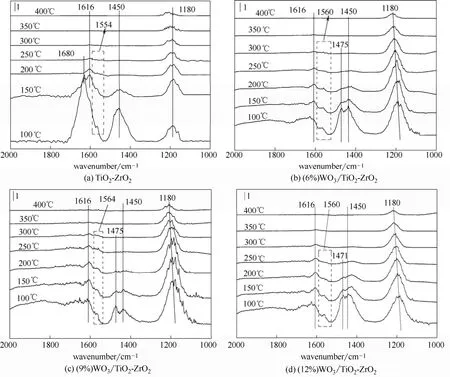
图4 催化剂25℃ NH3吸附饱和程序升温脱附Fig.4 Catalyst adsorption at 25℃ temperature program desorption
从图4还可以看出,1450 cm−1和1680 cm−1处属于Brønsted 酸中心的吸收峰在200℃左右基本消失,而在1180 cm−1和1616 cm−1处属于Lewis酸中心的吸收峰在350℃时还未消失,表明吸附于Brønsted酸中心的NH+4比吸附在Lewis酸中心的NH3更容易脱附(Brønsted酸中心吸附的NH3以NH+4的形式存在,Lewis酸中心吸附的NH3以NH3分子的形式存在)。众所周知,NH3的吸附是NH3-SCR反应的第1步,较长的停留时间有利于催化剂的表面反应,这可能是造成(x)WO3/TiO2-ZrO2系列催化剂的脱硝效率高于TiO2-ZrO2催化剂的原因之一。对于TiO2-ZrO2催化剂而言,脱附温度由100℃升至150℃时,1680 cm−1处的Brønsted酸中心消失,1616 cm−1处出现Lewis酸中心,而对于WO3负载后的催化剂,在1600~1700 cm−1之间,只有1616 cm−1处的Lewis酸中心,这表明WO3可能具有促进Brønsted酸中心向Lewis酸中心转化的作用。
图4中1560 cm−1左右出现的属于NH2吸附中心的吸收峰,且当WO3负载量为9%时,此吸收峰更加明显,这可能是因为TiO2-ZrO2催化剂在负载了WO3后,Lewis酸中心变得更强,具有更强的极化作用[23]。当NH3吸附在催化剂表面时,被极化的Lewis酸中心(W:原子核外电子排布[Xe]5d46s2, 5d轨道仍未充满,根据洪德规则,W原子5d轨道只需得到1个e−,就正好达到半充满,即能量最低状态,而Ti([Ar]3d24s2)和Zr([Kr]4d25s2),还要3个e−才能达到半充满状态,即能量最低状态,因此与Ti、Zr元素相比,W元素可能具有强大的吸电子能力,同时3种元素的电负性W(2.36)>Ti(1.54)>Zr(1.33)[24])具有强大的吸电子能力,会导致NH3的N—H键被强烈极化,促使NH3中N—H键由共价键向离子键过渡,进而使在程序升温脱附过程中产生的变化(图5),这可能是导致负载WO3之后,NH2的吸收峰更加明显的原因之一。在NH3-SCR过程中,NH3的活化(NH3分子的H原子转移至催化剂表面的氧化还原中心[25-26])是至关重要的一步[27]。毫无疑问,负载WO3之后,Lewis酸中心强度有所增强,且增强后的Lewis酸中心更有利于NH3的活化,这也可能是(9%)WO3/TiO2-ZrO2具有最高脱硝效率的主要原因。1610、3270和1680 cm−1处出现了Lewis酸中心和Brønsted 酸中心的吸收峰,1550 cm−1处出现了NH2吸附中心的吸收峰,这说明纯的WO3具有促进NH3活化的能力,且WO3/TiO2-ZrO2活化NH3的能力来源于WO3的负载。同时,结合图5可得,催化剂表面的Lewis酸中心是由TiO2-ZrO2载体提供的,而WO3的负载增强了催化剂表面Lewis的强度,促进了NH3的活化。

图5 WO3对NH3的活化机制推测Fig.5 Possible mechanism of NH3activation by WO3
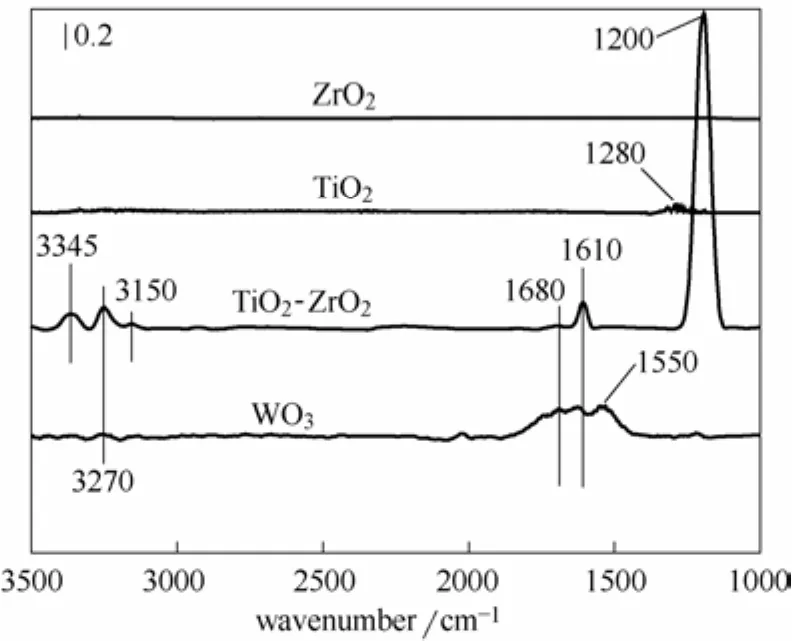
图6 催化剂与载体的氨气吸附的原位漫反射红外光谱Fig.6In situDRIFTS spectra of NH3adsorbed on catalysts and carrier at 350℃
2.5 不同含量钨氧化物对SCR脱硝效率的影响
如图7所示,在200~450℃范围内,4种催化剂的脱硝效率均呈现先增加后减小的趋势;相对于TiO2-ZrO2载体,在320~420℃范围内,当WO3的负载量为9%时,催化剂脱硝效率接近94%,温度窗口也较宽。这可能是因为纯WO3具有强大的Brønsted酸量[16],当钛锆载体掺杂了WO3之后,催化剂表面的Brønsted酸的数量和Lewis酸的强度与酸量显著增强,活性中间产物NH2的吸收峰也更加明显;同时,表1的BET表征也发现,添加WO3后催化剂孔隙结构更加稳定,这些特性都有助于提
图6为3种催化剂与载体在350℃持续氨气吸附的原位漫反射红外光谱,可以看出,ZrO2在350℃下对于NH3的吸附力极弱,无吸收峰出现;纯TiO2(锐钛型)在1280 cm−1[28]出现一处属于Lewis酸中心的吸收峰,TiO2-ZrO2催化剂在1200、1610、3150、3270、3345 cm−1[18]有5处归属于Lewis酸中心的吸收峰,且TiO2-ZrO2载体在1200 cm−1处的吸收峰的强度极大,这表明ZrO2的加入极大地增加了其表面Lewis酸中心的强度,且TiO2-ZrO2载体表面的Lewis酸中心是由TiO2提供的,纯WO3在高催化剂的脱硝效率。

图7 (x)WO3/TiO2-ZrO2系列催化剂的脱硝效率Fig.7 NOxconversion for different catalysts
3 结 论
(1)在320~420℃温度范围内,(9%)WO3/TiO2-ZrO2呈现出最好的脱硝活性,脱硝效率接近94%,并且具有较宽的温度窗口。
(2)通过BET、XRD、TPD、NH3-adsorbedin situDRIFTS等表征可知,WO3负载之后,孔隙的稳定性显著增强;催化剂表面的Brønsted酸中心的数量和Lewis酸中心的强度都有明显增加,且NH3-SCR过程中的活性中间产物NH2的吸收峰更加明显;NH3的吸附是由TiO2-ZrO2载体表面TiO2的Lewis中心完成的,ZrO2的掺杂提高了TiO2的Lewis中心强度。WO3的负载起到了进一步增强Lewis中心强度和促进NH3活化的作用。
(3)(9%)WO3/TiO2-ZrO2催化剂表面具有的高度WO3分散性,孔径频率在4.4~1.7 nm之间最大,Brønsted酸中心的数量、Lewis中心的酸量与强度的增加、活性中间产物NH2的增多的特征,是其具有最好脱硝活性的原因。
(4)WO3中W元素具有相对较大的电负性(2.36),促进了NH3的N—H键由共价键向离子键过渡,产生较多的活性中间产物NH2,这可能是促进NH3活化的原因。
[1] GB 13223—2011. Emission standard of air pollutants for thermal power plants(火电厂大气污染物排放标准)[S].
[2] Li Qiong(李穹), Wu Yuxin(吴玉新), Yang Hairui(杨海瑞), Lü Junfu(吕俊复). Simulation and optimization of SNCR process [J].CIESC Journal(化工学报), 2013, 64(5): 1789-1796.
[3] Zhou Yinggui(周英贵), Jin Baosheng(金保昇).Simulation study of multi-component mixing characteristic between flue gas and droplet for improved(SNCR+SCR) DeNOxtechnology [J].Journal of Combustion Science and Technology(燃料科学与技术), 2012, 18(4): 359-366.
[4] Desulfurization and Denitration Committee of CAEPI. Development Report on China Desulfurization and Denitration Industries in 2013[R].Beijing: China Environmental Protection Industry, 2014: 4-15.
[5] Zhou Guomin(周国民), Tang Jancheng(唐建成), Hu Zhenguang(胡振广), Zhao Haijun(赵海军), Gong Jiayou(龚家猷). Application research of SNCR technology in the pulverized-coal fired boiler [J].Power System Engineering(电站系统工程), 2010, 26(1): 18-21.
[6] Liu Q Y, Liu Z Y, Li C Y. Adsorption and activation of NH3during selective catalytic reduction of NO by NH3[J].Chin. J. Catal., 2006, 27(7): 636-646.
[7] Zhu Xiaoqiang(朱孝强), Huang Yaji(黄亚继), Shen Kai(沈凯), Xu Haitao(徐海涛), Zhang Yaping(张亚平), Zhou Changcheng(周长城). Preparation of V2O5/TiO2catalyst with ZrO2addition and selective catalytic reduction of NOx[J].Environmental Chemistry(环境科学), 2012, 31(4): 443-449.
[8] Wu Janbing(武建兵), Wang Hui(王辉), Qin Zhangfeng(秦张峰), Wu Zhiwei(吴志伟), Huang Lichun(黄礼春), Zhao Qi(赵启), Wang Jianguo(王建国). Selective oxidation of methanol to dimethoxymethane over V2O5/TiO2-ZrO2catalyst [J].Journal of Fuel Chemistry and Technology(燃料化学学报), 2011, 39(1): 64-68.
[9] Zhang Yandong(张延东), Li Huiyuan(李慧远), Zhu Shemin(祝社民), Zhang Limin(张利民), Wang Zhiliang(王志良), Shen Shubao(沈树宝).Preparation and catalytic performance of MnOx/TiO2-ZrO2catalysts used for selective catalytic reduction of NO at low temperature [J].Acta Scientiae Circumstantiae(环境科学学报), 2009, 29(2): 339-343.
[10] Yan Zhiyong(闫志勇), Hu Janfei(胡建飞), Xu Hong(徐鸿). Denitrification property of catalyst CeO2/TiO2-ZrO2with strong hydrothermal stability and sulfur tolerance [J].Journal of Chinese Society of Power Engineering(动力工程学报), 2011, 31(1): 58-63.
[11] Liu Yong(刘咏), Meng Ming(孟明), Guo Lihong(郭丽红), Zha Yuqing(查宇清). Effects of support calcination temperature on the structure and properties of NOxstorage and reduction catalyst K/Pt/TiO2-ZrO2[J].Chinese Journal of Catalysis(催化学报), 2007, 28(10): 850-856.
[12] Li Peng(李鹏), Zhang Yaping(张亚平), Xiao Rui(肖睿), Shen Kai(沈凯), Sun Keqin(孙克勤), Xu Haitao(徐海涛), Zhou Changcheng(周长城). Selective catalytic reduction of NOxwith NH3over V2O5-WO3/TiO2-ZrO2monolith catalysts [J].Journal of Central South University:Science and Technology(中南大学学报:自然科学版), 2013, 44(4): 1719-1725.
[13] Lu Xining(卢熙宁), Song Cunyi(宋存义), Tong Zhensong(童振松), Zhang Donghui(张东辉). Low-temperature catalytic reduction of nitrogen oxides over manganese-cerium composite oxides supported on zirconium-doped titanium dioxide [J].Journal of University of Science and Technology Beijing(北京科技大学学报), 2014, 36(9): 1222-1232.
[14] Yang Chao(杨超), Liu Xiaoqing(刘小青), Huang Bichun (黄碧纯), Wu Youming(吴友明).Structural properties and low-temperature SCR activity of zirconium-modified MnOx/MWCNTs catalysts [J].Acta Phys.-Chim.Sin.(物理化学学报), 2014, 30(10): 1895-1902.
[15] Lei P, Chi F, Lina S, Jun X Y, Xing C, Jian W, MingK, Tao L. Effect of V2O5/WO3-TiO2catalyst preparation method on NOx[J].Chinese Journal of Catalysis, 2014, (35): 2010- 2028.
[16] Vannia C S, Karen W, Adam F L, Shirley N. Physicochemical properties of WOx/ZrO2catalysts for palmiticacid esterification [J].Applied Catalysis B:Environmental,2015, 162: 75-84.
[17] Rodney F, Tanya V, Dmitry B L, Paul Mi, Jillian C. Formation of reactive Lewis acid sites on Fe/WO3-ZrO2catalysts for higher temperature SCR applications [J].Applied Catalysis B:Environmental,2015: 162: 174-179.
[18] Ting C, Bin G, He L, Lin Z.In situDRIFTS study of the mechanism of low temperature selective catalytic reduction over manganese-iron oxides [J].Chinese Journal of Catalysis, 2014, 35: 294-301.
[19] Boningari T, Panagiotis G S. Nickel-doped Mn/TiO2as an efficient catalyst for the low-temperature SCR of NO with NH3: catalytic evaluation and characterizations [J].Journal of Catalysis, 2012, 288: 74-83.
[20] Zhi C S, Duan W, Xiao D W, Jia L, Guo L. Structure, acidity and activity of CuOx/WOx-ZrO2catalyst for selective catalytic reduction of NO by NH3[J].Journal of Catalysis, 2010, 271: 43-51.
[21] Qian L, Hua C G, Ping L, Yu H Z, Ying L, Zhong N Q, Ying X, Zhao L Z.In situIR studies of selective catalytic reduction of NO with NH3on Ce-Ti amorphous oxides [J].Chinese Journal of Catalysis, 2014, 35: 1289-1298.
[22] Tsyganenko A A, Pozdnyakov D V, Filimonv V N.Infrared study of surface species arising from ammonia adsorption on oxides surfaces [J].J. Mol. Struct., 1975, 29: 299.
[23] Guido B. Spectroscopic characterization of the acid properties of metal oxide catalysts [J].Catal. Today,1998, 41: 191-206.
[24] Dalian Institute of Inorganic Chemistry Teaching and Research Section. Inorganic Chemistry(无机化学)[M]. 2nd ed. Beijing: Higher Education Press, 2005: 255-257.
[25] Calatayud M, Minot C. Reactivity of the oxygen sites in the V2O5/TiO2anatase catalyst [J].J. Phys. Chem. B,2004, 108(40): 15679-15685.
[26] Mark A, Nan-Yu T, Dumesic J A. Density functional theory studies of mechanistic aspects of the SCR reaction on vanadium oxide catalysts [J].J. Catal., 2003, 213: 115.
[27] Steffen B K, Andreas J K K, Anders R, Søren B R.High performance vanadia-anatasenanoparticle catalysts for the selective catalytic reduction of NO by ammonia [J].Journal of Catalysis, 2011, 284: 60-67.
[28] Long R Q, Yang R T. FTIR and kinetic studies of the mechanism of Fe3+-exchanged TiO2-pillared clay catalyst for selective catalytic reduction of NO with ammonia [J].J. Catal.,2000, 190: 22-31.
Preparation of WO3/TiO2-ZrO2catalyst for selective catalytic reduction and mechanism of NH3activation
WANG Longfei1, ZHANG Yaping1, GUO Wanqiu1, SHEN Kai1, ZHENG Pengfei2, YANG Linjun1
(1Key Laboratory of Energy Thermal Conversion and Control of Ministry of Education,School of Energy and Environment,Southeast University,Nanjing210096,Jiangsu, China;2School of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou450000,Henan,China)
(x)WO3/TiO2-ZrO2catalysts with different WO3content were prepared by the impregnation method and the catalytic performance for the selective catalytic reduction of NOxwith NH3(NH3-SCR) was investigated in a fixed-bed stainless steel reactor. The catalysts were characterized by BET, XRD, NH3-TPD andin situDRIFTS analysis of NH3adsorption, and revealed the change of the structural property and acidic capacity. The characterization results showed that WO3was in a well-dispersed state and WO3addition enhanced the thermal stability of catalysts obviously. The adsorption and activation of NH3were caused by TiO2-ZrO2and WO3, respectively. It was found that W displayed a huge electronegativity and prompted the transfer of the N—H bond of NH3from covalent bond to ionic bond, which could incur the NH3activation. The results of catalytic activity indicated that the catalyst with 9%(mass) WO3content exhibited 94% NO conversion within the wide temperature range of 320℃ to 420℃. (9%)WO3/TiO2-ZrO2possessed comparatively higher intensity of Lewis acidity andlarger amount of Brønsted acidity as well as more stable pore structure (4.4—1.7 nm). Besides, the absorption peak of the active intermediate species NH2was more obvious. All these characters probably accounted for its better catalytic performance.
catalyst; support;in situDRIFTS analysis of NH3adsorption; tungsten; activation
Prof. ZHANG Yaping, amflora@seu.edu.cn
10.11949/j.issn.0438-1157.20150277
O 643.36
:A
:0438—1157(2015)10—3903—08
2015-03-09收到初稿,2015-05-19收到修改稿。
联系人:张亚平。
:王龙飞(1988—),男,硕士研究生。
江苏省自然科学基金项目(BK2012347);国家自然科学基金项目(51306034);国家重点基础研究发展计划项目 (2013CB228505)。
Received date: 2015-03-09.
Foundation item: supported by the Natural Science Foundation of Jiangsu Province (BK2012347), the National Natural Science Foundation of China(51306034) and the National Basic Research Program of China (2013CB228505).

