LC-MS/MS测定单抗药动学参数的样品前处理方法研究进展
王晴,孙吉叶,沙春洁,刘万卉*
(1.烟台大学,山东 烟台 264003;2.山东绿叶制药有限公司,山东 烟台 264003)
LC-MS/MS测定单抗药动学参数的样品前处理方法研究进展
王晴1,孙吉叶2,沙春洁2,刘万卉1*
(1.烟台大学,山东 烟台 264003;2.山东绿叶制药有限公司,山东 烟台 264003)
随着生物技术药物研发的大力开展,单抗类药物的药动学评价越来越受到重视。对近年来应用LC-MS/MS检测单抗类药物药动学特征的文献进行归纳,总结其样品前处理的不同方法及各自优缺点和适用范围,为单抗类药物LC-MS/MS检测方法的进一步研究提供参考。
LC-MS/MS;抗体药物;药动学参数;样品前处理方法
自1986年首个治疗性的单克隆抗体被美国FDA批准以来,抗体药物以其亲和性高、活性高、副作用小、目标性强、药物-药物相互作用小等特点迅速席卷药品市场。尤其在炎症或免疫疾病、癌症、骨质疏松症、阿尔茨海默病、心血管疾病和传染病等疾病的治疗方面[1],抗体药物不断创新。随之,抗体药物的临床前药动学研究日益受到研究者的重视,在分析技术方面也迫切需要开发更为准确、灵敏、特异性强的方法。
目前用于抗体药物临床前药动学(PK)特征检测的方法,主要有ELISA法和LC-MS/MS方法。ELISA法应用普遍,直接、快速,可用于高通量检测,但其具有一些局限性,如检测范围较窄(2个数量级)[2]、寻找特异的抗原或抗体较复杂、只能测定游离的抗原或抗体含量[1]。LC-MS/MS作为一种新方法,弥补了ELISA法的众多缺点,其有较宽的分析范围(2~5个数量级)、较好的精密度(CV%≤15%)、分析灵敏度高[定量下限(LLOQ)可达1 μg·L-1]、可进行多参数检测,与稳定同位素标记的内标和适当的抗体富集处理过程相结合,该方法目前已应用于多肽类[3]、生物标记物[4]、抗药抗体(ADA)[5-6]、抗体药物联合体(ADC)[7]和抗体药物(利妥昔单抗[8]、Prolia[9]等)的PK特征研究。
LC-MS/MS方法测定单抗PK参数的难点在于样品前处理,因为单抗是相对分子质量约为150 000的蛋白质,且内源性血浆干扰蛋白含量高达60~80 g·L-1[10],故一般的用于化药样品的前处理方法不适用于单抗药物。本文综述了近年来LC-MS/MS方法测定单抗药物PK参数的样品前处理方法,为血清单抗测定的样品前处理方法的选择提供参考信息,为确定药动学实验中合理给药剂量、毒理实验中给药范围、药物生理作用及代谢过程提供依据。
1 直接酶解法
直接酶解法即采用一定浓度的胰蛋白酶直接酶解含待测蛋白药物的血清[3,11-15]。其中胰蛋白酶与待测蛋白的比例在1∶20到1∶100之间,常温酶解需8~16 h[10]。该方法可分为2种处理方法:溶液中酶解和蛋白球酶解。
溶液中酶解:将蛋白药物变性处理,在一定浓度的蛋白药物溶液中加入还原剂二硫代苏糖醇(DTT)溶液孵育,打开折叠蛋白中的二硫键,然后加入烷基化试剂碘乙酰胺(IAA)使还原后的巯基烷基化,形成稳定的硫化物,从而阻止二硫键的还原,使蛋白药物彻底变性。按比例加入适量胰蛋白酶或胞内蛋白酶溶液,使变性的蛋白药物充分酶解,产生长度大小不等的多肽片段。
蛋白球酶解:向含有待测蛋白药物的血清[11-14]或组织研磨液[15]中加入甲醇、乙腈或甲酸等蛋白沉淀剂。血清中变性的蛋白经离心形成蛋白球,取出蛋白球,使其在碳酸氢铵缓冲溶液中重新悬浮,加入一定浓度的胰蛋白酶,孵育酶解;或在重悬浮的碳酸氢铵缓冲溶液中加入DTT孵育后,再加入IAA进一步变性处理,最后加入胰蛋白酶进行酶解,使酶解更加完全[11],得到多肽片段。通过LC-MS/MS选取合适的多肽片段并进行定量,从而反映生物样品中蛋白药物浓度[15]。该方法简便、易于操作,但其干扰较大,该方法目前报道的最低LLOQ为0.1 mg·L-1[13],一般LLOQ为2~5 mg·L-1。其中蛋白球酶解较溶液中酶解更有优势,可直接除去血清中可溶性蛋白、盐类和大量磷脂[16]。
文献[12]比较了溶液中酶解和蛋白球酶解这2种方法的差异,其中蛋白球酶解的基质效应为79%,而溶液中酶解的基质效应为59%;蛋白球酶解的回收率为88%,而溶液中酶解的回收率仅为6%。此外,蛋白球酶解效率更高,酶解时间更短。可见,蛋白球酶解优于溶液中酶解。蛋白球酶解法越来越多地应用于蛋白类药物,尤其是单抗药物的PK研究。
2 酶解结合固相萃取法
酶解结合固相萃取(SPE)法即在直接酶解(溶液中酶解或蛋白球酶解)的基础上结合了SPE[1]。常用的SPE小柱为Oasis MCX 96-well plate[16-17],酶解后的混合溶液上样至RP-SPE小柱中,可除去溶液中盐类和高水溶性杂质,Oasis MCX 96-well plate主要用于除去胰蛋白酶酶解形成的杂质多肽片段。
酶解结合SPE法可除去样品中绝大多数干扰杂质,纯化生物样品,使杂质信号降低,LLOQ达到更低水平。应用2D-SPE进一步净化酶解混合液后,可提高生物样品中单抗检测灵敏度至500 μg·L-1(或3 mmol·L-1)[16]。然而,经过1D-或2D-SPE纯化后,生物样品中干扰蛋白浓度仍然很高,存在基质效应和灵敏度低等问题,需进一步研究以改善方法[16]。
3 白蛋白消耗法
白蛋白占全血中蛋白含量50%以上,约为45 g·L-1[20],应用白蛋白消耗试剂盒除去血清中大量的白蛋白或除去血清中其他杂质蛋白质,以富集含量较低的待测蛋白或单抗。市售白蛋白消耗试剂盒有消耗白蛋白、消耗IgG等种类。一般经白蛋白消耗试剂盒处理与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)可将混合蛋白溶液很好地分离[4,21],得到目标条带。将目标条带取下,切碎加入胰蛋白酶孵育,使目标蛋白酶解成多肽片段,进行洗脱收集。该方法常用于蛋白质组学和生物标记物的定量检测[20],一般蛋白试剂盒可除去血清样品中50%的杂质蛋白[10]。
白蛋白消耗试剂盒可检测生物样品中异常的生物标志物[20],依此判断生理、病理进程。白蛋白消耗试剂盒富集抗体药物时,线性范围为2~1 000 mg·L-1[21]。当目标蛋白有多种干扰蛋白时,如要除去生物样品中多种干扰,需要针对特定蛋白应用特定蛋白消耗试剂盒,因此需将蛋白试剂盒串联使用。
4 蛋白A、G富集法
蛋白A、G是分别来自于金黄色葡萄球菌和链球菌G族的蛋白,可以与IgG的Fc区域特异性结合,同时蛋白A、G可以偶联到磁珠上形成蛋白A、G磁珠复合体,或作为亲和配基偶联到琼脂糖基质上,从而特异性地与样品中的抗体分子结合,具有极高的选择性,亲和色谱所得蛋白的纯度一步可达到95%以上。以结合了蛋白A、G的磁珠或琼脂糖凝胶为载体,可富集血清中IgG,从而具备富集血清中抗体的能力。
利用蛋白A-凝胶富集血清中待测单抗,富集后溶
液以胞内蛋白酶酶解,从而得到特征性片段,然后采用LC-MS/MS法检测,其结果与ELISA法所得结果相吻合,在1~300 mg·L-1范围内,线性关系良好[22]。大部分文献报道应用蛋白G-磁珠进行单抗或ADA的富集[5-6],操作简便,重复性好。运用蛋白G-磁珠富集法处理样品,检测给药后猴血清中总单抗含量的线性范围为0.781~50.5 mg·L-1;利用免疫富集法处理样品,检测猴血清中游离单抗含量的线性范围为7.03~450 μg·L-1,由此可见,血清中总单抗和游离单抗含量相差很大[23]。蛋白A、G富集法优于直接酶解法,可间接地将血清中待测单抗富集,用于单抗总含量的测定,但不能用于测定游离抗体含量[1]。
5 免疫法
特异型抗体、抗原或受体的特异性位点可与待测抗体Fab段发生特性结合,故可将其用于生物样品中待测单抗的富集。一般实验步骤为:特异性捕获剂结合到生物素化的磁珠上,加入生物样品后,待测抗体Fab段即与捕获剂相结合,形成磁珠-捕获剂-待测抗体三联复合物。应用磁铁与磁珠相吸的原理,除去杂质,最后加入弱酸性溶液将抗体洗脱,再以胰蛋白酶酶解,得到目标多肽,进行液质检测[7-8,24-27]。
该方法因特异性捕获蛋白不易制备[20],且只能用于测定生物样品中游离待测单抗[1],故其应用受到限制。但采用该方法处理样品,检测的灵敏度较高(LLOQ可达1 μg·L-1)。例如,文献[25]报道利用免疫富集法捕获生物样品中利妥昔单抗,LLOQ可达到3.13 μg·L-1。在测定猴血清中单抗时,该方法灵敏度(LLOQ为7.03 μg·L-1)是蛋白G富集方法(LLOQ为0.78 mg·L-1)的100倍[23];在测定类胰岛素一号增长因子(IGF-1)时,该方法与直接酶解法相比灵敏度提高了250倍[1]。该方法检测结果与ELISA法相近[7-8]。
6 抗人IgG Fc富集法
抗人IgG Fc抗体一般来自羊、鼠、猴等动物,该单抗的Fab段可特异性地结合人IgG的Fc段。抗人IgG Fc抗体作为捕获剂,可特异性地捕获动物血清中含有人IgG Fc片段的抗体(人源化或嵌合型单抗)。将该捕获剂与磁珠结合,除去杂质,将待测单抗酶解,即可采用LC-MS/MS进行定量分析[9,28-30]。
该方法为近几年发展起来的LC-MS/MS测定单抗临床前PK特征的常用样品前处理方法,所用试剂易于获得、价格便宜、易于操作、具有一定的通用性,因此该方法应用越来越广泛[9,28-30]。研究人员分别以蛋白球酶解法、蛋白A/G富集法、抗人IgG Fc富集法进行样品前处理,然后采用LC-MS/MS检测猴血清中PCSK9单抗含量,结果显示,应用抗人IgG Fc抗体富集法进行样品前处理,检测灵敏度最高(LLOQ为100 μg·L-1)。使用LC-MS/MS测得的给药后猴血清中PCSK9单抗的含量略高于ELISA方法所得结果,经抗人IgG Fc富集法前处理结合LC-MS/MS检测可捕获临床前生物样品中总的待测抗体。ELISA方法灵敏度较高,最低LLOQ为1.25 μg·L-1,但LC-MS/MS方法可以同时测定待测单抗和内标含量,使用内标对单抗进行定量,结果更加准确,可信度更高[29]。
7 结语
在单抗药物的PK研究中,ELISA法是常规的检测途径,但对于机体产生抗药抗体时ELISA方法具有一定的局限性。而在选择适宜方法对血清样品进行前处理后,结合LC-MS/MS可检测出生物样品中待测单抗的确切含量——这是避免单抗药物产生毒性并确定合理给药剂量的前提。
以上LC-MS/MS方法检测单抗PK特征的样品前处理方法各有其优缺点。直接酶解法虽然前处理步骤简单,重复性好,但其灵敏度较低;酶解结合SPE,操作步骤相对简单同时提高了灵敏度,但用于监测长期给药的灵敏度仍不够;白蛋白消耗试剂盒方法,步骤简便易于操作,但需结合SDS-PAGE等分离纯化方法以提高灵敏度,该方法不易实现高通量,通常应用于生物标记物的检测,较少应用于单抗的样品前处理;采用蛋白A、G富集法进行样品前处理,检测的灵敏度与酶解结合SPE法相当,但操作相对复杂;免疫富集法灵敏度最高,但其操作步骤繁琐且试剂昂贵不易获得;抗人IgG Fc抗体法是新兴的一种富集方法,其灵敏度较高,试剂易于获取,操作相对简便,但灵敏度较免疫富集法略低。表1对各种样品前处理方法的灵敏度、
回收率和效率进行了比较。在抗体药物研发初期,对灵敏度要求不高时,可建立直接酶解法、酶解结合SPE法或蛋白A、G富集法对单抗血清样品进行样品前处理,以进行临床前PK特征的监测;在单抗药物开发后期,要求较高的灵敏度,则需要应用免疫富集法或抗人IgG Fc抗体法结合LC-MS/MS监测单抗药物的PK特征。
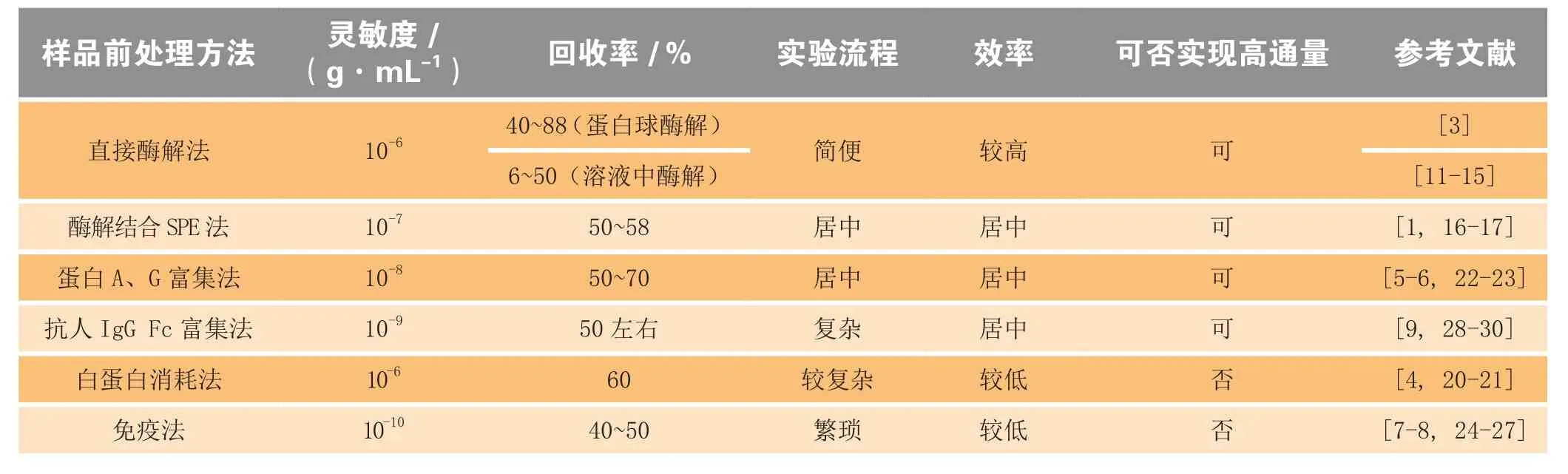
表1 LC-MS/MS检测单抗药动学特征的样品前处理方法比较Table1 Comparison of several sample pretreatment methods for detecting monoclonal antibodies’ PK characteristics by LC-MS/MS
综上所述,应用LC-MS/MS方法评价单抗药物PK特征时,样品前处理是关键。选取恰当的样品前处理方法可直接影响灵敏度、准确度与精密度等参数。在筛选过程中要依据实际实验中待测单抗浓度范围,多方法对比或联合使用,选取适当的样品前处理方法,从而得到药物在体内准确可靠的PK特性,为药物给药方案的设计以及PK评价提供依据。
[1]Ezan E, Becher F.Critical comparison of MS and immunoassays for the bioanalysis of therapeutic antibodies [J].Bioanalysis, 2009, 1 (8): 1375-1388.
[2]Bronsema K J, Bischoff R, Merbel N C.High-sensitivity LC-MS/MS quantifcation of peptides and proteins in complex biological samples: the impact of enzymatic digestion and internal standard selection on method performance [J].Anal Chem, 2013, 85 (20): 9528-9535.
[3]Barnidge D R, Dratz E A, Martin T,et al.Absolute quantifcation of the G protein-coupled receptor rhodopsin by LC/MS/MS using proteolysis product peptides and synthetic peptide standards [J].Anal Chem, 2003, 75 (3): 445-451.
[4]Holewinski R J, Jin Z, Powell M J,et al.A fast and reproducible method for albumin isolation and depletion from serum and cerebrospinal fuid [J].Proteomics, 2013, 13 (5): 743-750.
[5]Heinig K, Wirz T, Schick E,et al.Bioanalysis of therapeutic peptides: differentiating between total and anti-drug antibody bound drug using liquid chromatography-tandem mass spectrometry quantitation [J].J Chromatogr A, 2013, 1316: 69-77.
[6]Wang S J, Wu S T, Gokemeijer J,et al.Attribution of the discrepancy between ELISA and LC-MS/MS assay results of a PEGylated scaffold protein in post-dose monkey plasma samples due to the presence of antidrug antibodies [J].Anal Bioanal Chem, 2012, 402 (3): 1229-1239.
[7]Hengel S M, Sanderson R, Valliere-Douglass J,et al.Measurement ofin vivodrug load distribution of cysteine-linked antibody-drug conjugates using microscale liquid chromatography mass spectrometry [J].Anal Chem, 2014, 86 (7): 3420-3425.
[8]Dubois M, Fenaille F, Clement G,et al.Immunopurifcation and mass spectrometric quantifcation of the active form of a chimeric therapeutic antibody in human serum [J].Anal Chem, 2008, 80 (5): 1737-1745.
[9]Onami I, Ayabe M, Murao N,et al.A versatile method for proteinbased antigen bioanalysis in non-clinical pharmacokinetics studies of a human monoclonal antibody drug by an immunoaffinity liquid chromatography-tandem mass spectrometry [J].J Chromatogra A, 2014 (1334): 64-71.
[10]Li F, Fast D, Michael S.Absolute quantitation of protein therapeutics in biological matrices by enzymatic digestion and LC-MS [J].Bioanalysis,
2011, 3 (21): 2459-2480.
[11]Jiang H, Zeng J, Titsch C,et al.Fully validated LC-MS/MS assay for the simultaneous quantitation of coadministered therapeutic antibodies in cynomolgus monkey serum [J].Anal Chem, 2013 (85): 9859-9867.
[12]Ouyang Z, Furlong M T, Wu S,et al.Pellet digestion: a simple and effcient sample preparation technique for LC-MS/MS quantifcation of large therapeutic proteins in plasma [J].Bioanalysis, 2012, 4 (1): 17-28.
[13]Furlong M T, Ouyang Z, Wu S,et al.A universal surrogate peptide to enable LC-MS/MS bioanalysis of a diversity of human monoclonal antibody and human Fc-fusion protein drug candidates in pre-clinical animal studies [J].Biomed Chromatogr, 2012, 26 (8): 1024-1032.
[14]Nouri-Nigjeh E, Zhang M, Ji T,et al.Effects of calibration approaches on the accuracy for LC-MS targeted quantifcation of therapeutic protein [J].Anal Chem, 2014, 86 (7): 3575-3584.
[15]Duan X, Abuqayyas L, Dai L,et al.High-throughput method development for sensitive, accurate, and reproducible quantification of therapeutic monoclonal antibodies in tissues using orthogonal array optimization and nano liquid chromatography/selected reaction monitoring mass spectrometry [J].Anal Chem, 2012, 84 (10): 4373-4382.
[16]Yuan L, Aubry A F, Arnold M E,et al.Systematic investigation of orthogonal SPE sample preparation for the LC-MS/MS bioanalysis of a monoclonal antibody after pellet digestion [J].Bioanalysis, 2013, 5 (19): 2379-2391.
[17]Heudi O, Barteau S, Zimmer D,et al.Towards absolute quantifcation of therapeutic monoclonal antibody in serum by LC-MS/MS using isotopelabeled antibody standard and protein cleavage isotope dilution mass spectrometry [J].Anal Chem, 2008, 80 (11): 4200-4207.
[18]Bronsema K J, Bischoff R, Bouche M P,et al.High-sensitivity quantitation of a Nanobody®in plasma by single-cartridge multidimensional SPE and ultra-performance LC-MS/MS [J].Bioanalysis, 2015, 7 (1): 53-64.
[19]Yang Z, Ke J, Hayes M,et al.A sensitive and high-throughput LCMS/MS method for the quantifcation of pegylated-interferon-alpha2a in human serum using monolithic C18 solid phase extraction for enrichment [J].J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877 (18/19): 1737-1742.
[20]Baba M, Ohyama K, Kishikawa N,et al.Optimization of separation and digestion conditions in immune complexome analysis [J].Anal Biochem, 2013, 443 (2): 181-186.
[21]Hagman C, Ricke D, Ewert S,et al.Absolute quantification of monoclonal antibodies in biofluids by liquid chromatography-tandem mass spectrometry [J].Anal Chem, 2008, 80 (4): 1290-1296.
[22]Liu H, Manuilov A V, Chumsae C,et al.Quantitation of a recombinant monoclonal antibody in monkey serum by liquid chromatography-mass spectrometry [J].Anal Biochem, 2011, 414 (1): 147-153.
[23]Fernández Ocaña M, James I T, Kabir M,et al.Clinical pharmacokinetic assessment of an anti-MAdCAM monoclonal antibody therapeutic by LC-MS/MS [J].Anal Chem, 2012, 84 (14): 5959-5967.
[24]Jiang H, Xu W, Titsch C A,et al.Innovative use of LC-MS/MS for simultaneous quantitation of neutralizing antibody, residual drug, and human immunoglobulin G in immunogenicity assay development [J].Anal Chem, 2014, 86 (5): 2673-2680.
[25]Onami I, Ayabe M, Murao N,et al.A versatile method for protein-based antigen bioanalysis in non-clinical pharmacokinetics studies of a human monoclonal antibody drug by an immunoaffnity liquid chromatographytandem mass spectrometry [J].J Chromatogr A, 2014, 21 (1334): 64-71.
[26]Xu W, Jiang H, Titsch C,et al.Development and characterization of a pre-treatment procedure to eliminate human monoclonal antibody therapeutic drug and matrix interference in cell-based functional neutralizing antibody assays [J].J Immunol Methods, 2015, 416: 94-104.
[27]McAvoy T, Lassman M E, Spellman D S,et al.Quantification of tau in cerebrospinal fuid by immunoaffnity enrichment and tandem mass spectrometry [J].Clin Chem, 2014, 60 (4): 683-689.
[28]Li H, Ortiz R, Tran L,et al.General LC-MS/MS method approach to quantify therapeutic monoclonal antibodies using a common whole antibody internal standard with application to preclinical studies [J].Anal Chem, 2012, 84 (3): 1267-1273.
[29]Zhang Q, Spellman D S, Song Y,et al.Generic automated method for liquid chromatography-multiple reaction monitoring mass spectrometry based monoclonal antibody quantitation for preclinical pharmacokinetic studies [J].Anal Chem, 2014, 86 (17): 8776-8784.
[30]Law W S, Genin J C, Miess C,et al.Use of generic LC-MS/MS assays to characterize atypical PK profile of a biotherapeutic monoclonal antibody [J].Bioanalysis, 2014, 6 (23): 3225-3235.
Recent Progress in Sample Pretreatment Methods for Detecting Monoclonal Antibodies’ Pharmacokinetics Parameters by LC-MS/MS
WANG Qing1, SUN Jiye2, SHA Chunjie2, LIU Wanhui1
(1.Yan Tai University, Yantai 264003, China; 2, Shandong Luye Pharmaceutical Co., Ltd., Yantai 264003, China)
With the vigorous research and development of biopharmaceuticals, increased importance has been attached to the pharmacokinetic evaluation of therapeutic monoclonal antibodies (mAbs).Based on literature retrieval of recent articles on PK profle determination of therapeutic mAbs by LC-MS/MS, different methods for sample pretreatment, the advantages and disadvantages of each method as well as their respective application ranges were summarized in this paper, so as to provide
for further studies on determination of mAbs by LC-MS/MS.
LC-MS/MS; therapeutic antibody; PK parameter; method for sample pretreatment.
R917
A
1001-5094(2015)04-0300-05
接受日期:2015-02-03
*通讯作者:刘万卉,绿叶制药集团有限公司制剂与分析研究中心副总裁,科技部“长效缓控释及靶向技术国家重点实验室”副主任,烟台大学药学院副院长;
研究方向:药物代谢动力学,长效缓释微球制剂的研究开发;
Tel:0535-8308288;E-mail:wanhui@luye.cn

