渗透学科思想的教学
尚修正

摘 要:在进行化学教学的过程中,如果忽视学科思想的渗透,很有可能造成“只见树木不见森林”,学生缺乏有效建构知识过程中运用到的学科方法、学科思想,这将影响到学生学习成绩和学生的发展。如果在进行元素化合物知识教学过程中,能有效渗透学科思想,学生就能有效建构知识点的关系网,理解元素化合物转化主线。目前的高考题也越来越重视学科思想方法的考查。因此在教学中渗透学科思想,也应该引起教师的重视。
关键词:学科思想;铝的重要化合物;元素化合物教学
中图分类号:G632 文献标识码:B 文章编号:1002-7661(2014)24-212-03
通常来讲,一个学科由学科知识、学科能力和学科思想三部分组成,其中学科思想是学科的灵魂和核心。在进行化学教学的过程中,如果忽视学科思想的渗透,很有可能造成“只见树木不见森林”,学生缺乏有效建构知识过程中运用到的学科方法、学科思想,这将影响到学生学习成绩和学生的发展。
对于元素化合物知识,学生普遍觉得知识点多而杂,解题方法技巧性较强。如果在进行元素化合物知识教学过程中,能有效渗透学科思想,学生就能有效建构知识点的关系网,理解元素化合物转化主线。在元素化合物知识教学中,常见的学科思想方法有:1.“结构决定性质、性质决定用途”;2.通过对物质进行分类,运用比较和联想思想;3.数形结合;4强弱规律;5微粒观;6.科学探究,包括实验探究;7.运用化学史,体现化学史的知识和教育价值等。本文以人教版必修1第三章第二节——铝的重要化合物为例,具体阐释怎么样渗透化学学科思想。
一、引入新课
[讲述]著名物理化学家和化学教育家傅鹰说“化学给人以知识,化学史给人以智慧”,我们追寻古人和科学前辈的足迹,去了解铝的历史、铝发展,来获得有关铝的认识。
[ppt呈现] 科学史话 铝的价值几何:1746年,拉瓦锡(法国)证实不能用C还原Al2O3;1852年,奥尔斯泰(丹麦)用钾汞齐还原无水氯化铝,然后再真空条件下蒸馏出去汞,人类第一次得到几毫克的铝粉;1854年,戴维尔(法国)用金属Na还原NaAlCl4,得到纯度为97%的铝;1855年,巴黎国际博览会上,展出了一小块铝,标签上写到:“来自粘土的白银”,当时铝比黄金还贵,铝成为达官贵人炫耀财富的饰品;1886年,霍尔(美国)和埃鲁(法国)分别独立地发现了用冰晶石Na3AlF6作为助熔剂,通过电解熔融Al2O3制备铝的方法,从此人类找到大规模、廉价的获得金属铝的方法,铝价身价大跌成为“平民金属”;1892年,拜耳(奥地利)发明了用碱液从铝土矿中提取氧化铝的方法,这一方法与霍尔电解法结合奠定了现代工业电解法冶炼铝的基础。
[问题讨论]在1885年,铝价怎能比黄金?是什么使得铝身价大跌呢?用化学方程式解释霍尔电解法生产铝的原理。
[讲述]门捷列夫曾经说过:科学不但给人以知识,还能创造真正的精神和物质财富,更能创造出我们不能获得的东西。正式由于化学工业技术的进步,铝的大规模的使用才有可能。
学科思想:运用化学史,体现化学史的知识和教育价值。著名物理化学家和化学教育家傅鹰说“化学给人以知识,化学史给人以智慧”,通过金属铝的化学史的介绍,了解铝的发展历史、铝的冶炼方法,了解化学技术的进步对人类生产生活的影响。
二、Al2O3、Al(OH)3的性质
1、Al2O3的物理性质
[讲述]既然电解铝的过程中使用了氧化铝,那么氧化铝的物理性质、化学性质如何?
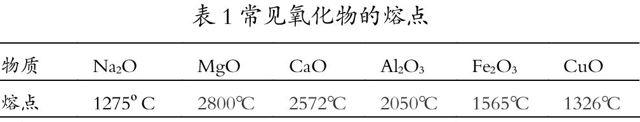
物质 Na2O MgO CaO Al2O3 Fe2O3 CuO
熔点 1275?C 2800℃ 2572℃ 2050℃ 1565℃ 1326℃
[阅读资料]阅读下面的表格1和资料,总结氧化铝的用途,并解释氧化铝具有这些用途的原因是什么?
表1常见氧化物的熔点
资料:天然存在的氧化铝——刚玉的硬度仅次于金刚石,是价廉的磨料、切割工具;熔点高于2000℃的物质可以作特级耐火材料,如制作耐火坩埚、耐火管、高温金属陶瓷;氧化铝在陶瓷工业中常做增白剂;④铝制品通常利用阳极氧化处理其表面从而形成致密氧化膜,保护内层金属
学科思想:性质决定用途,用途反映性质。从氧化铝的用途着手,反推氧化铝的物理性质。避免说教式介绍氧化铝的物理性质。
2、Al2O3的化学性质
[讲述]在第一节学习金属的有关性质时,我们学习到了铝与酸碱溶液的反应。不知同学们是否还记得实验现象,它有何特殊之处呢?
[实验视频]在两支试管中分别加入5 mL盐酸和5 mL氢氧化钠溶液,再分别放入一小段铝片。观察实验现象。
[问题讨论]两支试管中为什么刚开始没有气体产生,后来有气体产生?
[讲述]刚开始时没有气体?金属铝表面有氧化铝,氧化铝与酸、碱反应没有产生气体。一段时间后均有气体产生?氧化铝已经反应完全,金属铝与酸、碱反应产生了气体。说明氧化铝对金属铝的保护也是有限度的,在强酸、强碱条件下,氧化铝也是“泥菩萨过江,自身难保”。
[问题讨论]氧化铝为什么能和酸反应?哪些氧化物能酸反应?
[讲述]从氧化铝所属类别看,Na2O、MgO、CaO、Al2O3属于碱性氧化物:
Na2O+2HCl=2NaCl+H2O,MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O ,
这些反应的实质均为O2-和H+反应(渗透微粒观)。氧化
铝也属于碱性氧化物,和酸反应应该和前几者类似:Al2O3+6HCl=2AlCl3+3H2O。
[问题]氧化铝为什么能和碱反应?能和碱反应的氧化有哪些?
[讲述]说明氧化铝应该和CO2类似?均为酸性氧化物。CO2+2NaOH=Na2CO3+H2O,产物Na2CO3得出可以这么理解:Na2CO3中Na+?碱对应阳离子,CO32-?酸性氧化物对应酸根离子。
[问题]氧化铝对应的酸根离子可能是是什么?在哪里学过含铝的阴离子?
[讲述]氧化铝对应的酸根离子可能是AlO2-,于是得到氧化铝和NaOH溶液反应方程式:Al2O3+2NaOH=2NaAlO2+H2O。
学科思想:微粒观,类比思想。在比较的基础上根据根据两个事物在某些方面的相似或相同的属性,推测在其他方面也可能相同或相似。通过类比可以得出未知物质的性质。类比推理一般有下列模式[1]:若①A事物具有性质a,b,c,d ②B事物具有性质 , , 则③B类事物可能具有性质 。类比推理的核心是求同存异,获取新知。通过类比思想,降低Al2O3的化学性质学习的难度,使得推测出来的结果可靠可信。
3、Al(OH)3的制备
[讲述]了解和掌握物质的性质不是化学工作者最终目的,最终目的之一是制备和创造物质(自然界原来没有的物质)
[问题讨论]在实验室怎么制备一定量的NaOH、Ca(OH)2?如果现在实验室有铝片、稀盐酸、氢氧化钠溶液、氨水、硫酸铝溶液、蒸馏水,怎么样制备Al(OH)3?说出你的设计方案。
[学生方案总结]方案一:Al+H2O→Al(OH)3 方案二:Al2O3+H2O→Al(OH)3 方案三:Al2(SO4)3+NH3 H2O→Al(OH)3 方案四:Al片+稀盐酸+稀氨水→Al(OH)3 方案五:Al片+稀盐酸+ NaOH溶液→Al(OH)3 方案六:Al片+NaOH溶液→Al(OH)3 方案七:Al片+NaOH溶液+稀盐酸→Al(OH)3
[问题讨论]方案一、二、六是否可行?
[讲述]方案一因铝不能在水中溶液也不能跟水反应、方案二因氧化铝不能在水中溶液也不能跟水反应,方案六制备出来的是NaAlO2,这些实验方案都是错误的。其它方案都有可能制备出Al(OH)3。
[问题讨论]其余方案中,试剂(药品)加入有多少种滴加顺序?改变滴加顺序实质上改变什么?
[讲述]改变滴加顺序实质上改变的是物质的相对用量。
[分组实验]分几个小组:第1小组使用方案3制备,观察并记录现象,下同。第2小组使用方案3(和第一组试剂滴加顺序相反),第3小组使用方案4(注意稀盐酸用量),第4小组使用方案4(和第三小组试剂滴加顺序相反,注意稀氨水用量),第5小组使用方案5(注意稀盐酸用量),第6小组使用方案7(注意强氧化钠溶液用量)。
表2小组实验结果
小组 1 2 3 4 5 6
方案 3 3(滴加顺序相反) 4 4(滴加顺序相反) 5 7
现象 有白色沉淀 有白色沉淀 滴加氨水有白色沉淀,继续滴加氨水沉淀未明显溶解 滴加稀盐酸没有沉淀生成 滴加氢氧化钠有白色沉淀,继续滴加氢氧化钠沉淀消失 滴加稀盐酸有白色沉淀,继续滴加稀盐酸沉淀消失
[问题讨论]小组1、2现象为何一致,这说明什么?小组5、6现象类似,为什么刚开始有沉淀,后来沉淀消失?这能说明什么?你能写出这些反应对应的方程式吗?小组3、4仅仅是试剂滴加顺序不同为何现象明显不同?
[讲述]1、2两小组现象说明,Al2(SO4)3+6NH3 H2O=2Al(OH)3↓+3(NH4)2SO4(弱碱制备更弱的碱),Al(OH)3不能被NH3 H2O溶解。第5小组现象说明,2Al+6HCl=2AlCl3+3H2↑,AlCl3+3NaOH=Al(OH)3↓+3NaCl(强碱制备弱碱),生成的Al(OH)3可以被NaOH溶解,第6小组现象说明:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,生成的Al(OH)3可以被HCl溶解。小组4说明铝片不能和氨水反应,滴加稀盐酸时稀盐酸和氨水反应生成氯化铵。小组3反应原理和小组5类似,只是Al(OH)3不能被氨水溶解。
[问题讨论]Al(OH)3可以被HCl溶解,也可以被NaOH溶解?能和碱反应的物质属于哪些类别物质?Al(OH)3能和碱反应,说明Al(OH)3属于哪类物质?
[讲述]H+ + AlO2- + H2O?Al(OH)3?Al3+ + 3OH-,实际上Al(OH)3和铝酸H3AlO3是同一个物质。
NaAlO2+HCl+H2O=NaCl+Al(OH)3↓可以看成盐酸制备出了铝酸H3AlO3。Al(OH)3在强碱性条件下会发生酸式电离Al(OH)3?H+ + AlO2- + H2O,在这种条件下Al(OH)3表现出酸
性——铝酸H3AlO3,因此Al(OH)3+NaOH=NaAlO2+H2O,相当于弱酸和碱反应,制备出了更弱的酸——H2O。
[问题讨论]1.上述方案3、4、5、7能否制备出Al(OH)3?这些方案中哪些较好?2.课本上是怎么样制备Al(OH)3的?为什么不用强碱如NaOH来制备?
学科思想:强弱规律,科学探究。利用“强电解质可以制备弱电解质,弱电解质可以制备出更弱的电解质”,这一原理来深刻理解有关氢氧化铝的反应。其次,用科学探究的方法来讨论制备Al(OH)3的方法。科学探究并不等同于动手操作、进行实验活动,凡是有利于学生建构知识体系、形成科学观念、领悟科学研究方法的各种活动都属于科学探究范畴。 逻辑推理探究在教材中主要有两种类型:一种是在学生原有认知基础上 通过猜想与假设,运用已掌握的化学规律 从理论上推导出新的化学规律。它注重理论推导。另一种是利用化学实验,在实验基础上,通过对实验结论的分析、综合、比较、归纳和演绎等逻辑推理得出化学规律,它注重逻辑推理[2]。
在做实验之前对方案的评判、指导,如“[问题讨论]方案一、二、六是否可行?”、“[问题讨论]其余方案中,试剂(药品)加入有多少种滴加顺序?改变滴加顺序实质上改变什么?”都属于落体推理探究,这也是科学探究重要形式;其后分小组实验则是实验探究,这是通常教师比较熟悉的科学探究方式。
4、铝的化合物转化关系总结
[问题讨论]通过氧化铝和氢氧化铝的性质的学习,现在你能否总结铝的化合物(氧化铝和氢氧化铝)的重要性质,及其之间转化关系?试着以概念图的方式,画出物质间转化关系:
图1概念图示例图
[小结]氧化铝的性质,氢氧化铝的制备方法
三、启示
元素化合物知识的教学,物质化学性质、制备、用途是核心。如果单纯就知识论知识,必然造成知识点乱、杂、多,若能在教学过程中有效渗透学科思想,必然会对学生长远发展有利。目前的高考题也越来越重视学科思想方法的考查[3],这是和素质教育的本质要求是吻合的。在教学中渗透学科思想,也应该引起教师的重视。
参考文献:
[1] 林肃浩.《更高妙的高考化学思想方法》[M].杭州:浙江大学出版社,2012.
[2] 周存军.化学思想和方法培养的探究性教学[J].现代教育科学·普教研究,2010,(6).
[3] 孙建明.王后雄.基于学科思想方法整合的高考化学命题研究[J].课程·教材·教法,2014,34(3)

