肌动蛋白对结肠平滑肌大电导钙激活钾通道机械敏感性的影响
黄海霞,侯东燕,辛 方,任 杰,刘 萍,王 伟
(首都医科大学基础医学院生理学与病理生理学系,北京 100069)
·论 著·
肌动蛋白对结肠平滑肌大电导钙激活钾通道机械敏感性的影响
黄海霞,侯东燕,辛 方,任 杰,刘 萍,王 伟*
(首都医科大学基础医学院生理学与病理生理学系,北京 100069)
目的探讨大电导钙激活钾通道(large conductance calcium-activated potassium channels,BK)机械敏感性与肌动蛋白的关系。方法采用反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)技术检测BK各亚基信使核糖核酸(messenger ribonucleic acid,mRNA)水平;应用膜片钳技术记录小鼠结肠平滑肌细胞 BK的单通道活动,确定其机械敏感性;应用细胞松弛素B(cytochalasin B,Cyto B)破坏肌动蛋白,探讨肌动蛋白对BK机械敏感性的影响。结果小鼠结肠平滑肌细胞BK由α和β1亚基构成;BK的开放概率随施加在膜片上的负压刺激的增加而强度依赖性增加;破坏细胞骨架不影响通道的机械敏感性。结论小鼠结肠平滑肌细胞BK对机械刺激敏感,且具有强度依赖性;BK机械敏感性不依赖于肌动蛋白的完整性,内衬于细胞膜下的皮质肌动蛋白可能分担膜张力,从而保护BK免受过度的牵张刺激。
大电导钙激活钾通道;肌动蛋白类;肌细胞,平滑肌
大电导钙激活钾通道(large conductance calcium-activated potassium channels,BK)是消化道平滑肌细胞上主要的钾通道成员,具有机械敏感性[1-2],可能参与了平滑肌细胞对机械力的感受。关于机械外力是如何激活离子通道的,目前仍无定论。Naruse等[3]的研究认为鸡胚心肌BK的机械敏感性取决于位于α亚基C端的应激轴调节外显子(stress-axis regulated exon,STREX)片段,其中的A674氨基酸残基是力学信息偶联的必要结构。而S6跨膜片段和钾电导调控元件(regulatory domains of potassium conductance,RCK)之间的连接片段(linker)的长短则决定着传递到通道的外力的大小[4]。然而,近年研究发现小鼠结肠平滑肌BK 的α亚基不包含STREX外显子(称为ZERO型剪切体)[2,5],但是通道仍具有机械敏感性[2]。关于外力如何引起离子通道开放概率的增加,学者们还曾提出2个模型:膜模型(bilayer model)和链索模型(tethered model)[6]。前者设想应力通过膜脂质分子直接作用到通道,引起通道开放;而后者假设外力通过膜内偶联成分(如细胞骨架)作用于通道分子。研究发现破坏细胞骨架可以增加骨细胞的机械敏感性[7],而细胞骨架在机械刺激激活经典型瞬时感受器电位通道(classical transient receptor potential channels,TRPC)家族成员TRPC5通道中是必须的,破坏细胞骨架后该通道不能被机械刺激激活[8]。研究发现细胞骨架不是心肌ATP敏感钾通道(ATP sensitive potassium channels,KATP)感受机械刺激的必要成分,只是作为并联成分调节加载在通道上的膜张力[9]。本实验旨在研究细胞骨架的主要成分——肌动蛋白对小鼠结肠平滑肌细胞BK通道感受机械刺激的影响,以期揭示BK的机械敏感性机制。现报告如下。
1 材料与方法
1.1 小鼠结肠平滑肌细胞的急性分离 健康成年Balb/c小鼠,体质量(25±5) g,雌雄不拘,由首都医科大学实验动物部提供[许可证号为:SCXK-(军)2007-004]。禁食12 h,断颈处死,取结肠组织,置于冰无钙Hanks液:NaCl 125 mmol/L,KCl 5.36 mmol/L,NaHCO315.5 mmol/L,Na2HPO40.336 mmol/L,KH2PO40.44 mmol/L,葡萄糖10 mmol/L,蔗糖 2.9 mmol/L,羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid,HEPES) 11 mmol/L, pH为7.2。去除黏膜层,保留平滑肌层,剪碎,置于酶液中37 ℃水浴消化12 min。酶液成分为:4 g/L牛血清白蛋白,14 U/mL木瓜蛋白酶,230 kU/L Ⅱ型胶原酶和 1 mmol/L 胰蛋白酶抑制剂。Ⅱ型胶原酶购自美国 Worthington 公司,其他试剂均购自Sigma-Aldrich公司。去除酶液,加入无钙 Hanks液,轻轻吹打,将细胞悬液滴加在圆玻片上,静置10 min,待贴壁后加入无钙 Hanks液储存备用。
1.2 反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测 用 Trizol-氯仿-异丙醇法从新鲜分离的结肠平滑肌组织或急性分离的结肠平滑肌细胞中提取总RNA,反转录合成 cDNA 第1链,反应条件:55 ℃,50 min,85 ℃,5 min,然后进行 聚合酶链式反应(polymerase chain reaction, PCR)扩增。Trizol和RT-PCR两步法试剂盒为美国Invitrogen公司产品。PCR引物用 Oligo 6.0和Primier 5.0软件联合设计,由上海生工生物技术有限责任公司合成。PCR 反应条件:94 ℃预变性2 min;94 ℃变性30 s,58~60 ℃退火1 min,72 ℃延伸30 s,循环35次;反应结束后72 ℃延伸 10 min。内参为磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)。PCR产物经2%琼脂糖凝胶电泳,溴化乙铵染色,电泳结果用凝胶成像系统和Quantity-One软件采集分析。BK各亚基和GAPDH的引物,见表1。
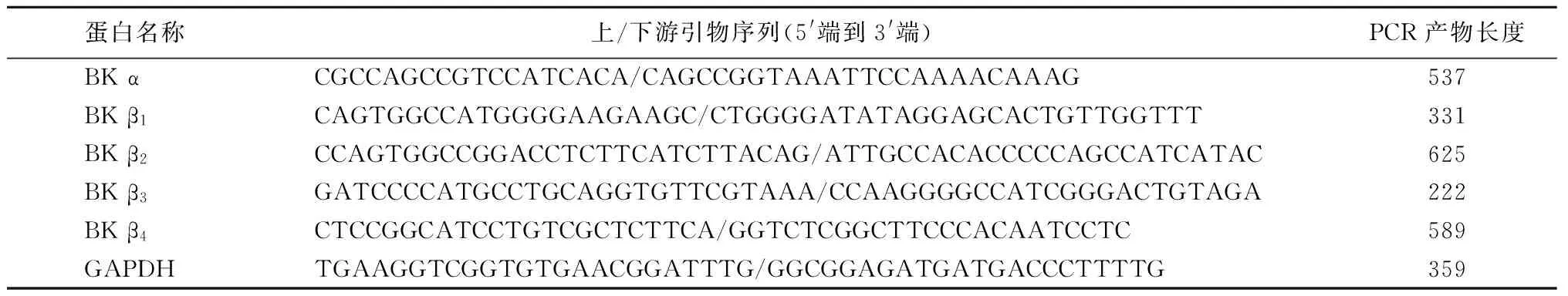
表1 BKα和β亚基及GAPDH mRNA扩增引物序列及预期产物片段大小
1.3 膜片钳实验 实验选择表面干净、折光性强、无收缩、贴壁良好的结肠平滑肌细胞用于封接。电极选用美国 Sutter公司生产的内径1.1 mm、外径1.5 mm的毛细玻璃管在电极拉制仪上(PB27,Narishige,日本)用两步法拉制出电极阻抗6~10 MΩ的玻璃微电极。实验联合应用膜片钳和压力控制技术记录通道的活动和对膜片施加负压刺激。单通道电流信号经膜片钳放大器Axopatch 200A(Axon Instruments,美国)输入数模转换器Digidata 1322(Axon Instruments,美国),采用pClamp 9.0专用软件进行记录。放大器的增益为100 mV/pA,采用2 kHz 的低通滤波,采样频率20 kHz。应用 pClamp 9.0单通道活动分析软件分析单通道数据。利用压力控制装置(Dale20,Luke Biomedical,英国)向电极内施加负压来对膜片施加牵拉刺激。由于BK分布密度较高,一个膜片上往往有多个BK通道,但是数目未知,故此采用总开放概率(open probability,NPo)来代表通道活动,N为膜片中最大通道数目,Po为单通道的开放概率。每一数据选取5 s的稳定值进行分析。实验采用膜内向外模式,电极内外液均为天冬氨酸钾140 mmol/L,EGTA 5 mmol/L,MgCl22 mmol/L,HEPES 10 mmol/L,pH调节到7.4。细胞松弛素B(cytochalasin B,Sigma-Aldrich,美国)用二甲基亚砜溶解,用浴池液稀释至终浓度20 μmol/L,二甲基亚砜的终浓度不超过0.1%。
1.4 统计学方法 应用SPSS 19.0统计软件包分析数据,计量资料比较分别采用F检验、q检验和配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 BKα和β1亚基在小鼠结肠平滑肌中的表达 PCR产物显示小鼠结肠平滑肌组织上可以检测到BK α 和 β1、β2、β4亚基的表达(图1A)。实验选取了睾丸组织做阳性对照(图1B)。由于小鼠结肠平滑肌组织中可能混有其他组织,实验进一步在光镜下收集急性分离的平滑肌细胞60个左右,检测BK α 和β亚基的表达情况。PCR产物显示小鼠结肠平滑肌细胞上仅检测到BK α和β1亚基的表达(图1C)。
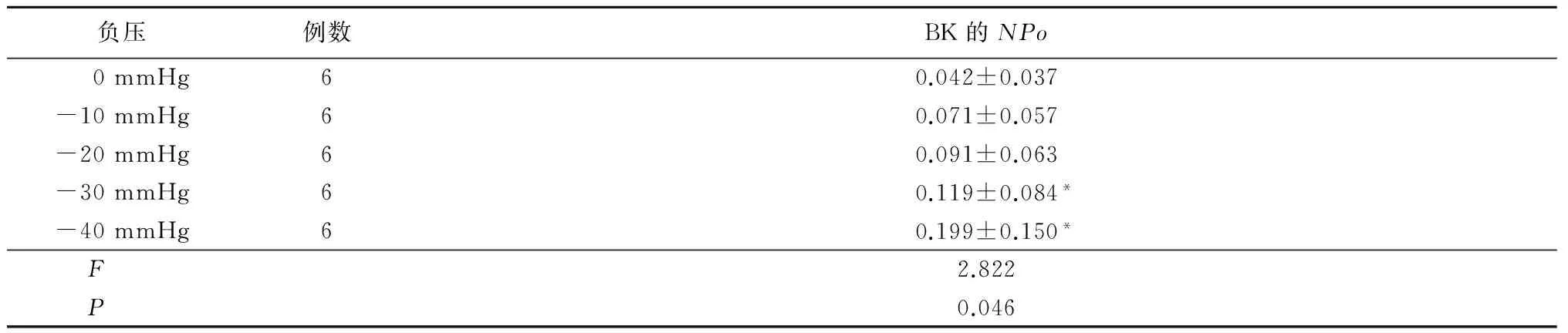
2.2 小鼠结肠平滑肌BK可被机械刺激强度依赖性激活 采用膜内向外模式,膜电位钳制于+40 mV,利用压力控制装置对膜片施加负压刺激,记录BK单通道电流的活动。施加负压刺激前(0 mmHg),细胞膜上BK自发地随机开放,BK的活动显示通道只有1级开放;膜片受到牵张刺激时,BK活动立刻增加,随着负压刺激增加,2级开放(有2个通道同时开放)逐渐增多(图2)。BK的NPo随着负压的增加而增加:负压由0 mmHg增加至-10、-20、-30、-40 mmHg, BK的NPo随之增加,在-30 mmHg和-40 mmHg的负压刺激下增加更明显(P<0.05)。见表2。
应用指数方程(NPo=Ae-kx)来拟合通道的NPo与负压间的关系。其中x为负压,介于0~-40 mmHg;A为零压力下的NPo,即通道的背景活动;k值代表通道的机械敏感性(单位是1/mmHg)。在细胞外零钙和膜内向外记录模式下,BK通道的NPo与负压刺激有很好的相关性(NPo=0.042 2e0.038 0x,R2=0.987 8,n=6),证实BK通道的活动呈刺激强度依赖性。
表2 不同压力下BK的NPo比较

负压例数BK的NPo 0mmHg60.042±0.037-10mmHg60.071±0.057-20mmHg60.091±0.063-30mmHg60.119±0.084*-40mmHg60.199±0.150*F 2.822P 0.046
*P<0.05与0 mmHg比较(q检验)
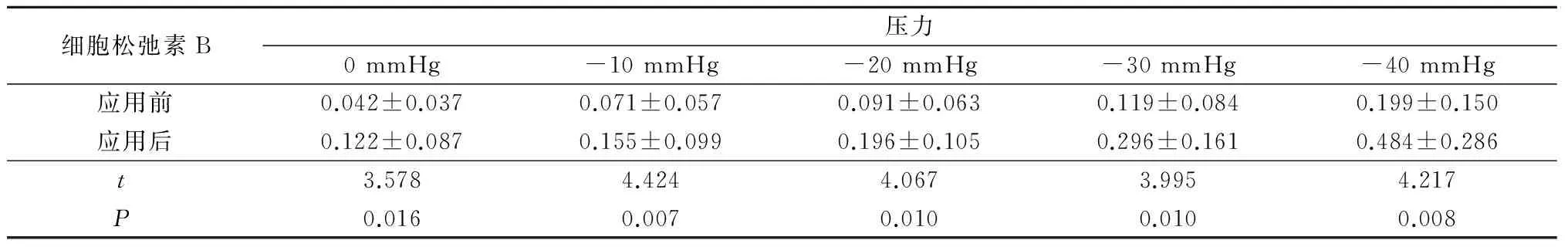
2.3 降解细胞骨架对小鼠结肠平滑肌BK机械敏感性的影响 肌动蛋白状态的变化可直接或间接地影响多种离子通道的活动。本实验采用细胞松弛素B破坏F-肌动蛋白,进一步研究细胞骨架对小鼠结肠平滑肌细胞BK通道活动的影响。图3A来自同一个结肠平滑肌细胞膜片,采用膜内向外模式记录,钳制膜电位于+40 mV。结果显示应用细胞松弛素B前,通道的背景活动较低,依次对膜片施加-10 mmHg到-40 mmHg的负压刺激,可以观察到通道NPo增加并呈刺激强度依赖性;应用细胞松弛素B 5 min后,0 mmHg下通道的背景活动已有增加,给予-10 mmHg到-40 mmHg的阶跃负压刺激后,依然呈现刺激强度依赖性的通道活动增加(F=4.694,P=0.006)。在相同负压条件下,应用细胞松弛素B后BK的NPo均高于应用细胞松弛素B前(P<0.05),见表3。
数据以指数方程NPo=Ae-kx进行拟合(图3B),其中x代表施加的负压刺激。拟合结果:应用细胞松弛素B前NPo= 0.042 2e0.038 0x(R2=0.987 8,n=6);当应用细胞松弛素B 5 min后,NPo=0.097 6 e0.039 2x(R2=0.996 5,n=6);其k值分别为0.038 0和0.039 2,十分接近。图3C表示用半对数曲线描述通道NPo与刺激强度的关系,此时2条开放概率-压力曲线半对数曲线基本平行,但是截距A不同。这说明细胞松弛素B只影响BK的背景活动,不影响BK的机械敏感性(即k值)。
表3 相同压力下应用与未应用细胞松弛素B的NPo比较

细胞松弛素B压力0mmHg-10mmHg-20mmHg-30mmHg-40mmHg应用前0.042±0.0370.071±0.0570.091±0.0630.119±0.0840.199±0.150应用后0.122±0.0870.155±0.0990.196±0.1050.296±0.1610.484±0.286t 3.5784.4244.0673.9954.217P 0.0160.0070.0100.0100.008
3 讨 论
本实验应用单通道膜片钳技术,在急性分离的成年小鼠结肠平滑肌细胞上采用膜内向外的记录模式研究BK通道的机械敏感性。研究发现小鼠结肠平滑肌细胞BK可以被负压刺激强度依赖性激活,实验中采用细胞松弛素B干预肌动蛋白的状态,发现破坏肌动蛋白后使BK背景开放活动有所增加,而机械敏感性没有变化。
牵张对于消化道是一种基本的生理性刺激,除了神经和体液机制外,消化道平滑肌细胞本身也能对机械刺激作出反应,牵张刺激可即刻引起肌细胞膜电位的变化,这可能与平滑肌细胞上机械敏感离子通道的活动相关。近年来的研究发现BK通道是消化道平滑肌细胞上一类重要的机械敏感钾离子通道[2,5]。然而关于消化道平滑肌细胞上BK的机械敏感性调节机制,国内外研究较少。
生理状态的BK由2种亚基组成,即构成孔道部分的α亚基和发挥调节作用的β亚基。完整的BK分子包含4个α亚基和4个β亚基,每个α亚基结合1个β亚基之后再形成BK的八聚体结构。α 亚基由KCNMA编码形成,β1~β4调节亚基分别由4个基因 KCNMB1~4编码。这4个编码β亚基的基因的表达具有组织特异性,其中KCNMB1主要在平滑肌中表达。本实验也发现在小鼠结肠平滑肌细胞上主要表达β1亚基。BK作为平滑肌钾通道的主要类型,其去极化和胞内钙激活以及极高的钾电导值特征,均使其在平滑肌运动控制中占据重要地位。本研究发现BK在无钙条件下可以被牵张刺激强度依赖性激活,提示机械刺激可能作为一种独立激活因素调控着BK的活动,这种机械敏感特性赋予了BK通道更多的病理生理意义。
然而有关BK的机械门控机制符合膜模型还是链索模型,目前尚未获得共识。Zhao等[4]的研究强调位于BK的α亚基C末端的一些特殊的元件对机械敏感性有特殊意义。这些相关的元件包括位于连接跨膜片段S6和第1个钾电导调节域的连接片段(linker),以及位于第1个钾电导调节域和第2个钾电导调节域之间的STREX插入体(一种剪切体);增加连接片段的长度会削弱通道对牵张刺激的反应,而缩短连接片段则使得通道对牵张刺激更敏感。因此,认为连接片段是将应力从下游结构域传递给通道的门控结构,连接片段的长度会影响这个力的传递。进一步研究认为,STREX插入体对于BK机械敏感性至关重要[3],去除STREX或将其中的苏氨酸(第674位)替换为丙氨酸可以彻底消除鸡胚心肌来源的BK对牵张刺激的反应。因此,认为BK所接受的应力来源于STREX第674位氨基酸与细胞膜某个未知结构的相互作用, STREX片段从膜上吸收机械能并通过C端连接片段传递给通道的激活门。小鼠结肠平滑肌细胞BK的α亚基缺乏STREX序列,但是仍具有机械敏感性[2,5]。这提示可能还有其他结构调控BK对机械刺激的感受。分析以上研究实验条件的异同发现,在小鼠结肠平滑肌细胞上除表达不含STREX序列的α亚基,还同时表达β1亚基。β1亚基在调节BK的钙敏感性和电压敏感性中的重要作用均已得到证实[10-11],BK对机械刺激的感受是否也有可能受β1亚基的调节,这一假设值得进一步研究证实。
细胞骨架是由微管、微丝、中间丝蛋白相互交织所形成的网络结构。细胞骨架系统不仅在维持平滑肌细胞形态、参与收缩活动中发挥作用,还与胞内蛋白质的合成、胞内物质的运输以及细胞器的转运等方面有关,同时还对膜离子通道的锚定和功能有重要的调节作用。细胞松弛素B是一种促进微丝解聚的药物,它在细胞内与微丝的正端结合,并引起F-肌动蛋白解聚,阻断G-肌动蛋白的聚合。已经有许多实验证实细胞骨架特别是肌动蛋白在介导机械刺激的过程中起了关键的作用。Guharay等[12]在研究骨骼肌牵张激活离子通道时,曾经应用细胞松弛素B 降解肌动蛋白网架,结果发现通道的活动明显增加。
本研究结果显示,在同一膜片应用细胞松弛素B后,BK通道的背景活动和在每一压力下的NPo较加药前有所增加,加药后NPo与压力的半对数关系曲线虽有上移,但是与加药前基本平行,提示通道的机械敏感性并未改变,BK的机械敏感性的门控机制符合膜模型。细胞骨架对消化道平滑肌上BK的机械敏感性的调节特点与心肌上KATP通道相类似[9]:作为通道力学微环境的重要成分,内衬于细胞膜的细胞皮质骨架可能作为细胞膜的并联成分承受部分细胞应力,使脂质膜的应力减少,从而保护通道免受过多的机械刺激,避免BK被过度激活。在膜内向外记录模式下,当向膜片施加负压刺激时,加载在膜片上的负压由膜脂质部分的应力和膜下皮质骨架的应力共同分担,而降解肌动蛋白骨架势必增加膜上的张力从而增加通道的背景NPo和对机械刺激的反应。
有关BK的机械敏感性机制的研究,不仅可以丰富机械敏感离子通道的门控机制的理论知识,并将为揭示平滑肌张力的肌源性调节机制和从机械信号感受的视角研究胃肠功能障碍奠定基础,为消化道运动功能紊乱的防治开辟崭新的领域。(本文图见封二)
[1] Takahashi K,Naruse K.Stretch-activated BK channel and heart function[J].Prog Biophys Mol Biol,2012,110(2/3):239-244.
[2] Wang W,Huang H,Hou D,et al.Mechanosensitivity of STREX-lacking BKCa channels in the colonic smooth muscle of the mouse[J].Am J Physiol Gastrointest Liver Physiol,2010,299(6):1231-1240.
[3] Naruse K,Tang Q,Sokabe M.Stress-axis regulated exon(STREX) in the C terminus of BK(Ca) channels is responsible for the stretch sensitivity[J].Biochem Biophys Res Commun,2009,385(4):634-639.
[4] Zhao H,Sokabe M.Tuning the mechanosensitivity of a BK channel by changing the linker length[J].Cell Res,2008,18(8):871-878.
[5] 侯东燕,刘萍,黄海霞,等.小鼠结肠平滑肌大电导钙激活钾通道的剪切与表达[J].首都医科大学学报,2011,32(2):224-229.
[6] Gottlieb PA,Bae C,Sachs F.Gating the mechanical channel Piezo1:a comparison between whole-cell and patch recording[J].Channels(Austin),2012,6(4):282-289.
[7] Yang Z,Tan S,Shen Y,et al.Inhibition of FSS- induced actin cytoskeleton reorganization by silencing LIMK2 gene increases the mechanosensitivity of primary osteoblasts[J].Bone,2015,74:182-190.
[8] Shen B,Wong CO,Lau OC,et al.Plasma membrane mechanical stress activates TRPC5 channels[J].PLoS One,2015,10(4):e0122227.
[9] Huang H,Liang L,Liu P,et al.Mechanical effects on KATPchannel gating in rat ventricular myocytes[J].PLoS One,2013,8(5):e63337.
[10] Yang Y,Sohma Y,Nourian Z,et al.Mechanisms underlying regional differences in the Ca2+sensitivity of BK(Ca) current in arteriolar smooth muscle[J].J Physiol,2013,591(Pt 5):1277-1293.
[11] Castillo K,Contreras GF,Pupo A,et al.Molecular mechanism underlying β1 regulation in voltage-and calcium-activated potassium(BK) channels[J].Proc Natl Acad Sci U S A,2015,112(15):4809-4814.
[12] Guharay F,Sachs F.Stretch-activated single ion channel currents in tissue-cultured embryonic chick skeletal muscle[J].J Physiol,1984,352:685-701.
(本文编辑:赵丽洁)
Effects of actin on mechanosensitivity of large conductance calcium-activated potassium channels in colonic smooth muscle cells
HUANG Hai-xia,HOU Dong-yan,XIN Fang,REN Jie,LIU Ping,WANG Wei*
(Department of Physiology and Pathophysiology, the School of Basic Medical Sciences,Capital Medical University, Beijing 100069, China)
Objective To study the relationship between the mechanosensitivity of large conductance calcium-activated potassium channels(BK) and actin.Methods The messenger ribonucleic acid(mRNA) of BK α- and β- subunits were detected by reverse transcription-polymerase chain reaction(RT-PCR) technique. BK single channel activities in mice colonic smooth muscle cells were recorded with patch-clamp technique and the mechanosensitivity was characterized. Then, cytochalasin B was used to break down actin to determine effects of actin on mechanosensitivity of BK.Results The BK in mice colonic smooth muscle cells was composed of α- and β1-subunits. The open probability of BK in colonic smooth muscle cells increased significantly and pressure-dependently under the stimulation of negative pressure. Breaking down actin did not affect BK mechanosensitivity.Conclusion BK in mice colonic smooth muscle cells was sensitive to mechanical stimuli and its activity was intensity-dependent. It was proven that mechanosensitivity of BK did not depend on the integrity of actin. The cortical actin, which lines parallel to bilayer, shares a proportion of membranous tension and protects BK from excess stretching.
large-conductance calcium-activated potassium channels;actins;myocytes, smooth muscle
2015-10-21;
2015-11-05
国家自然科学基金(31171105);北京市教育委员会科技发展计划项目(SQKM201210025001)
黄海霞(1975-),女,山东青岛人,首都医科大学基础医学院副教授,医学博士,从事离子通道研究。
*通讯作者。E-mail:wangwei@ccmu.edu.cn
R329.24
A
1007-3205(2015)11-1245-06
10.3969/j.issn.1007-3205.2015.11.002

