湿地植物根系泌氧及其在自然基质中的扩散效应研究进展
王文林,韩睿明,王国祥,*,唐晓燕,梁 斌
1 环境保护部南京环境科学研究所, 南京 210042 2 南京师范大学地理科学学院 江苏省环境演变与生态建设重点实验室, 南京 210023
湿地植物根系泌氧及其在自然基质中的扩散效应研究进展
王文林1,2,韩睿明2,王国祥2,*,唐晓燕1,梁 斌1
1 环境保护部南京环境科学研究所, 南京 210042 2 南京师范大学地理科学学院 江苏省环境演变与生态建设重点实验室, 南京 210023
湿地植物根系径向泌氧(ROL)是构造根际氧化-还原异质微生态系统的核心要素,其扩散层为好氧、厌氧微生物提供了良好生境并促进其代谢活动,使湿地植物根际成为有机物降解、物质循环及生命活动最为强烈的场所,已有成果证明湿地植物根系ROL的强弱与污染物的去除效果密切相关。因此,开展湿地植物根系ROL及其在自然基质中的扩散效应研究,对于了解湿地植物根系ROL机理及其根际氧环境特征,进而发挥湿地植物的污染去除功能具有十分重要的意义。基于此,首先归纳了湿地植物根系ROL特征及其受影响机制的研究现状,而后从种属差异、时空分布及对微生物的影响等方面对根系ROL在自然基质中的扩散效应国内外研究成果进行了总结,最终根据研究现状与不足对今后的研究方向进行了简要展望。创新之处在于:1)提出影响根系氧供给及氧输送释放通道的环境、生物等因素,阐述了其对根系ROL的影响机制;2)着重阐述了目前研究较少提及的根系ROL扩散效应测定方法。
湿地植物;根系;根系径向泌氧(ROL);自然基质;扩散效应
植物根系径向泌氧(ROL)作用是构造根际氧化-还原异质微生态系统的核心要素[1- 3],自1904年Hiltner提出根际概念以来,根际一直是农学领域和生态学领域研究的热点[4- 6]。1989年Reddy[7]推测湿地植物根系附近的富氧-厌氧微环境控制了根-沉积物界面的硝化-反硝化过程,提出了根-沉积物界面的硝化-反硝化理论,并用同位素技术测定了水稻(OryzasativaLinn.)、梭鱼草(PontederiacordataL.)、灯芯草(JuncuseffusesL.)的根际氮迁移转化过程,从而证实了这一理论,由此将根际研究从农作物拓展到湿地植物。
为应对湿地沉积物的厌氧环境,湿地植物通过根、茎强大的通气组织,将茎叶光合作用及气体交换作用获得的氧气运输到根部,保持根部适宜的氧浓度促进细胞分裂伸长、保持呼吸作用和代谢速率,同时通过根系ROL向根区沉积物释放氧气[8],其有利于根际沉积物中还原性的铁、锰被氧化[9],在根表形成红棕色的铁锰氧化物胶膜(铁膜)[10],减少了植物对有毒的还原性物质的吸收,铁膜既可为根系脱毒,又可通过金属离子之间的吸附解吸、氧化还原、有机无机的络合等作用改变根际环境中重金属阳离子和养分的存在形态,从而降低这些离子的生物有效性,起到钝化作用[11- 13],而形成的氧扩散层则为好氧、异氧微生物提供了良好生境并促进其代谢活动,是湿地植物根际成为有机物降解、物质循环及生命活动最为强烈的场所[14- 18]。此后的研究也证明湿地植物根系ROL的强弱与污染物的去除效果密切相关[19- 20]。
因此,开展湿地植物根系ROL及其扩散效应研究,对于了解湿地植物根系ROL机理及其根际氧环境特征,进而发挥湿地植物的污染去除功能具有重要意义。基于此,本文就湿地植物根系ROL及其在自然基质中的扩散效应的国内外研究现状进行了归纳总结,并对今后的研究方向进行了简要展望。
1 根系ROL特征
前人已开展大量针对湿地植物根系ROL效率的相关研究,成果为人工湿地中去污植物的选择提供了借鉴。表1为近年来利用圆筒状金属铂电极、柠檬酸钛比色两种主流技术测定不同类型湿地植物根系ROL的研究结果[21-27],所有研究植物均已成熟且置于污水中培养,前者表征的是单个根特定部位单位面积的ROL产率,后者则能表征整个根系单位质量的ROL产率。
相对于不同类型湿地植物根系ROL较为系统的研究,针对同一种植物根系ROL时空变化特征研究相对较少,吴振斌[21]等对石菖蒲(Acorustatarinowii)根系ROL长时间的测定后发现,实验第2周,根系靠近根尖处ROL约100 ng cm-2min-1,第7周下降到约50 ng cm-2min-1,当根系完全衰老时ROL近于零;邓泓[28]等根据10种湿地植物根系ROL在根不同部位的空间分布特征将其分为3种类型,类型Ⅰ为根系泌氧在根的任意部位均较高,如空心莲子草(Alternantheraphiloxeroides)、菵草(Beckmanniasyzigachne)、水芹(OenanthestoloniferaD.C)及棒头草(Polypogonfugax),类型Ⅱ为根系泌氧在根尖区域最高,之后沿根基部方向迅速降低,大部分植物均是这种类型,如风车草(Cyperusflabelliformis)、茳芏(Cyperusmalaccensis)、灯芯草、李氏禾(Leersiahexandra)及水生黍(Panicumpaludosum),通常根基处ROL仅为根尖区域(60—159 ng cm-2min-1)的4%—20%,类型Ⅲ为根系泌氧在根的任何位置泌氧率都很低,如类芦(Neyradiareynaudiana)。黄丹萍[29]等也证实了菖蒲(Acoruscalamus)根系ROL属于类型Ⅱ。
上述研究根系ROL测定均在无氧琼脂或营养液中进行,这两种介质相较于自然基质具有方便、实验结果干扰小,实验结果直观可以量化等优点,然而湿地植物普遍生长在沉积物中,其根际氧化区的形成是根系ROL及沉积物还原物质消耗共同作用的结果,以上研究并不能反映根系ROL在自然基质中的实际扩散效果。

表1 近年来湿地植物根系径向泌氧测定结果[21-27]Table 1 Values of radial oxygen loss in the rhizosphere of wetland plants in recent years[21-27]
2 根系ROL及其扩散效应测定技术
2.1 根系ROL测定
目前针对根系ROL的测定的主流技术已有较多介绍,黄丹萍等[30]就测定原理、优缺点对主流的湿地植物根系ROL测定方法进行了归纳总结,详见表2。

表2 湿地植物根系径向泌氧主要测定方法介绍[30]Table 2 Approaches applying to the measurement of radial oxygen loss in wetland plants[30]
2.2 根系ROL扩散效应测定
由于根系ROL扩散厚度往往只有数毫米[39- 40],且由于沉积物的复杂性,湿地植物根际ROL在沉积物中的扩散效应研究进展缓慢,随着微电极(Micro-electrode)、微光极(Micro-optode)等一维微探针技术[41]及二维平面光级(Planar-optode)技术的应用[42],使得原位测定湿地植物根际溶氧的微时空分布,真实反映根际氧环境特征成为可能,然而目前鲜见针对上述测定技术在根系氧扩散层测定应用的详细介绍。
2.2.1 一维微探针
溶氧微电极及微光极是能实现湿地植物根际某点溶氧浓度测定的一维微探针技术。前者是基于克拉克(Clark)型的电化学微传感器,以一支银或氯化银参比电极作为阳极和一支铂或金感应电极作为阴极,溶解氧(Dissolved oxygen, DO)通过硅酮橡胶膜进入腔体内的电解液,在参比电极电位约-0.8 V下的阴极表面被还原,通过测定氧化还原电流确定DO浓度[43]。后者则是基于荧光猝灭原理的光纤信息交换传感器,由于氧气是某些荧光指示剂的天然猝灭剂,其将氧敏感荧光指示剂制成氧传感膜耦合于光纤端部,采用高亮度发光二极管为光源与微型光电二极管检测系统,通过光纤传导荧光淬灭强度确定氧气浓度[44],钌络合物因为对搅拌不敏感、不受硫化氢、二氧化碳及盐度干扰等优点,是迄今为止应用最为广泛的氧敏感荧光指示剂[45]。与微电极相比,微光级具有不耗试剂、无需参比电极、不受电磁干扰等优点[46]。以上两种技术均已被广泛用于沉积物氧剖面测定[47- 49],Christensen等[41]及Gansert等[42]分别于1994年和2001年将2种技术最先运用于湿地植物根际氧剖面测定,但其只能测量某个点的DO浓度,且由于沉积物的不可透视性,其难于确定测定点与根表面的距离,但对于定位技术的细节国外研究者一直语焉不详。
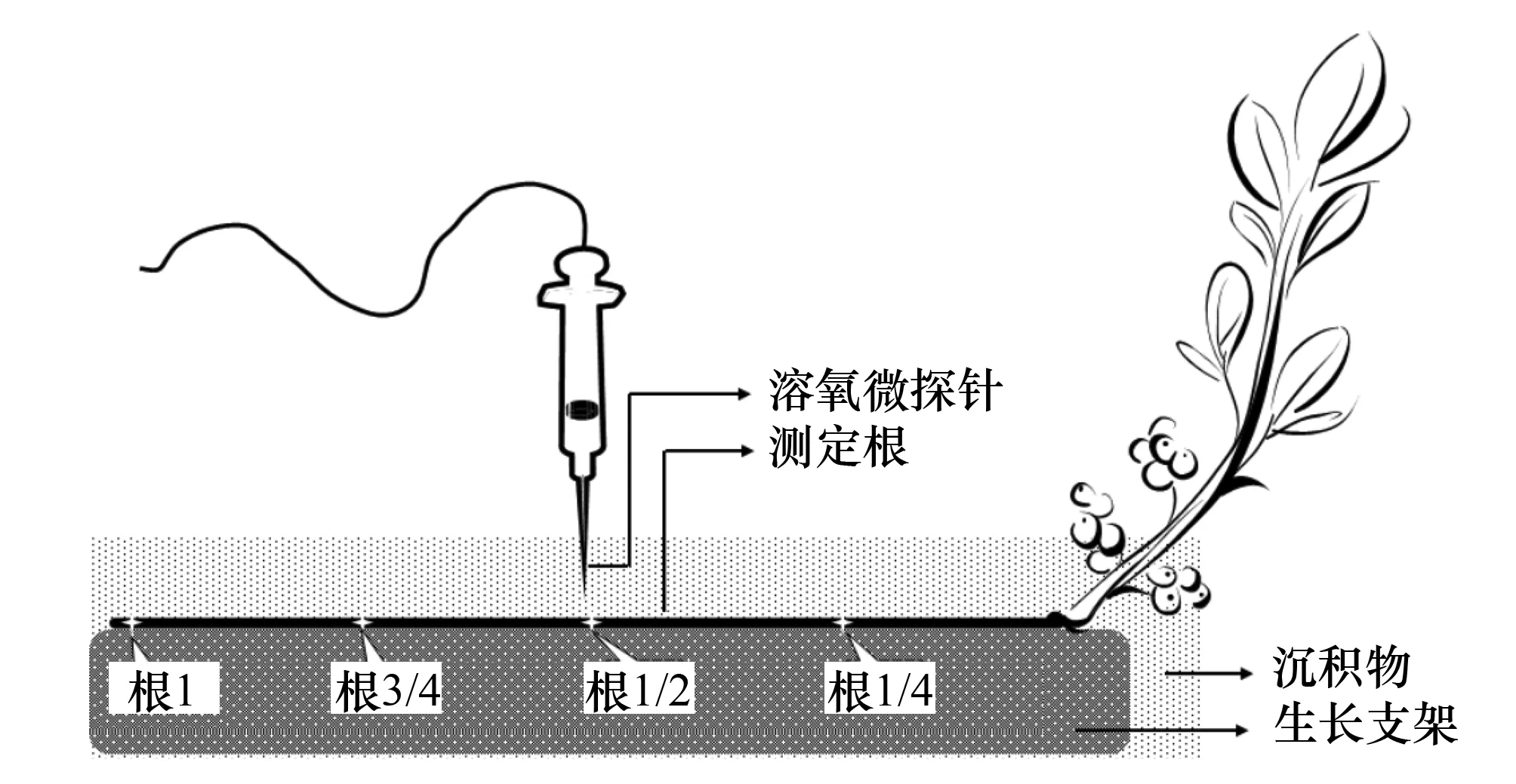
图1 一维溶氧微探针技术测定示意图[51] Fig.1 Shematic of the micro-electrode probe applying to the measurement of rhizosphere dissolved oxygen[51]
王文林等[50- 51]在总结国外研究者的相关方法基础上发明了根系水平测定法解决了定位难题,对湿地植物菖蒲单个根不同部位(根基部起总根长1/4处(根1/4)、根系中部(根1/2)、从根基部起总根长3/4处(根3/4)及根尖(根1))氧剖面浓度进行了控制性测定(图1)[51]。具体操作步骤为:将湿地植物根系拉直后固定在小型支架上,然后利用微电机操纵溶氧微探针定位到根测定部位表面处(通过目测并结合探针信号变化确定是否到达根表面[52]),再将实验盆内表层沉积物小心覆盖测定根,稳定30 min[39],然后操纵溶氧微电极反向位移,记录位移距离(程序自动记录)测定溶氧浓度,待溶氧浓度为零时停止测定,此时反向位移距离即为根系氧扩散层厚度。但这这一技术也有缺憾,其违背了根系纵向生长的原理,一根探针不能同步测定根多个位置ROL扩散层,在换位测定时需移除沉积物重新进行定位,破坏了根系原位生长环境。
2.2.2 二维平面光级
针对一维微探针技术只能点测的技术缺憾,Jensen等[53]首次将已在生物、医学及环境沉积学等领域成功应用的二维平面光级技术用于沉水植物大叶藻(Zosteramarina)的根际氧剖面测定,Frederiksen等[54]则利用该技术真正实现了湿地植物根际氧剖面的原位二维连续动态表征。其测定原理是将沉水植物大叶藻自然种植于装有沉积物的玻璃检测箱中,植物根部生长位置设置有透明检测口,而后通过凝胶把氧敏感荧光指示剂制成具有光学透明度的平面传感膜[55],并将其粘贴于检测窗口内侧,利用平面检测探头连续采集和处理光激发传感膜而得到动态荧光图像,最终得到根系氧剖面动态二维分布图[54,56],具体见图2。然而,该技术也存在缺陷,首先湿地植物根系生长不可控,探头只能检测到生长至平面传感膜附近的根系氧剖面动态变化,因而无法确定检测结果受单根影响还是多根共同影响,其次由于根系生长贴近检测箱壁,其释放的氧无法透过箱壁只能沿箱壁向两侧扩散,凝胶也有利于氧气扩散,这些均导致测定的根际氧扩散层厚度结果偏大[53]。

图2 二维平面光级技术测定示意图[54]Fig.2 Shematic of the 2-dimention planar optode applying to measuring the rhizosphere dissolved oxygen[54]
3 根系ROL影响因素
已有成果发现湿地植物ROL与氧供给及氧输送释放通道是否顺畅密切相关[8,57],而氧气供给主要受诸如光照、通气条件、温度、茎叶生物量等因素影响,氧气内部传输及向外部释放则主要与基质氧化还原性、根系衰老、根表铁膜、基质氮素、硫化物及有机酸浓度等因素密切相关。
3.1 氧供给影响因素
影响湿地植物根内部供氧来源的核心因素是植物的光合作用制氧及氧气交换作用。在白天,湿地植物茎叶的光合作用放氧是植物体内氧的主要供给机制[3,58],植株光合作用产生的氧气,除了供植株呼吸、剩余部分输送释放到底泥以维持根区的氧化状态,而在夜间光合作用无法进行时,湿地植物茎叶的气体交换作用则成为主要供给机制,其能使大气中的氧气通过植物叶表面、茎杆等的孔隙进入植物体内[59- 60]。Waters等[61]及Inoue等[36]分别发现水稻和香蒲(Typhaorientalis)无论有无照光根系均能测出ROL,照光条件较黑暗条件下ROL高1倍以上,表明挺水植物茎叶光合作用对根内部氧气贡献度超过茎叶的氧气交换作用。此外,照光增强了植物的蒸腾作用[62- 63],增加了植株内部的湿度与温度,从而提升了湿度诱导的压强梯度渗透作用及热力诱导的渗透作用,植物为降低蒸腾作用收缩气孔,导致气体交换能力减弱,Tanaka等[64]研究发现从20 ℃上升到30 ℃,芦苇(Phragmitesaustralis)根系ROL量下降了25.8%。
与挺水植物相比,沉水植物根内部供氧则可能以光合作用机制为主或以氧气交换机制为主。Pedersen等[52]发现在水体通气条件一致时,海神草(Cymodocearotundata)在照光条件下根表面溶氧浓度是遮光条件下的3.75倍,证明了其以光合作用为主的根内部供氧机制。而Laskov等[39]对穗花狐尾藻(Myriophyllumspicatum)单个根中部表面溶氧浓度的持续动态测定研究发现,在照光-空气(上覆水鼓入空气)条件下,溶氧浓度约为34%,变为遮光-空气条件后,下降有限至约30%,变为遮光-N2(上覆水鼓入N2)条件后,迅速降至0.5%以下,变为照光-CO2(上覆水鼓入CO2)条件后,仅上升至4%—9%,重新回到照光-空气条件后,重新上升至32%左右,由此提出狐尾藻茎叶光合作用对于根内部氧气贡献有限,其主要通过茎叶在水体中的氧气交换供给。
此外,湿地植物茎叶生物量作为光合作用制氧及氧气交换作用的载体会影响光合作用制氧量及氧气交换量,Connell等[3]发现在照光条件下,卵叶盐藻(Halophilaovalis)去掉一对叶根系ROL降低60%,当所有的叶全部去掉时,根系ROL则不能测出。
3.2 氧输送释放影响因素
影响氧内部传输及向外部释放的核心因素是根通气组织及细胞壁的通透性发育程度[8]。湿地植物根通气组织可分为裂生型(Schizogenous)通气组织和溶生型(Lysigenous)通气组织两种类型,前者氧气能通过皮层细胞之间形成孔隙传输直至根尖,典型湿地植物如水稻[65]等,后者氧气通过皮层细胞自身溶解形成的条状溶生性孔隙向根尖传输,典型湿地植物如菖蒲[29]等,孔隙越大越利于氧气传输。此外,在还原性基质中,绝大部分湿地植物为了保证氧气能够扩散到根尖区域,在根基区根表和皮层之间形成若干层厚壁细胞并发生木质化及栓质化作用,即泌氧屏障[66- 67],以避免大量氧气在运输过程中通过根轴向沉积物扩散[8],相反,根细胞壁越通透越利于根系ROL[8,31]。
已有研究表明,湿地植物根解剖学特征主要受根际环境影响诱导。汪晓丽等[68]研究发现,在pH较低时,施用铵态氮肥能诱导籼稻(OryzasativaL.subsp.sativa.)通气组织的形成,而硝态氮肥能诱导粳稻(OryzasotivaL.subsp.joponicaKato)通气组织的形成,黄丹萍等[29]也发现,高氮磷胁迫能增大菖蒲根通气组织孔隙度。Colmer等[69]开展了水稻根际缺氧环境模拟试验,观察到缺氧能诱导根通气组织孔隙度增大及在根基部形成根系泌氧屏障。邓泓等[28]对野外采集的多种湿地植物的根系ROL进行了测定,发现野外分布于强还原性底质的灯芯草等植物根系ROL在根尖区域最高,之后沿根基部方向迅速降低,而野外分布于较浅湿地的棒头草等植物根系ROL在根的任意部位均较高,通过对棒头草等植物根系在实验室进行缺氧处理后,其根系ROL特征向灯芯草等转变,即ROL向根基部方向迅速降低,因而推测棒头草根基部开始形成泌氧屏障以应对缺氧环境,印证了Colmer等研究结果。此外,Colmer等[69]还发现根系泌氧屏障形成可能具有可逆性,在对水稻根好氧处理一段时间后,其根基部泌氧开始增加,因而推测水稻根泌氧屏障开始变弱。
在还原性基质中,湿地植物根表铁膜的形成也会降低根壁的通透性,从而影响根系ROL[70- 71]。Claus等[72]发现湿地植物山梗莱(Lobeliadortmanna)根表铁膜的形成会降低根系ROL,认为根表铁膜加强了细胞阻隔作用,但其阻隔机制尚不清晰。不同的湿地植物其根表铁膜具有不同的沉积形式,Taylor等[73]发现香蒲根表铁膜可以渗透到根系外皮层内约3层细胞厚度的部位,Batty等[74- 75]则发现芦苇根表铁膜不均匀地沉积在根系外皮层外。而有研究则认为湿地植物根表铁膜的形成过程中不断的氧气消耗是导致根系ROL下降的主要因素[76]。除了基质氧化还原性外,根际沉积物中的硫化物[77]及有机酸[66]也会诱导湿地植物根系形成泌氧屏障。根系自身衰老也会引起通气组织退化及增厚根系泌氧屏障[21],如Zhang等[32]发现水葱(Scirpusvalidus)的白色新生根ROL量要显著高于棕色的老根。
4 根系ROL在自然基质中的扩散效应
4.1 形成氧扩散层
4.1.1 种属间差异
源于一定面积的根系持续的ROL量超过沉积物耗氧量[8],湿地植物根表面至沉积物存在氧浓度由高到低的氧扩散层,其氧分布不仅受光照等因素影响,存在明显的昼夜时间序列差异,还呈现出显著的种属差异,具有更高茎叶生物量和粗壮根系的挺水植物氧扩散层厚度显著高于沉水植物。研究者利用一维微探针技术发现在照光条件下沉水植物菹草(Potamogetoncrispus)和穗花狐尾藻氧扩散层厚度分别为100、250 μm[39],而挺水植物水稻、菖蒲、慈姑(Sagittariatrifolia)昼夜交替过程中根氧扩散层厚度则分别为200—350 μm[78]、380—680 μm[51]和720—980 μm[79],是上述沉水植物的1.4—9.8倍。然而,上述研究结果忽略了不同物种氧扩散层内部氧浓度下降速率的差异,Reddy等[7]将根区沉积物DO浓度在根表面DO浓度的90%及以上的氧气扩散层称为稳定氧化层,认为其能更好的表征根ROL累积性扩散效应,由此换算后,菹草和穗花狐尾藻稳定氧化层厚度仅为20、50 μm,而慈姑则达到400 μm,是上述沉水植物的8—20倍。当然,上述研究在不同的沉积物中进行,其耗氧速率的差异也会影响实验结果。不同的测定技术也会影响实验结果,Jensen等[53]同时使用一维微探针技术和二维平面光级技术对大叶藻根的氧扩散层进行测定后发现,后者测定结果至少较前者大2倍。
此外,Pedersen等[52]还首次报道了海水中沉水植物海神草根系的氧扩散层厚度仅有约80 μm,显著低于淡水沉水植物Littorellauniflora[41]、Lobeliadortmanna[80],后者更容易通过根系有效利用沉积物孔隙水中的CO2作为光合作用的无机碳源[81],这种机制被认为是导致后者根系ROL显著高于前者的重要原因。
4.1.2 时空分布特征
在沉积物中,湿地植物根系氧扩散层氧分布不仅存在以根为圆心的水平方向的空间梯度差异,而且从根基到根尖也存在明显的垂直方向的空间梯度差异。海神草、大叶藻、菹草、穗花狐尾藻等沉水植物氧扩散层厚度均呈现根基处最大,之后向根尖部方向迅速降低的特征[39],而菖蒲[50-51]、慈姑[79]等挺水植物氧扩散层厚度则呈现根中部最大、根基处最小,之后向根尖部方向逐步降低的特征。上述特征与前人通过金属铂电极在琼脂中的测定结果相悖,香蒲[21]、菖蒲[29]和真红树植物[38]在琼脂中测定的ROL速率表现为根尖区域最高,之后沿根基部方向迅速降低。有研究表明,在不考虑根系泌氧屏障时,湿地植物根系氧扩散强度与范围空间分布差异主要由根不同部位生物量所决定[50- 52],一般根茎型植物,其根系靠近基部部分直径显著高于靠近根尖部分,靠近根尖处根系泌氧面积显著下降,尽管根尖ROL速率最大,根尖处泌氧扩散层厚度仍然低于其它部位,根系氧扩散层不同部位的分布差异又与根系内部供氧强度显著相关,如王文林等[50]发现菖蒲幼苗在照光条件下根系不同部位氧扩散层强度及厚度差异显著,遮光条件下则无显著性差异。相比于沉水植物,挺水植物根基处氧扩散层厚度最小则证明根系泌氧屏障足够强时,将会直接阻碍根系ROL,挺水植物根系远比沉水植物发达,根内部氧气传输至根尖的路径也更长,且根基部具有支撑固定作用,这些导致挺水植物根基部泌氧屏障发育远强于沉水植物[82]。
此外,湿地植物根系氧扩散层氧分布也会因环境变化及自身生长发生动态变化。Pedersen等[52]在遮光-照光-遮光处理条件下对海神草根表面溶氧浓度进行了数小时的连续测定,发现氧浓度在约25%与75% 2个稳态浓度之间变化,每个稳态浓度形成时间约为1.5 h,并将其归因于叶片产生的氧气传输至根系至氧气浓度稳定需要一定时间[83];王文林等[51]对菖蒲幼苗生长过程(从株高约15 cm长至株高约60 cm)单个根的氧扩散层进行了约1个月的跟踪测定,发现根系氧扩散层氧浓度及厚度随着根系内部氧浓度及根直径的增大而增强,由于生长过程中叶片光合作用能力无显著差异,根系内部氧浓度的增大主要缘于光合作用及氧气交换作用的载体茎叶生物量的增加以及通气组织的快速发育。由于上述研究均采用一维微探针测定,其只能点测,并不能同时连续表征氧扩散层剖面变化。
Frederiksen[54]等利用二维平面光级技术实现了大叶藻根际氧剖面的原位二维连续动态表征,连续44h的测定结果表明,最早出现在平面传感膜附近的根系氧扩散层厚度逐步下降,后出现的根系则逐步上升,他将其归结为根系衰老。Blossfeld等[84]对灯芯草、片髓灯心草(Juncusinflexus)最早出现在平面传感膜附近约2 mm长的单根进行了22、34 h不等的连续测定(测定时间由灯芯草、片髓灯心草测定根的生长速率决定),发现实验中段(第10、18小时)测定根已长至检测窗口(12 mm×34 mm)顶端,此时2个测定根氧扩散层厚度最大,随着监测的进行,逐步沿根基部向根尖减弱,他将其归结为根基逐步形成泌氧屏障,根系泌氧带相对于整个根下移,由于测定根已长出检测窗口范围,因此实验结果显示为测定根氧扩散层逐步消失,同时他也承认,由于无法控制测定根生长,其若未按预期沿平面传感膜生长、隐藏在测定根后的其它根及植物根系生长对基质理化性质的改变均会影响实验结果[85]。上述动态研究均集中于海洋沉水植物,鲜见淡水湿地植物研究,且研究时间较短,鲜见诸如贯穿植物生长季的长时间尺度研究。
4.2 促进微生物生长
根系ROL与基质中总氮、总磷、化学需氧量的去除效果密切相关[19- 20,22- 23],一般认为根际微生物的代谢活动在污染物的吸附和降解中起着核心作用,而氧是影响其生存活动的关键因素,根区氧扩散层实为强烈的氧梯度变化层,富氧-厌氧微环境为有机物降解的异氧菌、硝化菌、反硝化菌及厌氧氨氧菌提供了适宜生境[7,14- 15]。目前,已有大量针对湿地植物根际微生物研究,并已上升到分子水平,研究结果表明湿地植物根际微生物种类、数量均显著高于非根际土壤,并随季节的温度变化而变化,温度越高,微生物数量越多、多样性越丰富[86- 90],同时发现根际微生物总DNA部分差异表达片段与BLASTX数据库中相关有机物分解菌、解磷菌、去氮菌具有高度的相似性[89, 91]。
然而,上述研究对象均难称根际微生物,总结起来主要有3类方式:1)参照陆生植物方式采集根际微生物,即将湿地植物盆栽于土壤中,采样时将植物根系挖出,抖落大土块, 收集附着在根系上的土壤作为根际土壤[86];2)将湿地植物水培,将根系培养水中的微生物作为根际微生物[91];3)将湿地植物根系生长区域内的沉积物作为根际沉积物,即将湿地植物根系置于根袋中,将根袋内的沉积物视为根际沉积物[87- 89]。由于根际厚度只有数毫米,上述方法采集的沉积物样品相对湿地植物根系而言尺度太大,且在采样过程中易受根系外部沉积物干扰,实际上根系不同部位氧扩散层氧的时空分布差异均会导致对应位置微生物的动态分布差异,现有研究结果并不能定量反映这一差异及其动态变化。
5 研究展望
目前针对湿地植物根系ROL在人工基质中的研究虽较为系统,但在未同步测定根内部氧气浓度情况下,基本均为外在环境因子的间接影响研究,而在自然基质中,虽然目前的研究已初步认识到湿地植物不同部位根系氧扩散层氧浓度与人工基质中的根系ROL特征并不一致,但对不同基质条件下根系氧扩散效应特别是长时间尺度连续变化特征的了解仍然十分有限,更是鲜见根际尺度下根系氧扩散对微生物的影响效应研究,究其原因,原位无损伤测定及取样的困难是重要影响因素。因此,解决方法学问题,开展湿地植物根际氧环境时空变化特征、根系氧扩散对根际微生物的影响研究对于了解湿地植物根系氧扩散效应机制,进而最大限度地发挥湿地植物在自然基质中的去污功能具有重要意义。
5.1 根际氧环境时空变化特征
开发控制性、无干扰的湿地植物根系氧扩散层及根组织内部氧气原位测定技术,在不同类型的自然基质中,对不同湿地植物根系不同部位氧扩散层及根组织内部氧气进行贯穿植物生长季的长时间尺度的原位精确测定,探讨不同环境因子对湿地植物根际氧环境的影响机制,揭示湿地植物在自然基质中的根际氧环境时空变化特征。
5.2 根系氧扩散对根际微生物的影响机制
开发控制性、无干扰的湿地植物根际尺度的微生物原位分层取样技术,并综合运用PCR技术、DNA限制性酶切技术、荧光标记技术、DNA序列自动分析技术等技术,从分子水平上表征湿地植物根际尺度上微生物种群结构多样性、空间及功能差异,揭示根系氧扩散对根际微生物的影响机制。
[1] Armstrong J, Armsrtong W, Beckeet P M.Phragmitesaustralis: Venturi- and humidity-induced pressure flows enhance rhizome aeration and rhizosphere oxidation. New Phytologist, 1992, 120(2): 197- 207.
[2] Flessa H. Plant-induced changes in the redox potential of the rhizospheres of the submerged vascular macrophytes Myriophyllum verticillatum L. andRanunculuscircinatusL. Aquatic Botany, 1994, 47(2): 119- 129.
[3] Connell E L, Colmer T D, Walker D I. Radial oxygen loss from intact roots of Halophila ovalis as a function of distance behind the root tip and shoot illumination. Aquatic Botany, 1999, 63(3- 4): 219- 228.
[4] 吕彪, 赵芸晨, 陈叶, 秦嘉海. 河西走廊盐土资源及生物改土效果. 土壤通报, 2001, 32(4): 149- 150.
[5] Zhang F S, Shen J B. Research progress of plant nutrition//China Agricultural Society Research Progress of Plant Protect and Plant Nutrition. Beijing: China Agricultural Press, 1999: 458- 469.
[6] 张彦东, 白尚斌, 王政权, 王庆成. 落叶松根际土壤磷的有效性研究. 应用生态学报, 2001, 12(1): 31- 34.
[7] Reddy K R, Patrick W H, Lindau J A C W. Nitrification-denitrification at the plant root-sediment interface in wetlands. Limnology and Oceanography, 1989, 34(6): 1004- 1013.
[8] Colmer T D. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots. Plant Cell and Environment, 2003, 26(1): 17- 36.
[9] Mendelssohn I A, Kleiss B A, Wakeley J S. Factors controlling the formation of oxidized root channels: a review. Wetlands, 1995, 15(1): 37- 46.
[10] Hansel C M, Fendorf S, Sutton S, Newville M. Characterization of Fe plaque and associated metals on the roots of mine-waste impacted aquatic plants. Environmental Science and Technology, 2001, 35(19): 3863- 3868.
[11] Christensen K K, Sand-jensen K. Precipitated Fe and Mn plaques restrict root uptake of phosphorus in Lobelia dortmanna. Canadian Journal of Botany, 1998, 72: 2158- 2163.
[12] Jacob D L, Otte M L. Long-term effects of submergence and wetland vegetation on metals in a 90-year old abandoned Pb-Zn mine tailings pond. Environmental Pollution, 2004, 130(3): 337- 345.
[13] Weis J S, Weis P. Metal uptake, transport and release by wetland plants: implications for phytoremediation and restoration. Environmental International, 2004, 30(5): 685- 700.
[14] Steer J, Harris J A. Shifts in the microbial community in rhizosphere and non-rhizosphere soils during the growth ofAgrostisstolonifera. Soil Biology and Biochemistry, 2000, 32(6): 869- 878.
[15] Yang C H, Crowley D E. Rhizosphere microbial community structure in relation to root location and plant iron nutritional status. Applied and Environmental Microbiology, 2000, 66(1): 345- 351.
[16] Courchesne F, Cloutier-hurteau B, Turmel M C. Relevance of rhizosphere research to the ecological risk assessment of trace metals in soils. Human and Ecological Risk Assessment, 2008, 14(1): 54- 72.
[17] Weiss J V, Emerson D, Megonigal J P. Geochemical control of microbial Fe(III) reduction potential in wetlands: comparison of the rhizosphere to non-rhizosphere soil. FEMS Microbiology Ecology, 2004, 48(1): 89- 100.
[18] Kumar V, Aggarwal N K, Singh B P. Performance and persistence of phosphate solubilizingAzotobacterchroococcumin wheat rhizosphere. Folia Microbiologica, 2000, 45(4): 343- 347.
[19] 吴海明, 张建, 李伟江, 张波. 人工湿地植物泌氧与污染物降解耗氧关系研究. 环境工程学报, 2010, 4(9): 1973- 1977.
[20] Li Y L, Wang X X. Root-induced changes in radial oxygen loss, rhizosphere oxygen profile, and nitrification of two rice cultivars in Chinese red soil regions. Plant and Soil, 2013, 365(1- 2): 115- 126.
[21] 吴振斌, 贺锋, 程旺元. 极谱法测定无氧介质中根系氧气输导. 植物生理学报, 2000, 26(3): 177- 180.
[22] 赖闻玲, 胡菊芳, 陈章和. 四种挺水植物生理生态特性和污水净化效果研究. 热带亚热带植物学报, 2010, 18(4): 421- 427.
[23] Lai W L, Zhang Y, Chen Z H. Radial oxygen loss, photosynthesis, and nutrient removal of 35 wetland plants. Ecological Engineering, 2012, 39: 24- 30.
[24] 刘志宽, 牛快快, 马青兰, 白晓华, 苏刘选. 8种湿地植物根部泌氧速率的研究. 贵州农业科学, 2010, 38(4): 47- 50.
[25] 黄永芳, 杨秋艳, 张太平, 何金涛. 水培条件下两种植物根系分泌特征及其与污染物去除的关系. 生态学杂志, 2014, 33(2): 373- 379.
[26] 李奕林. 水稻根系通气组织与根系泌氧及根际硝化作用的关系. 生态学报, 2012, 32(7): 2066- 2074.
[27] 李丽. 11种湿地植物在污染水体中的生长特性及对水质净化作用研究 [D]. 广州: 暨南大学, 2011.
[28] 邓泓, 叶志鸿, 黄铭洪. 湿地植物根系泌氧的特征. 华东师范大学学报: 自然科学版, 2007, (6): 69- 76.
[29] 黄丹萍, 贺锋, 肖蕾, 徐栋, 吴振斌. 高氮磷胁迫下菖蒲(AcoruscalamusLinn.)通气组织和根系释氧的响应. 湖泊科学, 2012, 24(1): 83- 88.
[30] 黄丹萍, 贺峰. 湿地植物根系泌氧研究. 环境科学与技术, 2009, 32(B12): 171- 176.
[31] Armstrong W. Aeration in higher plants//Advances in Botanical Research. London: Academic Press, 1979, 7: 225- 332.
[32] Zhang T C, Bezbaruah A N. Quantification of oxygen release by bulrush (Scirpusvalidus) roots in a constructed treatment wetland. Biotechnology and Bioengineering, 2005, 89(3): 308- 318.
[33] Kludze H K, Delaune R D, Patrick W H. Aerenchyma formation and methane and oxygen exchange in rice. Soil Science Society of America Journal, 1993, 57(2): 386- 391.
[34] Kludze H K, Delaune R D. Soil redox intensity effects on oxygen exchange and growth of cattail and sawgrass. Soil Science Society of America Journal, 1996, 60(2): 616- 621.
[35] Matsui T, Tsuchiya T. A method to estimate practical radial oxygen loss of wetland plant roots. Plant and Soil, 2006, 279(1- 2): 119- l28.
[36] Inoue T M, Tsuchiya T. Interspecific differences in radial oxygen loss from the roots of three Typha species. Limnology, 2008, 9(3): 207- 211.
[37] Armstrong J, Armstrong W.Phragmitesaustralisa- A preliminary study of soil-oxidizing sites and internal gas transport pathways. New Phytologist, 1988, 108(4): 373- 382.
[38] Pi N, Tam N F Y, Wu Y, Wong M H. Root anatomy and spatial pattern of radial oxygen loss of eight true mangrove species. Aquatic Botany, 2009, 90(3): 222- 230.
[39] Laskov C, Horn O, Hupfer M. Environmental factors regulating the radial oxygen loss from roots ofMyriophyllumspicatumandPotamogetoncrispus. Aquatic Botany, 2006, 84(4): 333- 340.
[40] Sand-Jensen K, Revsbech N P, Barker Jørgensen B. Microprofiles of oxygen in epiphyte communities on submerged macrophytes. Marine Biology, 1985, 89(1): 55- 62.
[41] Christensen P B, Revsbech N P, Sand-Jensen K. Microsensor analysis of oxygen in the rhizosphere of the aquatic macrophyteLittorellauniflora(L.) Ascherson. Plant Physiology, 1994, 105(3): 847- 852.
[42] Gansert D, Burgdorf M, Lösch R. A novel approach to the in situ measurement of oxygen concentrations in the sapwood of woody plants. Plant, Cell and Environment, 2001, 24(10): 1055- 1064.
[43] Demas J N, DeGraff B A, Coleman P B. Oxygen sensors based on luminescence quenching. Analytical Chemistry News and Features, 1999, 71(23): 793A- 800A.
[44] Peterson J I, Fitzgerald R V, Buckhold D K. Fiber-optic probe for in vivo measurement of oxygen partial pressure. Analytical Chemistry, 1984, 56(1): 62- 67.
[45] Mcdonagh C M, Lowe P, Mongey K, MacCraith B D. Characterisation of porosity and sensor response times of sol-gel derived thin films for oxygen sensor applications. Journal of Non-Crystalline Solids, 2002, 306(2): 138- 148.
[46] Xu W Y, Kneas K A, DeGraff B A. Oxygen sensors based on luminescence quenching of metal complexes: osmium complexes suitable for laser diode excitation. Analytical Chemistry, 1996, 68(15): 2605- 2609.
[47] Jørgensen B B, Marais D J D. The diffusive boundary layer of sediments: oxygen microgradients over a microbial mat. Limnology and Oceanography, 1990, 35(6): 1343- 1355.
[48] Rasmussen H, Jørgensen B B. Microelectrode studies of seasonal oxygen uptake in a coastal sediment: Role of molecular diffusion. Marine Ecology Progress Series, 1992, 81(3): 289- 303.
[49] Lansard B, Rabouille C, Massias D. Variability in benthic oxygen fluxes during the winter-spring transition in coastal sediments: an estimation by in situ micro-electrodes and laboratory mini-electrodes. Oceanologica Acta, 2003, 26(3): 269- 279.
[50] 王文林, 王国祥, 万寅婧, 夏劲, 唐晓燕, 陈昕, 梁斌, 庄巍. 光照和生长阶段对菖蒲根系泌氧的影响. 生态学报, 2013, 33(12): 3688- 3696.
[51] Wang W L, Han R M, Wan Y J, Liu B, Tang X Y, Liang B, Wang G X. Spatio-temporal patterns in rhizosphere oxygen profiles in the emergent plant speciesAcoruscalamus. PLoS ONE, 2014, 9(5): e98457.
[52] Pedersen O, Borum J, Duarte C M, Fortes M D. Oxygen dynamics in the rhizosphere ofCymodocearotundata. Marine Ecology Progress Series, 1998, 169: 283- 288.
[53] Jensen S I, Kuhl M, Glud R N, Jørgensen L B, Priemé A. Oxic microzones and radial oxygen loss from roots ofZosteramarina. Marine Ecology Progress Series, 2005, 293(1): 49- 58.
[54] Frederiksen M S, Glud R N. Oxygen dynamics in the rhizosphere ofZosteramarina: A two-dimensional planar optode study. Limnology and Oceanography, 2006, 51(2): 1072- 1083.
[55] Lee S K, Okura I. Photoluminescent determination of oxygen using metalloporphyrin-polymer sensing systems. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 1998, 54(1): 91- 100.
[56] Cao Z R, Zhu Q Z, Aller R C, Aller J Y. A fluorosensor for two-dimensional measurements of extracellular enzyme activity in marine sediments. Marine Chemistry, 2011, 123(1- 4): 23- 31.
[57] 刘志宽, 马青兰, 牛快快. 湿地植物根系泌氧及其在湿地处理中的应用. 海南师范大学学报: 自然科学版, 2010, 23(1): 84- 86, 92- 92.
[58] Visser E J W, Colmer T D, Blom C W P M, Voesenek L A C J. Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono- and dicotyledonous wetland species with contrasting types of aerenchyma. Plant, Cell and Environment, 2000, 23(11): 1237- 1245.
[59] Grosse W, Buchel H B, Tiebel H. Pressurized ventilation in wetland plants. Aquatic Botany, 1991, 39(1- 2): 89- 98.
[60] Brix H, Sorrell B K, Orr P T. Internal pressurization and convective gas-flow in some emergent fresh-water macrophytes. Limnology and Oceanography, 1992, 37(7): 1420- 1433.
[61] Waters I, Armstrong W, Thompson C J, Setter T L, Adkins S, Gibbs J, Greenway H. Diurnal changes in radial oxygen loss and ethanol metabolism in roots of submerged and non-submerged rice seedlings. New Phytologist, 1989, 113(4): 439- 451.
[62] Caffrey J M, Kemp W M. Seasonal and spatial patterns of oxygen production, respiration and root-rhizome release inpotamogetonperfoliatusI andZosteramarinaL. Aquatic Botany, 1991, 40(2): 109- 128.
[63] Frenzel P, Rothfuss F, Conrad R. Oxygen profiles and methane turnover in a flooded rice microcosm. Biology and Fertility of Soils, 1992, 14(2): 84- 89.
[64] Tanaka N, Yutani K, Aye T, Jinadasa K B S N. Effect of broken dead culms ofPhragmitesaustralison radial oxygen loss in relation to radiation and temperature. Hydrobiologia, 2007, 583(1): 165- 172.
[65] 赵锋, 王丹英, 徐春梅, 张卫建, 李凤博, 毛海军, 章秀福. 根际增氧模式的水稻形态、生理及产量响应特征. 作物学报, 2010, 36(2): 303- 312.
[66] Armstrong J, Armstrong W. Rice and Phragmites: Effects of organic acids on growth, root permeability, and radial oxygen loss to the rhizosphere. American Journal of Botany, 2001, 88(8): 1359- 1370.
[67] Hose E, Clarkson D T, Stendle E, Schreiber L, Hartung W. The exodermis: a variable apoplastic barrier. Journal of Experimental Botany, 2001, 52(365): 2245- 2264.
[68] 汪晓丽, 司江英, 陈冬梅, 封克. 低pH条件下不同氮源对水稻根通气组织形成的影响. 扬州大学学报: 农业与生命科学版, 2005, 26(2): 66- 70.
[69] Colmer T D, Cox M C H, Voesenek L A C J. Root aeration in rice (Oryzasativa): Evaluation of oxygen, carbon dioxide, and ethylene as possible regulators of root acclimatizations. The New Phytologist, 2006, 170(4): 767- 777.
[70] 邓丹, 吴可为, 邓泓. 根区通氧状况对水稻幼苗生长及吸收镉的影响. 生态学报, 2009, 29(5): 2520- 2526.
[71] 刘春英, 陈春丽, 弓晓峰, 周文斌, 杨菊云. 湿地植物根表铁膜研究进展. 生态学报, 2014, 34(10): 2470- 2480.
[72] Møller C L, Sand-Jensen K. Iron plaques improve the oxygen supply to root meristems of the freshwater plant,Lobeliadortmanna. The New Phytologist, 2008, 179(3): 848- 856.
[73] Taylor G J, Crowder A A, Rodden R. Formation and morphology of an iron plaque on the roots ofTyphalatifoliaL. grown in solution culture. American Journal of Botany, 1984, 71(5): 666- 675.
[74] Batty L C, Baker A J M, Wheeler B D, Curtis C D. The effect of pH and plaque on the uptake of Cu and Mn inPhragmitesaustralis(Cav.) Trin ex. Steudel. Annals of Botany, 2000, 86(3): 647- 653.
[75] Batty L C, Baker A J M, Wheeler B D. Aluminium and phosphate uptake byPhragmitesaustralis: The role of Fe, Mn and Al root plaques. Annals of Botany, 2002, 89(4): 443- 449.
[76] Liu H J, Zhang J L, Zhang F S. Role of iron plaque in Cd uptake by and translocation within rice (OryzasativaL.) seedlings grown in solution culture. Environmental and Experimental Botany, 2007, 59(3): 314- 320.
[77] Armstrong J, Armstrong W. Rice: Sulfide-induced barriers to root radial oxygen loss, Fe2+and water uptake, and lateral root emergence. Annals of Botany, 2005, 96(4): 625- 638.
[78] Revsbech N P, Pedersen O, Reichardt W, Briones A. Microsensor analysis of oxygen and pH in the rice rhizosphere under field and laboratory conditions. Biology and Fertility of Soils, 1999, 29(4): 379- 385.
[79] 夏劲, 王国祥, 王文林, 刘波. 慈姑(Sagittariatrifolia)根系泌氧特征. 生态与农村环境学报, 2012, 28(4): 422- 426.
[80] Pedersen O, Sand-Jensen K, Revsbech N P. Diel pulses of O2and CO2in sandy lake sediments inhabited byLobeliadortmanna. Ecology, 1995, 76(5): 1536- 1545.
[81] Pedersen O, Sand-Jensen K. Adaptations of submergedLobeliadortmannato aerial life form: morphology, carbon sources and oxygen dynamics. Oikos, 1992, 65(1): 89- 96.
[83] Smith R D, Dennison W C, Alberte R S. Role of seagrass photosynthesis in root aerobic processes. Plant Physiology, 1984, 74(4): 1055- 1058.
[84] Blossfeld S, Gansert D, Thiele B, Kuhn A J, Lösch R. The dynamics of oxygen concentration, pH value, and organic acids in the rhizosphere ofJuncusspp. Soil Biology and Biochemistry, 2011, 43(6): 1186- 1197.
[85] Schreiber C M, Zeng B, Blossfeld S, Rascher U, Kazda M, Schurr U, Höltkemeier A, Kuhn A J. Monitoring rhizospheric pH, oxygen, and organic acid dynamics in two short-time flooded plant species. Journal of Plant Nutrition and Soil Science, 2012, 175(5): 761- 768.
[86] 项学敏, 宋春霞, 李彦生, 孙祥宇. 湿地植物芦苇和香蒲根际微生物特性研究. 环境保护科学, 2004, 30(4): 35- 38.
[87] 江福英, 陈昕, 罗安程. 几种植物在模拟污水处理湿地中根际微生物功能群特征的研究. 农业环境科学学报, 2010, 29(4): 764- 768.
[88] 戴媛媛, 杨新萍, 周立祥. 芦苇根际微环境对潜流人工湿地氮与COD去除性能的影响. 环境科学, 2008, 29(12): 3387- 3392.
[89] DeJournett T D, Arnold W A, LaPara T M. The characterization and quantification of methanotrophic bacterial populations in constructed wetland sediments using PCR targeting 16S rRNA gene fragments. Applied Soil Ecology, 2007, 35(3): 648- 659.
[90] 陈永华, 吴晓芙, 陈明利, 张珍妮, 李科林, 王忠诚, 雷电. 人工湿地污水处理系统中植物套种模式根际微生物多样性研究. 环境科学, 2011, 32(8): 2397- 2402.
[91] 陈永华, 吴晓芙, 张珍妮, 蒋丽娟, 李科林, 柳俊. 人工湿地不同季节与单元之间根际微生物多样性. 生态学报, 2012, 32(22): 7247- 7254.
Research advancements on the radial oxygen loss in wetland plants and its diffusion effect in natural sediments
WANG Wenlin1,2, HAN Ruiming2, WANG Guoxiang2,*, TANG Xiaoyan1, LIANG Bin1
1NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China2JiangsuKeyLaboratoryofEnvironmentalChangeandEcologicalConstruction,CollegeofGeographicalScience,NanjingNormalUniversity,Nanjing210023,China
Radial oxygen loss (ROL) generated by wetland plants is the fundamental factor that maintains the heterogeneous oxidation-reduction microcosm in sediments. The subsequent diffusion layer provides fine microhabitats for both aerobic and anaerobic microorganisms and stimulates their metabolism, which makes the rhizosphere a superior active site for various processes including organism degradation, material circulation, and vigorous life activities. The intensity of ROL in the roots of wetlands plants is known to considerably affect the efficacy of pollutant removal. It is thus of special importance to investigate ROL in wetland plants and its diffusion effect to better understand the actual rhizosphere oxygen distribution and the underlying mechanisms of ROL generation, as well as to optimize the utilization of wetland plants for pollutant removal. The present review, therefore, aims at (1) summarizing the research advancements on the characteristics of ROL and the related influential impact factors on root oxygen supply; (2) deciphering the current knowledge on the diffusion effect of rhizosphere oxygen in terms of species differences, spatio-temporal distribution, and its regulating effects on microorganisms; and (3) raising perspectives on future research issues based on the pros and cons of quantification approaches to ROL. The existing research has comprehensively compared the ROL in different types of wetland plants in artificial substrates such as agar medium and nutrient solutions. The results have established a reference for choosing wetland plants for pollutant removal, suggesting that the level of ROL is closely related to oxygen supply and whether the oxygen transportation pathway is unobstructed. Meanwhile, the oxygen supply is mainly related to factors including irradiance, ventilation, temperature, and the biomass of shoots, and the inner oxygen transportation in plants and its external release are mainly related to the oxidation-reduction condition in substrates, root age, iron plaque, nitrogen in substrates, and the levels of sulfide and organic acids. Due to the restraints of measuring approaches, the above-mentioned work did not test the inner oxygen concentrations of roots at the same time, so it is difficult to disclose the mechanisms of oxygen supply in roots. Further, wetland plants commonly grow in sediments where the oxidized rhizosphere is the combined outcome of both ROL and depletion by sedimentary organic matter. The current knowledge may not be sufficient to indicate the real root oxygen release of wetland plants in sediments.Since the ROL diffusive layer is normally a few millimeters thick, and owing to the complexity of sediment, research on the diffusion effect of ROL in wetland plants has progressed slowly. With the application of techniques like microelectrodes, micro-optodes, and planar-optodes, as well as other one- and two-dimensional methods, it has become feasible to measure the micro-spatial and temporal distribution of real root oxygen circumstances. This has demonstrated that the rhizospheric oxygen concentrations at different root positions have different patterns in wetland plants than in artificial substrates. However, the features of oxygen diffusion in different substrates, especially the continuous oxygen changes under long-term scales, are still poorly known, and studies on the effect of ROL on microbial communities at the rhizospheric scale are rare. The feasibility of the non-destructiveinsitudetection of ROL is undoubtedly the current bottleneck. Therefore, it is important to advance methodological studies, study the spatio-temporal characteristics of rhizosphere oxygen conditions in wetland plants and the impact of oxygen diffusion on rhizosphere microbes, and elucidate the regulating mechanisms of ROL on microorganisms to offer theoretical support for maximizing the capacity of wetland plants in pollutant removal. The innovative points of the present review are that (1) it describes the environmental and biological factors associated with the oxygen supply, transportation, and release pathway and the underlying mechanisms affecting these; and (2) emphasizes the currently available detection approaches for measuring rhizosphere oxygen diffusion.
wetland plants; rhizosphere; radial oxygen loss (ROL); natural sediment; diffusion effect
国家水体污染控制与治理科技重大专项 (2012ZX07506-007,2014ZX07101-012); 浙江省环境污染控制技术研究重点实验室开放基金; 国家自然科学基金 (41173078); 江苏省自然科学青年基金项目(BK20140922)
2014- 03- 05;
日期:2015- 04- 20
10.5846/stxb201403050379
*通讯作者Corresponding author.E-mail: wangguoxiang@njnu.edu.cn
王文林,韩睿明,王国祥,唐晓燕,梁斌.湿地植物根系泌氧及其在自然基质中的扩散效应研究进展.生态学报,2015,35(22):7286- 7297.
Wang W L, Han R M, Wang G X, Tang X Y, Liang B.Research advancements on the radial oxygen loss in wetland plants and its diffusion effect in natural sediments.Acta Ecologica Sinica,2015,35(22):7286- 7297.

