绵羊CCNG1基因克隆及表达分析
高磊,沈敏,甘尚权,杨井泉,张译元
绵羊基因克隆及表达分析
高磊1,2,沈敏1,2,甘尚权1,2,杨井泉1,2,张译元1,2
1. 新疆农垦科学院畜牧兽医研究所,石河子 832000;2. 新疆兵团绵羊繁育生物技术重点实验室,石河子 832000
细胞周期蛋白cyclin G1(CCNG1)是一个重要的细胞周期调控因子,参与哺乳动物颗粒细胞增殖、卵母细胞成熟等繁殖生物学过程,但其在绵羊中鲜有报道。为了研究基因对绵羊发情调控以及季节性繁殖的影响,文章对绵羊基因进行了克隆和组织表达谱分析,利用Real-time PCR对该基因在多浪羊(常年发情)与中国美利奴羊(季节性繁殖)发情周期不同阶段性腺轴组织的表达变化进行了实时检测。获得了绵羊基因部分cDNA序列,其中编码区全长885 bp,编码294个氨基酸。CCNG1蛋白结构经预测存在多个磷酸化位点和蛋白激酶C磷酸化位点。基因在所检测绵羊各组织中均有表达,但在卵巢与肾脏中为高丰度表达;在不同绵羊品种发情周期不同阶段性腺轴组织的表达变化规律基本一致,卵巢、子宫、松果体、垂体均是在发情期达到峰值。但是在发情期和发情后期卵巢的表达量存在显著的品种间差异(<0.01)。研究结果表明,可能通过参与卵泡的生长发育继而达到对绵羊发情和季节性繁殖的调控。
绵羊;基因;克隆;表达;发情周期
细胞周期蛋白又称细胞周期素(Cyclins),是在细胞周期进程中发挥重要作用的一类特殊蛋白质。这类蛋白均拥有一个高度保守的结构域——细胞周期盒,通过这个特殊结构域,细胞周期蛋白与细胞周期素依赖性激酶(CDK)、细胞周期素依赖性激酶抑制剂(CKI)结合参与对细胞周期进程进行一系列精细而高度有序的调控[1]。目前,已发现有16个细胞周期蛋白家族成员,其中多个已被证实与哺乳动物卵母细胞成熟、颗粒细胞增殖、细胞生长、G1/S期的转换、细胞凋亡等生理过程密切相关[2~5]。细胞周期蛋白可能是卵巢及卵泡发育过程中重要的调控因子。
细胞周期素G1(Cyclin G1, CCNG1)是较晚发现的一个细胞周期蛋白。研究发现,基因在人和小鼠卵巢中呈高丰度表达;同时其表达与雌激素水平密切相关,推断可能在卵泡发育、颗粒细胞增殖、分化等过程扮演了重要的角色[6]。Liu等[7]研究显示,在小鼠各个时期卵泡的卵母细胞中均有表达,且随着卵泡发育成熟,其表达呈上升趋势;给予绒毛膜促性腺激素(Human chorionic gonadotropin, hCG)后,排卵前颗粒细胞中的表达水平显著降低;当颗粒细胞完全分化为黄体细胞后,mRNA水平进一步减弱。提示可能作为正调节因子参与卵母细胞减数分裂过程的调控和卵泡的发育。张惠等[8]研究发现,表达水平与hCG激素水平呈负相关,并以正调节因子参与颗粒细胞的增殖分化。另外,可能作为负调控因子参与子宫内膜上皮细胞的分化以及蜕膜化过程中基质细胞的增殖分化[9]。上述研究结果表明,在哺乳动物卵泡发育中可能扮演了重要的角色。但对于该基因确切的调控机制仍不明晰,其在绵羊卵泡发育以及发情调控中的作用尚未见相关报道。
本实验室前期通过构建多浪羊(常年发情)与中国美利奴羊发情期(季节性繁殖)卵巢组织抑制性消减杂交文库获得了与牛匹配的EST。结合前人的研究,推测可能是影响绵羊卵泡发育及发情周期调节的重要候选基因。基于此,本研究对绵羊CDS区序列进行了克隆并进行了组织表达谱分析,同时检测了发情周期不同阶段多浪羊和中国美利奴羊性腺轴组织(甲状腺、卵巢、子宫、松果体、下丘脑、垂体)mRNA的表达变化规律,为进一步了解绵羊完整的发情机制积累基础数据。
1 材料和方法
1.1 实验动物
选取3~4岁的多浪羊(常年发情)和中国美利奴羊(季节性繁殖)成年母羊各12只,进行统一饲养管理,通过早晚2次公羊试情,结合母羊阴道细胞类型分析[10],确定其发情周期。待其发情周期稳定之后,分别选取处于发情期(0~1.5 d)、发情后期(3~4 d)、发情间期(7~10 d)和发情前期(12~15 d)4个不同阶段的多浪羊与中国美利奴羊各3只,进行宰杀,迅速采集心脏、肝脏、脾脏、肺脏、肾脏、卵巢、子宫、淋巴结、小肠、下丘脑、甲状腺、松果体、垂体等组织样品,置液氮保存,以供备用。
1.2 方法
1.2.1 总RNA提取及cDNA合成
参照TRIzol Reagent (Invitrogen)说明书,分别提取多浪羊和中国美利奴羊各组织总RNA,0.7%琼脂糖凝胶电泳检测其完整性,并利用核酸蛋白分析仪测定RNA的浓度和纯度。cDNA第一链采用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) (TaKaRa)逆转录试剂盒进行合成。
1.2.2 绵羊cDNA的克隆
根据牛mRNA序列(GenBank登录号:BC150004)设计特异引物,由北京六合华大基因科技股份有限公司合成,引物序列及特征见表1。PCR扩增体系为25 µL,其中绵羊卵巢cDNA模板1 µL、10×Buffer 2.5 µL、dNTPs 2 µL、上下游引物(10 µmol/L)各0.5 µL、DNA聚合酶0.5 µL、ddH2O 18 µL。PCR扩增条件为:94℃预变性3 min;94℃变性30 s、 55℃复性30 s、72℃延伸45 s,共35个循环;最后再72℃延伸10 min。利用凝胶回收试剂盒(Promega)回收目的片段,并将其克隆到pMD19-T载体,转化DH5α感受态细胞,筛选阳性重组子,质粒提取后由北京六合华大科技股份有限公司进行测序。
1.2.3 生物信息学分析
利用DNAMAN 5.0软件进行序列拼接;使用Mega 5.0等软件构建CCNG1系统进化树,分析不同物种之间的序列差异;利用SMART软件预测CCNG1保守结构域;利用TMHMM Server 2.0、NetPhos 2.0 Serve、NetPhosK 1.0 Server软件预测CCNG1蛋白的跨膜结构域、磷酸化位点;利用signal 4.0、NetOGlyc4.0及NetNGlyc1.0软件预测信号肽、O糖基化位点及N糖基化位点。
1.2.4基因组织表达谱分析
根据克隆获得的绵羊基因的测序结果重新设计引物(表1),以发情期多浪羊的心脏、肝脏、脾脏、肺脏、肾脏、甲状腺、卵巢、子宫、淋巴结、小肠和下丘脑cDNA为模板进行半定量RT-PCR检测。以绵羊基因为参照,调整各组织cDNA初始模板浓度和最佳扩增循环数。PCR产物经琼脂糖凝胶电泳检测后,分别读取灰度值,并将持家基因与目的基因对应组织PCR产物的灰度值进行比较,分析基因在不同组织的相对表达量。
1.2.5 实时荧光定量PCR检测
分别以多浪羊和中国美利奴羊发情周期不同阶段的卵巢、子宫、松果体、下丘脑、垂体和甲状腺组织cDNA为模板,以绵羊为内参,进行实时荧光定量PCR检测,引物见表1。反应体系20 µL,其中:cDNA模板1 µL,SYBR® Premix Ex Taq (2×) (Tli RNaseH Plus) (TaKaRa)10 µL,上下游引物(10 mmol/L)各0.8 µL,ddH2O 7.4 µL。每个样品设3个生物学重复,并设置相应的阴性对照(扩增模板为双蒸水)。PCR扩增条件:95℃预变性30 s;95℃变性5 s、58℃复性20 s、72℃延伸20 s,共45个循环。扩增结束后,以0.1℃/s的速度进行溶解曲线分析。分别读取目的基因和持家基因的值,利用法(Qr=2-ΔΔCt)计算基因在不同品种绵羊发情周期不同阶段性腺轴组织mRNA的相对表达量。并利用SPSS(18.0)软件对定量数据进行单因素方差分析。
2 结果与分析
2.1 不同组织总RNA的提取
各组织样品总RNA经0.7 %变性琼脂糖凝胶电泳后,均可清晰见到18 S、28 S及5 S条带(图略),无蛋白和基因组污染。经核酸蛋白分析仪检测,所有样品的260/280均介于1.8~2.0之间。说明提取的总RNA具有较好的完整性,符合反转录要求。
2.2 绵羊CCNG1基因的克隆、测序及生物信息学分析
以多浪羊卵巢组织cDNA为模板,经克隆测序,获得一条长为2009 bp的目的片段(图略)。所获得的序列经与GenBank公布的牛基因序列比对,同源性高达96%,确定为绵羊基因(GenBank登录号:KC539855)。

表1 PCR引物信息
将获得的绵羊基因序列提交到UCSC (http://genome.ucsc.edu/)绵羊基因组数据库进行分析,结果表明,该基因位于绵羊5号染色体。所获序列包括32 bp的5′ UTR区、1092 bp的3′ UTR区以及885 bp的完整CDS区。其CDS区编码294个氨基酸,编码蛋白的分子量约为34 kDa,理论等电点(pI)为9.15(图1)。经DNAStar软件比对发现,绵羊CCNG1的氨基酸序列与山羊(预测)、牛、人、大鼠、小鼠等物种的同源性较高,分别为99.32 %、98.64%、93.90 %、90.51 %、90.17 %。结合系统进化树分析可以看出,绵羊与山羊、牛同处于一个分支上,亲缘关系最近(图2)。
蛋白保守结构域预测结果显示,绵羊CCNG1的细胞周期盒(Cyclin box)位于ORF 5′端135nt处,含有115个氨基酸。该周期盒序列与人、大鼠、小鼠、牛、猪等的同源性分别为98.26 %、97.39 %、97.39 %、99.13 %和98.26 %。在绵羊cyclin G1 N端没有发现“RXXL”基序和“SPXXXE/D”基序,这一结果与大鼠的研究结果一致。
Phyre软件预测结果表明,绵羊CCNG1蛋白存在12个a螺旋区域和1个β折叠区(图3)。磷酸化位点预测显示,绵羊CCNG1蛋白存在15个丝氨酸磷酸化位点、4个苏氨酸磷酸化位点、1个酪氨酸磷酸化位点以及一个特异性蛋白激酶磷酸化位点。糖基化位点及信号肽预测结果表明,CCNG1蛋白含有8个O糖基化位点,无N糖基化位点和信号肽。
“下划线”代表的是细胞周期蛋白盒。
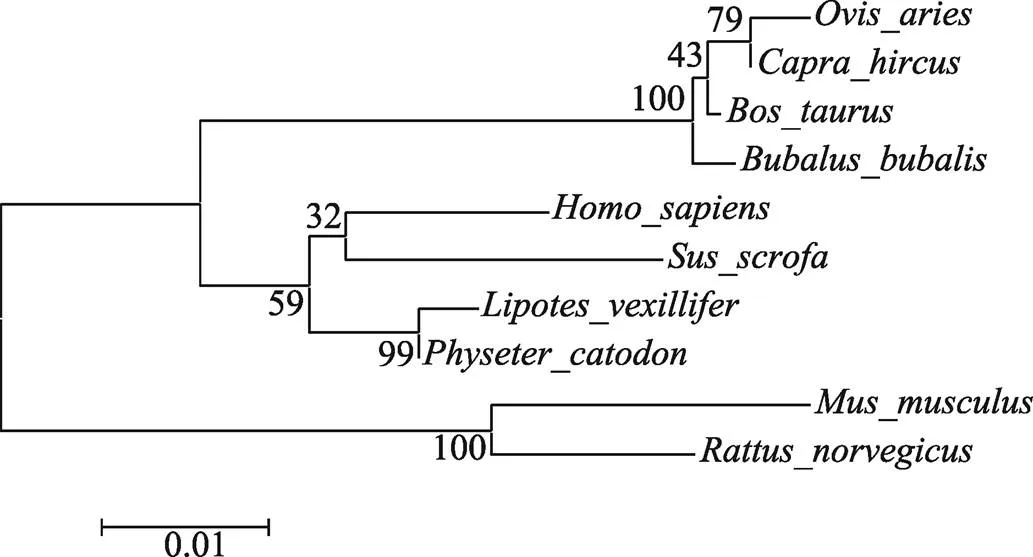
图2 不同物种CCNG1蛋白的系统进化树
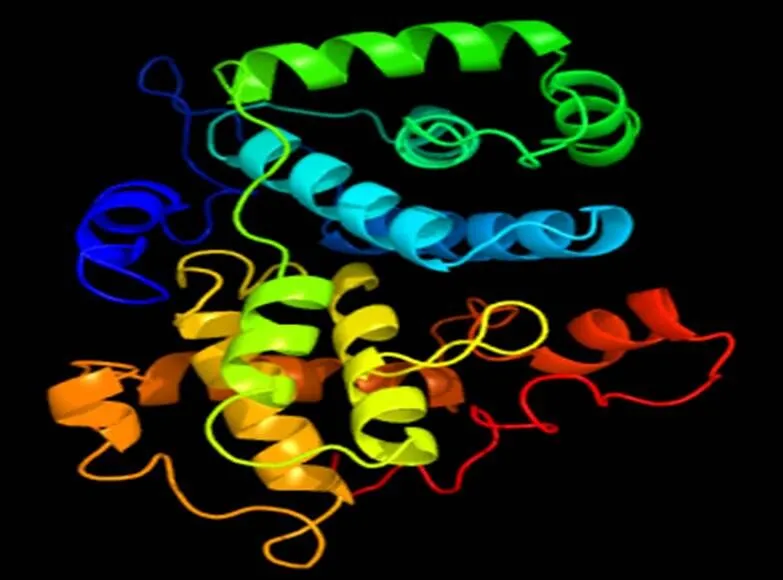
图3 绵羊CCNG1的三级结构预测
2.3 绵羊CCNG1基因的组织表达谱
半定量RT-PCR结果显示,基因在多浪羊的心脏、肝脏、脾脏、肺脏、肾脏、甲状腺、卵巢、子宫、淋巴结、小肠、下丘脑组织中均有表达,其中在卵巢和肾脏中表达丰度最高,其次是子宫、淋巴结、肝脏,在心脏、脾脏、肺脏、甲状腺、小肠及下丘脑中表达水平较低(图4)。
2.4 CCNG1在不同品种绵羊发情周期性腺轴组织的表达规律
从整个发情周期来看,不同绵羊品种性腺轴组织(卵巢、子宫、松果体、下丘脑和垂体)的mRNA表达规律基本一致:在发情前期表达水平较低,进入发情期后表达水平升高,到了发情后期表达水平仍然较高但相对于发情期有所降低,进入发情间期后表达水平下降到这个发情周期的最低点(图5)。但在表达丰度上,多浪羊和中国美利奴羊不同品种间存在较大差异:相对于甲状腺组织,中国美利奴羊性腺轴组织卵巢、子宫、下丘脑、松果体、垂体的表达水平在整个发情周期均低于甲状腺组织,表达丰度由高到低依次为:甲状腺、子宫、卵巢、垂体、松果体、下丘脑(图5B);多浪羊在发情前期性腺轴轴其他组织表达水平也是均低于甲状腺组织,但是进入到发情期和发情后期卵巢组织表达水平显著升高,表达水平分别达到甲状腺组织的2.2倍和1.7倍(<0.01),随后表达水平急剧下降,到发情间期表达水平为整个发情周期的最低点(图5A)。

图4 CCNG1在多浪羊发情期不同组织的半定量RT-PCR结果
另外,本文对不同绵羊品种发情周期不同阶段性腺轴组织表达水平也进行了比较(图6)。由图可见,贯穿整个发情周期,多浪羊除了子宫表达水平低于中国美利奴羊以外,其卵巢、松果体、垂体和下丘脑的表达量在多数时期都是高于中国美利奴羊。其中多浪羊的卵巢和松果体组织表达水平在发情前期、发情期和发情后期显著高于中国美利奴羊,而在发情间期品种间差异不大;多浪羊垂体组织在发情前期和发情期要显著高于中国美利奴羊(<0.05),但到了发情后期和发情间期,水平则低于中国美利奴羊,但品种间差异并不显著。在两个绵羊品种的整个发情周期中下丘脑的表达水平都非常低。

图5 不同绵羊品种发情周期性腺轴组织CCNG1表达变化
A:多浪羊;B:中国美利奴羊。

图6 不同绵羊品种发情周期不同阶段不同性腺轴组织CCNG1表达量的比较
同一品种不同组织相同小写字母表示差异不显著(>0.05),不同大写字母之间表示差异极显著(<0.01),不同小写字母之间表示差异显著(<0.05);*和**分别表示同一组织不同品种间差异显著(<0.05)和差异极显著(<0.01)。
3 讨 论
3.1 绵羊CCNG1基因及其蛋白结构特点
细胞周期蛋白盒(cyclin box)是细胞周期蛋白的特征性结构域,由一段长约110个氨基酸残基的高度保守的基序组成,主要负责结合CDKs[11]。目前所获得的不同物种的细胞周期蛋白均含有这一标志性结构[12~14]。本研究获得的绵羊CCNG1细胞周期蛋白盒序列与大鼠、牛等哺乳动物的相似度非常高,说明其具有高度保守性。
细胞周期蛋白的降解是细胞有丝分裂结束和进入下一个细胞周期的关键步骤,其N端结构对于细胞分裂中期的特异性降解是必需的[15]。其中位于细胞周期蛋白N端的降解框(Destruction box)主要参与由泛素介导的周期蛋白的降解,这是一段由9个氨基酸(RXXLGXIXN)组成的特殊序列,“RXXL”基序在cyclins以泛素化途径降解过程中发挥重要作用。通过分析蛋白质N端降解框的有无,可以初步判断该蛋白是否为持续表达。Tamura等[12]研究发现,大鼠CCNG1 N段含有一个典型的周期蛋白盒,但无降解框和PEST序列。本研究结果显示,绵羊CCNG1蛋白除含有细胞周期蛋白盒之外,也没有降解框和PEST序列,与来自大鼠的结果一致。说明绵羊CCNG1的稳定性较好,能够在细胞周期过程中持续表达。另外也进一步表明哺乳动物CCNG1不含有降解框和PEST序列的结构特点。
Tamura等[12]等研究表明,CCNG1氨基酸C端存在一段与人表皮生长因子受体(EGF-R)或禽类ErbB蛋白的酪氨酸磷酸化位点同源的自身磷酸化结构域,该结构域通过与p53结合行使调控功能。大鼠[13]、小鼠[14]、人[16]CCNG1的p53结合位点不同,提示这些功能性结合位点的差异可能在蛋白磷酸化或去磷酸化过程中起非常重要的作用。本研究结果表明,绵羊CCNG1存在15个丝氨酸磷酸化位点、4个苏氨酸磷酸化位点、1个酪氨酸磷酸化位点。初步推测这些磷酸化位点可能在细胞信号转导途径等方面扮演了重要的角色。
3.2 CCNG1在不同组织中的表达分析
是发现较晚的一种细胞周期素,目前对于它的确切功能还不是完全清楚。已知基因在人和小鼠的心脏、肝脏、骨骼肌、脾脏、肺脏、肾脏、肌肉、睾丸、胰腺、小肠、淋巴细胞、胃、大脑、卵巢等组织中均有表达,且在心脏、卵巢、肾脏和骨骼肌中表达丰度较高[5,17,18],表明该基因及其编码蛋白可能在这些组织器官的生长发育以及生理功能中发挥作用。本研究结果显示,在绵羊的心脏、肝脏、脾脏、肺脏、肾脏、甲状腺、卵巢、子宫、淋巴结、小肠、下丘脑等组织中均有表达,且在卵巢、骨骼肌和肾脏中为高丰度表达,这与上述研究结果较相近,说明基因具有广谱表达的特性。
3.3 CCNG1与绵羊繁殖性能的关系
本实验选择的多浪羊和中国美利奴羊均为新疆本地绵羊品种,二者在繁殖性能上存在明显差异,中国美利奴羊为典型的季节性繁殖,而多浪羊属于常年发情。本实验室前期通过构建这两个不同绵羊品种卵巢组织间抑制性消减文库,筛选到了一些差异表达基因,其中就包括基因。本研究结果进一步验证了之前文库筛选结果的准确性。为了进一步了解对绵羊繁殖性能的影响,本文重点针对不同品种绵羊发情周期不同阶段主要性腺轴组织(甲状腺、卵巢、子宫、下丘脑、松果体、垂体)的表达情况进行了实时荧光定量PCR检测。结果表明,在不同绵羊品种各组织中的表达谱基本一致,除下丘脑外,卵巢、子宫、松果体、垂体的表达量均是在发情期达到最高,其中尤以卵巢组织的表达变化最为显著,其在发情期和发情后期表达水平极显著高于发情间期和发情前期。发情期和发情后期是卵泡迅速发育、成熟排卵的时期,据毛文智等[19]报道,小尾寒羊发情期、发情后期(第一个卵泡波)的三级卵泡数量显著高于发情间期(<0.05);不同品种间,小尾寒羊的成熟卵泡数量显著高于东北细毛羊(<0.05)。已有研究表明,CCND2、CCNE、CCNB、CCNG1等多个细胞周期蛋白家族成员均参与了卵泡发育过程的调节[1~4]。Liu等[7]曾对CCNG1在不同发育阶段卵母细胞的表达变化进行了研究,发现处于生发泡时期(GV)小鼠卵母细胞表达较弱,当卵母细胞生发泡破裂(GVBD)后,mRNA以及蛋白水平较GV(减数分裂前期)期卵母细胞明显增强。本研究中,在绵羊有腔卵泡(三级卵泡和成熟卵泡)阶段表达水平显著升高。由此推测,可能作为一种正调节因子参与调控卵泡的生长发育和卵母细胞成熟过程。
卵巢卵泡的发生是相当精细、复杂的过程,受到多种基因的调控。促卵泡激素(FSH)、促黄体素(LH)以及雌激素等调控的卵泡颗粒细胞细胞周期的正常进行(主要指的是颗粒细胞的增殖与分化)对于卵泡发育、排卵以及黄体生成有着至关重要的作用,也是影响哺乳动物繁殖力高低的重要因素。激素通过调节一系列细胞周期进程相关调控因子,改变颗粒细胞的增殖进而达到对每一个卵泡发育的控制。结合本研究,两个绵羊品种在发情间期卵巢的表达水平均降到最低,推测可能是造成雌激素水平下降,孕酮分泌增加,进而导致卵泡颗粒细胞增殖减少,卵泡闭锁,黄体形成的原因之一。
在本研究中,我们还注意到常年发情的多浪羊在发情前期、发情期和发情后期卵巢组织的表达水平均极显著高于季节性繁殖的中国美利奴羊。但这种品种间的表达差异是否与二者繁殖特性上的差异,或者说与非繁殖季节启动原始卵泡发育的机制差异存在直接关系还不得而知。由于本次采样选择在9~11月份繁殖季节,未进行非繁殖季节的采样和检测分析,我们只能提出这种假设,希望在今后开展这部分的研究内容。
[1] Faradji F, Bloyer S, Dardalhon-Cuménal D, Randsholt NB, Peronnet F.Cyclin G coordinates cell growth and cell proliferation., 2011, 10(5): 805–818.
[2] Shimizu T, Hirai Y, Miyamoto A. Expression of cyclins and cyclin-dependent kinase Inhibitors in granulosa cells from bovine ovary., 2013, 48(5): e65–e69.
[3] Kolesarova A, Capcarova M, Sirotkin AV, Medvedova M, Kalafova A, Filipejova T, Kovacik J.assessment of molybdenum-induced secretory activity, proliferation and apoptosis of porcine ovarian granulosa cells., 2011, 46(2): 170–175.
[4] Cai L, Tu BP. Driving the cell cycle through metabolism., 2012, 28: 59–87.
[5] Horne MC, Goolsby GL, Donaldson KL, Tran D, Neubauer M, Wahl AF. Cyclin G1 and cyclin G2 comprise a new family of cyclins with contrasting tissue-specific and cell cycle-regulated expression., 1996, 271(11): 6050–6061.
[6] Jia JS, Xu SR. Present study on cyclin G1., 2004, 27(2): 129–133.
[7] Liu ZH, Zhang H, He YP, Zhang JH, Yue LM. Cyclin G1 expressing in mouse ovary and relating to follicular development., 2006, 37(6): 893–897.
[8] 张惠, 岳利民, 张金虎, 柳朝华, 何亚平. Cyclin G1在小鼠卵巢颗粒细胞的表达及调控. 四川生理科学杂志, 2006, 28(2): 54–56.
[9] Yue LM, Takiko D, Hou XN, Li ML, Wang HB, Nojima H, Dey S K, Das S K. Cyclin G1 and cyclin G2 are expressed in the periimpantation mouse uterus in a cell-specific and progesterone-dependent manne: Evidence for aberrant regulation with Hoxa-10 deficiencyr., 2005, 146(5): 2424–2433.
[10] 高磊, 甘尚权, 杨井泉, 沈敏. 多浪羊发情周期不同阶段阴道细胞变化观察. 黑龙江畜牧兽医, 2012, (21): 35–37.
[11] Nugent JH, Alfa CE, Young T, Hyams JS. Conserved structural motifs in cyclins identified by sequence analysis., 1991, 99(Pt 3): 669–674.
[12] Tamura K, Kanaoka Y, Jinno S, Nagata A, Ogiso Y, Shimizu K, Hayakawa T, Nojima H, Okayama H. Cyclin G: a new mammalian cyclin with homology to fission yeast Cig1., 1993, 8(8): 2113–2118.
[13] Zauberman A, Lupo A, Oren M. Identification of p53 target genes through immune selection of genomic DNA: The cyclin G gene contains two distinct p53 binding sites., 1995, 10(12): 2361–2366.
[14] Kimura SH, Kataoka TR, Endo Y, Nojima H. Genomic structure and chromosomal localization of mouse cyclin G1 gene., 1997, 46(3): 483–486.
[15] Glotzer M, Murray AW, Kirschner MW. Cyclin is degraded by the ubiquitin pathway., 1991, 349(6305): 132–138.
[16] Endo Y, Fujita T, Tamura K, Tsuruga H, Nojima H. Structure and chromosomal assignment of the human cyclin G gene., 1996, 38(1): 92–95.
[17] Jensen MR, Factor VM, Zimonjic DB, Miller MJ, Keck CL, Thorgeirsson SS. Chromosome localization and structure of the murine cyclin G1 gene promoter sequence., 1997, 45(2): 297–303.
[18] Liu ZP, Yue SJ, Chen XB, Kubin T, Braun T. Regulation of cardiomyocyte polyploidy and multinucleation by cyclinG1., 2010, 106(9): 1498–1506.
[19] 毛文智. 绵羊生殖周期卵巢形态学特点的研究[学位论文]. 长春: 吉林农业大学, 2007.
(责任编委: 蒋思文)
Molecular cloning and tissue expression of thegene in sheep
Lei Gao1,2, Min Shen1,2, Shangquan Gan1,2, Jingquan Yang1,2, Yiyuan Zhang1,2
Thegene encodes cyclin G1, which is an important cell cycle regulator and has been reported to be involved in reproductive biological processes, such as oocyte maturation and granule cell proliferation in mammals. But the study ofin sheep has been rarely reported. To examine the effects ofon estrous control and seasonal breeding in sheep, we first cloned and characterized the expression level of the sheepgene. Then by Real-time PCR, we detected and analyzed the expressions ofgene at mRNA levels in the hypothalamus-pituitary-ovary (HPO) axis in different stages of an estrous cycle in Duo Lang sheep (non-seasonal breeding) and Merino sheep (seasonal breeding). The results showed that the open reading frame of the sheepgene is 885 bp in length and encodes 294 amino acids. Bioinformatic analysis indicated that the secondary structure of the sheep CCNG1 protein contained multiple phosphorylation sites and some Protein Kinase C phosphorylation sites.mRNA was identified in all tissues tested, with the levels in ovary and kidney higher than others. The expression profiles ofin the HPO axis in different stages of an estrous cycle were similar in different sheep breeds: the expression levels ofin the ovary, uterus, pineal gland and pituitary gland all peaked in the estrus phase. But there were significant differences for expression change extent ofin ovaries in the oestrus and metestrus phase between different sheep breeds. The results suggested thatprobably participated in the regulation of estrous behavior and seasonal reproduction through controling the growth and development of follicles in sheep.
sheep;; cloning; expression; estrous cycle
2014-12-09;
2015-02-13
“973”前期研究专项(编号:2009CB125907),国家自然科学基金项目(编号:30960249),兵团种质资源创新与功能基因发掘及利用专项(编号:2012BB044)和新疆农垦科学院青年科学基金项目(编号:YQJ201315)资助
高磊,硕士,助理研究员,研究方向:动物分子遗传。E-mail: w.n007@163.com
沈敏,研究员,博士,研究方向:动物分子遗传。E-mail: shenmin0993@sina.com
10.16288/j.yczz.14-436
2015-3-11 9:20:51
http://www.cnki.net/kcms/detail/11.1913.R.20150311.0920.005.html

