白喉乌头的化学成分研究Δ
汪 芳,赵 军,赵翡翠,聂继红#(1.新疆医科大学中医学院,乌鲁木齐 80011;.新疆维吾尔自治区药物研究所/维吾尔药重点实验室,乌鲁木齐 80004;.新疆医科大学附属中医医院药学部,乌鲁木齐 80000)
白喉乌头的化学成分研究Δ
汪 芳1*,赵 军2,赵翡翠3,聂继红3#(1.新疆医科大学中医学院,乌鲁木齐 830011;2.新疆维吾尔自治区药物研究所/维吾尔药重点实验室,乌鲁木齐 830004;3.新疆医科大学附属中医医院药学部,乌鲁木齐 830000)
目的:研究白喉乌头的化学成分。方法:采用硅胶、Sephadex LH-20等色谱技术分离纯化白喉乌头中的化学成分,根据波谱数据和理化性质进行结构鉴定。结果与结论:共鉴定出了5个化合物,分别为Delvestidine(1)、高乌甲素(2)、N-去乙酰高乌甲素(3)、氨茴酰牛扁碱(4)、冉乌碱(5)。其中,化合物1、5为首次从白喉乌头中获得。
白喉乌头;生物碱;化学成分
*硕士研究生。研究方向:中药复方制剂的开发。E-mail:w fang9009@163.com
#通信作者:教授,主任药师,硕士生导师。研究方向:新药研发。电话:0991-5810646。E-mail:xjnjh411@163.com
白喉乌头Aconitum leucostomumWorosch.为毛茛科乌头属的多年生草本植物,主要分布于甘肃、新疆以及东北地区[1]。该药材根部供药用,其性味辛、苦,大热,有毒,具祛风散寒、消肿止痛、通经活络之功,一般用于风寒湿痹等疾患的治疗,收载于《哈萨克药志》等医药文献中[2]。此外,白喉乌头在草场上广泛生长,在严重危害牲畜生产与健康的同时,也会严重降低草地的品质和质量,继而制约畜牧业生产。若能将这种具有显著药用价值的植物进行了规范性利用与开发,将有利于牧区经济发展。为此,本研究对白喉乌头根进行了系统的化学成分研究。
1 材料
1.1 仪器
INOVA-600和400型超导核磁共振仪(美国VARIAN公司);WHF-203B暗箱式紫外分析仪(上海精科实业有限公司)。
1.2 试剂
硅胶(200~300目,青岛海洋化工);Sephadex LH-20凝胶(Amersham Pharmacia Biotech AB公司);硅胶G(青岛海洋化工);所用试剂均为分析纯。
1.3 药材
白喉乌头于2012年采自新疆伊犁州尼勒克县,经新疆维吾尔自治区中医院李永和教授鉴定为白喉乌头A.leucostomumWorosch.的干燥根。样品保存于新疆维吾尔自治区中医院药研室。
2 方法与结果
2.1 提取与分离
取白喉乌头根药材10.0 kg,粉碎,过20目筛,用95%乙醇冷浸提取,提取液经薄膜蒸发浓缩后以2%HCl混悬,石油醚萃取脱脂;剩余水液用氨水调pH至4,用二氯甲烷萃取,合并二氯甲烷萃取液,得pH为4的部位;水层用氨水调pH至8,用二氯甲烷萃取,合并二氯甲烷萃取液,得pH为8的部位;水层用10%NaOH调pH至11,用二氯甲烷萃取,得pH为11的部位;水层再用饱和正丁醇萃取,得正丁醇部位。将上述不同部位分别经反复硅胶、Sephadex LH-20凝胶柱色谱、结合重结晶等方式进行分离。其中,pH为4的部位经硅胶(200~300目)柱,用石油醚-乙酸乙酯-二乙胺(10∶1∶0.5~5∶5∶0.5,V/V/V)梯度洗脱:用石油醚-乙酸乙酯-二乙胺(10∶1∶0.5,V/V/V)洗脱的第4~9组分合并后经硅胶H柱、用石油醚-乙酸乙酯-二乙胺(20∶1∶0.5,V/V/V)洗脱得化合物1(748.0mg);用石油醚-乙酸乙酯-二乙胺(9∶1∶0.5,V/V/V)洗脱的第2~8组分中得到化合物2(18.887 8 g),第11~16组分合并后经ODS反相硅胶柱,用甲醇-水(7∶3,V/V)洗脱得到化合物3(8.037 3 g);用石油醚-乙酸乙酯-二乙胺(8∶2∶0.5,V/V/V)洗脱的第10~14组分合并后经硅胶(200~300目)柱、石油醚-乙酸乙酯-二乙胺(7∶3∶0.5,V/V/V)洗脱的第4~8组分得化合物5(300mg)。取pH为8的部位经硅胶(200~300目)柱、用石油醚-乙酸乙酯-二乙胺(10∶1∶0.5~5∶5∶0.5,V/V/V)梯度洗脱:由石油醚-乙酸乙酯-二乙胺(8∶2∶0.5,V/V/V)洗脱的第11~15组分合并后,经Sephadex LH-20凝胶柱色谱、用石油醚-三氯甲烷-甲醇(5∶5∶1,V/V/V)洗脱纯化得化合物4(315.3mg)。pH为11的部位与正丁醇部位待进一步分离。
2.2 结构鉴定
化合物1:白色粉末,碘化铋钾反应呈阳性。分子式:C33H48N2O8。1H NMR(400 MHz,CDCl3)δ:1.07(3H,t,J=36.8 Hz,N—CH2CH3),2.70(1H,s,H-17),3.23、3.35、3.37、3.46、3.47(各3H,s,—OCH3),3.67(1H,s,14-βH),5.73(1H,s,—NH2),6.65(1H,t,J=15.6 Hz,Ar-H),7.82(1H,d,J=8 Hz,Ar-H)。13C NMR(100 MHz,CDCl3)δ(ppm):14.85(C-22),25.59(C-2),27.92(C-12),28.04(C-15),31.89(C-3),37.70(C-4),37.97(C-13),0.48(C-5),46.71(C-10),47.55(C-11),51.81(C-21),51.92(C-9),53.27(C-19),54.36(C-8′),55.60(C-1′),56.42(C-16′),57.65(C-14′),59.81(C-6′),66.24(C-17),69.51(C-18),80.71(C-8),82.81(C-16),83.11(C-14),83.43(C-1),90.11(C-7),91.37(C-6),10.76(C-1″),116.25(C-5″),116.72(C-3″),131.08(C-6″),134.12(C-4″),150.58(C-2″),167.96(C=O)。以上数据与文献[3]中的Delvestidine基本一致,13C核磁共振谱化学位移基本一致,故确定该化合物为Delvestidine。
化合物2:白色方晶,碘化铋钾反应呈阳性。熔点(mp)
208~210℃。分子式:C32H44N2O8。1H NMR(400 MHz,CDCl3)δ:1.13(3H,t,J=6.8 Hz,N—CH2CH3),2.23(3H,s,—COCH3),3.32(6H,s,—OCH3×2),3.42(3H,s,—OCH3),7.03(1H,td,J1=1.2 Hz,J2=8.4 Hz,H-5″,Ar-H),7.50(1H,td,J1=1.6 Hz,J2=8.4 Hz,H-4″,Ar-H),7.93(1H,dd,J1=8 Hz,J2=1.2 Hz,H-3″,Ar-H),8.67(1H,d,J=8.4Hz,H-6″,Ar-H),11.06(1H,s,NHCOCH3);13C NMR(100 MHz,CDCl3)δ(ppm):13.56(C-22),24.14(C-12),25.56(NHCOCH3),26.23(C-2),26.81(C-6),31.87(C-3),36.32(C-13),44.89(C-15),47.58(C-7),48.58(C-5),49.01(C-21),49.90(C-10),50.98(C-11),55.72(C-19),56.35(C-16′),56.14(C-1′),57.94(C-14′),61.55(C-17),75.65(C-8),78.57(C-9),82.90(C-16),84.19(C-1),84.62(C-4),90.15(C-14),115.78(C-1″),20.22(C-3″),122.33(C-5″),131.08(C-6″),134.38(C-4″),141.65(C-2″),167.42(A rCO),169.04(NHCOCH3)。以上数据与从高乌头A. sinomontanumNakai中分离的高乌甲素基本一致,13C核磁共振谱化学位移基本一致,故确定该化合物为高乌甲素[4]。
化合物3:白色无定形粉末,碘化铋钾反应呈阳性。mp 202~204℃。分子式:C30H42N2O7。1H NMR(400 MHz,CDCl3)δ(ppm):1.11(3H,t,J=7.2Hz,N—CH2CH3),2.99(1H,s,H-17),3.30(3H,s,—OCH3),3.32(3H,s,—OCH3),3.41(3H,s,—OCH3),5.64(2H,s,—NH2),6.60(2H,m),7.22(1H,t,J=15.2 Hz),7.76(1H,d,J=8.4 Hz,Ar-H);13C NMR(100 MHz,CDCl3)δ:13.58(C-22),24.08(C-12),26.26(C-2),26.83(C-6),31.98(C-3),36.33(C-13),44.87(C-15),47.56(C-7),48.83(C-5),49.01(C-10),49.85(C-21),50.86(C-11),55.66(C-19),56.12(C-16′),56.53(C-1′),57.93(C-14′),61.62(C-17),75.69(C-8),78.58(C-9),82.90(C-1),82.94(C-16),84.41(C-4),90.19(C-14),111.95(C-1″),116.25(C-5″),116.63(C-3″),131.55(C-6″),133.80(C-4″),150.39(C-2″),167.37(ArCO)。以上数据与从高乌头A.sinomontanumNakai中分离的N-去乙酰高乌甲素基本一致,13C核磁共振谱化学位移基本一致,故确定该化合物为N-去乙酰高乌甲素[4]。
化合物4:白色粉末,碘化铋钾反应呈阳性。mp 165~167℃。分子式:C32H46N2O8。1H NMR(400 MHz,CDCl3)δ:1.07(3H,t,J=16 Hz,N—CH2CH3),3.26、3.34、3.35、3.42(各3H,s,—OCH3),3.61(3H,t,J=8 Hz,14-βH),3.92(1H,br,s,8-αH),4.00、4.13(各1H,s,18-H),5.74(2H,br,s,NH2),6.67、7.29(各1H,t,J=16 Hz,Ar-H),7.81(1H,d,J=8 Hz,Ar-H);13CNMR(100MHz,CDCl3)δ(ppm):14.10(C-22),26.17(C-2),28.73(C-12),32.26(C-3),33.59(C-15),37.58(C-4),38.27(C-13),43.25(C-5),46.15(C-10),49.08(C-11),50.34(C-9),51.03(C-21),52.46(C-19),55.82(C-1′),56.31(C-16′),57.85(C-6′),57.99(C-14′),64.55(C-17),68.63(C-18),77.54(C-8),82.59(C-16),83.94(C-14),84.06(C-1),88.51(C-7),90.90(C-6),110.33(C-1″),116.30(C-5″),116.84(C-3″),130.73(C-6″),134.33(C-4″),150.73(C-2″),167.81(C=O)。以上数据与从草乌A.kusnezoffiiReichb.中分离得到的氨茴酰牛扁碱基本一致,13C核磁共振谱化学位移基本一致,故确定该化合物为氨茴酰牛扁碱[5]。
化合物5:白色粉末,碘化铋钾反应呈阳性。mp.(130~132)℃。分子式:C32H44N2O9,1H NMR(400 MHz,CDCl3)δ:1.13(3H,t,J=16 Hz,N—CH2CH3),2.23(1H,s,NHCOCH3),3.33(3H,s,—OCH3),3.35(3H,s,—OCH3),3.43(3H,s,—OCH3),7.01(3H,t,J=12 Hz),7.41(1H,t,J=8 Hz),7.94(1H,d,J=8 Hz),8.67(1H,d,J=8 Hz,Ar-H),11.05(1H,br,s,加D2O消失,NHAc);13CNMR(100MHz,CDCl3)δ:14.55(C-22),25.55(NHCOCH3),25.94(C-12),26.58(C-2),31.64(C-3),32.54(C-6),36.68(C-13),38.05(C-15),48.65(C-5),49.64(C-10),51.12(C-21),51.39(C-11),55.23(C-19),56.22(C-1′),56.22(C-16′),57.97(C-14′),63.07(C-17),77.89(C-8),78.27(C-9),82.76(C-16),83.46(C-1),84.26(C-4),85.43(C-7),89.96(C-14),115.71(C-1″),120.24(C-3″),122.34(C-5″),131.53(C-6″),134.41(C-4″),141.64(C-2″),167.46(ArCO),169.06(NHCOCH3)。以上数据与从高乌头A.sinomontanumNakai中分离的冉乌碱基本一致,13C核磁共振谱化学位移基本一致,故鉴定该化合物为冉乌碱[4]。
化合物1~5的结构见图1。
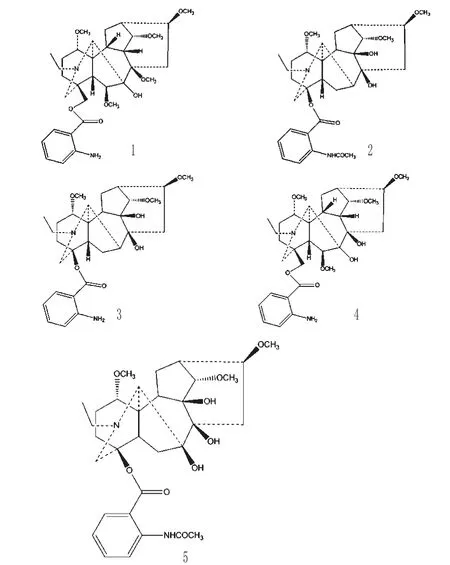
图1 5种化合物的化学结构Fig 1 Chem icalstructuresof 5 compounds
3 结论
本研究从白喉乌头中分离得到5个生物碱,分别为:Delvestidine(1)、高乌甲素(2)、N-去乙酰高乌甲素(3)、氨茴酰牛扁碱(4)、冉乌碱(5),其中化合物1、5为首次从该植物中获得。
致谢:本研究中的核磁共振波谱由中国科学院新疆理化技术研究所理化测试中心代测。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第27卷[M].北京:科学出版社,1979:113-326.
[2] 徐新,巴哈尔古丽·黄尔汗.哈萨克药志:一卷[M].北京:民族出版社,2009:45-47.
[3] Sam ir AR,Pelletier SW.New norditerpenoid alkaloids from Aconium septentrlonale[J].Tetrahedron,1992,48(7):1 183.
[4] 彭崇胜,王建忠,简锡贤,等.高乌头和彭州岩乌头中生物碱成分的研究[J].天然产物研究与开发,2000,12(4):45.
[5] 李正邦,吕光华,陈东林,等.草乌中生物碱的化学研究[J].天然产物研究与开发,1997,9(1):9.
(编辑:孙 冰)
Study on the Chem icalConstituentsofAconitum leucostomum
WANG Fang1,ZHAO Jun2,ZHAO Fei-cui3,NIE Ji-hong3(1.College of TCM,Xinjiang Medical University,Urumqi 830011,China;2.Xinjiang Institute of Materia Medica/Xinjiang Key Laboratory for Uyghur Medicines,Urumqi 830004,China;3.Dept.of Pharmacy,A ffiliated Chinese Traditional Medicine Hospital,Xinjiang Medical University,Urumqi830000,China)
OBJECTIVE:To study the chem ical constituents ofAconitum leucostomum.METHODS:The chem ical constituents ofA.leucostomumwere isolated and purified by silica gel and Sephadex LH-20 chromatography,etc..The structures were identified according to spectral data and physicochem ical properties.RESULTS&CONCLUSION:A total of 5 compounds were identified,including delvestidine(1),lappaconitine(2),N-deacetylase lappaconitine(3),anthranoyllycoctonine(4),ranaconitine(5). Compound 1 and 5 are isolated from this plant for the first time.
Aconitum leucostomum;A lkaloids;Chem ical constituents
R284.1
A
1001-0408(2015)09-1233-03
DOI 10.6039/j.issn.1001-0408.2015.09.28
国家自然科学基金(No.81160498)
2014-08-22
2015-01-04)

