长链非编码RNA作为潜在药物靶点的研究进展
张文辉,李加宇,杨世华,王晓刚
(1.暨南大学生物医药研究院, 广东 广州510632;2.华南农业大学广东省兽医临床重大疾病综合防控实验室, 广东 广州510632)
长链非编码RNA作为潜在药物靶点的研究进展
张文辉1,2,李加宇1,2,杨世华2,王晓刚1*
(1.暨南大学生物医药研究院, 广东 广州510632;2.华南农业大学广东省兽医临床重大疾病综合防控实验室, 广东 广州510632)
随着生命科学的不断发展,2012年DNA元件百科全书(ENCODE)项目进一步丰富了人类基因组功能元件的相关信息。该项目发现人类基因组超过80%的序列会被转录,其中大部分转录本是非编码RNA(ncRNA)。目前,在这些非编码RNA中,小RNA的研究相对深入,而长链非编码RNA(lncRNA)的研究相对较少。越来越多研究表明,很多lncRNA参与到人类重大疾病的发生、发展过程之中,并且一些动物实验证实lncRNA可作为药物靶点。因此,从lncRNA角度筛选新的药物靶点也越来越受到研究者的关注。重点总结了lncRNA的生物学功能及作为潜在药物靶点的研究进展。
长链非编码RNA;生物学功能;药物靶点
1 长链非编码RNA概述
长链非编码RNA(lncRNA)是长度大于200个碱基的不编码蛋白质的转录本[1]。lncRNA的长度差异很大,短的只有几百个碱基,而长的则达到十几万个碱基[2]。大部分lncRNA的碱基长度集中在1 000~5 000个的范围之内[3-4]。lncRNA具有与mRNA类似的结构特征:5'端有帽子结构,3'端有PolyA尾巴结构[5],但lncRNA却没有开放阅读框(ORF)[6]。
与编码蛋白质的mRNA相比,lncRNA具有较强的组织表达特异性,但其表达丰度低于编码蛋白质的mRNA[7]。研究人员将lncRNA的保守性分为3个方面:序列保守性、结构保守性和功能保守性。ENCODE项目研究表明,虽然编码lncRNA的基因数量比编码蛋白质的多,但lncRNA的序列保守性却比后者低[8-9]。然而,一些lncRNA的二级结构保守性相对较好,如不同物种的MALAT-1(Metastasis associated lung adenocarcinoma transcript 1)具有类似的二级结构[10]。不仅如此,有些lncRNA虽然序列保守性不强,但具有类似的功能,如XIST(X-inactive specific transcript)在不同物种之间均参与表观遗传介导的基因沉默。
2 lncRNA的生物学功能
随着越来越多的lncRNA被发现,研究其发挥功能的分子机制成为lncRNA研究领域的热点。目前主要归纳为5种分子模型。
2.1 信号分子模型
一些lncRNA在特定的细胞中表达,并且特异性对外界刺激响应,构成了细胞外信号微环境的一部分,这类调控基因表达的lncRNA的作用方式被定义为信号分子模型。比如受p53基因调控的lncRNA-PANDA(见图1),当DNA受到损伤时p53集合到CDKN1A的启动子区域,进一步激活PANDA。PANDA通过抑制NF-YA的表达,促进细胞凋亡,并增强p53介导的基因表达抑制作用[11]。

图1 PANDA作用的信号分子模型Figure 1 The signal molecule model of PANDA
2.2 引导分子模型
lncRNA作为生物大分子的引导者,主动指导蛋白复合物正确定位至调控位点,称为引导分子。成肌细胞分化时MyoD可以促进该lncRNA的表达,然后Dum可以结合到Dppa2的启动子区域,招募Dnmt家族成员Dnmt3a、Dnmt3b和Dnmt1结合到该部位,将其CpG岛甲基化,最终达到沉默Dppa2表达的作用[12]。研究者发现lncRNA-TUNA(见图2),其能够调节胚胎干细胞的多能性和促进干细胞向神经元分化,作用原理就是引导各种转录因子结合到靶基因的启动子区域,从而促进靶基因的表达[13]。
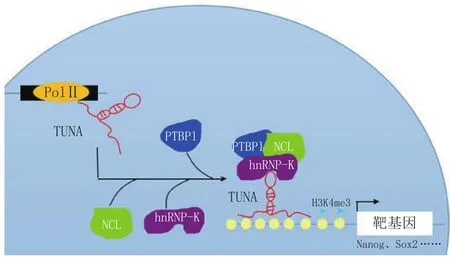
图2 TUNA作用的引导分子模型Figure 2 The guided molecule model of TUNA
2.3 反义调控模型
lncRNA可作为某些基因的反义转录本,并对该基因的表达起到调控作用,这种作用方式称之为反义调控模型。Oct4是维持胚胎多能性的一个关键基因,其假基因的一个反义转录本可以促进Oct4的转录,从而维持胚胎干细胞的多能性[14]。PTEN是一个抑癌基因,其转录受到自身一个反义转录本PTENpg1 asRNA α的调控[15]。PTENpg1 asRNA α可以招募EZH2和DNMT3A到PTEN的启动子区域,从而抑制PTEN的转录(见图3)。
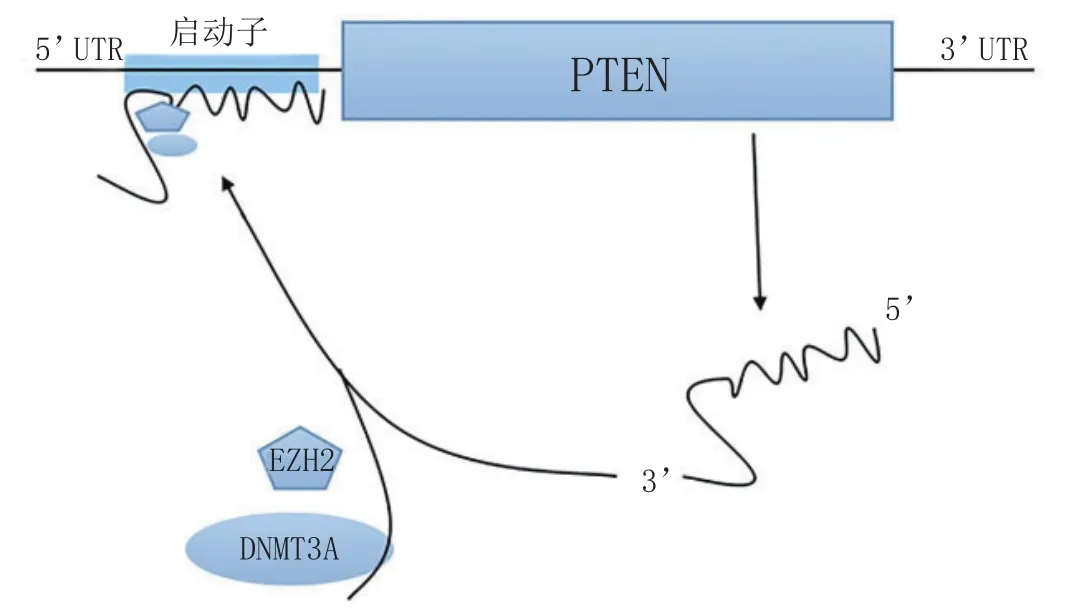
图3 PTEN作用的反义调控模型Figure 3 The antisense model of PTEN
2.4 支架分子模型
lncRNA可以为生物大分子的组装提供一个中央平台,称为支架分子模型。一个典型的例子就是HOTAIR(见图4),该lncRNA的5’-端能够与PRC2结合,而3’-端可以与LSD1/CoREST/REST复合体结合,然后以自身为支架,帮助蛋白复合物的组装,从而改变基因的甲基化状态,实现对靶基因的调节作用[16]。

图4 HOTAIR作用的分子支架模型Figure 4 The molecular scaffold model of HOTAIR
2.5 ceRNA模型
竞争性内源RNA(competing endogenous RNA,ceRNA)是一类可以竞争性结合microRNA(miRNA)的转录本[17-18]。miRNA是一类长度约22~24个碱基的非编码短链RNA,可以与AOG蛋白结合形成RISC复合体,与靶基因的3’-UTR或其他区域结合后,引起靶基因的降解或者翻译抑制[19]。mRNA和lncRNA均可作为ceRNA。在肝癌中lncRNA-HULC通过竞争性结合miR-372,削弱miR-372对其靶基因PRKACB的抑制作用,从而提高PRKACB的蛋白水平[20]。人胚胎干细胞含有丰富的lincRNA-RoR,通过竞争性结合miR-145,削弱其对靶基因的抑制作用,从而提高Oct4、Sox2和Nanog的蛋白表达水平(见图5)[21]。

图5 linc-ROR作用的ceRNA模型Figure 5 The ceRNA model of linc-ROR
3 lncRNA与药物研发
3.1 lncRNA与疾病的相关性
lncRNA与癌症、神经系统疾病和心血管疾病等多种重大疾病的发生发展密切相关。
3.1.1 lncRNA与癌症 研究发现,lncRNA在癌症中的作用可分为三类:一是作为原癌基因,如Hotair在乳腺癌、食管癌和肝癌等疾病中的表达水平显著升高,并与肿瘤的迁移呈正相关[22];二是作为抑癌基因,例如MEG3是一个定位于染色体14q32区域的印记基因[23],在神经胶质瘤中高表达,它通过刺激p53基因的活化抑制肿瘤细胞的增殖并促进其凋亡[24];三是可以同时发挥致癌和抑癌作用的lncRNA,如印迹基因H19既具有原癌作用,也具有抑癌作用。H19在前列腺癌、膀胱癌和乳腺癌等癌症中表达水平升高,发挥了类似于原癌基因的作用[25-26];而在小鼠肝癌模型的研究中发现,缺少H19可促进肿瘤的发生,这提示H19在肝癌中可能起抑癌基因的作用[27]。
3.1.2 lncRNA与神经系统疾病 BACE1 是阿尔茨海默病(AD)发生过程中的一种关键酶,它的一个反义lncRNA分子BACE1-AS可以调节BACE1的表达水平[28]。当siRNA降低BACE1-AS的表达水平后,β淀粉样蛋白的含量能够明显下调,这表明BACE1-AS可作为治疗AD的潜在药物靶点。lncRNA-Kcna2AS是钾离子通道基因Kcna2的反义转录本,在脊神经损伤时骨髓锌指蛋白(MZF1)结合到Kcna2AS近端启动子,并激活其转录,从而导致Kcna2蛋白水平下降,调节神经损伤过程[29]。
3.1.3 lncRNA与心血管疾病 位于染色体9p21位点的lncRNA-ANRIL与动脉粥样硬化有关[30]。ANRIL作为 骨 架 与PCC(Polycomb group)、PRC1(Polycomb complexes1)和PRC2(Polycomb complexes 2)形成复合物,抑制p16INK4a/p15INK4b的表达,阻止血管平滑肌细胞从G期向S期转化,从而防止血管内膜细胞增生,降低诱发动脉粥样硬化的发病风险[31]。位于Myh7基因内部的lncRNA-Mhrt与心衰有关[32]。在病理情况下,染色质抑制复合体Brg1-Hdac-Parp与Mhrt启动子结合并抑制其表达,从而导致心肌病变[33]。
3.1.4 lncRNA与肌肉萎缩 福氏肌肉综合征(FSHD)是由位于染色体4q35区域上的D4Z4抑制性元件缺失,导致基因无序表达而引起的遗传性疾病。lncRNA DBE-T可以招募Trithorax家族的Ash1L蛋白到达D4Z4位点,使组蛋白H3K36甲基化,从而激活该区域基因的转录并诱发FSHD[34]。lncRNA-MD1在人类和小鼠成肌细胞中高表达,以ceRNA的形式结合miR-133和miR-135,导致其靶基因MAML1和MEF2C翻译增强,从而调控肌肉分化,有望缓解杜氏肌肉综合征等肌萎缩疾病[17]。
3.1.5 lncRNA与其他疾病 研究发现ANRIL基因所处的染色质区域与冠心病、颅内动脉瘤、Ⅱ型糖尿病的易感性显著相关[35];SLC7A2-IT1A/B与累进性脑病和严重的小儿厌食症有关;FMR4与X染色体脆性综合征的发生密切相关[36]。
3.2 lncRNA作为药物靶点的研究现状
近期的研究表明,lncRNA在肿瘤和心血管等疾病中具有重要作用,并且一些药物的作用机制也是通过lncRNA来实现的,这给药物研发提供了一条新的思路。在喉鳞状细胞癌中,顺铂和紫杉醇可以降低lncRNA CDKN2B-AS1、HOTAIR和MALAT-1的表达,达到抑制癌症的作用[37]。在食管鳞状细胞癌中,β-榄香烯可以促进lncRNA CDKN2B-AS1的转录,进而抑制hTERT酶的表达,间接抑制癌细胞的增殖[38]。在前列腺癌中,木黄酮通过下调原癌基因HOTAIR的表达,从而抑制前列腺癌细胞的生长[39]。在乳腺癌中,17β-雌二醇通过降低MALAT-1的表达水平来抑制乳腺癌细胞的增殖、浸润和迁移[40]。氯吡格雷是一种用于治疗动脉硬化和心肌梗塞等疾病的常用药。研究发现该药可以抑制lncRNA HIF1A-AS1的表达,减少血管内皮细胞的凋亡,促进血管内皮细胞增殖,从而达到治疗心血管疾病的目的[41]。
3.3 以lncRNA为靶点的潜在核酸药物研究现状
lncRNA-BDNF-AS是脑衍生神经营养因子(BDNF)基因的反义转录本,可以抑制BDNF的表达。针对lncRNA-BDNF-AS的反义核酸(ASO)可以降低小鼠大脑中的BDNF-AS的水平,从而恢复BDNF基因的表达,有望成为促进神经损伤修复的潜在药物[42]。lncRNA-UBE3A-ATS是UBE3A基因的反义转录本,在安格曼综合征中,可以抑制UBE3A的表达。运用ASO将UBE3A-ATS降低,有望实现治疗该疾病的目的[43]。MALAT-1是位于核内具有CUG重复序列的转录本,可被ASO显著降低,为治疗MALAT-1导致的癌症等疾病提供了全新的治疗策略[44]。
4 展望
近年来,非编码RNA的研究使我们对基因的定义有了全新的认识,并导致分子生物学和遗传学的经典理论“中心法则”日益得到丰富。随着人类基因组中越来越多的lncRNA被发现和鉴定,生命大分子的数目获得极大扩充,使我们有机会重新审视生命的运行规律。不可否认,目前lncRNA的研究处于起始阶段,还有很多问题亟待解决。比如,现有研究lncRNA功能的技术手段十分缺乏,鉴定和克隆遇到诸多挑战,lncRNA的成药性和给药方式尚需深入研究。但我们相信,随着认识的逐步深入与技术的日益完善,从lncRNA出发,必将揭开认识生命本质与人类疾病的新篇章。将会有越来越多针对lncRNA的药物逐步被开发与应用,从而对生命科学研究和人类健康事业产生重大影响。
[1]Geisler S, Coller J.RNA in unexpected places: long non-coding RNA functions in diverse cellular contexts [J].Nat Rev Mol Cell Biol, 2013, 14 (11): 699-712.
[2]Mercer T R, Dinger M E, Mattick J S.Long non-coding RNAs: insights into functions[J].Nat Rev Genet, 2009, 10 (3): 155-159.
[3]Orom U A, Shiekhattar R.Long noncoding RNAs usher in a new era in the biology of enhancers [J].Cell, 2013, 154 (6): 1190-1193.
[4]Geisler S, Coller J.RNA in unexpected places: long non-coding RNA functions in diverse cellular contexts [J].Nat Rev Mol Cell Biol, 2013, 14 (11): 699-712.
[5]Guttman M, Amit I, Garber M, et al.Chromatin signature reveals over a thousand highly conserved large non-coding RNAs in mammals [J].Nature, 2009, 458 (7235): 223-227.
[6]Dinger M E, Pang K C, Mercer T R, et al.Differentiating protein-coding and noncoding RNA: challenges and ambiguities [J].PLoS Comput Biol, 2008, 4 (11): e1000176.
[7]Kornienko A E, Guenzl P M, Barlow D P, et al.Gene regulation by the act of long non-coding RNA transcription [J].BMC Biol, 2013, 11 (1):59.
[8]Whitehead J, Pandey G K, Kanduri C.Regulation of the mammalian epigenome by long noncoding RNAs [J].Biochim Biophys Acta, 2009, 1790 (9): 936-947.
[9]Faghihi M A, Wahlestedt C.Regulatory roles of natural antisense transcripts [J].Nat Rev Mol Cell Biol, 2009, 10 (9): 637-643.
[10]Smith M A, Gesell T, Stadler P F, et al.Widespread purifying selection on RNA structure in mammals [J].Nucleic Acids Res, 2013, 41 (17):8220-8236.
[11]Hung T, Wang Y, Lin M F, et al.Extensive and coordinated transcription of noncoding RNAs within cell-cycle promoters [J].Nat Genet, 2011, 43 (7): 621-629.
[12]Wang L, Zhao Y, Bao X, et al.LncRNA Dum interacts with Dnmts to regulate Dppa2 expression during myogenic differentiation and muscle regeneration[J].Cell Res, 2015, 25 (3): 335-350.
[13]Lin N, Chang K Y, Li Z, et al.An evolutionarily conserved long noncoding RNA TUNA controls pluripotency and neural lineage commitment [J].Mol Cell, 2014, 53 (6): 1005-1019.
[14]Hawkins P G, Morris K V.Transcriptional regulation of Oct4 by a long non-coding RNA antisense to Oct4-pseudogene 5[J].Transcription, 2010, 1 (3): 165-175.
[15]Johnsson P, Ackley A, Vidarsdottir L, et al.A pseudogene longnoncoding-RNA network regulates PTEN transcription and translation in human cells [J].Nat Struct Mol Biol, 2013, 20 (4): 440-446.
[16]Tsai M C, Manor O, Wan Y, et al.Long noncoding RNA as modular scaffold of histone modification complexes [J].Science, 2010, 329 (5992): 689-693.
[17]Salmena L, Poliseno L, Tay Y, et al.A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language? [J].Cell, 2011, 146 (3): 353-358.
[18]Seitz H.Redefning microRNA targets[J].Curr Biol, 2009, 19(10): 870-873.
[19]Ha M, Kim V N.Regulation of microRNA biogenesis[J].Nat Rev Mol Cell Biol, 2014, 15 (8): 509-524.
[20]Wang J, Liu X, Wu H, et al.CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer [J].Nucleic Acids Res, 2010, 38 (16): 5366-5383.
[21]Wang Y, Xu Z, Jiang J, et al.Endogenous miRNA sponge lincRNA-RoR regulates Oct4, Nanog, and Sox2 in human embryonic stem cell selfrenewal [J].Dev Cell, 2013, 25 (1): 69-80.
[22]Nilsson E E, Westfall S D, McDonald C, et al.An in vivo mouse reporter gene (human secreted alkaline phosphatase) model to monitor ovarian tumor growth and response to therapeutics [J].Cancer Chemother Pharmacol, 2002, 49 (2): 93-100.
[23]Wylie A A, Murphy S K, Orton T C, et al.Novel imprinted DLK1/GTL2 domain on human chromosome 14 contains motifs that mimic those implicated in IGF2/H19 regulation [J].Genome Res, 2000, 10 (11):1711-1718.
[24]Wang P, Ren Z, Sun P.Overexpression of the long non-coding RNA MEG3 impairs in vitro glioma cell proliferation [J].J Cell Biochem, 2012, 113 (6): 1868-1874.
[25]Fellig Y, Ariel I, Ohana P, et al.H19 expression in hepatic metastases from a range of human carcinomas [J].J Clin Pathol, 2005, 58 (10):1064-1068.
[26]Park J Y, Lee J E, Park J B, et al.Roles of long non-coding RNAs on tumorigenesis and glioma development [J].Brain Tumor Res Treat, 2014, 2 (1): 1-6.
[27]Keniry A, Oxley D, Monnier P, et al.The H19 lincRNA is a developmental reservoir of miR-675 that suppresses growth and Igf1r [J].Nat Cell Biol, 2012, 14 (7): 659-665.
[28]Faghihi M A, Modarresi F, Khalil A M, et al.Expression of a noncoding RNA is elevated in Alzheimer's disease and drives rapid feed-forward regulation of beta-secretase [J].Nat Med, 2008, 14 (7): 723-730.
[29]Zhao X, Tang Z, Zhang H, et al.A long noncoding RNA contributes to neuropathic pain by silencing Kcna2 in primary afferent neurons [J].Nat Neurosci, 2013, 16 (8): 1024-1031.
[30]Holdt L M, Beutner F, Scholz M, et al.ANRIL expression is associated with atherosclerosis risk at chromosome 9p21[J].Arterioscler Thromb Vasc Biol, 2010, 30 (3): 620-627.
[31]Kino T, Hurt D E, Ichijo T, et al.Noncoding RNA gas5 is a growth arrest- and starvation-associated repressor of the glucocorticoid receptor [J].Sci Signal, 2010, 3 (107): a8.
[32]Haddad F, Bodell P W, Qin A X, et al.Role of antisense RNA in coordinating cardiac myosin heavy chain gene switching [J].J Biol Chem, 2003, 278 (39): 37132-37138.
[33]Hang C T, Yang J, Han P, et al.Chromatin regulation by Brg1 underlies heart muscle development and disease [J].Nature, 2010, 466 (7302): 62-67.
[34]Cabianca D S, Casa V, Bodega B, et al.A long ncRNA links copy number variation to a polycomb/trithorax epigenetic switch in FSHD muscular dystrophy [J].Cell, 2012, 149 (4): 819-831.
[35]Wan G, Mathur R, Hu X, et al.Long non-coding RNA ANRIL (CDKN2B-AS) is induced by the ATM-E2F1 signaling pathway [J].Cell Signal, 2013, 25 (5): 1086-1095.
[36]Khalil A M, Faghihi M A, Modarresi F, et al.A novel RNA transcript with antiapoptotic function is silenced in fragile X syndrome [J].PLoS One, 2008, 3 (1): e1486.
[37]Chen H, Xin Y, Zhou L, et al.Cisplatin and paclitaxel target signifcant long noncoding RNAs in laryngeal squamous cell carcinoma [J].Med Oncol, 2014, 31 (11): 246.
[38]Hu Z, Wu H, Li Y, et al.β-Elemene inhibits the proliferation of esophageal squamous cell carcinoma by regulating long noncoding RNA-mediated inhibition of hTERT expression [J].Anticancer Drugs, 2015, 26 (5): 531-539.
[39]Chiyomaru T, Yamamura S, Fukuhara S, et al.Genistein inhibits prostate cancer cell growth by targeting miR-34a and oncogenic HOTAIR[J].PLoS One, 2013, 8 (8): e70372.
[40]Zhao Z, Chen C, Liu Y, et al.17beta-Estradiol treatment inhibits breast cell proliferation, migration and invasion by decreasing MALAT-1 RNA level [J].Biochem Biophys Res Commun, 2014, 445 (2): 388-393.
[41]Wang J, Chen L, Li H, et al.Clopidogrel reduces apoptosis and promotes proliferation of human vascular endothelial cells induced by palmitic acid via suppression of the long non-coding RNA HIF1A-AS1 in vitro [J].Mol Cell Biochem, 2015.doi: 10.1007/s11010-015-2379-1.
[42]Modarresi F, Faghihi M A, Lopez-Toledano M A, et al.Inhibition of natural antisense transcripts in vivo results in gene-specific transcriptional upregulation [J].Nat Biotechnol, 2012, 30 (5): 453-459.
[43]Meng L, Ward A J, Chun S, et al.Towards a therapy for Angelman syndrome by targeting a long non-coding RNA[J].Nature, 2015, 518 (7539): 409-412.
[44]Wheeler T M, Leger A J, Pandey S K, et al.Targeting nuclear RNA for in vivo correction of myotonic dystrophy [J].Nature, 2012, 488 (7409):111-115.
Research Progress in Long Noncoding RNAs as Potential Drug Targets
ZHANG Wenhui1,2, LI Jiayu1,2, YANG Shihua2, WANG Xiaogang1
(1.Biomedicine Institute of Jinan University, Guangzhou 510632, China; 2.Key Laboratory of Prevention and Control for Severe Clinical Animal Diseases of Guangdong Province, South China Agricultural University, Guangzhou 510632, China)
With the rapid development of life sciences in recent years, Encyclopedia of DNA elements (ENCODE) project has provided a comprehensive understanding of functional elements in human genome.It suggests that over 80 percent of the nucleotide bases in human genome may be transcribed, but most of the transcripts are noncoding RNA (ncRNA).Among these noncoding RNAs, investigations on long noncoding RNA (lncRNA) are inadequate compared with small RNA.Increasing evidence has shown that many lncRNAs are implicated in the occurrence and development of serious human diseases.In addition, lncRNAs have been identifed as drug targets in animal study.As a result, screening of novel drug targets from lncRNAs has drawns increased attention from researchers.Research progress in the biological functions of lncRNAs and their potential as drug targets have been reviewed in this paper.
long noncoding RNA; biological function; drug target
Q52
A
1001-5094(2015)03-0193-06
接受日期:2015-01-08
项目资助:国家自然科学基金资助项目(No.81370971);广东省杰出青年基金项目(No.S2013050013880);科技部重大科学研究计划重大科学问题导向项目(No.2012CBA01302);新世纪国家优秀人才支持计划项目(No.NCET-12-1078)
*通讯作者:王晓刚,教授;
研究方向:非编码RNA生物学;
Tel:020-85221983; E-mail:txg_wang@jnu.edu.cn

