索利那新联合多沙唑嗪控释片治疗夜尿相关性睡眠障碍临床研究
郭咏萍,蒋晓江,许志强,周红杰,李 玮,王景周(第三军医大学大坪医院野战外科研究所神经内三科,重庆400042)
夜尿是老年人常见的问题,破坏睡眠,导致日间疲乏,多数老年人睡眠中断的常见原因是夜尿症(即夜间觉醒排尿),需积极处理[1]。夜尿指夜间必须1次以上醒来进行排尿,夜尿作为下尿路症状的重要表现之一,也是膀胱过度活动的主要症状,是导致患者的生活质量下降非常重要的因素之一。重度夜尿(≥3次/晚)严重干扰睡眠,致使入眠困难,睡眠时程缩短,良好的睡眠是生理健康不可或缺的部分。伴夜尿相关性睡眠障碍不但降低患者生活质量,而且严重影响患者身心健康[2]。老年患者出现夜尿,多合并其他下尿路症状,临床表现主要为下尿路症候群(LUTS):尿急、尿频、急迫性尿失禁[3]。索利那新作为抗胆碱药物,成为对抗膀胱过度活动症(OAB)的首选药物。本研究拟观察索利那新在改善OAB的同时,是否具有对抗夜尿的疗效。因此,针对夜尿及其伴随的睡眠障碍,作者采用多沙唑嗪控释片(可多华)联合索利那新(卫喜康)治疗夜尿相关性睡眠障碍患者,观察治疗前后的相关指标变化,以期为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选择2011年5月至2013年10月本科收治的合并重度夜尿(≥3次/晚)患者34例,其中男21 例,女 13 例;年龄 54~78 岁,平均(64.2±11.8)岁;病程最短7个月,最长8年,平均(3.5±0.7)年。根据患者连续7 d填写的排尿日志,其症状为睡眠障碍伴夜尿,将夜间伴随尿急症状、排尿次数大于3次、病程超过6个月的患者纳入研究。排除有泌尿系统感染性疾病和对索利那新过敏或药物依从性差的患者。
1.2 方法
1.2.1 治疗方法 服用导眠药物佐匹克隆(成都新恒创药业有限公司,批号:138729-47-2),每晚 7.5 mg,加服卫喜康[安斯泰来制药(中国)有限公司,批号:J20090109]5 mg/d及可多华[辉瑞公司PfizerInc,批号:J20040073]4 mg/d。疗程为8周。
1.2.2 观察指标
1.2.2.1 夜尿情况观察 参照美国国立卫生研究院尿道综合征症状评分(USS)[4]进行夜尿评价,见表1。
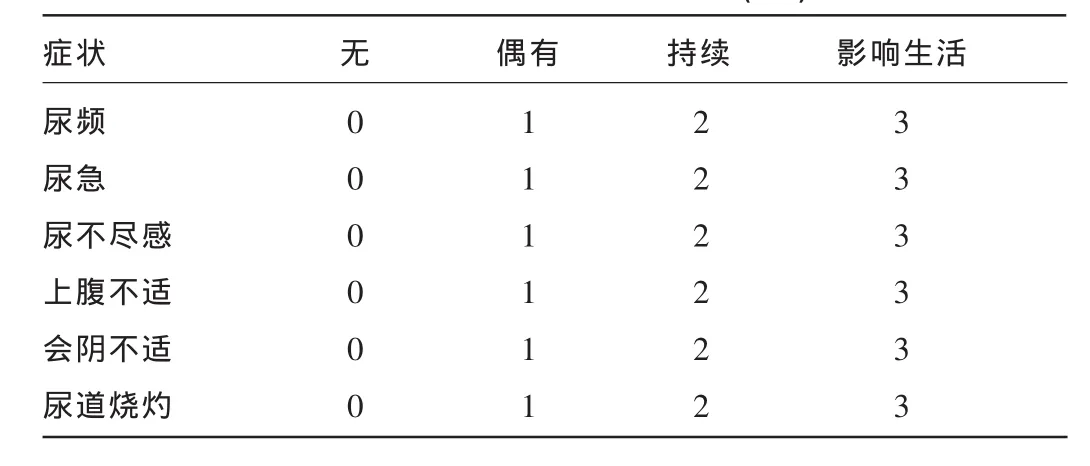
表1 尿频相关因子积分表(分)
1.2.2.2 患者睡眠质量评估 根据匹兹堡睡眠质量指数(PSQI)[5]进行评估,分值为 0~21 分,分值高代表睡眠质量较差。采用国际良性前列腺增生咨询组织国际协调委员会推荐的生活质量(QOL)评估表并参考患者排尿日志进行生活质量评分。
1.3 统计学处理 应用SPSS 19.0统计软件进行数据分析,治疗前后的计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后昼夜排尿次数比较 治疗后日间排尿次数[(7.4±1.6)次]及夜尿次数[(2.6±1.2)次]均较治疗前[(10.6±1.6)、(5.8±1.4)次]明显减少,差异均有统计学意义(P<0.05)。
2.2 治疗前后PSQI、USS、QOL评分比较 治疗后PSQI、USS、QOL评分均较治疗前明显降低,差异均有统计学意义(P<0.05),见表 2。
表2 治疗前后 PSQI、USS、QOL 评分情况(±s,分)
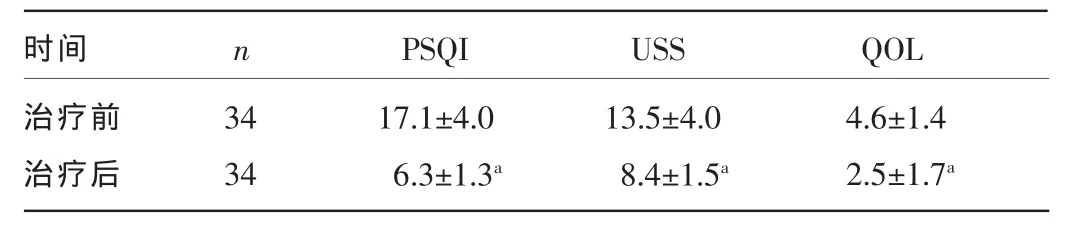
表2 治疗前后 PSQI、USS、QOL 评分情况(±s,分)
注:与治疗前比较,aP<0.05。
17.1±4.0 6.3±1.3a 13.5±4.0 8.4±1.5a USS时间治疗前治疗后34 34 n PSQI 4.6±1.4 2.5±1.7a QOL
2.3 治疗前后主要睡眠指标比较 与治疗前比较,治疗后患者睡眠潜伏期缩短,睡眠效率提高,总睡眠时间延长,差异均有统计学意义(P<0.05),见表 3。
表3 治疗前后主要睡眠指标比较(±s)
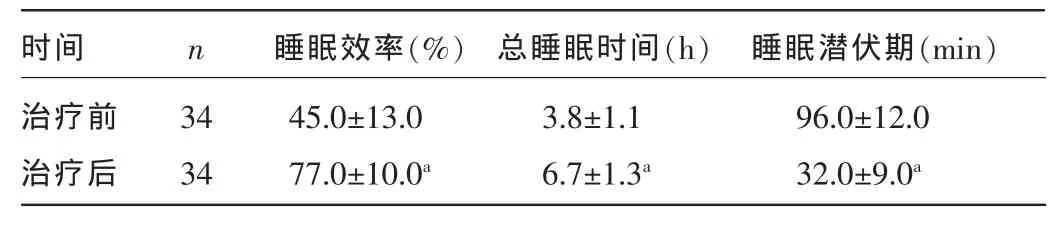
表3 治疗前后主要睡眠指标比较(±s)
注:与治疗前比较,aP<0.05。
时间治疗前治疗后45.0±13.0 77.0±10.0a 3.8±1.1 6.7±1.3a 96.0±12.0 32.0±9.0a睡眠效率(%) 总睡眠时间(h) 睡眠潜伏期(min)n 34 34
2.4 药物不良反应 4例患者服药后出现轻度口干,无排尿困难等症状出现。
3 讨 论
夜尿症虽然广为学者所知,但仍然有众多医生对其存在较大误解。夜尿症是对健康构成重大损害的一组症状之一,应引起更多的重视和研究。夜尿症是睡眠障碍的最常见原因之一,18岁以上欧洲男、女性夜尿症患者分别为49%、55%,在日本年龄大于或等于40岁的男、女患有夜尿症的患者高达72%、67%[6]。夜尿在老年人中发病率为24%~55%[7],夜尿引起严重睡眠障碍,并诱发老年人跌倒,增加了骨折等并发症发生的可能,增加老年患者病死率及明显降低其生活质量[8]。夜尿导致的睡眠剥夺,可诱发患者情绪低落或抑郁状态的发生,引起心理和社会活动能力的下降,夜尿是引起健康相关性生活质量减退的最大不利因素。针对夜尿原因的临床治疗具有重要的现实意义。通过改善严重夜尿,从而减轻夜尿相关性睡眠障碍,减轻LUTS症状如尿频、严重夜尿,稳定日间情绪,疲劳感,具有重要价值。夜间睡眠紊乱,再次入眠困难,但目前治疗缺乏有效药物。
可多华是多沙唑嗪的控释剂型代表药物,是第三代α1受体阻滞剂,其独特的胃肠道治疗系统技术使得药物有控制的释放,血清药物浓度长效稳定,控释片阻断α1A和α1D受体的比例是1∶1.6相对较均衡,故其可同时作用于前列腺和膀胱,增加膀胱顺应性和膀胱容量。多中心、随机、开放、平行研究资料证实,与坦索罗辛比较,多沙唑嗪控释片(Doxazosin-GITS)可显著减少老年男性患者的夜尿次数,并改善患者夜间睡眠质量,从而提高患者的生活质量[9]。可多华能高选择性地阻断α1D受体,显著降低排尿阻力。缓解功能性尿道梗阻[10]。多沙唑嗪还可以通过抑制患者泌尿道上皮细胞释放过多的ATP来缓解患者的尿路刺激症状。这些发现为多沙唑嗪在减少夜尿次数方面的应用提供了理论和实验基础。其在心血管方面不良反应少见且轻微,安全性及依从性良好,易被患者接受,可以长期用药,以减少症状复发。由于α1受体阻滞剂单药对OAB效果欠佳,需联合M受体拮抗剂。
抗毒蕈碱类药品是治疗夜尿的一线药物,其机制是能有效增减功能膀胱的容量。尿动力学提示夜尿与功能膀胱容量减少有关。索利那新作为新一代高选择M受体拮抗剂,其作用机制类似于抗毒蕈碱药物,其半衰期为45~68 h,中华医学会泌尿外科学分会、国际尿控学会制订的OAB治疗指南均推荐索利那新为一线治疗药物[11-12],既往资料结合本次研究结果显示,索利那新可显著降低患者尿急、夜尿次数,增加功能膀胱容量,增加平均每次排尿量及夜间排尿间隔时间[10,13]。α1受体与LUTS关系密切,已证实阻断α1受体可使膀胱的过度收缩正常化,有效缓解膀胱的刺激症状和梗阻症状[14]。
本组34例患者口服助眠药物(佐匹克隆每晚7.5mg),增加服用多沙唑嗪(可多华Doxazosin-GITS)及卫喜康片,从而有效使患者PSQI、USS、QOL降低,显著减少患者夜尿次数,延长排尿间隔时程,通过增加有效膀胱容量改善储尿期功能,明显改善患者睡眠障碍,提高患者的生活质量。本组治疗后睡眠改善情况、尿频综合指数、昼夜排尿次数、生活质量等较治疗前显著改善,说明二者联合用药是治疗严重夜尿相关性睡眠障碍的一种有效方法。但个体化的诊疗方法缺乏大量的临床验证,尚需进一步临床研究资料的研究。
[1]Carlson BW,Palmer MH.Nocturia in older adults:implications for nursing practice and aging in place[J].Nurs Clin North Am,2014,49(2):233-250.
[2]Vaughan CP,Juncos JL,Trotti LM,et al.Nocturia and overnight polysomnography in Parkinson disease[J].Neurourol Urodyn.2013,32(8):1080-1085.
[3]Saglam HS,Gökkaya CS,Salar R,et al.The effects of age,metabolic syndrome,nocturnal polyuria and sleep disorders on nocturia[J].Adv Clin Exp Med,2013,22(4):489-494.
[4]Takao T,Tsujimura A,Kiuchi H,et al.Correlation between overactive bladder symptoms and quality of life in Japanese male patients:focus on nocturia[J].Urology,2013,82(1):189-193.
[5]Zeitzer JM,Bliwise DL,Hernandez B,et al.Nocturia compounds nocturnal wakefulness in older individuals with insomnia[J].J Clin Sleep Med,2013,9(3):259-262.
[6]Homma Y,Yamaguchi O,Hayashi K,et al.Epidemiologic survey of lower urinary tract symptoms in Japan[J].Urology,2006,68(3):560-564.
[7]Swithinbank LV,Donovan J,James MC,et al.Female urinary symptoms:age prevalence in a community dwelling population using a validated questionnaire[J].Neurourol Urodyn,1998,16:322-324.
[8]Van Doorn B,Kok ET,Blanker MH,et al.Nocturia:Prevalence,incidence and mortality-risk in older men, the Krimpen Study[J].Eur Urol Suppl,2011,10(2):29.
[9]Lepor H.PhaseⅢmulticenter placebo-controlled study of tamsulosin in benign prostatic hyperplasia.Tamsulosin Investigator Group[J].Urology,1998,51(6):892-900.
[10]Zhang K,Yu W,Jin J,et al.Effect of doxazosin gastrointestinal therapeutic system 4 mg vs tamsulosin 0.2 mg on nocturia in chinese men with lower urinary tract symptoms:a prospective,multicenter,randomized,open,parallel study[J].Urology,2011,78(3):636-640.
[11]Fowler CJ.Update on the neurology of Parkinson′s disease[J].Neurourol Urodyn,2007,26(1):103-109.
[12]Chou EC,Hung MJ,Yen TW,et al.The translation and validation of Chinese overactive bladder symptom score for assessing overactive bladder syndrome and response to solifenacin treatment[J].J Formos Med Assoc,2014,113(8):506-512.
[13]Kosilov K,Loparev S,Iwanowskaya M,et al.Effectiveness of combined high-dosed trospium and solifenacin depending on severity of OAB symptoms in elderly men and women under cyclic therapy[J].Cent European J Urol,2014,67(1):43-48.
[14]Smith A,Wein A.Current pharmacotherapy of nocturia.Expert Opin[J].Pharmacother,2013,14(7):885-894.

