菌丝霉素抑菌活性鉴定及其在防治牛乳腺炎中的应用
■孙丹丹 周玉岩 温黎俊 逯佩凤 苏志坚 黄亚东
(1.广东海纳川药业股份有限公司,广东佛山 511400;2.暨南大学生命科学技术学院,广东广州 510632)
奶牛乳腺炎是高发病率且传播非常迅速的一种常见疾病,也是一直困扰奶牛业发展的主要难题。大多数国家牛乳腺炎的发病率约为40%,每头牛平均减少奶量约为15%[1]。无乳链球菌、停乳链球菌、金黄色葡萄球菌是乳腺炎的最常见传染性病原体[2],常存在于乳牛的皮肤、乳头及乳房内,通过擦洗乳房用的毛巾、水、挤奶员的手、挤奶杯等。传染性致病菌的危害比较大,挤奶期治疗可以控制致病菌,但不能立刻解决泌乳期牛乳中体细胞数过高问题,从而会影响牛乳的销售。目前奶牛乳腺炎通常使用青霉素、庆大霉素、氧氟沙星等抗生素进行治疗[3]。长期使用抗生素类药物会增加耐药性,严重时导致菌群失衡。特别是近年来“超级细菌”逐渐增多,使得在合理用药的同时研发新一代安全高效的抗菌制剂显得尤为迫切。本试验利用酵母系统重组表达了菌丝霉素,鉴定其抗菌谱,并灌注到奶牛乳腺中,评价对奶牛乳腺炎的治疗效果,为奶牛乳腺炎的防治提供了一种新的手段。
1 材料与方法
1.1 试验材料
菌丝霉素NZ2114基因,由上海捷瑞生物工程有限公司合成。
载体pPicZα,由暨南大学医药生物技术研究开发中心惠赠。
毕赤酵母GS115,由暨南大学医药生物技术研究开发中心惠赠。
受试菌:金黄色葡萄球菌CMCC26003,ATCC25923,ATCC12600。
耐药金黄色葡萄球菌4株,从奶牛中分离。无乳链球菌,购自菌种保藏中心。
蛋白酶:胃蛋白酶、胰蛋白酶、木瓜蛋白酶。
1.2 试验动物
选用泌乳期的4~8岁青壮年黑白花奶牛,共15头,急性乳腺感染引发炎症,其症状为乳房肿胀,牛奶异常,有凝块或者絮片,但无其它症状。
1.3 载体构建及在酵母中的表达
菌丝霉素NZ2114蛋白序列如下:GFGCNGP⁃WNEDDLRCHNHCKSIKGYKGGYCAKGGFVCKCY。
按照蛋白编码序列,设计相对应的酵母偏好性密码子,提交生物公司合成。将合成的NZ2114基因克隆到pUC57中,用 XhoI、AvrII双酶切后,将NZ2114基因插入毕赤酵母表达载体pPicZα,位于α因子信号肽突变体序列的下游,得到重组质粒 pPicZα-NZ2114,并对该质粒进行限制性酶切及测序鉴定。
将重组质粒pPicZα-NZ2114经PmeI酶切后,电转移进到毕赤酵母GS115,用含0.5~1 mg/ml Zeocin(博莱霉素)的 YPD培养基筛选,30℃培养 2~3 d,筛选多拷贝转化子。
将阳性转化子接种于含20 ml BMGY培养基中的试管中,30℃,220 r/min摇床培养24 h。将20 ml菌体转移至 200 ml BMMY诱导培养基中,30℃,220 r/min继续培养,每24 h补加 200 μl 100%甲醇。共培养120 h。
1.4 菌丝霉素纯化及鉴定
发酵液用12 000 r/min离心,弃沉淀菌体,收集上清。用饱和度40%~50%的硫酸铵沉淀总蛋白,用20 mM的PB缓冲液溶解沉淀物,使用分子筛层析柱G25脱盐。
脱盐后的样品使用阳离子交换色谱CM分离纯化。用pH值5.0的20 mM PB缓冲液平衡柱子,再分别用0.3 M NaCl、0.5 M NaCl洗出洗脱峰。
高效液相色谱HPLC(安捷伦2010C)。洗脱液为乙腈和水,流速1 ml/min,检测器波长254 nm,CM纯化后的样品过0.22 μm滤膜,进样10 μl。60 min,从8%~80%乙腈洗脱,乙腈中添加0.1%TFA。
HPLC后,使用ABI 4700质谱仪鉴定纯化蛋白的分子量。
1.5 菌丝霉素的稳定性试验
1.5.1 热稳定性
纯化蛋白1 μg/μl在40、60、80、100 ℃条件下处理5、15、30 min,将处理后的样品取20 μl加到以金黄色葡萄球菌CMCC26003为测试菌的平板的孔中,置于37℃,培养12 h。以未处理样品、水和氨苄青霉素Amp作为对照。
1.5.2 pH值稳定性
设定8个pH值2、3、4、5、6、7、8、9梯度,纯化蛋白1 μg/μl在37℃ 时在上述pH值缓冲液中作用2 h。pH值2、3、4、5 用醋酸-醋酸钠缓冲溶液,pH值5、6 用磷酸缓冲液,pH值8、9用Tris-HCl缓冲液。
将处理后的样品取20 μl加到以金黄色葡萄球菌CMCC26003为测试菌的平板的孔中,置于37℃,培养12 h。以未处理样品、水和氨苄青霉素Amp作为对照。
1.6 菌丝霉素的抑菌谱鉴定
将受试菌在平板划线,再转接到相应的液体培养基中,至对数生长期,用生理盐水调节受试菌液,使之在625 nm波长检测吸收为0.090~0.10,然后按1∶100稀释,摇匀。
纯化后浓度为1 μg/μl菌丝霉素蛋白用微孔滤膜过滤,加入受试菌中,并使终浓度为1 000、500、100、50、10、1、0.5 μg/ml。然后置于37 ℃条件下,培养12 h。阳性对照为氨苄青霉素。
1.7 菌丝霉素对牛乳腺炎的防治试验
选择泌乳期的4~8岁青壮年黑白花奶牛,共15头,随机分为3组,每组5头。第1组为空白对照组,不给予药物;第2组为菌丝霉素治疗组,按0.05%的剂量给予乳房灌注,每天给药2次,每次给药20 ml;第3组为阳性药物组,按青霉素G钾10万单位,每天给药2次,进行乳房内注射给药。连续给药7 d。
观察指标为痊愈和有效:痊愈指临床乳腺炎的症状全部消失,乳房组织柔软,牛奶中没有凝块,牛奶颜色较白。有效指临床乳腺炎的症状减轻,或者不再恶化,牛奶正常,但乳房肿胀没有完全消失。
2 试验结果
2.1 载体构建及在酵母中的表达

图1 PCR鉴定重组子电泳
NZ2114基因位于α-factor突变体基因下游,二者总共约500 bp,PCR鉴定,扩增出大小为500 bp左右的片段,与预测一致。
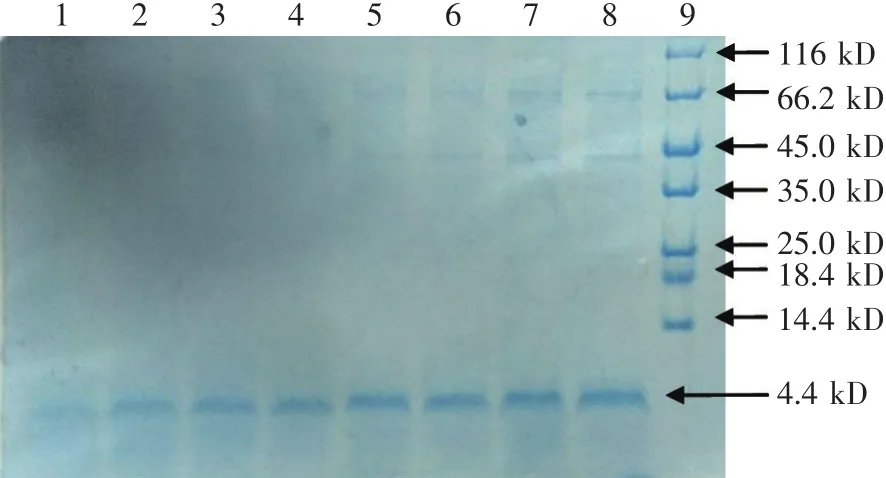
图2 毕赤酵母重组表达菌丝霉素的SDS-PAGE电泳
2.2 菌丝霉素纯化及鉴定
经过G25、CM和RP-HPLC后,得到纯度为90%以上的菌丝霉素蛋白。

图3 菌丝霉素的RP-HPLC纯化
质谱在4 412.69处有最高峰。菌丝霉素理论分子量为4 413.92。与预测结果一致。说明毕赤酵母GS115菌株表达的物质是菌丝霉素NZ2114。

图4 菌丝霉素的质谱分析
2.3 菌丝霉素的稳定性
2.3.1 热稳定性
在40、60、80、100 ℃条件下处理5、15、30 min后,菌丝霉素对金葡CMCC26003仍有抑菌活性,抑菌圈未见减小,说明菌丝霉素对热的稳定性良好,见图5。
2.3.2 pH值稳定性
不同pH值处理后的菌丝霉素对金黄色葡萄球菌CMCC26003都有抑菌活性,但当pH值2~3时和pH值8~9时,抑菌圈与对照相比变小,说明活性有所下降。见图6。
2.4 菌丝霉素抑菌谱
菌丝霉素抑菌谱见表1。
2.5 动物试验及指标测定(见表2)
从表2可以看出,菌丝霉素抗感染的痊愈率和有效率略高于抗生素组。细菌学检测证明菌丝霉素治疗前后,牛乳腺感染区的金黄色葡萄球菌和无乳链球菌的数目显著下降,对耐药金葡萄球菌也有很好的抑制作用,尤其是耐药金葡萄球菌,效果好于青霉素G。
3 讨论
防御素是一类具有广谱抗微生物活性的阳离子小肽,具有抗菌、抗病毒、趋化、免疫调节等多种生物学功能,具有药用价值,在预防和治疗疾病方面有良好的应用,也为替代传统抗生素提供了新途径。

图5 菌丝霉素的热稳定性分析
图6 菌丝霉素的pH值稳定性分析
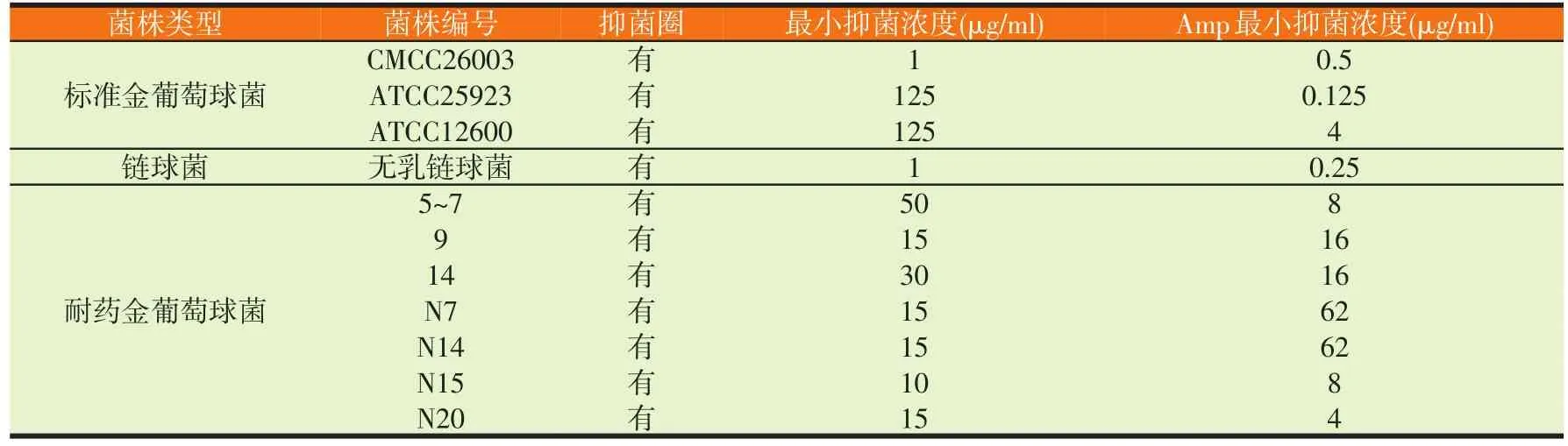
表1 菌丝霉素对不同细菌的抑菌试验
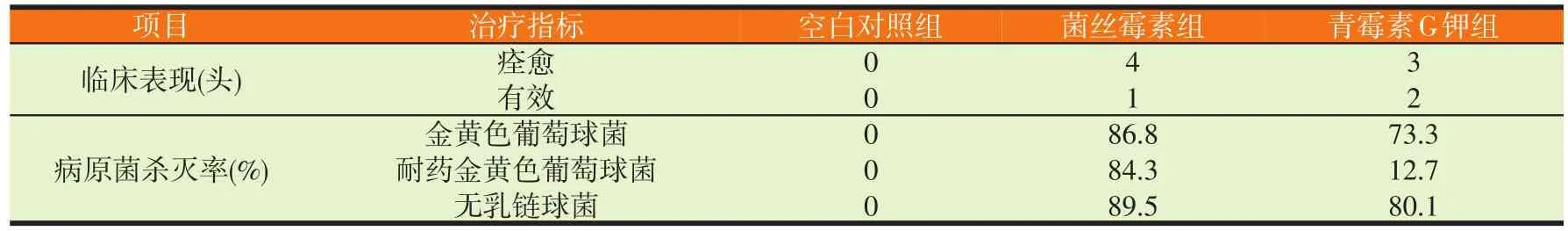
表2 菌丝霉素对乳区急性感染的治疗效果
菌丝霉素是2005年由丹麦诺维信公司从腐生子囊菌假黑盘菌(Pseudoplectania nigrella)中发现的第一个真菌防御素,具有典型的CSαβ结构,体外可以抑制多种革兰氏阳性菌的生长[4]。利用基因重组技术,菌丝霉素在大肠杆菌和毕赤酵母中都得到了成功的表达[5-6]。
本研究利用酵母表达系统,在α-factor信号肽后连接菌丝霉素基因,成功建立了分泌型表达的载体。毕赤酵母属于真核表达系统,安全高效,表达水平高,培养基廉价,发酵工艺成熟,易放大。通过此系统,菌丝霉素蛋白可大量表达,分离纯化简便。此方法的建立,为后续大规模工业化生产奠定了基础。
饲料行业中应用防御素,以天蚕素研究最早,主要针对革兰氏阴性菌有抑制作用,能提高母猪产仔率、解决仔猪腹泻等问题。防御素应用于治疗和预防牛乳腺炎,是近十几年新兴的研究热点,如Marcus发现两种活性多肽A70和A53,可抑制从牛乳腺炎中分离到的金葡和链球菌,有治疗牛乳腺炎的应用前景[7]。我们发现菌丝霉素在体外有对预防和治疗牛乳腺炎的作用,属于首次报道。
4 小结
通过毕赤酵母表达的真菌防御素——菌丝霉素在体外对金黄色葡萄球菌、无乳链球菌等革兰氏阳性菌有很好的抑制作用,对温度、酸碱都比较稳定,在牛体内灌注后能够预防和治疗牛的急性乳腺炎,也可作为外用杀菌剂喷洒到环境、挤奶用品上,是新一代安全高效的抗菌制剂,有良好的应用前景。本研究为菌丝霉素的制备提供了方法,为预防和治疗牛乳腺炎提供了初步试验结果,经过后续不断地深入研究,菌丝霉素可望发展为一类新兽药。

