促红细胞生成素对缺氧缺血性脑损伤大鼠的脑保护作用及机制
张晶,黄蕊,郝玲,刘娜
(1河北医科大学第一医院,石家庄050031;2定州市妇幼保健院)
围产期缺氧缺血性脑损伤(HIBD)是新生儿常见疾病,是导致脑瘫、癫痫、智力低下等中枢神经系统疾病的主要原因之一,亦是引起新生儿死亡的重要原因[1]。目前,HIBD的发病机制尚不明确,动物实验表明,HIBD能致神经元细胞的坏死和凋亡,进而导致病理性症状的发生[2,3]。对HIBD引起的脑损伤目前尚无有效防治措施。促红细胞生成素(EPO)是一种主要由肾脏和肝脏组织合成的糖蛋白,是调节血液中红细胞增殖、分化与成熟的细胞因子。近年发现EPO受体在中枢神经系统中表达,对脑损伤神经元具有保护作用[4,5]。本实验通过建立HIBD大鼠模型,应用EPO药物对HIBD大鼠进行干预治疗,分析EPO对HIBD脑组织的Fas、FasL表达的影响,探讨EPO对HIBD大鼠神经元可能的保护机制,从而为HIBD的临床治疗提供理论依据。
1 材料与方法
1.1 材料 实验动物:新生7 d健康的Wistar大鼠120只,雌雄不限,体质量12~18 g,由河北医科大学实验动物中心提供。主要试剂:EPO注射液(沈阳三生制药股份有限公司)。BCA蛋白浓度测定试剂盒、IP细胞裂解液(碧云天生物技术研究所)。TRIzol(美国Invitrogen公司),M-MLV逆转录酶(日本TaKaRa公司),Real Master Mix试剂盒(德国Qiangen公司),GAPDH、Fas及 Fas配体(FasL)抗体(美国 SANTA CRUZ公司)。主要仪器:ABI7300(美国ABI公司),bio-rad垂直版电泳槽,常压缺氧舱(河北有机玻璃厂)及氧浓度监测仪(日本3A公司生产,1H21A型),显微镜(OlympusH-CX31)。
1.2 模型制备、分组及干预 将Wistar大鼠用氯胺酮30 mg/kg腹腔注射麻醉后,游离左侧颈总动脉,双线结扎。将大鼠随机分为假手术组(对照组)、HIBD组和EPO治疗组各40只,根据处死大鼠的时间点(6、12、24、48、72 h)不同,进一步分为 5 个亚组,每个亚组平均8只大鼠。对照组仅分离左颈总动脉但不结扎血管及缺氧。EPO治疗组在HIBD模型建立后立即腹腔注射重组人红细胞生成素注射液(5 000 IU/kg),HIBD组腹腔注射等体积生理盐水。模型组和EPO治疗组缺血术后恢复2 h,置于2 000 mL常温常压缺氧舱内,以1.0~2.0 L/min的速度输入体积分数为8%氧气和体积分数为92%氮气的混合气体,以氧浓度监测仪进行检测,使氧浓度维持体积分数为8%,持续2 h。2 h后恢复正常供氧,制成HIBD动物模型(左侧大脑半球)。上述动物均回笼饲养,6、12、24、48、72 h 时分别随机处死各组大鼠8只,取左侧大脑半球,用于后续DNA模板和蛋白的提取。
1.3 脑组织中Fas及FasL mRNA表达检测 采用Real-time PCR法。按TRIzol说明书提取大鼠脑组织标本中总RNA。RNA的浓度经紫外线分光光度计测定:A260/A280=1.8~2.0,说明 RNA 的完整性较好,将浓度调整为500 ng/μL。采用TaKaRa公司RNA M-MLV kit试剂盒,在10 μL反应体系中逆转录RNA合成cDNA,cDNA产物用于后续的扩增实验或置于-20℃保存备用。引物序列:Fas上游引物:5'-CCTCCCATCCTCCTGACCACCG-3',下 游 引物:5'-CTGGTTGCCTTGGTAGGATTG-3',扩增片段117 bp;FasL上游引物:5'-TCCCTGGAGAAGAGCTACGA-3',下游引物:5'-TCACTCGTAAACCGCTTCCCTC-3',扩增片段 182 bp;β-actin上游引物:5'-CCTGTTAAATGGGCCACTTTC-3',下游引物:5'-AGCACTGTGTTGGCGTACAG-3',扩增片段 194 bp。20 μL 反应总体积,取cDNA 1 μL,加 PCR mix buffer 10 μL,上下游引物各 0.6 μL,DEPC-H2O 为 7.8 μL。循环条件:95℃预变性5 min;94℃、30 s;56℃、30 s;72℃、45 s,40个循环。反应结束后记录相关Ct值,根据 2-ΔΔct公式计算各组中 Fas、FasL 基因的相对表达量。
1.4 脑组织中Fas及FasL蛋白表达检测 采用Western blotting法。将大鼠的脑组织在冰浴条件上加细胞裂解液进行研磨并裂解30 min,15 000 r/min离心10 min,收集上清组织(总蛋白标本),利用CBA进行蛋白定量,按等量样本30 μg上样,10%SDS-PAGE凝胶电泳,80 V电泳至溴酚蓝到分离胶后,上调电压至100 V,直至溴酚蓝到达凝胶底部约0.5 cm处停止电泳,80 V湿转90 min,TBST洗涤,5%的脱脂奶粉封闭,室温下摇床维持1 h。TBST洗涤,加一抗,4℃冰箱摇床孵育过夜,TBST洗涤,孵育二抗30 min,TBST洗涤,ECL显影,扫片,利用Bio-rad公司的图形分析软件Quantity one对条带进行灰度值扫描,对结果进行定量分析。
1.5 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,多组间比较采用重复测量数据的方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组脑组织中Fas、FasL mRNA表达比较 对照组在不同时点的大鼠脑组织中Fas mRNA相对表达量均维持在较低水平,在HIBD组6 h后处死的大鼠脑组织中,Fas mRNA相对表达量开始增加,12 h时达最大值,随后开始逐步下降,至72 h后Fas mRNA相对表达量降至接近基础水平;在EPO治疗组中,Fas mRNA表达与HIBD组有相似的变化趋势(先升高后降低),但变化幅度明显减小,且在12、24、48 h时Fas mRNA表达均明显低于HIBD组(P均<0.05)。FasL mRNA表达在HIBD组脑组织中6~24 h开始急剧增减,并在12~24 h维持很高的表达水平,24 h后开始下降,并降至接近基础水平;6、12、24和48 h时EPO治疗组FasL mRNA表达均显著低于HIBD组(P均<0.05)。详见表1、表2。
表1 三组不同时点Fas mRNA在脑组织中的相对表达量比较(±s)
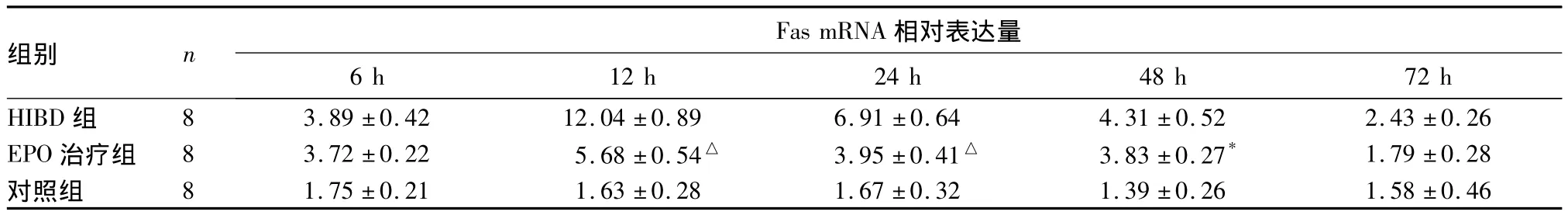
表1 三组不同时点Fas mRNA在脑组织中的相对表达量比较(±s)
注:与 HIBD 组相比,*P <0.05;与 HIBD组相比,△P <0.01。
组别 n Fas mRNA相对表达量6 h 12 h 24 h 48 h 72 h HIBD 组 8 3.89 ±0.42 12.04 ±0.89 6.91 ±0.64 4.31 ±0.52 2.43 ±0.26 EPO 治疗组 8 3.72±0.22 5.68±0.54△ 3.95 ±0.41△ 3.83±0.27* 1.79±0.28对照组 8 1.75 ±0.21 1.63 ±0.28 1.67 ±0.32 1.39 ±0.26 1.58 ±0.46
表2 三组不同时点FasL mRNA在脑组织中的相对表达量比较(±s)

表2 三组不同时点FasL mRNA在脑组织中的相对表达量比较(±s)
注:与 HIBD 组相比,*P <0.05;与 HIBD组相比,△P <0.01。
组别 n FasL mRNA相对表达量6 h 12 h 24 h 48 h 72 h HIBD 组 8 4.69 ±0.61 19.54 ±1.67 22.61 ±2.06 5.29 ±0.732.92 ±0.21 EPO 治疗组 8 2.78±0.17* 6.94±0.78△ 6.25 ±0.52△ 3.12±0.36* 2.32±0.23对照组 8 1.52 ±0.20 1.73 ±0.31 1.82 ±0.35 1.42 ±0.27 1.48 ±0.34
2.2 各组脑组织中Fas、FasL蛋白表达比较 Fas蛋白的表达变化与在基因水平有类似趋势(先升高后降低),在HIBD组24 h后Fas蛋白表达水平达到最高,之后有小幅度下降;EPO治疗组总体表达变化不明显,在12 h和24 h Fas蛋白水平有小幅度上升,但明显低于HIBD组,且在24 h和48 h两个时点的差异有统计学差异(P均<0.05)。在HIBD组中FasL总体表达水平较Fas蛋白要高,在6 h后就维持在较高水平,在12 h和24 h的表达水平远高于对照组,72 h后降至接近基础水平;EPO治疗组经过EPO处理后,FasL蛋白表达水平显著降低,在多个时点表达水平均低于HIBD组(P均<0.05)。详见表3、表4。
3 讨论
新生儿HIBD是一种常见的新生儿疾病,可导致新生儿死亡或严重神经系统损害,是造成胎儿偏瘫、认知及智力障碍的重要病理基础。HIBD重要的脑组织病理变化是大量神经元细胞的变性、坏死或凋亡[6]。临床目前尚无特异性的治疗策略。最初发现EPO可增加红细胞,促使组织的携氧量提高,促进红细胞的生存;动物实验证明,其对神经元亦有一定的保护作用[4]。本研究结果显示,EPO干预HIBD大鼠后,在基因水平和蛋白水平上均可以下调大鼠脑组织中Fas、FasL表达,阻断神经元细胞的凋亡,保护脑组织神经元细胞。这一发现为HIBD的靶向干预和临床治疗提供了新思路。
表3 三组不同时点Fas蛋白在脑组织中的相对表达量比较(±s)

表3 三组不同时点Fas蛋白在脑组织中的相对表达量比较(±s)
注:与 HIBD 组相比,*P <0.05,△P <0.01。
组别 n Fas 蛋白相对表达量6 h 12 h 24 h 48 h 72 h对照组 8 1.92 ±0.31 1.73 ±0.27 1.64 ±0.25 1.41 ±0.22 1.59 ±0.32 HIBD 组 8 3.27 ±0.27 3.84 ±0.89 5.71 ±0.56 4.09 ±0.36 2.34 ±0.18 EPO 治疗组 8 3.72±0.22 5.68±0.54 3.95 ±0.41△ 3.83±0.27*1.79 ±0.28
表4 三组不同时点FasL蛋白在脑组织中的相对表达量比较(±s)

表4 三组不同时点FasL蛋白在脑组织中的相对表达量比较(±s)
注:与 HIBD 组相比,*P <0.05,△P <0.01。
组别 n FasL 蛋白相对表达量6 h 12 h 24 h 48 h 72 h对照组 8 1.67 ±0.18 1.82 ±0.23 1.25 ±0.17 1.91 ±0.57 1.62 ±0.42 HIBD 组 8 4.47 ±0.43 7.48 ±0.89 9.57 ±1.08 7.14 ±0.62 3.96 ±0.34 EPO 治疗组 8 2.04±0.25* 2.57±0.23△ 3.01 ±0.27△ 1.92±0.16△ 1.35±0.11*
EPD是由人体肝脏和肾脏分泌的一种造血生长因子,一种耐热的含唾液酸的酸性糖蛋白激素,相对分子质量约34 kD,作用于骨髓造血干细胞,促进骨髓红细胞增生与分化,对机体供氧状况发挥重要的调控作用[7]。目前研究显示,EPO是一种多效细胞因子,可促进红系祖细胞分裂,增加循环中红细胞数量[8]。研究[9,10]发现,EPO 可通过与其受体结合,激活下游Janus激酶2(JAK2)、信号转导和转录活化蛋白3(STAT3)、磷脂酰肌醇3激酶 (PI3K)、蛋白激酶B(PKB)和NF-κB等信号通路,从而抑制神经元凋亡。
细胞凋亡是HIBD导致神经元细胞死亡的重要形式,但缺氧时神经元细胞亦可发生坏死,主要取决于缺氧或缺血的严重程度。严重缺氧缺血时可引起能量衰竭,导致细胞内外钙离子平衡无法维持、细胞肿胀、细胞器破坏、神经元细胞坏死等一系列生理病理过程改变,这种现象在缺血病灶中往往有较明显表现;如果缺血缺氧程度较轻时或在有效干预治疗后,细胞形态无明显改变,病理改变是选择性神经元的损伤,启动少部分神经元细胞内相关凋亡基因,导致小部分神经元出现程序性死亡。细胞坏死是不可控的过程,并会产生大量炎症;而细胞凋亡是一个受精细调控的过程,是酶联激活反应。研究[11]表明,HIBD大部分神经元死亡通过细胞凋亡途径实现,因此通过体外药物干预阻止缺氧缺血周围神经元细胞凋亡,对HIBD的损伤和防治有重要意义。
Fas是肿瘤坏死因子受体和神经生长因子受体家族的细胞表面分子,表达于多种细胞表面,相对分子质量为40~50 kD的Ⅰ型跨膜蛋白,含有3个富含半胱氨酸的肽链,具有重要功能的细胞表面受体。FasL是一种相对分子质量为40 kD的Ⅱ型跨膜蛋白,由281个氨基酸组成,FasL仅表达于活化的T细胞,与Fas结合后,进一步与细胞内的死亡受体结构域结合,原凋亡信号首先活化Caspase启始因子,使pro-Caspase-8活化为Caspase-8,效应分子特异地水解细胞中的一系列底物,Caspase引发的级联反应是细胞凋亡过程的中心环节,导致细胞凋亡[12]。
本研究发现,正常生理情况下,大鼠脑组织中的Fas/FasL相对表达量均维持在一个较低水平,以便维持机体正常更新分化的基础状态。在HIBD组大鼠脑组织中,Fas/FasL基因和蛋白水平在6 h开始增加,基因水平在12 h达最高峰,并在24 h维持在较高水平,随后开始下降;蛋白水平在6~24 h持续增加,并在24 h时达最大值。蛋白水平表达相对滞后于基因表达,这符合基因先转录后翻译的规律。表明HIBD能明显引起脑组织中的神经元细胞凋亡,这一结果与文献[13,14]报道结果相似。经EPO干预治疗后,无论在基因水平还是在蛋白水平,Fas/FasL表达均低于HIBD组,表明EPO可通过减少Fas/FasL表达,阻断Fas/FasL细胞受体死亡途径,减少神经元细胞的凋亡,从而保护脑神经元细胞。
综上所述,HIBD可通过基因水平和蛋白水平上调Fas/FasL表达,促进神经元细胞凋亡,从而引起大鼠脑组织神经元损伤,EPO可明显减缓其对脑组织神经元的伤害。
[1]Busl KM,Greer DM.Hypoxic-ischemic brain injury:pathophysiology,neuropathology and mechanisms[J].Neuro Rehabilitation,2010,26(1):5-13.
[2]Northington FJ,Ferriero DM,Graham EM,et al.Early neurodegeneration after hypoxia-ischemia in neonatal rat is necrosis while delayed neuronal death is apoptosis[J].Neurobiol Dis,2001,8(2):207-219.
[3]Wang X,Zhang J,Si D,et al.Progesterone inhibits the expression of cycloxygenase-2 and interleukin-1β in neonatal rats with hypoxic ischemic brain damage[J].Int J Neurosci,2014,124(1):42-48.
[4]Iwai M,Stetler RA,Xing J,et al.Enhanced oligodendrogenesis and recovery of neurological function by erythropoietin after neonatal hypoxic/ischemic brain injury[J].Stroke,2010,41(5):1032-1037.
[5]裴雪梅,高然,张国英,等.促红细胞生成素对新生儿缺氧缺血性脑病患儿血清NSE和S-100B的影响[J].中国当代儿科杂志,2014,16(7):705-708.
[6]Northington FJ,Chavez-Valdez R,Martin LJ.Neuronal cell death in neonatal hypoxia ischemia[J].Annal Neurol,2011,69(5):743-758.
[7]Jelkmann W.Physiology and pharmacology of erythropoietin[J].Transfus Med Hemother,2013,40(5):302-309.
[8]Jacobs K,Shoemaker C,Rudersdorf R,et al.Isolation and characterization of genomic and cDNA clones of human erythropoietin[J].Nature,1985,313(6005):806-810.
[9]Mammis A,McIntosh TK,Maniker AH.Erythropoietin as a neuroprotective agent in traumatic brain injury:review[J].Surgical Neurol,2009,71(5):527-531.
[10]谷金宁,李杰,王林全,等.EPO对癫痫大鼠心肌中JNKMAPK和 P38MAPK 表达的影响[J].山东医药,2010,50(9):26-27.
[11]Zhang XY,Yang YJ,Xu PR,et al.The role of β-catenin signaling pathway on proliferation of rats neural stem cells after hyperbaric oxygen therapy in vitro[J].Cell Mol Neurobiol,2011,31(1):101-109.
[12]Villa-Morales M,Fernández-Piqueras J.Targeting the Fas/FasL signaling pathway in cancer therapy[J].Expert Opin Ther Targets,2012,16(1):85-101.
[13]王伟,王军,徐艳,等.缺血缺氧性新生大鼠皮层神经元胞浆Smac/Diablo,caspase-9的表达及参附注射液的干预作用[J].中华神经医学杂志,2011,10(3):228-231.
[14]祝大丽,朱萍,王瑞娇,等.三七总皂甙对新生SD大鼠窒息致脑损伤后Bax表达影响的实验研究[J].中国妇幼保健,2013,28(16):2608-2611.

