利福平耐药实时荧光定量核酸扩增检测技术对涂阴肺结核诊断价值的评价
谭英征 陈双华 龙云铸 李 丹 傅京力 周杜鹃 傅金球
1.湖南省株洲市中心医院感染内科,湖南株洲 412007; 2.湖南中医药高等专科学校,湖南株洲 412012
近年来,结核患者日益增多,目前肺结核的实验诊断主要应依靠痰涂片找抗酸杆菌、结核菌素皮肤试验(tuberculin skin test,TST)及痰培养。 因痰涂片对痰液标本内结核杆菌含量要求高,达到一定浓度方能检测阳性,涂阴肺结核患者往往因为痰涂片抗酸染色阴性,临床上不易早期发现,常被延误治疗。TST 是个操作简单、方便、快捷的筛查结核的免疫学方法,在临床上应用广泛,但有较高的假阳性和假阴性率,对结核感染与卡介苗接种后感染无法鉴别,降低了它的临床价值[1]。痰液结核杆菌培养是诊断结核病的金标准,但结核杆菌生长缓慢,培养周期长,且对实验室生物安全级别要求高,故传统的临床诊断涂阴肺结核试验方法有限。因此,寻找一种能快速、敏感诊断涂阴肺结核的实验技术十分重要。
利福平耐药实时荧光定量核酸扩增(Xpert MTB/RIF) 检测技术对结核杆菌具有较高的敏感性和特异度[2]。本研究通过对131 例涂阴肺结核和123 例其他肺病患者进行Xpert MTB/RIF 检测, 探讨Xpert MTB/RIF 在涂阴肺结核快速、早期诊断中的临床价值。
1 资料与方法
1.1 一般资料
选择2014 年6~12 月到株洲市中心医院(以下简称“我院”)结核门诊就诊患者为研究对象。 入选涂阴肺结核患者131 例 (涂阴肺结核患组), 年龄18~82岁,平均(41.2±15.3)岁;肺结核确诊患者114 例(肺结核确诊组),年龄21~79 岁,平均(39.6±16.5)岁;其他肺病患者123 例(其他肺病组),年龄17~78 岁,平均(40.4±17.5)岁。 该研究经我院医学伦理委员会批准,所有参与研究者均签署了知情同意书。
1.2 诊断标准
1.2.1 入选标准 肺结核确诊患者除有发热、 咳嗽、咳痰、盗汗等临床表现及影像学资料支持外必须有痰结核分枝杆菌培养结果。 涂阴肺结核诊断标准:①具有午后低热、咳嗽、咯血、盗汗、乏力等典型肺结核临床症状及肺部CT 表现者; ②痰涂片抗酸染色阴性者;③支气管或肺部组织病检支持结核性改变者;④诊断性抗结核治疗2 个月后症状改善,复查CT 提示有好转者[3]。
1.2.2 排除标准 ①影像学不典型者行支气管镜检查或病理检查明确为非结核感染者;②仍不能明确者行诊断性抗结核治疗2 个月后症状及影像学病变无改善者。 ③常规行痰涂片、痰固体培养,排除结核感染者。
1.2.3 其他肺病者 包括肺病肿瘤(25 例)、普通肺炎(53 例)、支气管扩张(15 例)、慢性阻塞性肺疾病(26例)肺部其他疾病(4 例)。
1.3 研究方法
对所有入选患者均进行TST、痰固体培养和Xpert MTB/RIF 检测。TST 所用试剂购自北京高科技生命科技开发有限公司,痰固体培养基为罗氏培养基,由珠海贝索公司生产,Xpert MTB/RIF 仪器及试剂由美国Cepheid 公司研发生产,均在有效期内使用。 特异度=真阴性人数/(真阴性人数+假阳性人数)×100%;阳性预测值=真阳性人数/(真阳性人数+假阳性人数)×100%; 阴性预测值=真阴性人数/(真阴性人数+假阴性人数)×100%。
1.3.1 TST 试验 吸取试剂5 U(0.1 mL)注入前臂内侧上中1/3 交界处皮内,形成皮丘。 经72 h 观察注射部位反应,考虑到现代人卡介苗接种率高,本研究以硬结的横径及纵径平均≥10 mm 为阳性。
1.3.2 痰固体培养 痰培养采用4%氢氧化钠处理分离培养。吸取痰标本到前处理管中,加入4%氢氧化钠前处理液充分混匀, 静置15 min 后取吸管吸取前处理液均匀接种在培养基斜面上,观察培养情况,记录生长结果[4-5]。
1.3.3 Xpert MTB/RIF 检测 取1 mL 痰液标本与含氢氧化钠及异丙醇的处理液按1∶2 比例混合,在涡旋震荡器上震荡15~30 s, 室温静置15 min。 取混合液2 mL 转移至一次性多室塑料反应盒中, 然后将反应盒放置到检测模块中, 仪器进行自动化分析, 约2 h后可读取结果[6]。
1.4 统计学方法
采用SPSS 13.0 统计学软件进行数据分析, 计量资料数据用均数±标准差(s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 Xpert MTB/RIF 在肺结核确诊组与其他肺病组的检测情况比较
通过检测发现Xpert MTB/RIF 检测在肺结核确诊组中为82.45%(94/114),在其他肺病组中为0.81%(1/123), 肺结核确诊组中Xpert MTB/RIF 检测阳性率明显高于其他肺病组,差异有高度统计学意义(P <0.01)。 Xpert MTB/RIF 检测对肺结核确诊组的阳性预测值为98.95%(94/95),阴性预测值85.92%(122/142)。
2.2 Xpert MTB/RIF、TST 在涂阴肺结核组与其他肺病组的检测情况比较
涂阴肺结核组中Xpert MTB/RIF 检测阳性率为80.92%(106/131),其他肺病组中Xpert MTB/RIF 检测阳性率为0.81%(1/123)。涂阴肺结核组中Xpert MTB/RIF 检测阳性率明显高于其他肺病组,差异有高度统计学意义(P <0.01)。 涂阴肺结核组中TST 检测阳性率为64.89%(85/131), 与涂阴肺结核组中Xpert MTB/RIF 检测阳性率80.92%比较, 明显低于涂阴肺结核组中Xpert MTB/RIF 检测阳性率, 差异有高度统计学意义(P <0.01)。Xpert MTB/RIF 检测对涂阴肺结核的阳性预测值为99.07%(106/107), 阴性预测值83.00%(122/147)。 见表1。
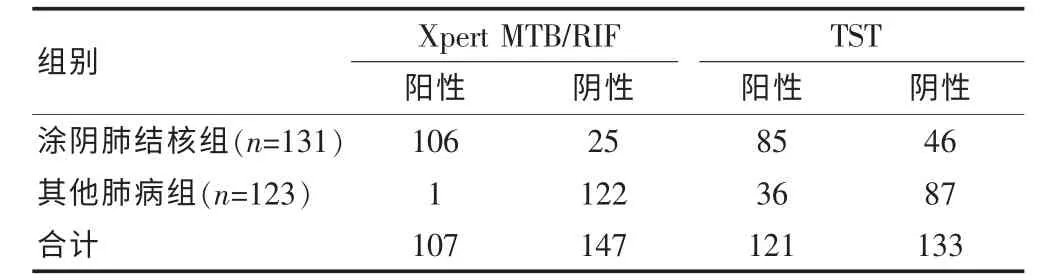
表1 两组Xpert MTB/RIF、TST 检测结果(例)
2.3 Xpert MTB/RIF、痰培养在涂阴肺结核与其他肺病组的检测情况比较
涂阴肺结核组中Xpert MTB/RIF 检测阳性率为80.92%(106/131),痰培养检测阳性率为71.76%(94/131)。涂阴肺结核组中Xpert MTB/RIF 检测阳性率明显高于痰培养检测阳性率,差异有统计学意义(P <0.05)。涂阴肺结核组中Xpert MTB/RIF 检测特异度为99.19%(122/123),与涂阴肺结核组中痰培养检测特异度100.00%(123/123)相比,差异无统计学意义(P >0.05)。 见表2。
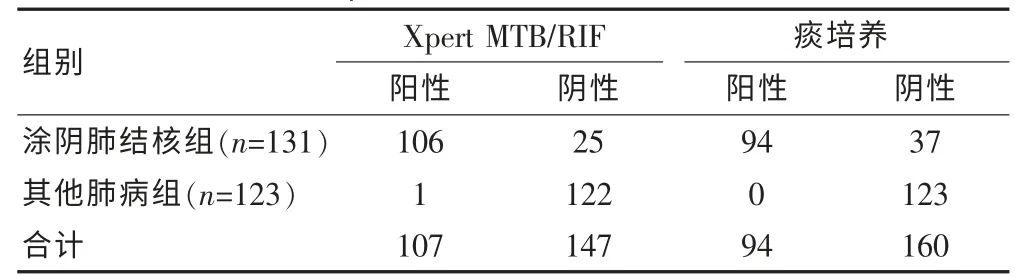
表2 两组Xpert MTB/RIF、痰培养检测结果(例)
3 讨论
肺结核是世界上致死率最高的传染性疾病之一,随着社会老龄化,肺结核患者逐年增加[7-9]。 目前我国肺结核实验室常规检查方法是痰涂片找抗酸杆菌,其耗时短、花费小,但检查敏感度低、对标本含菌量高,致使很多涂阴肺结核患者漏诊[10]。 痰培养结核杆菌是结核诊断的金标准[11],但痰培养方法存在周期长、敏感度相对低,对实验室的生物安全要求高,耗时长,不易普及[12],造成涂阴肺结核临床诊断困难、治疗延误。早诊断、 早治疗涂阴肺结核患者对控制结核病的传播、减少结核耐药,具有十分重要的社会意义。因此临床上亟需开发出一种快速、准确、安全的诊断方法。
Xpert MTB/RIF 检测法是利福平耐药实时荧光定量核酸扩增检测技术, 采用Cepheid 公司GeneXpert检测系统,针对rpoB 基因81bp 利福平耐药核心区间(RRDR)设计引物、探针,检测其是否发生突变[13],它是将样品的准备、 定量PCR 扩增和荧光检测集于一体的核酸扩增检测分析系统。 操作简单,无需太多培训,只需要在标本盒中加入待检测标本,系统可自动完成标本纯化、离心、DNA 提取、DNA 特异序列检测,2 h 内便可得到检测结果[14],封闭性好,不易造成交叉污染,对涂阴肺结核患者的敏感度高[15]。 多中心研究证实Xpert MTB/RIF 检测敏感度与特异度高、 耗时短,被世界卫生组织为遏制结核病推荐的检验方法[16]。本研究中对131 例涂阴肺结核组患者痰液予Xpert MTB/RIF 检测,阳性率为80.92%(106/131),肺结核确诊组中Xpert MTB/RIF 检测阳性率为82.45%(94/114),两者阳性率均高,差异无统计学意义(P >0.05)。其他肺病组中Xpert MTB/RIF 检测阳性率为0.81%(1/123)。涂阴肺结核组中Xpert MTB/RIF 检测阳性率明显高于其他肺病组,差异有高度统计学意义(P <0.01)。提示Xpert MTB/RIF 检测对肺结核患者有较高的敏感性。
TST 是结核感染诊断的一个重要参考指标[17],将结核杆菌产物注入体表,如受试者感染了结核分枝杆菌,则形成超敏反应性炎症,出现红肿、硬结[18]。 临床使用非常广泛,但其特异性受到接种卡介苗和非结核分枝杆菌的影响,且有较多的假阴性,临床意义有限[19]。 本研究中对涂阴肺结核组患者中行TST 检测,阳性率为64.89%(85/131),与涂阴肺结核组中Xpert MTB/RIF检测阳性率(80.92%)比较,明显低于涂阴肺结核组中Xpert MTB/RIF 检测阳性率,差别有统计学意义(P <0.01)。 Xpert MTB/RIF 检测对肺结核确诊组的阳性预测值为98.95%,阴性预测值为85.92%;对涂阴肺结核的阳性预测值为99.07%,阴性预测值为83.00%。说明对怀疑涂阴肺结核患者行Xpert MTB/RIF 检测对诊断有较大帮助。痰结核杆菌培养是结核病诊断金标准,本研究中, 涂阴肺结核组中痰培养检测阳性率为71.76%(94/131), 与Xpert MTB/RIF 检 测 阳 性 率[80.92%(106/131)]比较,痰培养检测阳性率明显低于Xpert MTB/RIF 检测阳性率,差异有统计学意义(P <0.05)。涂阴肺结核组中Xpert MTB/RIF 检测特异度高达99.19%(122/123),与涂阴肺结核组中痰培养检测特异度[100.00%(123/123)]比较,差异无统计学意义(P>0.05)。 但痰培养对实验室生物安全级别要求高,不能常规开展,且耗时长,培养周期为6~8 周,不利于患者的早期合理治疗[20]。 Xpert MTB/RIF 检测自动化程度高, 唯一手动操作就是将标本置入一次性标本盒内,检测报告时间2 h,比痰培养节省甚多时间[21]。
Xpert MTB/RIF 检测是一种简便、快捷、准确的检测方法[22],综合国内外的诊治报道[23-27]进展,临床应用高于TST、痰培养,可更好地辅助临床医师对涂阴肺结核患者进行早期诊断和治疗, 为结核病的控制、预防提供了有力的帮助,值得临床推广。
[1] 朱春玲,候远沛,彭素真,等.γ-干扰素体外释放试验在结核诊断中的应用评价[J].临床肺科杂志,2014,19(10):1833-1844.
[2] Vadwai V,Boehme C,Nabeta P,et al. Xpert MTB/RIF:a new pillar in diagnosis of extrapulmonary tuberculosis? [J]. J Clin Microbiol,2011,49(7):2540-2545.
[3] 李红,唐神结,史祥,等.全血γ-干扰素释放试验对涂阴肺结核诊断价值的研究[J].中华临床医师杂志:电子版,2012,6(16):4894-4895.
[4] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程[S].北京:中国协和医科大学出版社,2006.
[5] 赵雁林,王黎霞.结核分枝杆菌药物敏感性实验标准化操作程序及质量保证手册[S].北京:人民卫生出版社,2013.
[6] 张治国,欧喜超,孙倩,等.利福平耐药实时荧光定量核酸扩增技术检测痰标本中结核分枝杆菌及其耐药性的研究[J].中国防痨杂志,2013,35(1):13-14.
[7] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010 年全国第五次结核病流行病学抽样调查报告[R].中国防痨杂志,2012,34(8):485-508.
[8] 张蕴淑,侯琰.延续性护理干预对提高肺结核患者认知效果的影响[J].中国医药科学,2012,2(11):102-103.
[9] 彭朝荣.老年性肺结核50 例临床分析[J].中国医药科学,2012,2(19):163-164.
[10] 郑惠聪,陈益彪.涂阴肺结核的诊断与治疗[J].临床肺科杂志,2012,17(5):941-942.
[11] 李艳英.56 份结核杆菌涂片与培养的对比分析[J].临床肺科杂志,2011,16(10):1545-1546.
[12] 刘家云,郝晓柯.结核病实验室诊断方法新进展[J].临床检验杂志,2013,31(2):115-116.
[13] 邹远妩,刘尚武,朱蕾.Xpert Mtb/RIF 检测结核分枝杆菌及其耐药性在结核病辅助诊断中的临床价值[J].临床肺科杂志,2015,20(3):568-570.
[14] 杨藴华,韩中波.Xpert Mtb/RIF 技术在结核病诊断及耐药检测中的应用[J].中国实用医药,2015,10(7):195-196.
[15] 郑志刚.Xpert Mtb/RIF 检测结核杆菌和利福平耐药的研究及应用进展[J].应用预防医学,2014,20(2):120-121.
[16] 宋世森.利福平耐药实时荧光定量核酸扩增检测技术检测菌株和痰标本的结果分析[J].结核病与肺部健康杂志,2014,3(2):110-111.
[17] 赵红梅,张放.结核分枝杆菌特异性抗原检测在临床诊断中的意义[J].中国卫生标准管理,2015,6(1):36-37.
[18] 李卫彬,候琰,程新征.结核菌素试验的临床应用进展[J].临床肺科杂志,2014,19(4):737-738.
[19] 葛燕萍,肖和平.γ-干扰素释放试验与结核菌素皮肤试验辅助检测肺外结核病的比较[J].中国防痨杂志,2014,36(3):194-196.
[20] 王震,龚玉华,钱彩娣,等.5 种结核杆菌检测方法的临床应用价值[J].检验医学与临床,2015,12(3):334-335.
[21] 赵冰,欧喜超,夏辉.Xpert Mtb/RIF 检测技术在结核病诊断中的应用评价[J].中国防痨杂志,2014,36(6):462-464.
[22] 尹青琴,申阿东.Xpert Mtb/RIF 试验在结核病诊断中的研究现状[J].中华结核和呼吸杂志,2012,35(5):363-365.
[23] Sachdeva KS,Raizada N,Sreenivas A,et al. Use of Xpert MTB/RIF in decentralized public health settings and its effect on Pulmonary TB and DR-TB case finding in India[J].PLoS One,2015,10(5):e0126065.
[24] Rabna P,Ramos J,Ponce G,et al. Direct Detection by the Xpert MTB/RIF Assay and Characterization of Multi and Poly Drug-Resistant Tuberculosis in Guinea-Bissau, West Africa [J]. PLoS One,2015,10(5):e0127536.
[25] Iram S,Zeenat A,Hussain S,et al. Rapid diagnosis of tuberculosis using Xpert MTB/RIF assay-Report from a developing country [J]. Pak J Med Sci,2015,31(1):105-110.
[26] Pho MT,Deo S,Palamountain KM,et al.Optimizing tuberculosis case detection through a novel diagnostic device placement model:the case of Uganda[J].PLoS One,2015,10(4):e0122574.
[27] McNerney R,Cunningham J,Hepple P,et al.New tuberculosis diagnostics and rollout[J].Int J Infect Dis,2015,32:81-86.

