黄蜀葵花中黄酮类成分的含量测定及HPLC指纹图谱研究
王 妍,王宝华,鲁 冰,杨贝贝,李 萍,孟庆卿,季文琴(北京中医药大学中药学院 北京 100102)
黄蜀葵花中黄酮类成分的含量测定及HPLC指纹图谱研究
王 妍,王宝华*,鲁 冰,杨贝贝,李 萍,孟庆卿,季文琴(北京中医药大学中药学院 北京 100102)
目的 采用高效液相色谱法建立黄蜀葵花的HPLC指纹图谱,同时测定其中金丝桃苷、异槲皮苷、杨梅素和槲皮素的含量。方法 以Diamonsil C18柱(200mm×4.6mm,5μm)为色谱柱,流动相为乙腈-4mL·L-1磷酸溶液,梯度洗脱,检测波长为360nm;采用指纹图谱相似度软件进行相似度评价。结果 确定了黄蜀葵花的17个共有峰,建立了10批药材的共有图谱,并比较了样品中金丝桃苷、异槲皮苷、杨梅素和槲皮素的含量。结论 该方法灵敏度高,重复性好,结果准确。指纹图谱信息结合有效成分含量测定,可较为全面地评价黄蜀葵花的质量。
黄蜀葵花;金丝桃苷;异槲皮苷;杨梅素;槲皮素;指纹图谱
黄蜀葵花为锦葵科植物黄蜀葵Abelmoschus manihot(L.)Medic.的干燥花,其主要功效为清利湿热、消肿解毒,内服用于治疗淋浊水肿、湿热壅遏,外用治疗水火烫伤、痈疽肿毒[1-2]。研究表明,黄蜀葵花以黄酮类化合物为主要活性成分,其中以金丝桃苷、异槲皮苷、杨梅素和槲皮素的含量较高[3-4]。本实验采用HPLC法建立了同时测定黄蜀葵花中黄酮类成分金丝桃苷、异槲皮苷、杨梅素和槲皮素含量的方法[56],并比较了不同产地黄蜀葵花中黄酮类成分的含量差异;还建立了黄蜀葵花药材的HPLC指纹图谱[78],对不同产地黄蜀葵花药材指纹图谱进行对比分析,为黄蜀葵花药材质量的全面评价和有效控制提供方法参考和科学依据。
1 仪器与试药
1.1 仪器 LC-20AT高效液相色谱仪,包括四元高压梯度泵系统、紫外检测器、柱温控制系统、自动进样系统(日本岛津公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);Sartorious BT 25S型十万分之一电子分析天平(北京赛多利斯仪器有限公司)。
1.2 试药 金丝桃苷对照品(购于成都曼思特生物科技有限公司,批号:MUST-13080201);异槲皮苷对照品、杨梅素对照品、槲皮素对照品(均购于成都普菲德生物技术有限公司,批号分别为120404,121013,121120)。甲醇、乙腈、磷酸均为色谱纯;水为液相用水;其他试剂均为分析纯。黄蜀葵花药材,来源于10个不同的产地,经北京中医药大学中药学院生药系刘春生教授鉴定为锦葵科植物黄蜀葵Abelmoschus manihot(L.)Medic.的干燥花冠,10批黄蜀葵花药材来源及产地见表1。

表1 10批黄蜀葵花药材来源Tab.1 Resource of Abelmoschus manihot samples
2 方法与结果
2.1 黄蜀葵花中金丝桃苷、异槲皮苷、杨梅素、槲皮素的含量测定
2.1.1 色谱条件 色谱柱:Diamonsil C18柱(200mm ×4.6mm,5μm);流动相:乙腈-4mL·L-1磷酸溶液梯度洗脱;流速:1.0mL·min-1;检测波长:360nm;柱温:30°C。梯度洗脱条件见表2,色谱图见图1。

表2 流动相梯度洗脱程序Tab.2 The mobile phase program of gradient elution

图1 高效液相色谱图A.样品;B.金丝桃苷、异槲皮苷、杨梅素、槲皮素混合对照品;1.金丝桃苷;2.异槲皮苷;3.杨梅素;4.槲皮素Fig.1 HPLC chromatogramsA.sample of Abelmoschus manihot;B.mixed reference substances of hyperfine,isoquercitrin,myricetin and quercetin;1.hyperfine;2.isoquercitrin;3.myricetin;4.quercetin
2.1.2 对照品溶液的制备 精密称取金丝桃苷对照品3.12mg、异槲皮苷对照品3.18mg、槲皮素对照品3.17mg、杨梅素对照品3.28mg,加甲醇超声溶解,定容至25mL量瓶中,即得各单一对照品溶液。分别从每个量瓶中吸取1mL单标母液,置于10mL量瓶中,定容,即得混合对照品溶液。
2.1.3 供试品溶液的制备 精密称定10个不同产地的黄蜀葵花药材粉末(过四号筛)各约0.2g,置于具塞锥形瓶中,精密加入甲醇25mL,称定质量,超声处理(功率250W,频率30kHz)30min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即为供试品溶液。
2.1.4 线性关系考察 精密吸取金丝桃苷、异槲皮苷、杨梅素、槲皮素对照品储备液各1mL,分别置于10mL量瓶中,稀释,定容,分别精密吸取1,2,4,8,10和16μL注入液相色谱仪,测定色谱峰峰面积,以对照品进样量(X)为横坐标、色谱峰峰面积(Y)为纵坐标,进行线性回归,结果见表3。
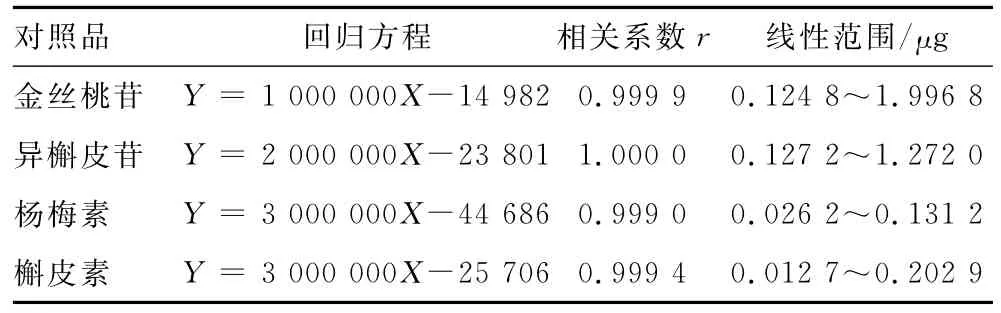
表3 线性关系考察结果Tab.3 The results of linear relationship
结果表明,金丝桃苷、异槲皮苷、杨梅素和槲皮素在线性范围内与峰面积均呈良好的线性关系。2.1.5 精密度考察 精密吸取同一供试品溶液10μL,重复进样6次,测定色谱峰峰面积,RSD分别为0.12%,0.21%,0.39%和1.27%,表明仪器精密度良好。
2.1.6 重复性考察 精密称取同一批次药材6份,分别制成供试品溶液,测定峰面积,计算含量。结果表明,金丝桃苷、异槲皮苷、杨梅素、槲皮素的平均含量分别为1.572%,0.582%,0.078%和0.064%,RSD分别为2.27%,2.20%,2.35%和2.51%,该方法重复性良好。
2.1.7 稳定性考察 精密吸取同一供试品溶液10 μL,分别在0,2,6,12,24和48h测定峰面积,RSD分别为0.86%,1.01%,1.67%和1.94%,说明样品在48h内稳定。
2.1.8 加样回收率考察 精密称取已知含量的样品0.2g,精密加入一定量金丝桃苷、异槲皮苷、杨梅素、槲皮素对照品,制成供试品溶液,测定峰面积值,计算加样回收率。结果表明,金丝桃苷、异槲皮苷、杨梅素、槲皮素的平均加样回收率分别为100.98%,103.46%,100.78%和100.24%,RSD分别为0.86%,1.00%,0.47%和1.30%,加样回收率符合实验要求。
2.1.9 样品中金丝桃苷、异槲皮苷、杨梅素、槲皮素含量测定 精密吸取供试品溶液10μL进样,测定峰面积,计算含量,结果见表4。
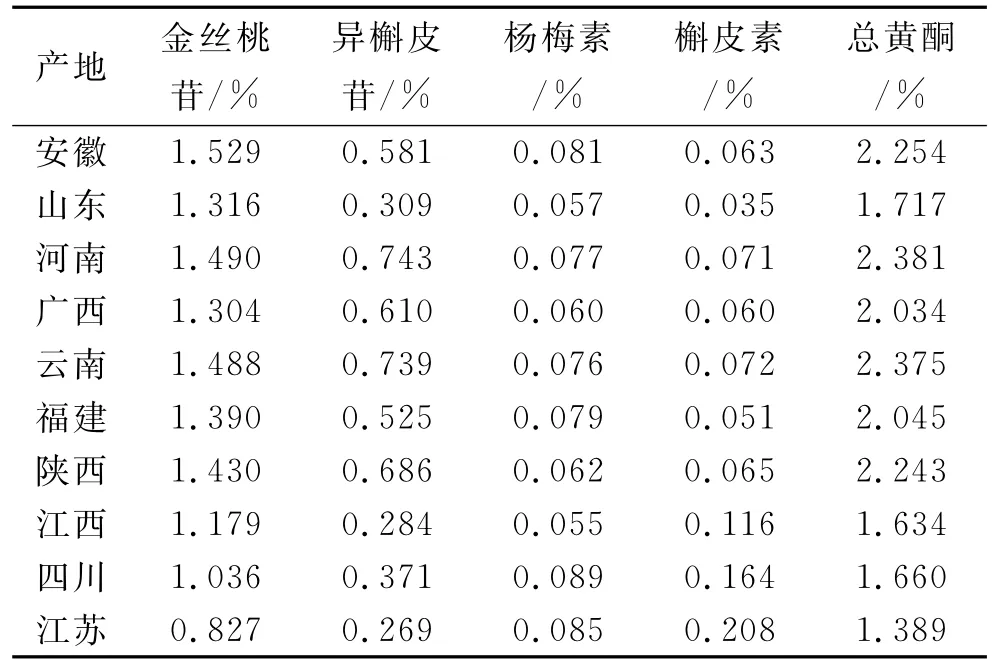
表4 不同产地黄蜀葵花中金丝桃苷、异槲皮苷、杨梅素和槲皮素含量Tab.4 The contents of hyperfine,isoquercitrin,myricetin and quercetin of Flos Abelmoschus manihot from different areas
结果表明,10批黄蜀葵花中金丝桃苷为0.827%~1.529%,异槲皮苷为0.269%~0.743%,杨梅素为0.055%~0.089%,槲皮素为0.035%~0.208%。所有药材中金丝桃苷均高于0.50%,符合《中国药典》(2010年版)对黄蜀葵花质量标准的要求。其中河南、云南产地的总黄酮含量较高,安徽、陕西、福建、广西产地次之;而安徽产地的金丝桃苷含量最高,为1.529%;河南产地的异槲皮苷含量最高,为0.743%;四川产地的杨梅素含量最高,为0.089%;江苏产地的槲皮素含量最高,为0.208%。说明不同产地的黄蜀葵花中的4种黄酮类成分的含量有差异。通过对不同产地黄蜀葵花药材中4种黄酮成分的含量测定,为初步评价黄蜀葵花药材的质量提供依据。
2.2 黄蜀葵花HPLC指纹图谱研究
2.2.1 色谱条件 色谱柱:Diamonsil C18柱(200 mm×4.6mm,5μm);流动相:乙腈-4mL·L-1磷酸溶液梯度洗脱;流速:1.0mL·min-1;检测波长:360nm;柱温:30°C。梯度洗脱条件见表5。

表5 流动相梯度洗脱程序Tab.5 The mobile phase program of gradient elution
2.2.2 精密度实验 取同一供试品溶液,重复进样6次,检测指纹图谱,采用《中药色谱指纹图谱相似度评价系统2004A版》软件进行数据分析,以金丝桃苷为参照物,计算得相似度均大于90%,17个共有峰相对保留时间RSD为0.01%~0.31%,相对峰面积RSD为0.22%~2.60%,结果表明该方法精密度良好。
2.2.3 重复性实验 取供试品溶液6份,检测指纹图谱,采用《中药色谱指纹图谱相似度评价系统2004A版》软件进行数据分析,以金丝桃苷为参照物,计算得相似度均大于90%,17个共有峰相对保留时间RSD为0.02%~0.62%,相对峰面积RSD为0.47%~2.95%,结果表明该方法重复性良好。
2.2.4 稳定性实验 取同一供试品溶液,分别在0,2,6,12,24和48h进样,检测指纹图谱,采用《中药色谱指纹图谱相似度评价系统2004A版》软件进行数据分析,以金丝桃苷为参照物,计算得相似度均大于90%,17个共有峰相对保留时间RSD为0.02%~0.78%,相对峰面积RSD为0.94%~2.90%,结果表明样品在48h内比较稳定。
2.2.5 指纹图谱的测定 精密吸取对照品溶液、供试品溶液各10μL,注入高效液相色谱仪,检测指纹图谱。样品溶液和混合对照品溶液的HPLC图见图2。

图2 HPLC指纹图谱A.样品;B.金丝桃苷、异槲皮苷、杨梅素、槲皮素混合对照品;10.金丝桃苷;11.异槲皮苷;15.杨梅素;17.槲皮素Fig.2 HPLC fingerprints chromatogramsA.sample of Abelmoschus manihot;B.mixed reference substance of hyperfine,isoquercitrin,myricetin and quercetin;10.hyperfine;11.isoquercitrin;15.myricetin;17.quercetin
通过比较样品图与对照品图,对样品图中的色谱峰进行标定,样品图中保留时间为32.528,34.892,46.291和58.706min处的色谱峰即10,11,15和17号峰分别为金丝桃苷、异槲皮苷、杨梅素、槲皮素对照品的色谱峰。结合有关文献推测,谱图中14和16号峰可能是槲皮素-3′-O-葡萄糖苷和棉皮素-8-O-β-葡萄糖醛酸苷[9-11],但还需进一步地研究和确定。
2.2.6 指纹图谱的生成及相似度评价 按上述色谱条件对10批黄蜀葵花药材进行分析检测,采用《中药色谱指纹图谱相似度评价系统2004A版》,对10批黄蜀葵花药材的HPLC图谱进行分析,分别进行时间窗的设定、谱峰匹配,共标定了17个共有峰,见图3。指纹图谱中单峰面积大于或等于5%总峰面积的色谱峰有5个,分别为10,11,12,14和16号峰,其他的峰单峰面积均小于5%。以金丝桃苷色谱峰为参照峰S,对各共有峰的相对保留时间和相对峰面积进行统计,17个共有峰相对保留时间RSD为0.03%~0.63%,各产地药材共有峰保留时间一致。10个不同产地黄蜀葵花药材的指纹图谱相似度为90%以上,不同产地药材图谱具有很高的相关性,表明不同产地黄蜀葵花药材质量有较好的相似性。各产地黄蜀葵花药材相似度见表6。
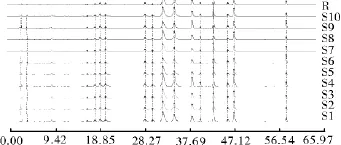
图3 10批黄蜀葵花药材HPLC指纹图谱Fig.3 HPLC fingerprints for 10batches samples

表6 10批黄蜀葵花样品相似度Tab.6 Similarities for 10batches samples
3 讨论
本实验采用HPLC法快速地测定了黄蜀葵花中主要活性成分的含量,结果准确可靠,重复性好,为进一步研究黄蜀葵花药材中黄酮类成分与药效的相关性奠定研究基础;并通过对10批样品的分析,初步建立了具有17个共有峰的黄蜀葵花药材高效液相指纹图谱,在短时间内较好地实现了黄蜀葵花中主要活性成分的分离,操作简单易行,灵敏度高,为制定该药材质量标准、研究和开发利用该药材资源提供科学依据。
[1]国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010:287.
[2]刘爽,江蔚新,吴斌.黄蜀葵化学成分及药理活性研究进展[J].中国现代中药,2010,12(8):5-8.
[3]刘子修,李燕思,周艳萍,等.黄蜀葵花化学成分与药动学研究进展[J].中南药学,2012,10(11):839-841.
[4]张元媛,贾晓妮,曹永翔,等.黄蜀葵花化学成分研究[J].西北药学杂志,2008,23(2):80-82.
[5]杨志芳,王维娜,杨坤,等.HPLC法测定不同产地黄蜀葵花中金丝桃苷、异槲皮苷及槲皮素-3′-葡萄糖苷含量[J].解放军药学学报,2005,21(5):388-390,393.
[6]蒋建春,朱华云.HPLC法测定不同产地黄蜀葵花中黄酮类成分含量[J].药学与临床研究,2010,18(6):537-539.
[7]石芸,池玉梅,谈献和,等.黄蜀葵花HPLC指纹图谱及金丝桃苷、槲皮素含量测定研究[J].西北药学杂志,2011,26(6):399-402.
[8]徐柏颐,谈献和,朱华云,等.黄蜀葵花HPLC指纹图谱研究[J].中药材,2011,34(6):888-890.
[9]池玉梅,朱华云,居羚,等.高效液相-四级杆飞行时间串联质谱分析黄蜀葵花中黄酮醇类化合物[J].分析化学,2009,37(2):227-231.
[10]池玉梅,居羚,朱华云,等.基于HPLC-ESI/Q-TOF MS/MS的中药中黄酮类成分识别[A].药用植物化学与中药有效成分分析研讨会论文集(上)[C].2008:151-155.
[11]池玉梅,居羚,朱华云,等.高效液相-四级杆飞行时间串联质谱识别黄蜀葵花的成分[A].2008南京国际中医药论坛论文集[C].2008:385-389.
Determination of flavonoids and HPLC fingerprint of Flos Abelmoschus manihot
WANG Yan,WANG Baohua*,LU Bing,YANG Beibei,LI Ping,MENG Qingqing,JI Wenqin(School of Medicine,Beijing University of Chinese Medicine,Beijing 100102,China)
Objective To establish HPLC fingerprint of Flos Abelmoschus manihot and to determine the content of hyperfine,isoquercitrin,myricetin and quercetin.Method Separation was performed on a Diamonsil C18(200mm×4.6mm,5μm)chromatographic column,acetonitrile-4mL·L-1phosphoric acid as the mobile phase with gradient elution.The detection wavelength was at 360nm and the data was processed on the similarity of fingerprint software.Result 17common peaks in chromatograms were separated from 10batches samples.The common pattern was established,and the comparison of hyperfine,isoquercitrin,myricetin and quercetin in the samples was made.Conclusion The method is sensitive,repeatable and accurate.Fingerprint of the effective constituents could be used to control the quality of Flos Abelmoschus manihot availably.
Flos Abelmoschus manihot;hyperfine;isoquercitrin;myricetin;quercetin;fingerprint
10.3969/j.issn.1004-2407.2015.04.005
R284
A
1004-2407(2015)04-0345-05
2015-03-10)
北京中医药大学中药复方制药研究创新团队项目
王妍,女,在读硕士研究生
*通信作者:王宝华,女,教授,硕士生导师

