思茅松种子园遗传多样性的RAPD分析*
朱云凤,陈少瑜,郝佳波,2,吴 涛,2
(1.云南省林业科学院,云南 昆明650201;2.云南省森林植物培育与开发利用重点实验室;国家林业局开放性重点实验室云南珍稀濒特森林植物保护和繁育实验室,云南 昆明650201)
思茅松 (Pinus kesiya var.langbianensis)为松科(Pinaceae)松属 (Pinus)树种,常绿乔木,通常树体高达20~30 m,胸径60 cm,树冠广圆形;树皮褐色,裂成龟甲状薄块片脱落;枝条一年生长两轮或多轮;主要速生用材树种之一。是中国亚热带西部山地林木的代表类型。思茅松树干通直,木材纹理好、变形小、出材率高、材质优良,常用于建筑、造纸、制作家具、制胶合板等。活立木可采取松脂,树皮可提取栲胶,思茅松产脂量较高,产出的松香和松节油品质好,是云南主要用材和采脂树种,具有较高的经济、生态和社会价值[1]。目前云南省思茅松的立木蓄积量9 306×104m3,松香年蓄积量为11.5 × 104t[2]。RAPD(random amplified polymorphic DNA,RAPD)是1990年由美国杜邦公司科学家Williams和加利福尼亚生物研究所的Welsh等发明的一种分子标记技术[3~5]。近年来RAPD已成功应用于植物遗传分析的各个方面,如遗传多样性和系统发育研究、目的基因的定位与分子标记的辅助育种、品种鉴定、遗传作图和DNA指纹图谱等方面[6~23]。目前思茅松在种源选优[24]、同工酶分析[8~9]、产脂优树选优[25]等方面研究进展显著,但RAPD标记在思茅松的遗传关系方面的相关研究报道甚少,鉴于此,作者以思茅松85个优良无性系为研究对象,在以思茅松优化RAPD技术的基础上,进行遗传多样性分析,为思茅松标记辅助的优良无性系鉴定、早期选择、杂交亲本的选配和育种群体的多样性评价提供技术支持。
1 材料和方法
1.1 材料
试验材料采自云南省西双版纳自治州普文林场内的思茅松优树汇集区。该林场地处北纬22.24°~22.26°,东经 101.04°~ 101.06°,海拔 800 ~ 1 354 m,年平均气温 20.1℃,年降水量 1 655.3 mm,土壤为赤红壤。
本次试验共采集122个优良无性系中的85个无性系,每个无性系随机采集1个单株上木质化程度较低的新梢,放入装有硅胶的自封袋中,标号,带回实验室,保存于-30℃冰箱保存作为分子标记试验的材料备用。这85个优良无性系分别来自7个天然居群,它们分别是景东者后、墨江通关永马、思茅蔓歇坝和思茅木乃河、景谷县碧安、普洱一工段、普洱二工段。居群编号、各居群对应无性系号、居群所在地以及无性系数量见表1。

表1 85个优良无性系及来源Tab.1 85 Pinus kesiya var.langbianensis superior clones from different provenances
7个居群所在的5个县分别是普洱市思茅区、墨江哈尼族自治县、景谷傣族自治县和景东彝族自治县,其中居群1、6来自思茅区,居群2来自景东县,居群3、7来自宁洱县,居群4来自景谷县,群体5来自墨江县。
1.2 试验方法
1.2.1 思茅松基因组DNA提取
采用Solarbio试剂盒提取思茅松基因组DNA。
1.2.2 RAPD-PCR 扩增及引物筛选
通过初筛和复筛,从北京奥科鼎盛生物科技有限责任公司合成的120条引物中筛选出稳定性强,多态性高的引物用于所有样品的RAPD-PCR扩增[26~27]。
20 μL的RAPD反应体系含20~60 ngDNA模板1.0 uL,10 μM 引物 1.0 μL,2 × Taq PCR MasterMix 10 μL,无菌 ddH20 8.0 μL。热反应的基本程序为:94℃预变性5 min;94℃变性30 s;复性45 s,温度从Tm+5℃在10次循环内逐步降至Tm-5℃ (每1次循环退火温度降低1℃),72℃延伸2 min,10个循环;之后Tm℃复性45 s,72℃延伸2 min,25个循环;最后72℃延伸7 min;4℃保存。
1.2.3 扩增结果电泳及记录
用筛选出的引物对所有无性系样本进行RAPD-PCR扩增,通过琼脂糖凝胶电泳检测,照相,记录结果。
1.3 遗传多样性及聚类分析
统计产生多态位点的引物在7个居群中扩增的电泳带总数与多态带的数目。无性系指纹图谱中的每一条带作为一个分子标记,同一个位点上以出现条带记为“1”,不出现为“0”来记录,将图谱数据转化为0/1数据矩阵。采用 POPGENE32和MEGA2软件计算多态位点百分率PPB、平均每个位点的有效等位基因数Ne、Nei’s基因多样指数H和Shannon’s多样性信息指数I等多样性指标,以及遗传距离 (GD)和Nei’s遗传相似性度 (I),并构建各无性系以及各居群的遗传关系UPGMA聚类树状图。
2 结果与分析
2.1 RAPD扩增及引物筛选结果
基于1.2.2的扩增体系和反应程序,从120条引物中筛选出的20条稳定性强、多态性高的引物,用于所有样品的扩增。20条引物及扩增结果见表2,引物C13对部分试验材料的扩增结果见图1。

表2 各引物多态性位点Tab.2 Each primer polymorphisms(SNPs)
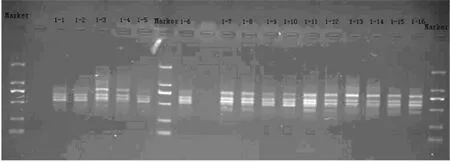
图1 C13对部分无性系的扩增结果Fig.1 RAPD-PCR based on Primer C13
由于退火温度是影响RAPD技术稳定性的主要因素的特点,在体系优化要特别注意退火温度的选择,具体是根据连续两次梯度PCR,进行退火温度的筛选。选择为连续两次PCR扩增结果一致的温度作为PCR的退火温度,温度为37℃。
2.2 7个居群的思茅松种子园的遗传多样性
本项研究所收集的7个居群的多态位点百分率PPB、平均每个位点的有效等位基因数Ne、Nei’s基因多样指数H和Shannon’s多样性信息指数I的结果见表3。从表3可以看出,7个居群的多态位点百分率PPB的范围是22.85% ~73.57%,平均值59.48%;平均每个位点的有效等位基因数Ne的范围是 1.228 6 ~ 1.402 9,平均值 1.350 3;Nei’s基因多样指数 H 的范围是0.114 3 ~0.243 3,平均值0.206 3;Shannon’s多样性信息指数I的范围是 0.158 4 ~0.369 4,平均值 0.310 0。其中居群5(墨江通关永马,16个无性系)的遗传多样性水平最高,PPB、Ne、H、I分别为 73.57%、1.402 9、0.243 3、0.369 4。其次是居群 1(思茅曼歇坝,19个无性系),PPB、Ne、H、I分别为70.71%、1.361 7、0.221 3、0.339 9。而居群 3(普洱二工段,2个无性系)的遗传多样性水平最低,PPB、Ne、H、I分别为 22.85%、1.228 6、0.114 3、0.158 4。其次是居群 4(景谷碧安,13个无性系),PPB、Ne、H、I分别为 57.14%、1.346 2、0.205 4、0.307 4。

表3 各居群的遗传多样性指标Tab.3 Genetic diversity index of each population based on RAPD
2.3 7个居群的遗传关系及聚类
用POPGENE32软件对由85个样本组成的来自7个种源地的居群所有条带的“0、1”矩阵进行分析,得到样本间的遗传距离I和Nei’s遗传一致度D,结果见表4。

表4 7个居群基于RAPD的Nei’s遗传一致度和遗传距离Tab.4 Nei’s genetic identity and genetic distance of 7 populations based on RAPD
由表4可知,这7个居群的遗传距离范围是0.030 6~0.150 9。其中遗传距离最近的是居群5(墨江通关永马),遗传距离为0.038 5和居群6(思茅木乃河),遗传距离为0.030 6。遗传距离最远的则是居群3(普洱二工段),遗传距离为0.142 3和居群4(景谷碧安),遗传距离为0.150 9。
基于表4中的遗传距离绘制聚类图 (图2)。由图2可知,来自不同种源地的各居群之间的遗传关系及聚类结果。在遗传距离约0.08以上,可将7个居群分成3个类群。其中居群3(普洱二工段,2个无性系)为1个类群,居群4(景谷碧安,13个无性系)、居群5(墨江通关永马,16个无性系)和居群6(思茅木乃河,9个无性系)组成第2个类群,而居群1(思茅曼歇坝,19个无性系)、居群2(景东者后,13个无性系)和居群7(普洱一工段,13个无性系)则组成第3个类群。

图2 7个居群的RAPD标记的聚类分析树状图Fig.2 Dendrogram of RAPD markers of 7 populations
3 结论与讨论
(1)思茅松种子园收集的优良无性系保存了思茅松种质资源丰富的遗传多样性
85个无性系的多态位点百分率PPB为87.85%,平均每个位点的有效等位基因数 Ne为1.451 7,Nei’s基因多样指数 H 为0.274 9,Shannon’s多样性信息指数I为0.420 2。数据表明思茅松种子园收集的优良无性系保存了思茅松种质资源丰富的遗传多样性。
姜远标[7]等人曾研究的20个思茅松家系,其多态位点百分率PPB仅为43.87%,表明该种子园优树汇集区的85个思茅松无性系的遗传多样性远高于之前研究的20个家系。姜远标等人之前研究20个家系与本研究的85个无性系中的20个无性系有相同的母本,且研究中每个家系只采集了1个单株进行研究,所以此研究结果也正好印证了85个思茅松无性系更加丰富的遗传基础。
此外,对比其他研究者对松属其他植物油松(Pinus tabuleaformis)和马尾松 (P.massoniana)的RAPD标记研究,其多态位点百分率PPB大于其他3位研究者研究的油松和马尾松;平均每个位点的有效等位基因数Ne大于赵飞等研究的油松[20],但小于万爱华等研究的马尾松[18];Nei’s基因多样指数H小于其他3位研究者研究的油松和马尾松[18~20];Shannon’s多样性信息指数 I也小于其他3位研究者研究的油松和马尾松。总之,这几项衡量遗传多样性的指标与其它已研究的松属植物相比,并未明显小于其他松属植物的这些遗传多样性指标,因此可以说,思茅松种子园内优树汇集区的85个无性系与其他省份的油松种子园、油松天然居群和马尾松种子园的的遗传多样性相当。此外,来自3个种源地的油松[19]以及来自8个种源地的马尾松[18],特别是来自4个省的12个天然居群的油松[20],其研究者都得出了遗传多样系丰富的结论,而它们的遗传多样性指标并未高于本研究的85个思茅松无性系,因此,云南省林业科学院普文试验林场思茅松种子园收集的优良无性系保存了思茅松丰富的遗传多样性,为其进一步遗传改良提供了基础。
本研究结果显示,7个居群的遗传多样性水平从高到低排列依次是居群5>居群1>居群7>居群2>居群6>居群4>居群3。从这个排列次序也可看出各居群对整体遗传多样性的贡献程度。而各居群遗传多样性的大小与选优母本所在的天然居群大小、分布、选择优树的数量及分子标记分析的无性系数量等因素有关,此结果可以为今后试验对象的选择提供依据。居群3在本次试验中因客观条件的限制,取样过少,导致居群3的遗传多样性参数偏低。
(2)基于RAPD分子标记的遗传距离及聚类分析为思茅松杂交群体的选择提供参考
由图2的结果可以看出各居群之间的遗传关系,并将7个居群分为遗传差异较明显的3大类群,居群3相对其他居群的遗传距离最大。而居群4、居群5和居群6之间的遗传距离较小,可归为一类;居群1、居群7和居群2之间的遗传变异也较小,可归为另一类;而这两类居群之间的遗传变异则相对较大。此结果可为杂交群体的选择提供分子水平上的依据。
依据此关系可以为育种时杂交亲本的选配提供参考。例如,当根据需要选择居群3内的各无性系作为杂交的父本材料时,由图2就可以看出居群3内的各无性系与其它各无性系的遗传关系,根据远交优势的原理,在选择与之杂交的母本时,就应该选择与居群3内各无性系遗传距离尽可能远的无性系,这样杂交之后得到优秀子代的可能性将会更大。
此外,临近的两个县之间的距离最多不超过100 km。思茅松属风媒传粉植物,其传粉距离较远,居群之间应存在一定程度的基因交流。将各居群的遗传距离和聚类图与7个居群所在的5个县的空间距离相比较发现,各居群的空间距离和遗传距离之间并没有表现出明显的相关关系,即空间距离远的两个居群,其遗传距离并不一定大,而空间距离近的两个居群,其遗传距离并不一定小。这说明空间距离不是影响这7个居群间遗传距离的主要因素。其原因与思茅松的繁殖机制以及各居群所在地的地形、风向、动物活动或地理变迁等因素有关。例如地形的原因,空间距离较近的两个居群之间若存在山川,它们之间的基因交流就会受到影响,由此两个居群之间的遗传距离反而会较远。
[1]吴征镒,郑万钧,傅立国.中国植物志[M].北京:科学出版社,1978:259.
[2]李思广,蒋云东,李 明.思茅松树脂道数量与产脂力回归关系研究[J].福建林业科技,2007,34(1):59-62.
[3]Grodzicker T,Williams J,Sharp P,et al.Physical mapping of temperature-sensitive mutations of adenovirus[J].Cold Spring Harbor Symp.Quant.Biol,1975,34:439-446.
[4]Welsh J,MoClel M.Fingerprinting genomes using PCR which arbitrary primes[J].Nucleic Acids Research,1990,18:7213-7218.
[5]Williams J G,Kubelik A R,Livak K J,et al.DNA polymorphism amplified by arbitrary primers are usefull as genetic markers[J].Nucleic Acids Research,1990,18:6531-6535.
[6]姜远标,吴 涛,陈少瑜,等.思茅松RAPD反应体系的优化[J].东北林业大学学报,2007,35(9):16-18.
[7]姜远标,陈少瑜,吴 涛.思茅松优良家系的分子遗传变异[J].中南林业科技大学学报,2007,27(6):109-113.
[8]陈少瑜,赵文书,王 炯.思茅松天然种群及其种子园的遗传多样性[J].福建林业科技,2002,29(3):1-5.
[9]陈少瑜,赵文书,张树红.思茅松种子园遗传结构及遗传多样性[J].云南大学学报(自然科学版),2001,23(6):472-477.
[10]许玉兰,段安安.思茅松遗传改良研究现状及育种策略的探讨[J].西南林学院学报,2004,24(4):69-71.
[11]陈灵芝.中国的生物多样性-现状及其保护对策[M].北京:科学出版社,1993:31-113.
[12]王忠华.DNA指纹图谱技术及其在作物品种资源中的应用[J].分子植物育种,2006,4(3):425-430.
[13]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:145-146.
[14]高 翔,庞红喜,裴阿卫,等.分子标记技术在植物遗传多样性研究中的应用[J].河南农业大学学报,2002,36(4):358-359.
[15]曹雅男,李庆章,孙 岳,等.正品龙胆遗传多样性的 RAPD 及 ISSR分析[J].中草药,2005,36(1):100-104.
[16]Qian Wei,Ge Song ,HONG De-Yuan.Assessment of genetic variation of Oryza gr anulata detected by RAPDs and ISSRs[J].Acta Botanica Sinica,2000,42(7):741-750.
[17]Zhang Zhi-yong,Chen Yong-yan,Li De-zhu.Detection of Low Genetic Variation in a Critically Endangered Chinese Pine,Pinus squamata,Using RAPD and ISSR Markers[J].Biochemical Genetics,2005,43(5-6):239-249.
[18]万爱华,徐有明,管兰华,等.马尾松无性系种子园遗传结构的RAPD分析[J].东北林业大学学报,2008,36(1):18-22.
[19]陈建中,葛水莲,杨明建.太行山东麓油松种子园遗传多样性的RAPD分析[J].北方园艺,2010(7):130-132.
[20]赵 飞,樊军锋,杨培华,等.12个油松种群遗传多样性的RAPD分析[J].北方园艺,2011(11):112-116.
[21]赵 静,田义轲,王彩虹,等.与苹果果皮红色性状相关的RAPD分子标记的筛选[J].果树学报,2006,23(2):165-168.
[22]张虎平,虎海防,牛建新,等.新疆核桃早实特性及RAPD 分析[J].西北植物学报,2005,25(11):2157-2162.
[23]苏晓华,奎 金,陈伯望,等.杨树叶片数量性状相关联标记及其图谱定位研究[J].林业科学,2000,36(1):33-40.
[24]舒筱武,李瑞安,高 仪,等.思茅松地理种源试验初报[J].云南林业科技,1985(2):20-25.
[25]翁海龙,陈宏伟,段安安.思茅松高产脂优树选择[J].西北林学院学报,2010,25(3):71-74.
[26]吴 涛,陈海云,陈少瑜,等.八角 ISSR-PCR反应体系的建立及引物筛选[J].西部林业科学,2013,42(2):8-13.
[27]蔡年辉,吕学辉,贺 斌,等.云南松SSR-PCR反应体系的优化研究[J].西部林业科学,2013,42(6):57-61.

