降胆固醇的活性成分及其机理研究进展
朱东宏,周春霞,洪鹏志
(广东海洋大学食品科技学院,广东湛江 524088)
降胆固醇的活性成分及其机理研究进展
朱东宏,周春霞*,洪鹏志
(广东海洋大学食品科技学院,广东湛江 524088)
血液中胆固醇含量高是诱发人类心血管疾病的主要因素之一。近年来,具有降低血液中胆固醇含量的功能食品逐渐成为研究热点。胆固醇在人体内的代谢是一个相对复杂的过程,包括胆固醇的吸收、合成、分解和排泄等,降低胆固醇的功能食品在一定程度上能降低血液中胆固醇的含量。综述了降低胆固醇功能食品的活性成分及其作用机理,如尼曼-匹克C1型类似蛋白1(NPC1L1)抑制剂、酰基辅酶A-胆固醇酰基转移酶(ACAT)抑制剂和3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂等,旨在提高其在食品行业的应用。
功能食品;胆固醇;活性成分;作用机理
近年来,高胆固醇、高脂肪食物越来越多出现在餐桌上,造成人体胆固醇过量,从而引发动脉粥样硬化、高血压、冠心病等一系列心血管疾病。目前,我国心脑血管疾病患者大约有2.9亿,每5个成年人中就有1人患心脑血管疾病,而且发病越来越年轻化[1]。面对如此庞大的数量,中国工程院院士高润霖教授表示:靠治疗将负担沉重,只有转变医疗模式,以预防为主才是出路。大量的临床实践表明,降胆固醇功能食品(如燕麦、大豆、山楂、茶、大蒜等)对于预防心血管疾病有显著作用。Bell等[2]研究表明燕麦β-葡聚糖有吸收胆汁和促进胆汁酸排出体外的作用,从而使胆固醇向胆汁酸转化,有效抑制血清中胆固醇的上升。崔洪斌等[3]研究发现大豆异黄酮可以提高去卵巢大鼠血液中高密度脂蛋白(HDL)水平,并降低血浆中总胆固醇水平。刘北林等[4]研究发现山楂黄酮能显著提高大鼠血清高密度脂蛋白,并降低血清低密度脂蛋白,从而使血清中胆固醇含量降低。笔者综述了胆固醇的代谢途径及降胆固醇功能食品的活性成分与7种主要的作用机理,旨在为流行病学研究提供依据,并提高功能食品在生活中的应用。
1 胆固醇的代谢途径
人体内的胆固醇分为内源性胆固醇和外源性胆固醇。内源性胆固醇主要在肝脏和各组织细胞的胞浆中合成,外源性的胆固醇主要来自动物性食物(如蛋黄、肉、肝、脑等)。近年来,研究表明人体70%以上的胆固醇来源于体内自身合成,外源性的胆固醇仅占1/4左右,人体每天大约有1 200~1 700 mg的胆固醇进入到小肠内腔中[5],小肠中胆固醇(Cholesterol,C)的吸收开始于转运蛋白NPC1L1。NPC1L1好比一辆运输车装载着胆固醇,在肝脏和小肠细胞上来回运送。当进入小肠上皮细胞后,胆固醇在ACAT2的作用下酯化成胆固醇酯(Cholesteryl ester,CE)。随后,微粒体甘油三酯转运蛋白(Microsomal triglyceride transfer protein,MTP)将CE包裹变成乳糜微粒(Chylomicrons,CM)。最后,CM通过淋巴系统进入到血液里[6-7](图1)。
人体内胆固醇的减少主要是通过转化与排泄。每天约有50%的胆固醇在肝脏中转化成胆汁酸盐、类固醇激素和维生素D前体物质等。胆固醇排出体外主要通过3条路径:①以胆汁酸盐的形式随胆汁排出体外或直接随胆汁排出。②通过三磷酸腺苷结合盒转运体G5和G8(The ATP-binding cassette transporters sub-family G member 5 and 8,ABCG5/8)带离肠道排出体外。③随粪便排出体外。当胆固醇的代谢发生紊乱时会导致某些疾病。大量的临床及试验研究结果都证实,血浆胆固醇代谢紊乱会导致血浆中极低密度脂蛋白的升高,这已是公认的动脉粥样硬化病理机制[8]。肝脏中胆固醇合成与分解代谢的紊乱会导致胆固醇的过饱和结晶析出,使得胆固醇含量升高,这是胆固醇结石形成的重要原因之一[9]。目前,降低血浆胆固醇已是心脑血管疾病预防的常规手段,而功能食品降胆固醇的机制也得到越来越多人的关注。
2 功能食品降胆固醇的活性成分及其作用机理
近年来,流行的降胆固醇功能性食品种类繁多,其活性成分与作用机理也不尽相同。常见的活性成分主要有大蒜素、花青素、三萜酸、儿茶素、β-葡聚糖等。这些活性物质降胆固醇的机理又可以大致分为7类:尼曼-匹克C1型类似蛋白1(NPC1L1)抑制剂、酰基辅酶A-胆固醇酰基转移酶(ACAT)抑制剂、3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂、低密度脂蛋白(LDL)受体调节、胆汁重吸收抑制剂、胆固醇7α-羟化酶(CYP7A1)催化剂、胆固醇脂转运蛋白(CETP)抑制剂。降胆固醇主要的功能食品及其活性成分与作用机理见表1。
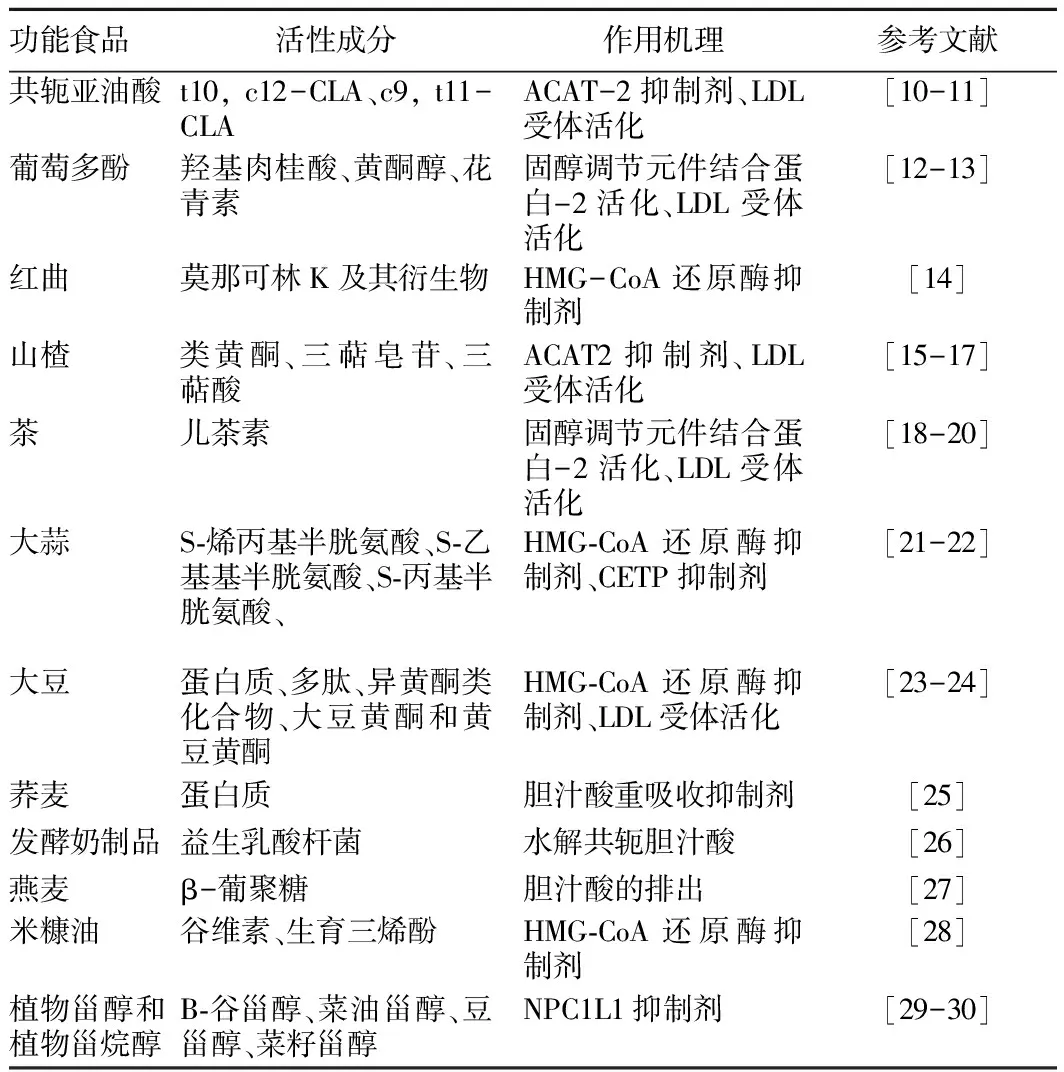
表1 降胆固醇功能食品的活性成分及其作用机理
2.1 尼曼-匹克C1型类似蛋白1(NPC1L1)抑制剂尼曼-匹克C1型类似蛋白1(Niemann-Pick type C1 like 1,NPC1L1)是一种跨膜蛋白,是肠道吸收固醇类脂质尤其是外源性胆固醇的关键转运蛋白,对胆固醇的代谢起着重要作用[31]。功能食品的活性成分能有效抑制NPC1L1的活性,从而减少肠道对胆固醇的吸收。研究表明,鱼油中的多不饱和脂肪酸(如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA))能促进胆固醇的排出并通过激活氧化物酶体增殖体活化受体A(PPARA)下调NPC1L1蛋白基因的表达,抑制胆固醇膜内的转运,从而使血浆胆固醇含量降低[32];益生菌(如乳酸菌和双歧杆菌等)通过下调NPC1L1蛋白基因来降低小肠细胞对胆固醇的吸收[33];姜科植物的根茎提取物姜黄素也能下调NPC1L1在mRNA水平和蛋白水平的表达,抑制胆固醇的吸收,实现降血脂的作用[34];人造奶油、动物油脂和植物油脂中的植物甾醇与胆固醇的结构相似,在肠道细胞中与胆固醇共同竞争NPC1L1,减少小肠内胆固醇的吸收,使胆固醇直接排出体外。此外,ABCG5/8能将肠道中过多的植物甾醇带离肠道细胞并排出体外[35]。
2.2 酰基辅酶A-胆固醇酰基转移酶(ACAT)抑制剂酰基辅酶A-胆固醇酰基转移酶(ACAT)在生物体内催化胆固醇与长链脂肪酸发生酯化反应生成胆固醇酯。ACAT在动物体内有2种同工酶:ACAT1和ACAT2[36],其中ACAT2主要参与胆固醇的吸收。一般认为,功能食品特异性地抑制ACAT2能减少胆固醇的吸收和运输,防止胆固醇酯化,减少胆固醇酯在动脉壁上积蓄,最终阻止动脉粥样硬化的形成[37]。研究表明,山楂中的三萜酸能明显抑制肠道中ACAT的活性,降低血浆胆固醇含量。在仓鼠和兔子试验中,已经证实三萜酸是有效的ACAT抑制剂[38];柑橘类黄酮素和柚皮素也对降低ACAT活性有显著作用,并能有效降低小鼠血浆的胆固醇含量;日常饮食中的共轭亚油酸(Conjugated linoleic acid,CLA)[10]是一组位置和几何异构的十八碳共轭二烯酸,具有下调肠道中ACAT的活性的功能;肝脏中的植物激素与染料木苷也能功能性地抑制ACAT活性。
2.3 3-羟基-3-甲基戊二酰辅酶A还原酶(HMG-CoA Reductase)抑制剂HMG-CoA还原酶是生物体内合成胆固醇的限速酶。2分子的乙酰辅酶A在HMG-CoA还原酶的催化下生成甲羟戊酸(Mevalonate),作为合成内源性胆固醉原料的甲羟戊酸再经反应生成异戊二烯(Isoprene)与三十碳六烯(Squalene),最终合成胆固醇[5](图2)。研究表明,功能食品活性成分能调控HMG-CoA还原酶的表达方式,并特异性抑制HMG-CoA还原酶的活性,使得内源性胆固醇的合成量减少。例如,水溶性膳食纤维中的短链脂肪酸能抑制HMG-CoA还原酶的活性,其机理在于水溶性膳食纤维可以在结肠中进行发酵,生产出一系列短链脂肪酸(包括乙酸、丙酸和丁酸),其中丙酸可以在结肠内被吸收并流传到肝脏,抑制肝脏中HMG-CoA还原酶的活性,从而降低胆固醇的生物合成[39];由红曲霉发酵大米制成的红曲含有活性成分莫那可林K,能有效抑制HMG-CoA还原酶的活性,降低血浆胆固醇的含量[14];米糠和薏米中的生育三烯酚是一种有效的HMG-CoA还原酶抑制剂[28];从发酵或未发酵的大豆中分离出来的金雀异黄酮、大豆苷元、黄豆黄素都能抑制HMG-CoA还原酶的活性[23]。
2.4 低密度脂蛋白(LDL)受体调节低密度脂蛋白(LDL)是携带胆固醇最多的脂蛋白,由极低密度脂蛋白(Very low-density lipoproteins,VLDL)转化而来。若血液中低密度脂蛋白胆固醇浓度过高,则会在心脑等部位血管的动脉壁上沉积,形成动脉粥样硬化等疾病。体内过量的LDL主要是通过受体介导途径来消除,LDL受体的作用是介导LDL的摄取和代谢,功能食品的活性成分则主要是通过上调LDL受体的活性来达到降低血浆胆固醇含量的目的。研究表明,共轭亚油酸中的活性成分c9,t11-CLA和t10,c12-CLA在动物试验中能调节LDL受体的活性,降低胆固醇含量。研究还发现,共轭亚油酸能减少人体癌症的发病率,降低人体内储存的脂肪含量,增加人体的免疫能力等生理功能[10];大豆中的活性成分异黄酮在动物细胞中也能有效上调LDL受体的活性[40];此外,红酒中的红酒多酚能显著增加LDL受体结合的活性和其基因的表达。这是因为红酒多酚主要调节了脂蛋白的代谢途径。因此,适量的饮用红酒可以降低患心血管疾病的风险[12];茶叶中的儿茶素降低胆固醇的能力已经得到了广泛认可,这是因为儿茶素能使肝脏中LDL受体的活性得到提高[19];在山楂中的三帖酸、山楂酊(TCR)、黄酮类化合物、三萜皂苷和胺类等物质都已经被证实能使得肝脏中LDL受体的活性得到上调,使得更多的血浆胆固醇流入肝脏,从而降低血浆中的胆固醇水平[15-17]。
2.5 胆汁酸螯合剂胆汁酸螯合剂也称为胆汁酸重吸收抑制剂。人体每日需要12~32 g胆汁酸来消化肠道内脂类食物,而胆固醇合成胆汁酸的能力仅为0.4~0.6 g,此时机体就会对胆汁酸进行回收利用。胆汁酸螯合剂能与胆汁酸在肠道中结合,并抑制其重吸收,使得血浆中的胆固醇流入肝脏,合成更多的胆汁酸,从而使胆固醇浓度降低。研究发现,许多降胆固醇功能食品在人体内充当着胆汁酸螯合剂的作用,如燕麦中的β-葡聚糖(β-glucan)是燕麦降低胆固醇的活性因子,其作用机理主要是因为β-葡聚糖降低了胆汁酸的重吸收并增加了胆汁酸的排泄,现今燕麦已成为普遍接受的降胆固醇功能食品[27];日常饮食中,钙能如螯合剂一样与胆汁酸结合生成沉淀物,减少胆汁酸的重吸收并增加其排泄,从而使血浆中胆固醇含量得到降低;水溶性纤维在肠道中与胆汁酸具有一样的功能,所以水溶性纤维能抑制胆汁酸的重吸收,降低胆固醇含量;某些由乳酸菌、双歧杆菌、肠球菌等菌种发酵而成的乳制品已被证实有能力降低血浆中胆固醇含量,其作用机理在于益生菌可以减少胆汁酸在肠道中的重吸收。乳酸杆菌可以水解胆汁酸,使其排泄速度加快并减少重吸收程度[26]。
2.6 胆固醇7α-羟化酶(CYP7A1)催化剂CYP7A1是肝脏中胆固醇分解为胆汁酸的限速酶。人体中近50%的胆固醇都是通过CYP7A1催化途径转化为胆汁酸而排除体外[41]。CYP7A1催化剂使肝脏中胆固醇转化为胆汁酸的速率增快,同时使血浆胆固醇流入肝脏,最终使血浆胆固醇含量降低。研究表明,许多功能食品都具有上调CYP7A1活性的能力,如荞麦中的蛋白质对于降低血浆中的胆固醇有显著效果,其作用机理在于荞麦能上调CYP7A1的基因,使CYP7A1的活性增强,从而加强了胆汁酸的排出量[25];钙也是一种能上调CYP7A1基因的矿物质,并且能增加胆汁酸的排出。近年来研究发现姜黄素也可以上调CYP7A1基因并增加胆汁酸的排出,因此姜黄素作为降胆固醇的活性成分受到人们越来越多的关注[42]。此外,还有一些抗性淀粉和葡萄多酚也能上调CYP7A1基因并促进胆汁酸的排出。
2.7 胆固醇脂转运蛋白(CETP)抑制剂胆固醇酯转运蛋白(CETP)是一种血浆糖蛋白,介导胆固醇酯(CE)从HDL转运到LDL和VLDL,同时将等量的甘油三酯(TG)分子反向转运。CETP的反向转运过程会降低血液中HDL的浓度,并提高LDL和VLDL的浓度,从而导致动脉粥样硬化的产生。因此,功能食品特异性抑制CETP介导的转运过程将成为治疗心血管疾病的有效方法[5]。研究表明,苹果中的苹果多酚能降低CETP的活性。当仓鼠的饮食中加入过量的胆固醇后,通过摄入苹果能适当减少血液中胆固醇含量[10];葡萄多酚中的花青素能使CETP的活性受到抑制,使得LDL胆固醇浓度降低,HDL胆固醇浓度得到提高[12];花生与葡萄中的白藜芦醇能有效抑制CETP的活性,在仓鼠的动物试验中给仓鼠喂食高胆固醇的饮食后,适当的添加白藜芦醇能降低体内胆固醇含量[24];脱脂牛奶与橄榄油的组合能增加高胆固醇血症患儿体内的HDL胆固醇和载体蛋白A-I的含量[43]。
3 小结
降胆固醇功能食品在减少心血管疾病的发病风险中起着重要的作用,有必要区分这类功能食品的活性因子及相关的作用机理。必须指出的是降胆固醇功能食品的作用机理可能是一种机理主导,也有可能是多种机理共同作用。近年来,大部分研究表明膳食纤维、植物甾醇、大豆、山楂、茶、发酵乳制品、甘蔗脂肪醇、荞麦、燕麦、米糠油、洋葱、大蒜、红曲米、杏仁、鱼油、亚麻籽、黑米、甘草和人参油等功能食品能降低胆固醇活性,但这些研究大多数只在细胞培养和动物模型上完成。今后,应该开展更多的随机对照试验来验证这些功能食品。
[1] 谭敦民. 《中国心血管病报告2012》让人们警醒什么[J]. 保健医苑,2013(11):32-34.
[2] BELL S,COLDMANM V M,BISTRIAN B R,et al. Effect β-glucan from oat and yeast on serum lipids[J].Critical Reviews in Food Science and Nutrition,1999,39(2):189-202.
[3] 崔洪斌,那晓琳,方庆伟.大豆异黄酮对去卵巢大鼠脂、骨代谢的影响[J].中国公共卫生, 2003, 19(7): 836-837.
[4] 刘北林,董继生,倪小虎,等. 山楂黄酮提取及降血脂研究[J]. 食品科学,2007(5):324-327.
[5] CHEN Z Y,MA K Y,LIANG Y M,et al.Role and classfication of cholesterol-lowing functional foods[J].Journal of Functional Foods,2011,3:61-69.
[6] BERGE K E, TIAN H, GRAF G A,et al.Accumulation of dietary cholesterol in sitosterolemia causedby mutations in adjacent ABC transporters[J]. Science,2000,290:1771-1775.
[7] LEE M H, LU K,HAZARDS, et al. Identification of a gene, ABCG5, important in the regulation of dietary cholesterol absorption[J]. Nature Genetics,2001,27: 79-83.
[8] 王宇辉,刘国庆.胆固醇和甘油三酯代谢紊乱与代谢性心血管病的研究进展[J].中国医学前沿杂志:电子版,2012(8):19-22.
[9] 韩涛,张殿彩,傅赞.胆固醇代谢异常与胆固醇结石形成的研究进展[J].江苏医药,2012(15):1811-1814.
[10] LAM C K, CHEN J,CAO Y, et al.Conjugated and nonconjugated octadecaenoic acids affect differently intestinal acyl coenzyme A:cholesterol acyltransferase activity[J].Atherosclerosis,2008, 198: 85-93.
[11] YU-POTH S, YIN D,ZHAO G,et al. Conjugated linoleic acid upregulates LDL receptor gene expression in HepG2 cells[J].Journal of Nutrition,2004,34(1):68-71.
[12] PAL S, HO N, SANTOS C,et al. Red wine polyphenolics increase LDL receptor expression and activity and suppress the secretion of ApoB100 from human HepG2 cells[J]. Journal of Nutrition,2003,133(3):700-706.
[13] JIAO R,ZHANG Z,YU H, et al. Hypocholesterolemic activity of grape seed proanthocyanidin is mediated by enhancement of bile acid excretion and up-regulation of CYP7A1[J]. Journal of Nutritional Biochemistry,2010,21:1134-1139.
[14] MAN R Y, LYNN E G, CHEUNG F,et al. Cholestin inhibits cholesterol synthesis and secretion in hepatic cells (HepG2)[J]. Molecular and Cellular Biochemistry,2002,233(1/2):153-158.
[15] RAJENDRAN S, DEEPALAKSHMI P D, PARASAKTHY K,et al. Effect of tincture of Crataegus on the LDL- receptor activity of hepatic plasma membrane of rats fed an atherogenic diet[J]. Atherosclerosis,1996,123(1/2):235-241.
[16] 黄文文,叶小利,李学刚. 山楂中抑制HMG-CoA还原酶的活性成分及其协同效应的研究[J]. 中国中药杂志,2010(18):2428-2431.
[17] 唐世英,胡桂才,李来. 山楂降血脂作用有效部位的研究[J]. 云南中医学院学报,2009(5):43-45.
[18] KUHN D J, BURNS A C, KAZI A,et al. Direct inhibition of the ubiquitin-proteasome pathway by ester bond-containing green tea polyphenols is associated with increased expression of sterol regulatory element-binding protein 2 and LDL receptor[J]. Biochimica et Biophysica Acta,2004, 1682:1-10.
[19] BURSILL C A, ABBEY M, ROACH P D. A green tea extract lowers plasma cholesterol by inhibiting cholesterol synthesis and upregulating the LDL receptor in the cholesterol-fed rabbit[J]. Atherosclerosis,2007,193(1):86-93.
[20] LEE M S, PARK J Y, FREAKE H,et al. Green tea catechin enhances cholesterol 7alpha-hydroxylase gene expression in HepG2 cells[J]. British Journal of Nutrition,2008,99(6):1182-1185.
[21] LIU L, YEH Y. S-Alk(en)yl cysteines of garlic inhibit cholesterol synthesis by deactivating HMG-CoA reductase in cultured rat hepatocyte[J]. Journal of Nutrition,2002,132:1129-1134.
[22] KWON M J, SONG Y S, CHOI M S, et al. Cholesteryl ester transfer protein activity and atherogenic parameters in rabbits supplemented with cholesterol and garlic powder[J]. Life Sciences,2004,72(26): 2953-2964.
[23] SUNG J H, CHOI S J, LEE S W,et al. Isoflavones found in Korean soybean paste as 3-hydroxy-3-methylglutaryl Coenzyme A reductase inhibitors[J]. Bioscience,Biotechnology and Biochemistry,2004,68(5): 1051-1058.
[24] CHO S J, JUILLERAT M A, LEE C H. Identification of LDL-receptor transcription stimulating peptides from soybean hydrolysate in human hepatocytes[J]. Journal of Agricultural and Food Chemistry,2008,56(12): 4372-4376.
[25] KAYASHITA J, SHIMAOKA I, NAKAJOH M,et al. Consumption of buckwheat protein lowers plasma cholesterol and raises fecal neutral sterols in cholesterol-fed rats because of its low digestibility[J]. Journal of Nutrition,1997,127:1395-1400.
[26] KAWASE M, HASHIMOTO H, HOSODA M, et al. Effect of administration of fermented milk containing whey protein concentrate to rats and healthy men on serum lipids and blood cholesterol[J]. Journal of Dairy Science,2000,83:255-263.
[27] ELLEGÅRD L,ANDERSSON H. Oat bran rapidly increases bile acid excretion and bile acid synthesis: An ileostomy study[J].European Journal of Clinical Nutrition,2007,61(8): 938-945.
[28] DAS S, NESARETNAM K, DAS D. K. Tocotrienols in cardioprotection[J]. Vitamins and Hormones,2007,76: 419-433.
[29] JONES P J, MACDOUGALL D E, NTANIOS F, et al.Dietary phytosterols as cholesterol-lowering agents in humans[J]. Canadian Journal of Physiology and Pharmacology,1997,75:217-227.
[30] JESCH E D, SEO J M, CARR T P,et al. Sitosterol reduces messenger RNA and protein expression levels of Niemann-Pick C1-like 1 in FHs 74 Int cells[J]. Nutrition Research,2009,29(12): 859-866.
[31] 杨俊瑶,胡炎伟,张鹏,等. 尼曼-匹克C1型类似蛋白1影响胆固醇代谢的研究进展[J]. 生理学报,2012(6):721-728.
[32] MATHUR S N,WATT K R, FIELD F J, et al.Regulation of intestinal NPC1L1 expression by dietary fish oil and docosahexaenoic acid[J]. J Lipid Res,2007, 48(2): 395-404.
[33] 郭春锋,张兰威. 益生菌降胆固醇功能研究进展[J]. 微生物学报,2010,50(12):1590-1599.
[34] FENG D, OHLSSON L, DUAN R D. Curcumin inhibits cholesterol uptake in Caco-2 cells by down-regulation of NPC1L1 expression[J]. Lipids Health Dis,2010,9: 40.
[35] ANDERSSON S W, SKINNER J, WELCH A A, et al. Intake of dietary plant sterols is inversely related to serum cholesterol concentration in men and women in the EPIC Norfolk population: A cross-sectional study[J]. European Journal of Clinical Nutrition,2004, 58(10): 1378-1385.
[36] 陆颖菲,高向东,顾觉奋.微生物来源的ACAT抑制剂的研究进展[J]. 中国新药杂志,2011(15):1418-1422.
[37] 丁德荣,沈竞康. ACAT抑制剂的研究进展[J]. 中国新药杂志,2005(4):396-400.
[38] LIN Y, VERMEER M A, TRAUTWEIN E. Triterpenic acids present in hawthorn lower plasma cholesterol by inhibiting intestinal ACAT activity in hamsters[J]. Evidence Based Complementary Alternative Medicine,2009, PMID19228775 (Epub ahead of print).
[39] WONG J M, DE SOUZA R, KENDALL C W,et al. Colonic health: Fermentation and short chain fatty acids[J]. Journal of Clinical Gastroenterology,2006, 40:235-243.
[40] CARUSO M G, MESSA C, ORLANDO A,et al. Early induction of LDL receptor gene expression by genistein in DLD-1 colon cancer cell line[J]. Fitoterapia,2008, 79(7/8):524-528.
[41] HUBACEK JA, BOBKOVA D. Role of cholesterol 7alpha-hydroxylase (CYP7A1) in nutrigenetics and pharmacogenetics of cholesterol lowering[J]. Mol Diagn Ther,2006,10: 93-100.
[42] KIM M, KIM Y. Hypocholesterolemic effects of curcumin via up-regulation of cholesterol 7a-hydroxylase in rats fed a high fat diet[J]. Nutrition Research and Practice,2010,4(3):191-195.
[43] ESTE′VEZ-GONZA′LEZ M D, SAAVEDRA-SANTANA P, LO′PEZ-RS L,et al. HDL cholesterol levels in children with mild hypercholesterolemia: Effect of consuming skim milk enriched with olive oil and modulation by the TAQ 1B polymorphism in the CETP gene[J]. Annuals of Nutrition and Metabolism,2010,56(4): 288-293.
Research Progress in Cholesterol-lowering Functional Bioactives and Mechanism
ZHU Dong-hong, ZHOU Chun-xia*, HONG Peng-zhi
(College of Food Science and Technology, Guangdong Ocean University, Zhanjiang, Guangdong 524088)
Cholesterol-lowering functional food is always an issue, because blood cholesterol level is strongly correlated with cardiovascular disease (CVD). Cholesterol homeostasis is maintained by a complex mechanism of sterol absorption, anabolism, catabolism and excretion. Functional foods with lower cholesterol must affect blood cholesterol level in some degree. In this review, the cholesterol-lowering active ingredients in functional foods and its seven kinds of mechanisms were summarized, and the main mechanisms are intestinal Niemann-Pick C1 like 1 (NPC1L1) inhibitors, intestinal acyl-CoA:cholesterol (ACAT2) inhibitors, 3-hydroxy-3-methylglutaryl (HMG-CoA) reductase inhibitors, and so on. Moreover, the aim was to expand its application in the food industry.
Functional foods; Cholesterol; Bioactive; Mechanism
朱东宏(1988-),男,河南信阳人,硕士研究生,研究方向:水产品深加工。*通讯作者,副教授,博士,硕士生导师,从事水产品深加工研究。
2015-03-12
S 87
A
0517-6611(2015)11-145-04

