非酒精性脂肪性肝病患者血清VEGF水平与IL-6、hs-CRP的相关性分析
欧阳小予 陈建平 杨 阳 刘桑燕
三明市第二医院消化内科,福建省永安市 366000
非酒精性脂肪性肝病患者血清VEGF水平与IL-6、hs-CRP的相关性分析
欧阳小予 陈建平 杨 阳 刘桑燕
三明市第二医院消化内科,福建省永安市 366000
目的:探讨非酒精性脂肪性肝病(NAFLD)患者血清血管内皮生长因子(VEGF)与白介素-6(IL-6)、高敏C反应蛋白(hs-CRP)、白细胞计数(WBC)的相关性。方法:选取2013年1月-2015年1月在我院明确诊断NAFLD患者122例,同时选取同期门诊健康体检者108例作为研究对象,采用全自动生化检测仪检测相关生化指标,通过酶联免疫吸附试验(ELISA)检测血清中VEGF、IL-6水平,免疫比浊法检测血清hs-CRP水平。结果:与对照组比较,脂肪肝组在臀围、腰围、体质指数、收缩压、舒张压、丙氨酸氨基转氨酶、天门冬氨酸转氨酶、甘油三酯、总胆固醇、低密度脂蛋白、血糖、尿酸、同型半胱氨酸、WBC、hs-CRP、VEGF、IL-6等临床指标均明显升高,差异有统计学意义(P均<0.01);进一步Pearson相关分析提示脂肪肝组血清VEGF水平与IL-6、hs-CRP、WBC均呈正相关(r分别为0.602、0.698、0.713,均P<0.01)。结论:NAFLD患者血清VEGF水平明显升高,其水平与IL-6、hs-CRP、WBC等均呈正相关,细胞因子、炎症因子参与了NAFLD的发生发展。
非酒精性脂肪肝 血管内皮生长因子 白介素-6 高敏C反应蛋白
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是以低浓度全身炎症为特征的炎症紊乱状态,其存在明显血管内皮功能障碍,与动脉粥样硬化的发生密切相关[1,2]。研究发现:多种细胞因子影响血管的生长,其中血管内皮生长因子(Vascular endothelial growth factor,VEGF)作为主要血管生长因子,在血管中发挥主要作用,其可反映血管内皮损伤的程度[3]。另有大量研究发现:NAFLD患者血清相关炎症因子明显升高[4~6]。本研究旨在探讨NAFLD患者血清VEGF水平及其与相关炎症因子的相关性,为临床上治疗NAFLD提供理论依据。
1 资料与方法
1.1 一般资料 选取2013年1月-2015年1月在我院消化内科住院,经肝脏彩超检查明确诊断为NAFLD患者122例(脂肪肝组)及同时期门诊健康体检者108例(对照组)。脂肪肝组患者中,男72例,女50例,年龄32~71岁,平均年龄(57.43± 11.86)岁。对照组中,男64例,女44例,年龄28~67岁,平均年龄(59.58±13.23)岁。两组患者在年龄、性别方面差异无统计学意义(P>0.05),具有可比性。纳入及排除标准:(1)纳入标准:NAFLD的诊断参照《NAFLD诊疗指南(2010年修订版)》[7],且肝脏彩超符合弥漫性脂肪肝的诊断标准,同时无饮酒史或饮酒折合乙醇量<140g周(女性<70g周);(2)排除标准:除外酒精性肝炎、病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病。
1.2 材料与试剂 VEGF、IL-6酶联免疫吸附实验试剂盒(由武汉博士德生物工程有限公司提供)、hs-CRP免疫比浊试剂盒(美国RB公司)、PBS缓冲液(北京索莱宝生物科技有限公司)、无菌蒸馏水。
1.3 仪器与设备 酶标仪(美国Bio-Rad公司)、恒温水浴箱(上海实验仪器公司)、全自动生化分析仪OLYMPUS AU2700(日本日立公司)、低温离心机(Thermo公司)、量筒、微量移液器(1ml、200μl、10μl)。
1.4 实验方法
1.4.1 血压测量。所有入选对象均经静息30min后由专人采用符合计量标准的台式水银柱血压计测量右侧肱动脉血压,连续测量3次,每次间隔至少2min,取3次平均值为个体值。
1.4.2 身高、体质量、腰围(WC)、臀围(HC)测量。所有受试者均脱鞋、免冠、仅穿单薄衣物测量身高、体重,计算体质量指数(BMI),BMI=体重身高2(kgm2)。WC是沿腋中线肋骨下缘与髂嵴连线中点的水平周径。HC是臀部最大周径。
1.4.3 生化指标测量。所有受试者均禁食12h后抽取清晨空腹肘静脉血液标本,采用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天门冬氨酸转移酶(AST)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、血糖(GLU)、尿酸(UA)、白细胞(WBC)。
1.4.4 血清VEGF、IL-6、hs-CRP水平测定。所有研究对象均留取空腹肘静脉血5ml,置于含依地酸钠(EDTA)抗凝管中,静置30min,4℃,3 000rmin,离心20min,留取血清标本放置-80℃冰箱保存。采用酶联免疫吸附实验检测血清VEGF、IL-6水平,免疫比浊法检测血清hs-CRP水平,试剂盒由武汉博士德生物工程有限公司提供,测定方法严格按照说明书进行操作。
1.5 统计学分析 所有数据均采用SPSS19.0统计软件进行处理,计量资料数据以均数±标准差表示,两组间比较采用t检验,计数资料采用卡方检验,变量间的关联分析采用Pearson相关分析,P≤0.05为差异有统计学意义。
2 结果
2.1 两组各临床指标比较 与对照组比较,脂肪肝组患者在HC、WC、BMI、SBP、DBP、ALT、AST、TG、TC、LDL-C、GLU、UA、Hcy均明显升高,HDL-C明显降低,差异有统计学意义(均P<0.01)。而在ALB、Scr、BUN等方面差异无统计学意义(P>0.05)。见表1。
表1两组各临床指标对比(±s)
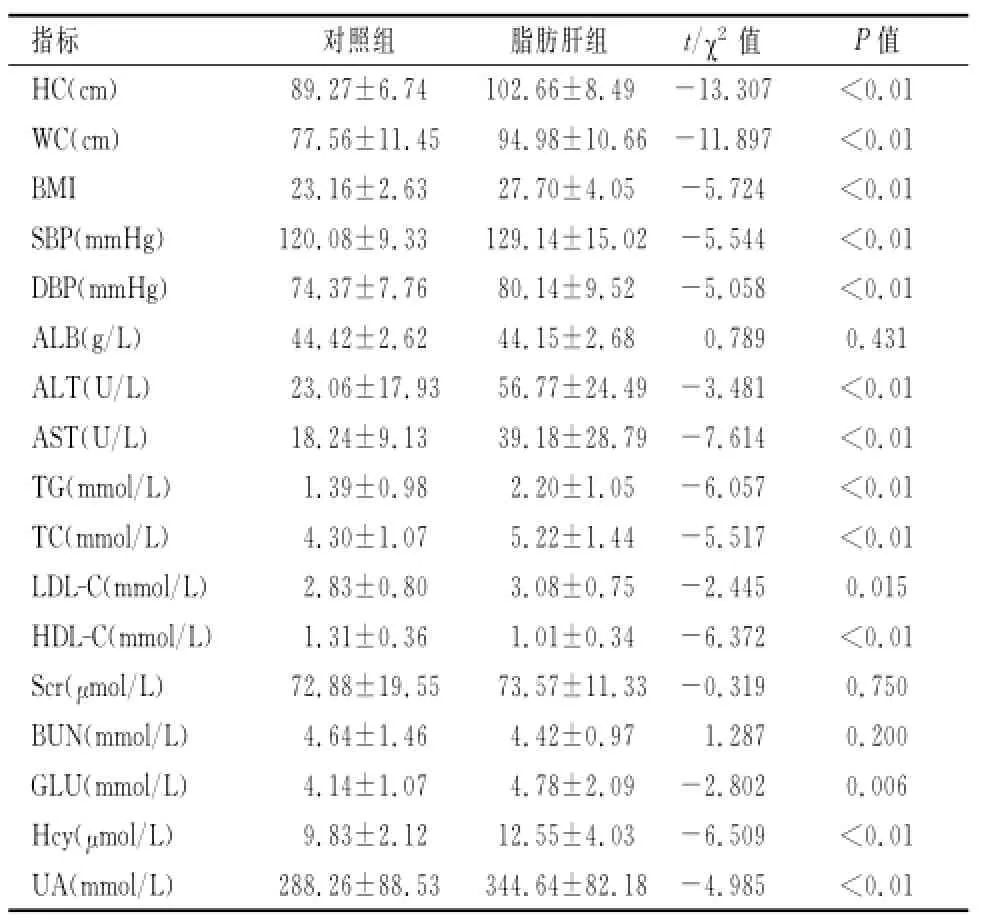
表1两组各临床指标对比(±s)
注:1mmHg=0.133kPa。
指标对照组脂肪肝组tχ2值P值0.01 WC(cm)77.56±11.45 94.98±10.66-11.897<0.01 BMI 23.16±2.63 27.70±4.05-5.724<0.01 SBP(mmHg)120.08±9.33 129.14±15.02-5.544<0.01 DBP(mmHg)74.37±7.76 80.14±9.52-5.058<0.01 ALB(gL)44.42±2.62 44.15±2.68 0.789 0.431 ALT(UL)23.06±17.93 56.77±24.49-3.481<0.01 AST(UL)18.24±9.13 39.18±28.79-7.614<0.01 TG(mmolL)1.39±0.98 2.20±1.05-6.057<0.01 TC(mmolL)4.30±1.07 5.22±1.44-5.517<0.01 LDL-C(mmolL)2.83±0.80 3.08±0.75-2.445 0.015 HDL-C(mmolL)1.31±0.36 1.01±0.34-6.372<0.01 Scr(μmolL)72.88±19.55 73.57±11.33-0.319 0.750 BUN(mmolL)4.64±1.46 4.42±0.97 1.287 0.200 GLU(mmolL)4.14±1.07 4.78±2.09-2.802 0.006 Hcy(μmolL)9.83±2.12 12.55±4.03-6.509<0.01 UA(mmolL)288.26±88.53 344.64±82.18-4.985<HC(cm)89.27±6.74 102.66±8.49-13.307<0.01
2.2 两组血清VEGF、IL-6、hs-CRP、WBC水平比较 与对照组比较,脂肪肝组血清VEGF、IL-6、hs-CRP、WBC浓度均明显升高,差异均有统计学意义(P均<0.01)。见表2。
表2 两组血清VEGF、IL-6、hs-CRP水平比较(±s)
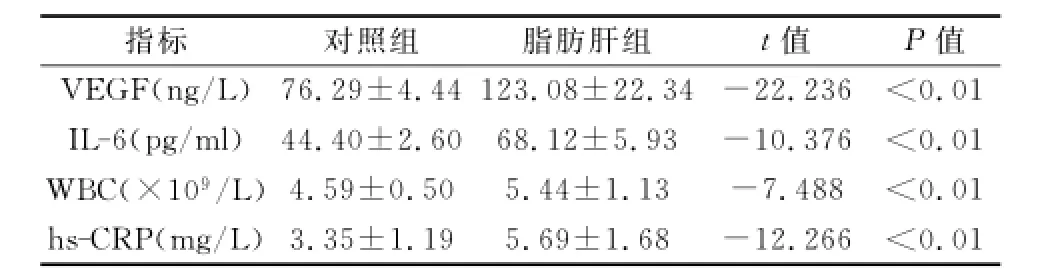
表2 两组血清VEGF、IL-6、hs-CRP水平比较(±s)
指标对照组脂肪肝组t值P值0.01 0.01 IL-6(pgml)44.40±2.60 68.12±5.93-10.376<0.01 WBC(×109L)4.59±0.50 5.44±1.13-7.488<0.01 hs-CRP(mgL)3.35±1.19 5.69±1.68-12.266<VEGF(ngL)76.29±4.44 123.08±22.34-22.236<
2.3 脂肪肝组中VEGF与IL-6、hs-CRP、WBC的相关性分析 Pearson相关分析结果显示:脂肪肝组血清VEGF水平与血清IL-6、hs-CRP、WBC水平均呈正相关(r分别为0.602、0.698、0.713,均P<0.01)。
3 讨论
NAFLD是指除外酒精和其他明确的肝损害因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,其已成为慢性肝病的第二位原因。全球流行病学调查结果显示:NAFLD的患病率为17%~33%,肥胖及2型糖尿病患者中可达75%[8]。目前有研究发现其是以低浓度全身炎症为特征的炎症紊乱状态,存在明显血管内皮功能障碍,如得不到有效治疗,将最终发生动脉粥样硬化。因此,寻找能够逆转或延缓NAFLD的因子或药物,对于临床上治疗进展的NAFLD具有重要意义。
VEGF可由血管内皮细胞、巨噬细胞和平滑肌细胞等多种细胞产生,其在正常血管中不表达。而有研究证明:VEGF与血管内皮损伤密切相关,在急性冠脉综合征、动脉硬化及血管相关疾病中高表达[3]。机体微炎症持续状态,可引起血管内皮细胞损伤、血管通透性增加,炎症因子可刺激血管内皮细胞及平滑肌细胞分泌VEGF,VEGF表达上调引起血管内皮细胞及平滑肌细胞增殖,引起血管动脉粥样硬化,动脉粥样硬化进一步加重了机体的微炎症状态。
炎性因子被认为在NAFLD的发生、发展中起着关键作用[9],其常伴随肠源性内毒素血症的发生,而肠源性内毒素血症能够激活NF-κB信号传导系统,引起炎症介质TNF-α、IL-6的大量释放,TNF-α、IL-6能促进炎症反应,刺激炎症指标hs-CRP的产生[10]。增加的TNF-α可使NO产生下降。同时NAFLD常常伴有胰岛素抵抗,而胰岛素抵抗可增强内皮细胞产生和释放ET-1,ET-1与NO的比例失衡,最终引起血管内皮功能障碍而促使动脉粥样硬化发生[11]。本研究发现:与对照组比较,NAFLD患者血清IL-6、hs-CRP、WBC等反应炎症的指标均明显升高,差异有统计学意义(均P<0.01)。这表明NAFLD患者存在明显的微炎症状态。同时采用酶联免疫吸附实验检测NAFLD患者血清VEGF水平结果显示:与对照组比较,NAFLD患者血清VEGF水平明显升高,差异有统计学意义(P<0.01),这说明NAFLD患者血管内皮存在明显的损伤。进一步单因素相关分析结果提示:NAFLD患者血清VEGF水平与血清IL-6、hs-CRP、WBC均呈明显正相关(r分别为0.602、0.698、0.713,均P<0.01),这进一步说明NAFLD患者存在明显内皮功能损害,且其损害程度与机体微炎症程度呈正相关。
综上所述,NAFLD患者血清IL-6、hs-CRP、WBC、VEGF等指标均明显升高,血清VEGF与IL-6、hs-CRP、WBC均呈明显正相关,提示炎症因子、细胞因子参与了NAFLD的发生、发展。
[1]Sciacqua A,Perticone M,Miceli S,et al.Endothelial dysfunction and nonalcoholic liver steatosis in hypertensive patients〔J〕.Nutr Metab Cardiovasc Dis,2011,21(7):485-491.
[2]Roitberg GE,Sharkhun OO,Ushakova TI,et al.Nonalcoholic fatty liver disease as an atherosclerosis risk factor〔J〕.Eksp Klin Gastroneterol,2010,18(7):20-24.
[3]鲁序亮.糖尿病肾病患者血清脂联素和血管内皮生长因子水平与氧化应激的关系〔J〕.中华实用诊断与治疗杂志,2013,35(3):261-262.
[4]Braunersreuther V,Viviani GL,Mach F,et al.Role of cytokines and chemokines in non-alcoholic fatty liver disease〔J〕.World J Gastroenterol,2012,18(8):727-735.
[5]Coulon S,Francque S,Colle I,et al.Evaluation of inflammatory and angiogenic factors in patients with non-alcoholic fatty liver disease〔J〕.Cytokine,2012,59(2):442-449.
[6]芦建慧,陈俭静,彭相文,等.非酒精性脂肪肝患者血清白介素-6的检测及意义〔J〕.中国现代医学杂志,2013,23(32):45-49.
[7]中华医学会肝病学分会脂肪肝和酒精性肝病学组.NAFLD诊疗指南(2010年修订版)〔J〕.中华肝脏病杂志,2010,10(3):163-166.
[8]Levene AP,Goldin RD.The epidemiology,pathogenesis and histopathology of fatty liver disease〔J〕.Histopathology,2012,61(2):141-152.
[9]Tiniakos DG,Vos MB,Brunt EM,et al.Nonalcoholic fatty liver disease:pathology and pathogenesis〔J〕.Annu Rev Pathol,2010,32(5):145-171.
[10]Devaraj S,Singh U,et al.Human C-reactive protein and the metabolic syndrome〔J〕.Curr Opin Lipidol,2009,20(3):182.
[11]李素红,韩德五,周鑫,等.NAFLD在动脉粥样硬化发生发展中的作用〔J〕.中国动脉硬化杂志,2012,20(1):30-36.
(本文通讯作者:刘桑燕)
(编辑落落)
Correlation between Vascular Endothelial Growth Factor and Interleukin-6,High-sensitivity C-reactive Protein in Patients with Nonalcoholic Fatty Liver Disease
OUYANG Xiaoyu,CHEN Jianping,YANG Yang,et al.Department of Digestive Internal Medicine,the Second Hospital of Sanming,Yong’an City,Fujian Province 366000
Objective:To investigate the correlation between vascular endothelial growth factor and interleukin-6,highsensitivity C-reactive protein,white blood cells count in patients with Nonalcoholic fatty liver disease.Methods:Select the 122patients with nonalcoholic fatty liver disease(fatty liver group),108people with no fatty liver disease(normal control group)were chosen for the study.The related biochemical indices were detected with automatic biochemical analyzer.The levels of serum VEGF and IL-6were measured by Enzyme-linked immunosorbent experiment.The levels of serum hs-CRP were measured by Immune turbidimetry.Results:The comparison of hip circumference(HC),waist circumference(WC),body mass index(BMI),systolic blood pressure(SBP),diastolic blood pressure(DBP),alanine aminotransferase(ALT),aspartate aminotransferase(AST),total cholesterol(TG),triglycerides(TC),low density lipoprotein(LDL-C),glucose(GLU),uric acid(UA),homocysteine(Hcy),white blood cells count(WBC),high-sensitivity C-reactive protein(hs-CRP),vascular endothelial growth factor(VEGF),interleukin-6(IL-6)levels between fatty liver group and normal control group were higher in the fatty liver group than those of normal control group,the difference were significant(all P<0.01).Pearson correlation analysis show that serum VEGF levels and IL-6,hs-CRP,WBC were positively correlated in patients with nonalcoholic fatty liver disease(r=0.602,0.698,0.713,all P<0.01).Conclusion:The levels of VEGF were significantly increased in nonalcoholic fatty liver disease,it was positively correlated with IL-6,hs-CRP,WBC,suggesting that cytokines and inflammatory cytokines might play an important role in the pathogenesis of nonalcoholic fatty liver disease.
Nonalcoholic fatty liver disease,Vascular endothelial growth factor,Interleukin-6,High-sensitivity C-reactive protein
R575.5
A
1001-7585(2015)19-2589-03
2015-05-25

