复方护肝解酒晶解酒护肝作用的研究
王志萍, 雷晓翠, 邓家刚 , 夏 星, 赵斌斌, 王美琪
(1. 广西中医药大学药学院,广西 南宁530001;2. 广西中药药效研究重点实验室,广西 南宁530001;3. 广西高校中药制剂共性技术研发重点实验室,广西南宁530001)
复方护肝解酒晶由壮药余甘果、万寿果(枳椇子)、杭菊花、葡萄籽、柠檬、车前子、铁皮石斛、罗汉果及陈皮等药食两用[1]的药材组成,原方为广西中医药大学邓家刚教授的临床经验方,临床上主要用于防醉酒和解醉酒具有较好疗效。方中的药材均具有不同程度的护肝解酒作用,如枳椇子水提液给小鼠灌胃后,可显著降低血液中乙醇的浓度,明显降低肝组织中MDA 水平[2];余甘果水提醇沉物对D-半乳糖胺所致急性肝损伤具有明显的保护作用[3],而且其主要成分为没食子酸,对肝脏具有一定的保护作用[4]。
为了进一步验证复方护肝解酒晶的护肝解酒作用,笔者开展了药效学实验研究,通过直接给予小鼠致醉剂量的食用酒造模,观察其翻正反射情况,记录酒后醉酒维持时间,测定肝组织中乙醇脱氢酶 (ADH)活力及丙二醛(MDA)、谷胱甘肽(GSH)、甘油三酯(TG)水平,然后测定小鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)活性。
1 试药与仪器
1.1 试药 复方护肝解酒晶(广西中医药大学现代中药制剂工程中心,批号20131215),其高剂量组配制方法为称取复方护肝解酒晶适量,加纯净水溶解,配成0.36 g/mL的药液,即小鼠给药量7.2 g/kg,相当于19.6 g(药材)/kg;中剂量组配制方法为称取复方护肝解酒晶高剂量药液适量,加纯净水稀释成0.18 g/mL 的药液,即小鼠给药量3.6 g/kg,相当于9.8 g (药材)/kg;低剂量组配制方法为称取复方护肝解酒晶中剂量药液适量,加纯净水稀释成0.09 g/mL 的药液,即小鼠给药量1.8 g/kg,相当于4.9 g (药材)/kg;红星二锅头酒(56°,北京红星股份有限公司,批号20111101);海王金樽片(深圳海王健康科技发展有限公司,批号20120503);磷酸氢二钠为分析纯(成都市科龙化工试剂厂,批号0120522);磷酸二氢钠为分析纯(天津博迪化工股份有限公司,批号20111006)。考马斯亮蓝、乙醇脱氢酶(ADH)、谷丙转氨酶(ALT/GPT)、谷草转氨酶(AST/GOT)、丙二醛(MDA)、还原型谷胱甘肽(GSH)测试盒(南京建成生物工程研究所,批号分别为20140113、 20140115、 20131223、 20131228、 20140112、20140111);甘油三酯测定试剂盒(酶偶联比色法/单试剂型,浙江东瓯诊断产品有限公司,批号2013110023)。
1.2 动物 昆明种小鼠,雄性,体质量(20 ±2)g (广西医科大学实验动物中心,实验动物许可证号SCXK [桂]2009-0002)。
1.3 仪器 TU-1901 双光束紫外可见光光度计(北京普析通用仪器有限公司);YN-80P 制冰机(上海英纽特制冷设备有限公司);酶标仪(美国BioTek 公司);一次性使用无菌注射器(浙江欧健医用器材有限公司);采样容器为试管(姜堰市永康医疗器械厂)。
2 试验方法
2.1 小鼠醉酒量的确定 取小鼠30 只,随机分为3 组,每组10 只,分别以二锅头0.12、0.14、0.16 mL/10 g 灌胃,观察其步态和活动情况,记录翻正反射消失和恢复时间,根据实验结果来确定小鼠的醉酒量[5-6]。
2.2 解酒护肝作用研究 取小鼠84 只,随机分为6 组,设置空白对照组、模型对照组、海王金樽对照组、复方护肝解酒晶高剂量组、中剂量组、低剂量组,每组14 只,按“2.1”项下的最佳给酒量灌服二锅头,而空白对照组灌服以等体积的纯净水。30 min 后,空白对照组和模型对照组灌服纯净水20 mL/kg,阳性对照组灌服海王金樽2.0 g/kg,复方护肝解酒晶高、中、低剂量组分别按7.2、3.6、1.8 g/kg 灌服。
然后,观察并记录小鼠步态情况,记录其翻正反射消失[7-8]和恢复时间,计算耐受(从灌胃二锅头至翻正反射完全消失的时间)和醉酒维持时间(从翻正反射完全消失到完全恢复的时间)。灌酒后禁食12 h,24 h 后眼球取血,离心5 min (转速3 500 r/min),取上清液,按试剂盒操作说明测定血清中ALT 和AST 活性。然后,断颈处死小鼠,立即取出肝脏,PBS 缓冲液洗涤并用滤纸吸净,精密称定,剪碎,加PBS 缓冲液,匀浆后离心5 min (转速3 500 r/min),取上清液,制成10%肝匀浆上清液,测定ADH 活性以及MDA、GSH、TG 水平。
3 实验结果
3.1 小鼠醉酒量的确定结果 由表1 可知,小鼠灌酒后,均出现步态不稳和活动量减少现象。其中,第1 组浅睡,腹呼吸明显;第2 组翻正反射全部消失,出现沉睡现象;第3 组在灌酒后24 h 内出现死亡现象。因此,本实验选择第2 组的0.14 mL/10 g 为适宜灌酒量。
3.2 小鼠解酒护肝作用研究结果 由表2 ~表5 可知,与模型组相比,复方护肝解酒晶高剂量组能缩短小鼠的醉酒维持时间,有显著性差异(P <0.05),而高、中剂量组能使小鼠肝组织中ADH 活力显著增加(P <0.05),显著提高GSH 水平(P <0.05),显著降低MDA 和TG 水平和血清中AST 和ALT 活力(P <0.05)。
表1 小鼠醉酒量的确定结果(±s,n=10)
注:耐受时间为从灌胃酒精至翻正反射完全消失的时间;醉酒维持时间为从翻正反射消失到恢复的时间
组别 每10 g 给酒量/mL耐受时间/min醉酒维持时间/min醉酒率/%死亡率/%1 0.12 31.7 ±9.4 139.5 ±31.73 60 0 2 0.14 22.9 ±7.58 249.8 ±59.84 100 0 3 0.16 11.5 ±6.62 340.5 ±26.8 100 20
表2 复方护肝解酒晶对小鼠醉酒时间的影响(±s)

表2 复方护肝解酒晶对小鼠醉酒时间的影响(±s)
注:与模型组比较,△P <0.05,△△P <0.01
组别 例数 耐受时间/min 醉酒维持时间/min空白组 14——模型组 14 14.21 ±10.71 212.57 ±22.49阳性组 12 26.33 ±40.00 167.33 ±61.11△△高剂量组 14 27.93 ±22.72 167.14 ±41.46△中剂量组 13 28.54 ±4.73 192.23 ±57.10低剂量组14 17.36 ±0.96 188.34 ±35.62
表3 复方护肝解酒晶对小鼠肝组织中ADH 活力的影响(±s)
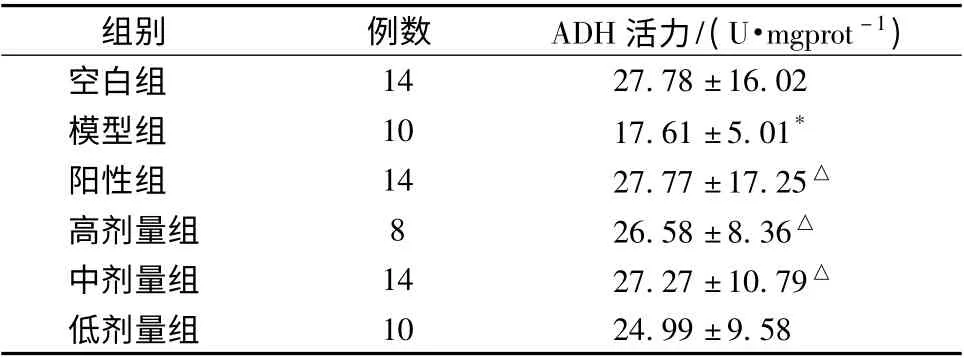
表3 复方护肝解酒晶对小鼠肝组织中ADH 活力的影响(±s)
注:与空白组比较,* P <0.05,**P <0.01;与模型组比较,△P <0.05,△△P <0.01。高剂量组原有14 只,但有6 只在灌胃时,酒精进入气管而死亡,故最终只有8 只,下同
组别 例数 ADH 活力/(U·mgprot -1)14 27.78 ±16.02模型组 10 17.61 ±5.01*阳性组 14 27.77 ±17.25△高剂量组 8 26.58 ±8.36△中剂量组 14 27.27 ±10.79△低剂量组空白组10 24.99 ±9.58
表4 复方护肝解酒晶对小鼠血清中AST 和ALT 活力的影响(±s)

表4 复方护肝解酒晶对小鼠血清中AST 和ALT 活力的影响(±s)
注:与空白组比较,* P <0.05,**P <0.01;与模型组比较,△P <0.05,△△P <0.01
组别 例数 AST 活力/(U·L -1) ALT 活力/(U·L -1)14 37.06 ±7.94 32.89 ±21.84模型组 10 47.28 ±13.89* 51.62 ±15.09*阳性组 14 36.52 ±8.17△ 38.18 ±11.21△高剂量组 8 36.28 ±8.79△ 34.61 ±10.12△中剂量组 14 35.41 ±8.44△ 26.24 ±7.64△△低剂量组空白组10 34.87 ±8.58 34.90 ±18.06
表5 复方护肝解酒晶对小鼠肝组织中GSH、MDA、TG水平的影响(±s)

表5 复方护肝解酒晶对小鼠肝组织中GSH、MDA、TG水平的影响(±s)
注:与空白组比较,* P <0.05,**P <0.01;与模型组比较,△P <0.05,△△P <0.01
组别 例数GSH/(U·mgprot -1)MDA/(U·mgprot -1)TG/(U·mgprot -1)14 0.078 ±0.047 1.494 ±1.235 0.128 ±0.052模型组 10 0.041 ±0.027* 2.784 ±1.077* 0.205 ±0.077*阳性组 14 0.077 ±0.049△1.648 ±1.415△ 0.144 ±0.063△高剂量组 8 0.076 ±0.033△1.578 ±1.321△ 0.142 ±0.036△中剂量组 14 0.076 ±0.046△ 1.737±0.686△△0.152 ±0.064△低剂量组 10 0.074 ±0.084 1.764 ±0.639△空白组0.165 ±0.070
4 讨论
复方护肝解酒晶是以天然水果及卫生部公布的药食两用或可用于保健食品的中药为原料,加上适宜的辅料制备而成,不仅可起到很好的解酒作用,同时还有护肝作用。
本实验发现,复方护肝解酒晶高、中剂量组可显著升高ADH 活性(P <0.05),加快乙醇在体内的代谢。由于在乙醇代谢过程中,ADH 起到重要作用,因此根据其活性可判断乙醇在体内的代谢速度[9],并能显著抑制肝细胞TG和MDA 水平的升高(P <0.05),显著增加GSH 水平(P<0.05)。乙醇可导致磷酸甘油增多,从而促进TG 合成,同时激活氧分子,产生大量氧自由基,致使肝细胞膜的脂质过氧化及体内GSH 的耗竭[10],而且它还能直接与GSH结合[11],消耗后者的量,使其抗氧化能力减弱,导致MDA 水平升高,显著降低血清中AST 和ALT 活力(P <0.05),它们主要存在于肝细胞中,当肝脏受损时,肝脏中的转氨酶会进入血液,引起血清中两者水平升高。正常情况下,肝内转氨酶的含有量约为血液中的100 倍,但当肝脏受损时,1%的肝细胞坏死就可使血清转氨酶的活性升高1 倍[12]。因此,转氨酶活性的升高是肝脏损害的重要标志。
综上所述,复方护肝解酒晶具有显著的解酒和护肝作用。
[1] 中华人民共和国国家卫生和计划生育委员会. 卫生部关于进一步规范保健食品原料管理的通知[EB/OL]. [2002-03-11]. http://wsb. moh. gov. cn/mohwsjdj/s3593/200810/38057.shtml
[2] 嵇 杨,陆 红. 枳椇子药理研究概况[J]. 中医药学报,2002,30(1):416.
[3] 李 萍,谢金鲜,林启云,等. 余甘子对D-半乳糖胺致小鼠急性肝损伤的影响[J]. 云南中医中药杂志,2003,24(1):3l-35.
[4] Anand K K,Singh B,Saxena A K,et al. 3,4,5-Trihydroxy benzoic acid (gallic acid),the hepatoprotective principle in the fruits of Terminalia belerica-bioassay guided activity[J]. Pharmacol Res,1997,36(4):315-321.
[5] 张会香,刘邻渭. 中草药解酒保健饮料的研究[J]. 食品科学,2002,23(4):63-65.
[6] 齐锦生,赵京山,李 恩. 解酒醒神方药对酒精中毒小鼠模型作用的实验研究[J]. 中国中医基础医学杂志,2001,7(11):47-49.
[7] 徐叔云,卞如濂,陈 修. 药理实验方法学[M]. 北京:人民卫生出版社,1994:657.
[8] 杨牧祥,于文涛,胡金宽,等. 酒速愈对急性酒精中毒小鼠解酒作用及酒精代谢的影响[J]. 中外健康文摘:医药月刊,2007,4(3):37-39.
[9] 李 萍,钟赣生. 葛花对酒后血中乙醇浓度和肝中乙醇脱氢酶活性的影响[J]. 科技导报,2009,27(23):82-86.
[10] 赵 敏,池莉平,王凤岩,等. 小鼠急性酒精性肝损伤模型的建立及应用[J]. 华南预防医学,2005,31(1):14 -17.
[11] 童 英,姚小曼,吴少平,等. 乙醇诱发急性肝损伤生物标记物的探讨[J]. 中国食品卫生杂志,1999,11(2):12-14.
[12] 金静敏,贾少谦,高留泉,等. 丹葛解酒茶对小鼠酒精性肝损伤血清ALT、AST 的影响[J]. 内蒙古中医药,2004(5):47-49.

