血清胃蛋白酶原、甘氨酰脯氨酸二肽氨基肽酶测定在胃癌中的临床意义探讨
武良,张德忠,江伟春,刘泽洪,叶永玲
(1.青田县人民医院普通外科,浙江青田323900; 2.青田县人民医院检验科,浙江青田323900)
血清胃蛋白酶原、甘氨酰脯氨酸二肽氨基肽酶测定在胃癌中的临床意义探讨
武良1,张德忠2,江伟春1,刘泽洪1,叶永玲2
(1.青田县人民医院普通外科,浙江青田323900; 2.青田县人民医院检验科,浙江青田323900)
目的探讨血清胃蛋白酶原(PG)Ⅰ、Ⅱ及甘氨酰脯氨酸二肽氨基肽酶(GPDA)水平与胃癌的关系。方法采用酶连续监测法检测50例胃癌、50例浅表性胃炎、50例胃溃疡、50例慢性萎缩性胃炎患者及50名健康体检者(正常对照组)血清PGⅠ、PGⅡ及GPDA水平,以碳14尿素呼气试验检测幽门螺杆菌(Hp)感染。采用受试者工作特征(ROC)曲线分析各项目对胃癌的诊断价值。结果与正常对照组比较,胃溃疡组血清PGⅠ、PGⅡ水平明显升高(P<0.05),PGⅠ/PGⅡ比值(PGR)明显降低(P<0.05),GPDA水平2个组之间差异无统计学意义(P>0.05);胃癌组和慢性萎缩性胃炎组血清GPDA、PGⅠ水平及PGR均明显降低(P<0.05),而PGⅡ水平明显增高(P<0.05)。胃癌组、浅表性胃炎组、胃溃疡组和慢性萎缩性胃炎组、正常对照组Hp感染阳性率分别为76%(38/50)、68%(34/50)、80%(40/50)、72%(36/50)及58%(29/50)。胃溃疡组Hp感染阳性率明显高于正常对照组(χ2=5.657,P<0.05),其余各组间差异均无统计学意义(P>0.05)。各组Hp感染阳性和阴性患者之间血清PGⅠ、PGⅡ及PGR差异均无统计学意义(P>0.05)。血清PGⅠ、PGⅡ、PGR和GPDA诊断胃癌的ROC曲线下面积分别为0.763、0.397、0.801、0.715;PGⅠ、PGR及PGⅠ+PGR分别与GPDA并联后对胃癌的诊断灵敏度均有不同程度的提高,诊断特异性均≥70.00%。结论血清PGⅠ、PGⅡ和GPDA对于胃癌的诊断有一定的参考价值,联合检测价值更大。
胃蛋白酶原;甘氨酰脯氨酸二肽氨基肽酶;胃癌
胃癌是我国最常见的恶性肿瘤之一,其发病率和死亡率位居各种恶性肿瘤之首,严重威胁着人民的生命健康。胃蛋白酶原(pepsinogen,PG)是一种相对分子质量为42 000的单链多肽,含PGⅠ和PGⅡ2种亚型。PGⅠ仅由胃底腺的主细胞和颈黏液细胞产生,而PGⅡ除由上述2种细胞分泌外,还由幽门腺和Brunner腺分泌。血清PG在早期胃癌的筛查和病情监控中具有十分重要的作用,可有效反映胃黏膜不同部位的腺体和细胞数量情况及其分泌功能的状态[1]。甘氨酰脯氨酸二肽氨基肽酶(glycyl-proline dipeptidyl aminopeptidase,GPDA)是一种相对分子质量为220 000的大分子量蛋白质,在胃癌患者中的表达明显低于胃癌前病变及非萎缩性胃炎患者,与唾液酸联合检测对诊断胃癌有重要价值[2]。GPDA与PG联合检测在胃癌诊断中的临床应用鲜见报道。因此,我们检测了胃癌、浅表性胃炎、胃溃疡、慢性萎缩性胃炎患者血清PGⅠ、PGⅡ及GPDA水平的变化,评价PGⅠ、PGⅡ及GPDA诊断胃癌的临床价值。
材料和方法
一、研究对象
随机选取2011年1月至2014年5月青田县人民医院收治的50例胃癌(男30例,女20例,年龄39~72岁)、50例浅表性胃炎(男28例,女22例,年龄36~68岁)、50例胃溃疡(男31例,女19例,年龄37~70岁)及50例慢性萎缩性胃炎患者(男28例,女22例,年龄37~69岁)。所有患者均经胃镜及病理组织学检查确诊,胃黏膜病变按照中国抗癌协会《新编常见恶性肿瘤诊治规范胃癌分册》胃黏膜病变的诊断标准[3]做出诊断,且入选患者无合并全身其他系统及器官的恶性肿瘤,无严重的肝肾功能不全,近1个月未服用质子泵抑制剂或相关抗菌药物,未行幽门螺杆菌(Helicobacter pylori,Hp)根除治疗。同时选取青田县人民医院健康体检者50名作为正常对照组,男27名,女23名,年龄40~68岁。各组间性别构成和年龄差异均无统计学意义(P>0.05)。本研究经青田县人民医院伦理委员会批准并备案,所有患者均签署知情同意书。
二、方法
1.Hp感染检测采用碳14尿素呼气试验检测Hp,在HUBT-20型Hp测试仪上完成。阳性者为Hp现症感染,检测试剂及仪器均由深圳市中核海得威生物科技有限公司提供。
2.GPDA及PGⅠ、PGⅡ水平的测定所有对象均于清晨空腹采集静脉血3 mL,2 100×g离心10 min分离血清,采用酶连续监测法检测PGⅠ、PGⅡ及GPDA水平,试剂盒由温州伊利康生物技术有限公司提供,仪器为日立7600全自动生化分析仪。
三、统计学方法
采用SPSS 16.0软件进行统计分析。计数资料采用χ2检验;计量资料以±s表示,2个独立样本的比较采用t检验,多组间比较采用q检验或方差分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析各项目对胃癌的诊断价值。以P<0.05为差异有统计学意义。
结果
一、各组PGⅠ、PGⅡ、PGⅠ/PGⅡ比值(PGⅠ/PGⅡratio,PGR)及GPDA水平的变化
与正常对照组比较,胃癌组PGⅠ、PGR及GPDA水平明显降低,PGⅡ水平明显升高(P<0.05);慢性萎缩性胃炎组血清PGⅠ、PGR及GPDA水平均明显降低(P<0.05),PGⅡ明显升高(P<0.05);胃溃疡组PGR降低(P<0.05),PGⅠ、PGⅡ水平明显上升(P<0.05),而GPDA水平2个组间差异无统计学意义(P>0.05)。胃癌组、慢性萎缩性胃炎组、消化性溃疡组之间PGⅠ、PGⅡ、PGR及GPDA水平差异均有统计学意义(P<0.05)。见表1。
表1 各组PGⅠ、PGⅡ、PGR及GPDA水平的变化(±s)
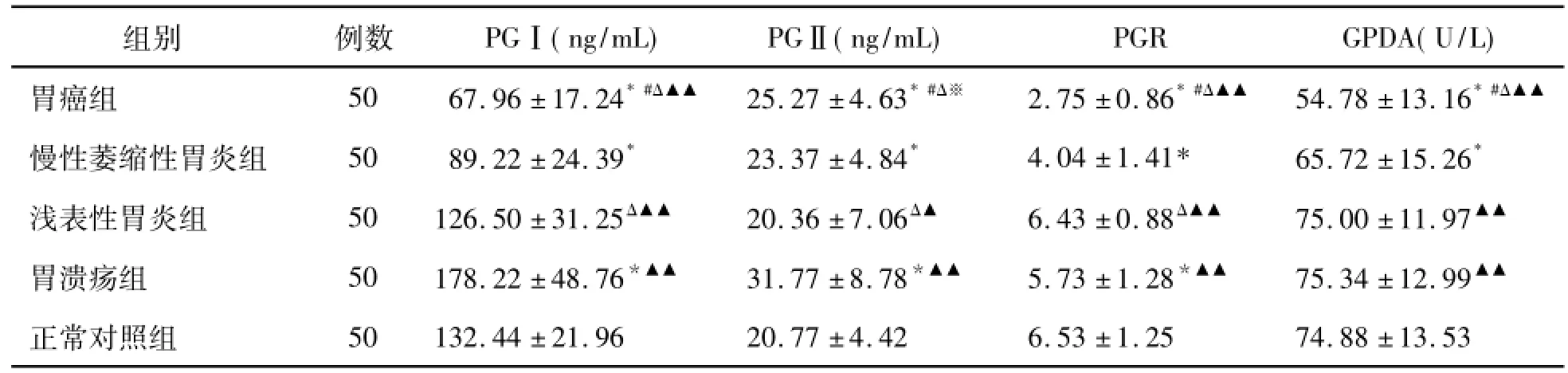
表1 各组PGⅠ、PGⅡ、PGR及GPDA水平的变化(±s)
注:与正常对照组比较,*P<0.01;与浅表性胃炎组比较,#P<0.01;与胃溃疡组比较,ΔP<0.01;与慢性萎缩性胃炎组比较,▲P<0.05、▲▲P<0.01
组别例数PGⅠ(ng/mL)PGⅡ(ng/mL)PGR GPDA(U/L)胃癌组50 67.96±17.24*#Δ▲▲25.27±4.63*#Δ※2.75±0.86*#Δ▲▲54.78±13.16*#Δ▲▲慢性萎缩性胃炎组50 89.22±24.39*23.37±4.84*4.04±1.41*65.72±15.26*浅表性胃炎组50 126.50±31.25Δ▲▲20.36±7.06Δ▲6.43±0.88Δ▲▲75.00±11.97▲▲胃溃疡组50 178.22±48.76*▲▲31.77±8.78*▲▲5.73±1.28*▲▲75.34±12.99▲▲正常对照组50 132.44±21.96 20.77±4.42 6.53±1.25 74.88±13.53
二、各组Hp阳性率的比较
碳14尿素呼气试验检测结果显示胃癌组、浅表性胃炎组、胃溃疡组、慢性萎缩性胃炎组、正常对照组Hp感染阳性率分别为76%、68%、80%、72%及58%。胃溃疡组Hp感染阳性率明显高于正常对照组(χ2=5.657,P<0.05),其余各组间差异均无统计学意义(P均>0.05)。见表2。
三、同组Hp阳性及阴性患者PGⅠ、PGⅡ、PGR及GPDA水平的比较
各组内Hp阳性与阴性患者之间PGⅠ、PGⅡ、PGR及GPDA水平差异均无统计学意义(P>0.05),见表2。
四、血清PGⅠ、PGⅡ和PGR及GPDA诊断胃癌的ROC曲线分析
ROC曲线分析显示PGⅠ、PGⅡ、PGR及GPDA的最佳临界值分别为80.50 ng/mL、25.70 ng/mL、3.28和57.50 U/L,此时的灵敏度、特异性、阳性预测值、阴性预测值见表3。PGⅠ、PGⅡ、PGR及GPDA的ROC曲线下面积分别为0.763、0.397、0.801和0.715。PGⅠ、PGR及GPDA有较大价值,PGⅡ价值较低。见表4、图1。
表2 各组内Hp阳性和阴性患者血清PGⅠ、PGⅡ、PGR及GPDA水平的比较(±s)

表2 各组内Hp阳性和阴性患者血清PGⅠ、PGⅡ、PGR及GPDA水平的比较(±s)
阳性阳性例数(%)PGⅠ(ng/mL)PGⅡ(ng/mL)PGR GPDA(U/L) Hp组别例数胃癌组50 38(76)66.37±18.86 24.52±4.71 2.78±0.97 54.16±12.01浅表性胃炎组50 34(68)131.41±28.69 20.99±6.27 6.45±0.97 75.00±11.41胃溃疡组50 40(80)180.28±45.94 31.60±8.76 5.86±1.33 75.80±13.36慢性萎缩性胃炎组50 36(72)86.14±21.66 22.92±4.16 3.99±1.38 65.69±13.48正常对照组50 29(58)132.83±18.59 20.23±3.99 6.75±1.42 75.28±13.40组别例数Hp阴性阴性例数(%)PGⅠ(ng/mL)PGⅡ(ng/m L)PGR GPDA(U/L)胃癌组50 12(24)73.00±9.51 27.67±3.57 2.66±0.34 56.75±16.65浅表性胃炎组50 16(32)116.06±34.74 19.03±8.58 6.38±0.70 75.00±13.49胃溃疡组50 10(20)170.01±60.90 32.48±9.31 5.21±0.93 73.50±11.85慢性萎缩性胃炎组50 14(28)97.14±29.75 24.53±6.30 4.16±1.51 67.14±19.26正常对照组50 21(42)131.90±26.41 21.52±4.96 6.22±0.91 74.33±14.03
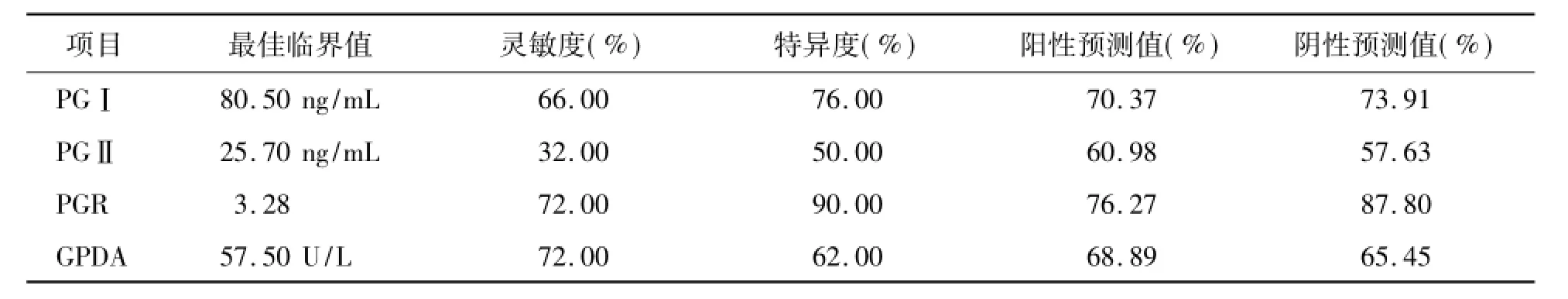
表3 PGⅠ和PGR及GPDA指标最佳临界值及阳性预测值、阴性预测值
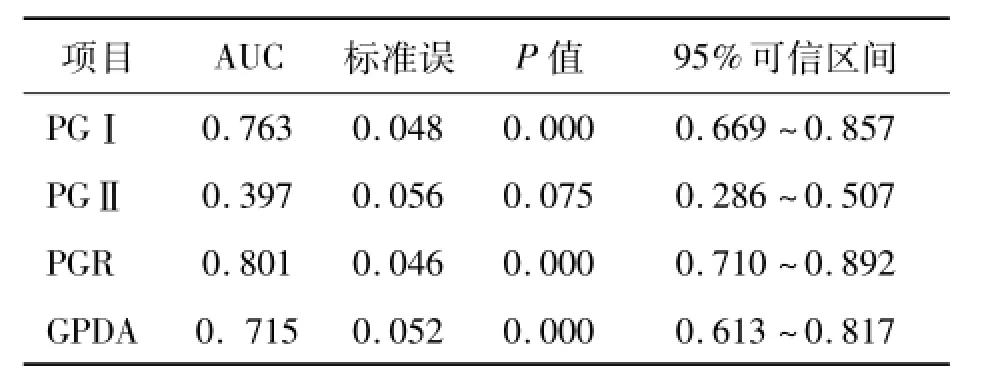
表4 PGⅠ、PGⅡ、PGR及GPDA的ROC曲线下面积比较
五、PG和GPDA联合检测对胃癌的诊断价值
PGⅠ、PGR及PGⅠ+PGR分别与GPDA并联(即任一指标阳性即诊断为胃癌)检测后对胃癌的诊断灵敏度均有不同程度的提高;诊断特异性均≥70.0%,见表5。

图1 胃癌患者PGI、PGII和PGR及GPDA的ROC曲线
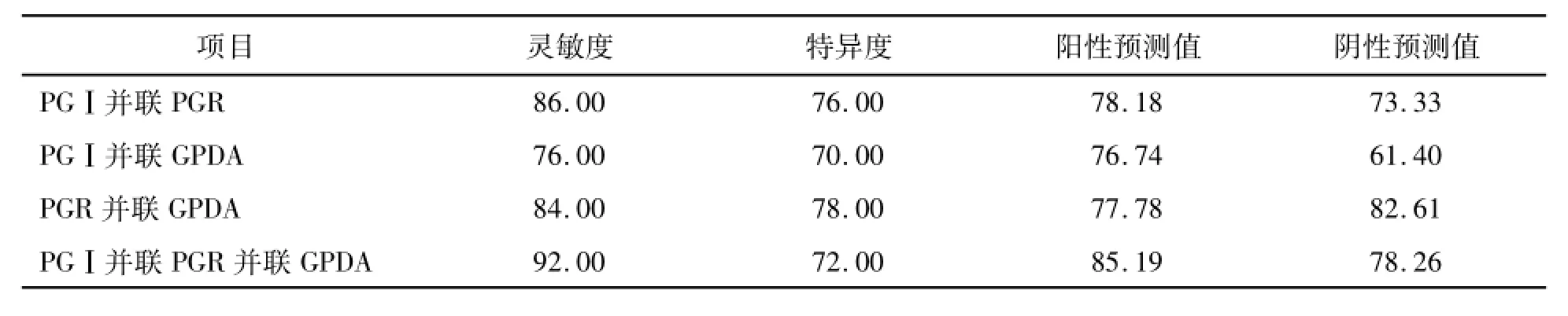
表5 PG和GPDA并联检测对胃癌的诊断价值(%)
讨论
胃癌是最常见的恶性肿瘤之一,目前诊断胃癌的主要方法是纤维胃镜和上消化道造影检查,其中胃镜是确诊胃癌的“金标准”,但对亚临床症状患者尚不能作为普查手段。早期胃癌缺乏一定的特异性症状和体征,当发现时往往已是中、晚期,从而失去了最佳的治疗时机,影响胃癌的预后。PGⅠ、PGⅡ反映了胃黏膜腺体和细胞的数量,也间接反映了胃黏膜不同部位的分泌功能。不同的胃黏膜疾病PGⅠ的分泌表现不同,PGR也会发生变化[4]。GPDA是一种水解甘氨酰脯氨酸β-萘酰胺的二肽萘酰胺酶,广泛分布于肝、肾、唾液腺、颌下腺、淋巴结等组织及唾液、血液等体液中,但其生理功能尚不清楚。研究发现GPDA在肝癌中显著升高[2],而在胃癌中显著降低[5]。本研究结果显示,与正常对照组比较,慢性萎缩性胃炎组、胃癌组PGⅠ、PGR及GPDA明显降低(P<0.05),而PGⅡ明显升高(P<0.05);胃溃疡组PGR降低,PGⅠ、PGⅡ升高(P<0.05),而GPDA水平2个组之间无明显变化(P>0.05)。提示血清PG可作为胃癌的辅助诊断指标[6-7]。PG发生变化的机制可能为:(1)慢性萎缩性胃炎由于胃黏膜萎缩,正常腺体功能丧失,被幽门腺或肠上皮化生代替,腺体和主细胞数量减少,酶原的产生受到影响,故血清PGⅠ水平下降,进而导致PGR降低;(2)胃癌患者由于癌组织浸润及黏膜萎缩逐渐扩大,主细胞进一步受损丢失,尤其表现在进展期胃癌上;同时,致癌因子,尤其是Hp长期持续感染可造成PG基因突变,从而使主细胞失去分泌PGⅠ的能力;另外,因分泌PGⅡ的胃黏膜细胞分布较广以及幽门腺化生使PGⅡ产生增多,从而造成胃癌患者PGⅠ、PGR降低;(3)胃溃疡患者由于主细胞及壁细胞数量增加,PG分泌也相应增多;溃疡造成黏膜破损,导致PG自胃腔进入血液的机会增加,血清PGⅠ、PGⅡ上升。有研究显示消化性溃疡初发患者PGⅠ明显升高,而复发者PGⅡ明显升高;十二指肠溃疡复发患者PGⅠ、PGⅡ均明显升高,治愈后PGⅠ、PGⅡ恢复正常[8]。因此,过高的血清PGⅠ、PGⅡ水平对提示消化性溃疡的诊断和疗效观察有重要的临床意义[9]。
研究表明肿瘤的发生、发展与细胞外基质(extracellular matrix,ECM)破坏密切相关。ECM大体上可分为胶原、蛋白聚糖和糖蛋白。GPDA能特异性水解ECM胶原分子中含有丰富的甘氨酰脯氨酰结构,造成胶原降解,从而促进肿瘤发生、发展。至于胃癌患者GPDA降低的机制尚待进一步研究。
Hp感染初期可引起慢性浅表性胃炎,后期可导致慢性萎缩性胃炎、肠上皮化生、不典型增生,与胃癌的发生密切相关[10]。碳14尿素呼气试验结果显示胃癌组、浅表性胃炎组、慢性萎缩性胃炎组、正常对照组Hp感染阳性率相近(P>0.05),仅胃溃疡组Hp感染阳性率明显高于正常对照组(P<0.05);且各组内Hp阳性与阴性患者的PGⅠ、PGⅡ和PGR及GPDA水平差异均无统计学意义(P>0.05)。有研究报道,Hp感染后主要通过增加宿主细胞内钙离子流、磷酸肌醇浓度和cAMP刺激胃泌素分泌增加,从而增加PG的合成分泌[11],PGⅡ分泌增多较PGⅠ明显[12]。这与本研究结果不一致,其原因可能与本研究选择的患者例数较少及地区不同有关。
本研究结果还显示,血清PGⅡ诊断胃癌的ROC曲线下面积仅为0.397,诊断价值较低; PGⅠ、PGR及GPDA诊断胃癌的ROC曲线下面积均>0.70,提示PGⅠ、PGR及GPDA在诊断胃癌方面有较大的价值。ROC曲线分析显示PGⅠ、PGR、GPDA的最佳临界值分别为80.50 ng/mL、3.28和57.50 U/L,此时的灵敏度分别为66.00%、72.00%、72.00%,特异性分别为62.00%、76.00%、90.00%。PG与GPDA并联可提高灵敏度,但特异度降低;其中,PGⅠ、PGR和GPDA以并联的方式联合检测,灵敏度可达92.0%,而特异性仍达70.0%。值得注意的是,血清PG是诊断胃癌的良好指标,但只能用于从萎缩性胃炎(包括肠化生)进展到胃癌的人群,对无萎缩的胃癌患者不宜使用[13]。虽然如此,但80%的胃癌组织中均存在着严重萎缩,可造成血清PGⅠ、PGR下降[14]。因此,血清PG和GPDA对胃癌的诊断有一定的参考价值,两者联合检测的价值更大。
[1]邱志琦,温少磊,谭智毅.胃蛋白酶原Ⅰ、Ⅱ及其比值在胃癌筛查中的应用[J].检验医学与临床,2013,10(14):1806-1807.
[2]项文坤,熊锋宝,杨铁一,等.血清唾液酸上皮膜抗原及甘氨酰脯氨酸二肽氨基肽酶单项及联合检测诊断胃癌的临床研究[J].中国实用内科杂志,2009,29(11):1012-1014.
[3]徐光炜.新编常见恶性肿瘤诊治规范——胃癌分册[M].北京:北京医科大学中国协和医科大学联合出版社,1999:40-47.
[4]梁军.血清胃蛋白酶原在胃腺癌诊断中的临床价值[J].全科医学临床与教育,2014,12(3):247-249.
[5]KAGEYAMA T.Pepsinogens,progastricsins,and prochymosins:structure,function,evolution,and development[J].Cell Mol Life Sci,2002,59(2): 288-306.
[6]张金锋.血清胃蛋白酶原、CEA、CA19-9及CA72-4检测对胃癌的诊断价值探讨[J].检验医学,2014,29(8):831-834.
[7]卢灿荣,张士武,张勇,等.癌胚抗原、糖链抗原72-4和胃蛋白酶原联合检测评价胃癌的诊断价值[J].检验医学,2012,27(6):442-444.
[8]费凤英,王金金,祝新华.血清胃蛋白酶原检测在胃癌诊治中的应用进展[J].医学信息,2011,24 (3):1461-1463.
[9]赵兰静,刘春兴,安仙园.血清胃蛋白酶原和抗Hp IgG抗体对消化性溃疡的临床意义[J].检验医学,2014,29(11):1124-1127.
[10]KONTUREK PC,KONTUREK SJ,BRZOZOWSKI T.Helicobacter pyloriinfection in gastric cancerogenesis[J].J Physiol Pharmacol,2009,60(3):3-21.
[11]LORENTE S,DOIZ O,TRINIDAD SERRANO M,et al.Helicobacter pylori stimulates pepsinogen secretion from isolated human peptic cells[J].Gut,2002,50 (1):13-18.
[12]SUN LP,GONG YH,WANG L,et al.Serum pepsinogen levels and their influencing factors:a population-based study in 6 990 Chinese from North China[J].World J Gastroenterol,2007,13(48): 6562-6567.
[13]OISHI Y,KIYOHARA Y,KUBO M,et al.The serum pepsinogen test as a predictor of gastric cancer:the Hisayama study[J].Am J Epidemiol,2006,163 (7):629-637.
[14]赵瑶,刘银梅,胡文斌,等.胃蛋白酶原在癌前病变、胃癌诊断中的应用进展[J].实用癌症杂志,2011,26(2):205-207.
(本文编辑:龚晓霖)
“检验医学新技术”继续教育回执(复印有效)
注:单位和家庭地址可任选其一填写(原则上按您的通信地址填写);地址填写格式:×省×市×区(县)×路×弄×号×室
1673-8640(2015)09-0911-05
R446.11
A
10.3969/j.issn.1673-8640.2015.09.011
2014-12-17)
武良,男,1964年生,学士,主任技师,主要从事普通外科相关工作。