DNA甲基化对动脉粥样硬化影响的研究进展
陈 婕,王肖龙
·综述与进展·
DNA甲基化对动脉粥样硬化影响的研究进展
陈 婕,王肖龙
动脉粥样硬化性心血管病已成为全球人口主要致死的病因,其发病原因复杂。DNA甲基化是表观遗传学的重要构成之一,在甲基化转移酶的作用下调控基因的转录活性。近期研究发现,DNA甲基化在动脉粥样硬化发生、发展过程中起着重要作用。本文就DNA甲基化影响动脉粥样硬化形成的近年来研究作一综述。
动脉粥样硬化;DNA甲基化;环境因素;基因
动脉粥样硬化性心血管疾病已经成为发达国家的主要发病和死亡原因,发展中国家的发病率也在逐年增加[1]。2006年卫生部就关于我国居民主要死亡原因情况进行调查统计,数据显示:我国有1/3的疾病死亡归为心血管疾病,之所以会成为全世界流行的疾病主要归因于环境因素和现代人的生活饮食习惯[2]。
动脉粥样硬化(atherosclerosis,AS)主要的病理改变是动脉管壁内脂质积聚导致管壁增厚、弹性降低以及管腔狭窄。近年来国内外学者对AS发病机制与表观遗传学的关系成为研究热点。自1865年孟德尔发现分离规律和自由组合规律两个重要的遗传学规律以来,研究者们逐渐了解到不能仅仅从DNA序列上寻找众多复杂疾病的病因。表观遗传学证实了组织细胞内DNA序列并未改变但基因的表达水平可遗传性变化。所以,基因组序列并不能完全解释多因素疾病,基因-环境交互作用可能在动脉粥样硬化的形成和发展中起到关键的影响[3,4]。DNA甲基化是可以调控基因选择性转录表达的表观遗传修饰,现已成为一个研究热点。随着国内外学者大量的实验研究,DNA甲基化在AS的发病机制中也逐步被认识。现根据近年来关于DNA甲基化修饰作用于AS形成的研究结果进行综述。
1 DNA甲基化修饰
DNA甲基化为最多见的碱基化学修饰,在正常的细胞组织中,大部分散在的胞嘧啶-磷酸-鸟嘌呤(CpG)处于甲基化状态,但CpG岛则未被甲基化修饰,当维持甲基化模式的酶出现调节紊乱时,被保护的CpG岛区域内的2-羰基-4-氨基嘧啶就会通过DNA甲基转移酶(DNA methytransferase,DNMT)甲基化后形成5-甲基胞嘧啶,使DNA构象发生变化而不能启动转录,阻碍基因表达。有实验证明如果DNA甲基转移酶1(DNA methytransferase 1,DNMT1) 和DNA甲基转移酶3b(DNA methytransferase 3b,DNMT3b)共同作用会比三种甲基转移酶单独作用于甲基化位点更降低基因的表达水平。甲基化影响DNA转录的途径可能有以下3条:①直接对易甲基化的转录因子产生作用,使其失去与DNA相结合的能力;②甲基CpG黏附分子与甲基化不敏感的转录因子结合而使它们活性丧失;③通过改变染色质结构阻碍转录因子与其调控序列结合。有研究者发现:DNMT、组蛋白修饰、RNA干扰均是DNA甲基化的影响因素。
2 DNA甲基化、同型半胱氨酸异常增高与动脉粥样硬化形成
2.1 甲基化作用于动脉粥样硬化形成 动脉粥样硬化的形成受到基因组甲基化的影响,DNA甲基化可以调节某些被甲基化区域的基因表达和血管平滑肌细胞的分化[5]。Post等发现,与正常样本相比,动脉粥样硬化的斑块中ER a启动子CpG岛甲基化水平增高,可能导致疾病基因转录水平发生变化而使血管平滑肌细胞数目异常增多[6]。同时,我国有学者指出,动脉粥样硬化的形成与高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)使单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)DNA低甲基化有关[7]。所以,AS的形成是多个基因甲基化以及不同基因不同甲基化水平联合作用的结果。
2.2 高同型半胱氨酸调节甲基化修饰促进动脉粥样硬化形成 1969年McCully指出:血清中游离的同型半胱氨酸(homocysteine,Hcy)含量增高可能会促进AS的发生。随着表观遗传学近几年来深入的研究,高同型半胱氨酸血症对动脉粥样硬化发生发展的表观遗传学调控也逐渐被国内外学者关注。Sharma等[4]将高同型半胱氨酸血症的冠状动脉粥样硬化性心脏病(coronary atherosclerotic disease,CAD)患者与正常同型半胱氨酸的CAD患者对比,发现只有高同型半胱氨酸血症的CAD患者DNA甲基化。同时,大量研究表明,同型半胱氨酸促进血管平滑肌细胞数目过度增加,并且随着Hcy浓度越高,作用时间越长,血管平滑肌细胞增殖程度越高[8,9]。血管平滑肌细胞数目异常增多后在脂肪条纹中泡沫化,促使脂肪条纹发生脂肪病变,形成纤维斑块,最终发展成为动脉粥样硬化[9]。但目前的发现尚不能解释同型半胱氨酸水平如何调节AS的表观遗传调控机制。
3 关联基因的甲基化和动脉粥样硬化的关系
对AS相关基因甲基化的研究已成为当今热门趋势,迄今为止,主要是关于雌激素受体基因、成纤维细胞生长因子、腺苷三磷酸结合盒转运体A1的研究。
3.1 雌激素受体基因 雌激素受体基因是目前学者探究最多的基因。雌激素影响心肌重塑,防止细胞凋亡,避免心肌细胞和血管内皮细胞损伤和坏死。在正常机体中,雌激素可以拮抗动脉粥样硬化性疾病,其关键是与雌激素结合的雌激素受体(estrogen receptor,ER)。雌激素受体有ERа、ERβ两种亚型,存在于细胞质和细胞核中。曾经对于心血管的研究大部分都集中于ERа,直到1996年才对ERβ有所认识。曾有报道显示1/3 的ERа位于小窝蛋白-1中或者靠近脑动脉和冠状动脉的血管内皮细胞质膜内,而ERβ主要位于细胞核中。然而也有研究人员发现ERа和ERβ均存在于质膜中,并且根据实验数据了解到几乎所有的内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的活化均由ERβ介导[10,11]。
目前有研究表明,AS患者的外周血中ERа基因启动序列CpG岛甲基化呈阳性的比率高于对照组,并且实验组ERа基因的mRNA表达水平低于对照组,由此表明在AS患者病变过程中ERа基因的高甲基化状态所致其RNA低水平表达可促进AS的发生[12,13]。Kim等[14]通过对多部位动脉中粥样斑块区域和非粥样斑块区域对比得出:斑块区域中的ERβ始终呈较高的甲基化水平,当抑制DNMT活性时ERβ会在血管细胞中活跃的表达。提示,ERβ基因的后生修饰异常会促进AS的发展和血管老化。所以ERа和ERβ的DNA甲基化对AS的形成和发展均至关重要。
3.2 成纤维细胞生长因子 Tang等发现成纤维细胞生长因子(fibroblast growth factor 2,FGF2)在心血管系统中扮演着双重角色。在正常的心脏血管壁中能维持血管的平衡稳定,保护血管内皮细胞的存活。但在动脉粥样硬化病变的心脏血管中,FGF2及其受体参与炎症反应,使血管内膜增生,促进血管内斑块的形成[15]。Chang等[16]研究表示Hcy破坏内皮细胞主要是通过转录抑制FGF2基因的启动子,使其启动子区甲基化,而特异性下调成纤维细胞生长因子在动脉内皮细胞内表达。这一研究结果与Li等的结果相吻合。同时,Chang等[16]还发现如果抑制FGF2启动子区甲基化,则上述改变可以发生逆转。但目前国内外关于FGF2甲基化促进动脉粥样硬化生成发展的机制的研究并不多,这或许是未来研究的一个新方向。
3.3 腺苷三磷酸结合盒转运体A1 近几年对腺苷三磷酸结合盒转运体A1(ATP-binding transporter A1,ABCA1) 研究成为国内外的热点。ABCA1包含两个三磷酸腺苷(ATP)结合结构域和两个6-螺旋跨膜结构域,在某些组织中的外周血巨噬细胞中大量表达。ABCA1是胆固醇逆转运体,最主要的功能就是将血管壁上累积的胆固醇转移到肝组织进行排泄。同时,ABCA1也是高密度脂蛋白(high density lipoprotein,HDL)合成的关键基因,调节它的产生和迁移[17]。
我国学者实验研究发现[18,19],AS患者白细胞中的ABCA1基因启动子序列较正常人呈高甲基化状态,ABCA1 基因的转录活性较正常人低,且随着血浆中高密度脂蛋白胆固醇(HDL-C)水平的增高而降低,表明白细胞中ABCA1 基因高甲基化和低HDL浓度与AS的形成有紧密的联系。Yu等[17]做了关于同型半胱氨酸通过单核细胞源性泡沫细胞的ABCA1和酰基辅酶A胆固醇酰基转移酶1(acylcoenzyme A:cholesterol acyltransferase-1,ACAT1) DNA甲基化调节胆固醇排泄的研究发现,ABCA1 DNA甲基化抑制了ABCA1的表达而造成机体内胆固醇大量累积。
3.4 与动脉粥样硬化有关的其他基因 除了以上3种常见基因外,国内外研究较多与AS形成发展有关的基因包括P53基因、细胞外超氧化物歧化酶基因等,而组织因子途径抑制物2 (tissue factor pathway inhibitor-2,TFPI -2)、低密度脂蛋白受体(low-density lipoprotein, LDL Receptor)基因和单羧酸转运蛋白(monocarboxylate transporters,MCTs)等也尚有研究报道,而这些基因(见图1)的甲基化或者多个基因表达水平改变的协同作用可能都会导致AS的形成。
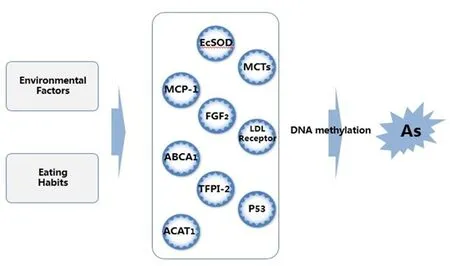
注:EcSOD—细胞外超氧化物歧化酶;MCTs—单羧酸转运蛋白;TFPI-2—组织因子途径抑制物2。
图1 与动脉粥样硬化相关的基因甲基化
4 外界环境因素、生活饮食习惯对甲基化修饰的影响
研究显示环境因素和生活饮食习惯很大程度地影响了动脉粥样硬化的形成。叶酸作为最近研究最多的膳食纤维化合物,已经成为营养素预防疾病的热门话题。研究发现叶酸可以调节同型半胱氨酸的代谢,拮抗因HHcy所致的主动脉组织B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)低甲基化,使B淋巴细胞瘤-2 mRNA表达水平降低,也许叶酸有拮抗粥样斑块进一步发展的作用[20]。但其能否预防动脉粥样硬化的发生还存在争议。
雌激素能够预防AS的发生而大豆中含有大豆异黄酮,其与雌激素有相似结构,故又称为植物雌激素。Fang等[21]实验结果表明,大豆异黄酮能够通过抑制DNA甲基化转移酶激活被甲基化的沉默基因。因此,黄豆的饮食疗法可能将会成为预防AS的又一个方向标。
5 中药对基因甲基化修饰的调控
目前我国尚未研制出成熟的去甲基化药物并且药物细胞毒性较大,所以通过对甲基化修饰的调控来拮抗AS的进一步发展的中药研究更加成为研究者关注的焦点。近期我国学者通过中药作用DNA甲基化稳定粥样斑块的基础研究发现:血府逐瘀胶囊和四季三黄胶囊联合作用可使整个基因组甲基化水平增加而降低机体内三酰甘油的含量,增加动脉内斑块的稳定性,但对AS发生的作用还待进一步确定[22]。而雌激素一直受各国心血管疾病研究人员的热捧,在中药治疗AS的方面也不例外。有研究发现参茸补血丸可以调节甲基化水平,活化RNA聚合酶,增高雌激素水平[23],所以参茸补血丸通过升高甲基化水平来拮抗AS值得深入探究。Wang等[24]发现补肾宁心煎可以抑制细胞黏附分子,提高 ERβ的表达,增强eNOS活性,抑制单核细胞趋化蛋白-1的转录进而缓解AS的早期病理损伤,因此可以进一步研究补肾宁心煎是否可以通过调控甲基化作用干预AS的发生、发展。
6 结语和展望
DNA甲基化对AS影响的研究还处于初步阶段,一些相关基因在什么条件下会发生甲基化,DNMT如何识别基因甲基化位点,甲基化影响基因转录的具体过程还需要更深入的探究。但是,目前研究报道提示基因甲基化是可以发生逆转的,这将给AS的防治提供了明确的方向。DNMT3b可以使已经去甲基化的特异性位点再次甲基化,我们将以此当作突破口,阻断DNMT识别DNA序列的甲基化位点,使其酶不能发挥甲基化作用。今后随着特异性 DNA甲基化位点的发现,可以探索抑制此位点甲基化的策略,恢复基因功能。同时,利用中药调节基因甲基化水平来抑制AS的进一步发展也将成为当今研究的新方向标。相信随着学者更深入地研究,通过中西医结合的方法能够对环境和遗传相互作用所致的动脉粥样硬化起到更好的防治作用。
[1] Yu XH,Zhang J,Zheng XL,et al.Interferon-γ in foam cell formation and progression of atherosclerosis[J].Clin Chim Acta,2015,441:33-43.
[2] Jones GW,McLeod L,Kennedy CL,et al.Imbalanced gp130 signalling in ApoE-deficient mice protects against atherosclerosis[J].Atherosclerosis,2015,238(2):321-328.
[3] Petronis A.Epigenetics as a unifying principle in the aetiology of complex traits and diseases [J].Nature,2010,465(7299):721-727.
[4] Sharma P,Garg G,Kumar A,et al.Genome wide DNA methylation profiling for epigenetic alteration in coronary artery disease patients[J].Gene,2014,541(1):31-40.
[5] Hiltunen MO,Ylä-Herttuala S.DNA methylation,smooth muscle cells,and atherogenesis[J].Arterioscler Thromb Vasc Biol,2003,23(10):1750-1753.
[6] Bressler J,Shimmin LC,Boerwinkle E,et al.Global DNA methylation and risk of subclinical atherosclerosis in young adults:The Pathobiological Determinants of Atherosclerosis in Youth (PDAY) study[J].Atherosclerosis,2011,219(2):958-962.
[7] 王菊.高同型半胱氨酸血症经NF-κB/DNMT1诱导ApoE-/-鼠MCP-1DNA低甲基化致动脉粥样硬化的研究 [D].银川:宁夏医科大学,2013.
[8] 祖权.高同型半胱氨酸血症与动脉粥样硬化的关系及其临床意义[J].吉林医学,2015,36(1):110-112.
[9] Petramala L,Acca M,Francucci CM,et al.Hyperhomocysteinemia:A biochemical link between disease[J].J Endocrinol Invest,2009,32(4Suppl):10.
[10] Knowlton AA,Lee AR.Estrogen and the cardiovascular system[J].Pharmacol Therapeutics,2012,135:54-70.
[11] 徐启华,曹济民.内皮型一氧化氮合酶在动脉粥样硬化中的作用[J].医学研究杂志,2010,39(8):95-97.
[12] Deschamps AM,Murphy E,Sun J.Estrogen receptor activation and cardioprotection in ischemia reperfusion injury[J].Trends Cardiovasc Med,2010,20(3):73-78.
[13] 智艳芳,李肖甫,邱翠,等.动脉粥样硬化患者ERа基因启动序列的高甲基化改变[J].实用检验医师杂志,2013,5(4):210-214.
[14] Kim J,Kim JY,Song KS,et al.Epigenetic changes in estrogen receptor beta gene in atherosclerotic cardiovascular tissues and in-vitro vascular senescence[J].Biochim Biophys Acta,2007,1772(1):72-80.
[15] Liu MH,Tang ZH, Li GH,et al.Janus-like role of fibroblast growth factor 2 in arteriosclerotic coronary artery disease:Atherogenesis and angiogenesis[J].Atherosclerosis,2013,229 (1):10-17.
[16] Chang PY,Lu SC,Lee CM,et al.Homocysteine inhibits arterial endothelial cell growth through transcriptional downregulation of fibroblast growth factor-2 involving G protein and DNA methylation [J].Circ Res,2008,102(8):933-941.
[17] Yu L,Xiaoling Y,Linna M,et al.Homocysteine-mediated cholesterol efflux via ABCA1 and ACAT1 DNA methylation in THP-1 monocyte-derived foam cells[J].Acta Biochim Biophys Sin,2013,45(3):220-228.
[18] 韩学波,张慧萍,马胜超,等.ABCA1 DNA甲基化水平与AS及血脂的关系[J].中国输血杂志,2013,26(5):426-428.
[19] 马雅玲.ABCA1甲基化与基因型和动脉粥样硬化性血栓性脑梗死的关系[D].长沙:中南大学,2013.
[20] Cong G,Jia S,Luo C,et al.Folic acid prevents Bcl-2 hypomethylation in rats with hyperhomocysteinemia[J].Journal of Hygiene Research,2012,41(2):268-272.
[21] Fang MZ,Chen D,Sun Y,et al.Reversal of hypermethylation and reactivation of p16INK4a,RAR beta,and MGMT genes by genistein and other isoflavones from soy[J].Clin Cancer Res,2005,11(19 Pt 1):7033-7041.
[22] 赵伟峰,周明学,王绿娅,等.活血解毒中药对动脉粥样硬化小鼠斑块稳定性、血脂及DNA甲基化水平的影响[J].北京中医药,2014,33(3):215-218.
[23] 吴文婷,金明.DNA甲基化在眼科疾病中的应用以及中药调节甲基化的研究进展[J].中国中医眼科杂志,2014,24(2):149-152.
[24] Wang L,Qiu XM,Hao Q,et al.Anti-inflammatory effects of a Chinese herbal medicine in atherosclerosis via estrogen receptor β mediating nitric oxide production and NF-κB suppression in endothelial cells[J].Cell Death Dis,2013,4:1-13.
(本文编辑 郭怀印)
上海市自然科学基金项目(No.12ZR1432600);上海市科委项目(No.12401903400,14401972202);上海市中西医结合重点病种—慢性心衰建设项目(No.zxbz2012-08)
上海中医药大学附属曙光医院(上海201203)
王肖龙,E-mail:wxlqy0214@163.com
R543.5 R256.2
A
10.3969/j.issn.1672-1349.2015.10.009
1672-1349(2015)10-1177-03
2015-04-03)

