梅毒螺旋体粘附于人脑微血管内皮细胞的实验研究
吴凡 张瑞丽 张津萍 王千秋
近10年,我国梅毒发病率逐年升高,其中三期梅毒发病率年均增长20.92%[1]。神经梅毒是三期梅毒的表现形式之一,它是由梅毒螺旋体侵犯中枢神经系统引起的一种慢性感染性疾病,国内已有学者研究本病的临床特点,但尚无发病机制的相关研究报道[2-3]。神经梅毒作为一种经血源播散的感染性疾病,血液循环中的梅毒螺旋体粘附并穿越血脑屏障是神经梅毒发病机制的关键步骤之一。但人脑微血管内皮细胞(human brain microvascular endothelial cells,HBMEC)作为血脑屏障的重要组成部分,与外周血管内皮细胞存在较大差异,如细胞间存在大量的紧密连接,内皮细胞跨膜电阻高,缺乏胞饮囊泡等[4]。本研究将梅毒螺旋体与原代HBMEC混合培养,采用扫描电镜技术和暗视野显微镜检查计数法观察梅毒螺旋体与HBMEC的粘附情况,为进一步研究神经梅毒的发病机制提供理论基础和新的研究思路。
材料和方法
一、材料
1.动物及细胞来源:3月龄成年雄性新西兰大白兔购自江苏省金陵种兔场,于中国医学科学院皮肤病研究所实验动物中心按要求喂养,合格证号为201403098。体重2.5~3 kg,快速血浆反应素环状卡片实验(RPR)阴性。梅毒螺旋体Nichols株由厦门大学附属中山医院杨天赐教授馈赠。原代HBMEC生产于Cell Systems公司。
2.主要试剂与仪器:内皮细胞完全培养液(美国Cell Systems公司),EDTA-胰蛋白酶消化液(美国Gibco公司),暗视野显微镜(日本Nikon公司),EX70倒置相差显微镜(日本Olympus公司),S-3000N型扫描电镜(日本Hitachi公司)。
二、方法
1.原代HBMEC的复苏与培养:从液氮容器中取出HBMEC冻存管,迅速置于37℃水浴锅中后,200×g离心5 min,弃上清液。内皮细胞完全培养液重悬细胞,接种于培养瓶中,37℃5%CO2培养,选择3~6代细胞进行实验。
2.梅毒螺旋体培养:双侧兔睾丸分别注射1×107~3×107条梅毒螺旋体,每周观察3次兔睾丸的大小和硬度,判断是否形成睾丸炎,睾丸炎明显时处死实验动物,无菌条件下取下双侧睾丸,组织剪碎后加提取液于室温下振荡30 min,取组织液于室温下1000×g离心10min,取上清液,4℃下12000×g离心30 min。移去上清液,加适量细胞培养液稀释沉淀物至 4 × 106条/ml、8 × 106条/ml、1.6 × 107条/ml。
3.扫描电镜观察:将直径为14 mm的圆形盖玻片置于24孔细胞培养板中,每孔接种2×105个HBMEC,37℃5%CO2培养,倒置相差显微镜下观察,细胞融合达40%左右用于实验。实验前2 h移去旧培养液,换新鲜培养液,然后加入1.6×107条/ml梅毒螺旋体悬液,于混合培养0.5、2、4 h后取出盖玻片,磷酸盐缓冲液(PBS)冲洗3次,加预冷的2.5%戊二醛4℃固定16 h,1%锇酸固定1 h,乙醇梯度脱水,冷冻,喷金,扫描电镜下观察并照相。
4.梅毒螺旋体粘附实验:HBMEC培养方法同上,细胞融合达40%左右用于实验。实验前2 h移去旧培养液,换新鲜培养液,加入不同密度(4×106/ml、8× 106/ml、1.6× 107/ml)梅毒螺旋体悬液,每孔 500 μl,37 ℃ 5%CO2培养,于混合培养 2、4、6、16 h 后移除上清液,取出盖玻片,PBS冲洗3次,暗视野显微镜下计数20个细胞上粘附的梅毒螺旋体数目,重复观察3次,独立进行2次实验。
结 果
一、扫描电镜观察
梅毒螺旋体主体呈均匀的细条型,含8~12个螺旋,两端逐渐变尖,呈锥形,无法辨别头端和尾端。混合培养0.5 h后就有梅毒螺旋体粘附于HBMEC表面(图1A)。混合培养2、4 h后,HBMEC表面吸附的梅毒螺旋体数量逐渐增加,且表现为集中吸附于HBMEC细胞膜的某一区域(图1B、1C)。混合培养4 h,可见多条梅毒螺旋体吸附于细胞膜上相近位置(图1D、1E、1F),有1条梅毒螺旋体已部分进入HBMEC下方,另外一部分位于细胞外(图1E);有2条梅毒螺旋体与HBMEC粘附的部位已经与细胞膜部分融合(图1F)。
二、梅毒螺旋体与HBMEC的粘附情况
加入不同密度的梅毒螺旋体悬液与HBMEC混合培养后,不同培养时间及不同密度组间梅毒螺旋体粘附数目差异均有统计学意义(F=387.72、593.23,均P<0.001),且培养时间与密度存在交互作用(F=98.74,P<0.001),即不同密度组梅毒螺旋体粘附数目随时间变化的趋势不同(表1)。进一步分析单独效应,在固定梅毒螺旋体悬液各密度条件下,不同时间点之间的梅毒螺旋体粘附数目比较,差异均有统计学意义(P<0.001),且各培养时间点不同密度组梅毒螺旋体粘附数目比较,差异亦均有统计学意义(P<0.001)。在3个不同密度组中,梅毒螺旋体粘附数量随培养时间的延长而增加,6 h时达到高峰,然后呈下降趋势。两两比较发现,4×106条/ml和8×106条/ml组中4和6 h间粘附数量差异无统计学意义,8×106条/ml组2和16 h间粘附数量的差异无统计学意义(P=0.374、0.922、0.206),其余时间点间差异均有统计学意义(均P<0.001);1.6×107条/ml组中每个时间点粘附数量差异均有统计学意义(均为P<0.001)。此外,除培养2h时8×106条/ml和1.6×107条/ml组的粘附数量差异无统计学意义(P=0.730),其余各时间点各组间比较差异均有统计学意义(均P<0.05)。
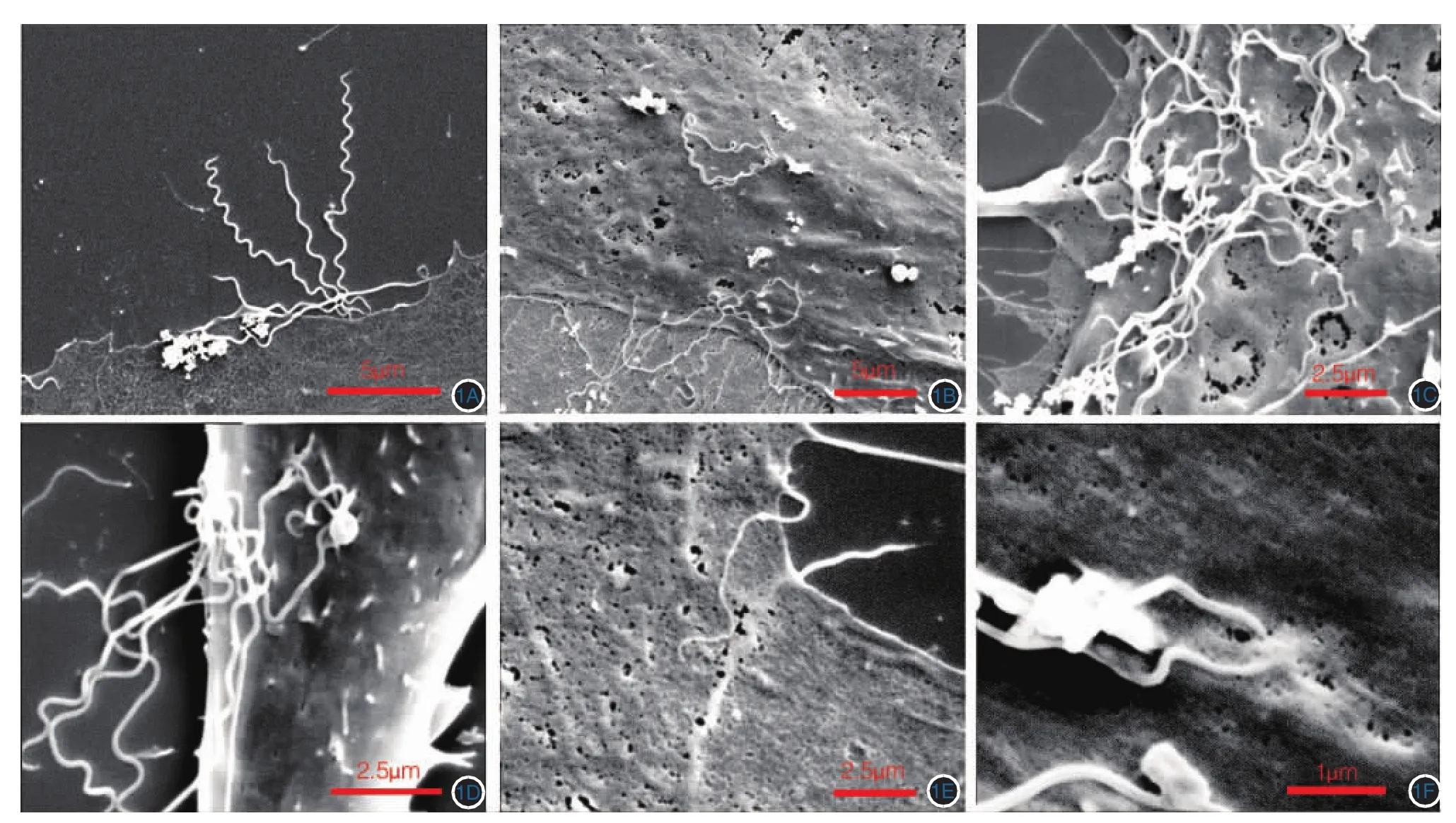
图1 梅毒螺旋体与人脑微血管内皮细胞(HBMEC)粘附的扫描电镜观察 1A:混合培养0.5 h,可见梅毒螺旋体与HBMEC粘附;1B:混合培养2 h;1C:混合培养4 h,HBMEC吸附的梅毒螺旋体数量逐渐增加;1D:混合培养4 h,数条梅毒螺旋体集中粘附于细胞膜上;1E:混合培养4 h,1条梅毒螺旋体部分“钻入”HBMEC下方,而细胞膜表面完整;1F:混合培养4 h,在吸附部位梅毒螺旋体末端与细胞膜发生融合

表1 梅毒螺旋体与人脑微血管内皮细胞共培养不同时间的粘附情况
讨 论
神经梅毒是梅毒螺旋体感染中枢神经系统后引起的一种感染性疾病,本病发病隐匿,临床表现复杂多样且缺乏特征性,是一种误诊率高达73.3%的疾病[5]。梅毒螺旋体作为一种侵袭性病原菌已被证实可在体外培养环境下粘附并穿越人真皮微血管内皮细胞、人主动脉内皮细胞、人脐静脉内皮细胞和Hela细胞等多种人体细胞[6-7]。本研究选择原代HBMEC作为实验细胞,加入具有活力的梅毒螺旋体混合培养,利用扫描电镜和暗视野显微镜观察梅毒螺旋体与细胞的粘附情况。结果显示,梅毒螺旋体的粘附率整体呈现先上升,4 h达最大值,而后逐渐下降的趋势。Hayes 等[8]将梅毒螺旋体分别与兔睾丸细胞和HEP-2在不同的温度下混合培养,结果显示,随着培养温度的升高,细胞上粘附的梅毒螺旋体数量逐渐增加,37℃时粘附率最高,且在2 h时梅毒螺旋体的粘附数量达到最大,指出梅毒螺旋体的粘附程度依赖于培养温度和梅毒螺旋体的活力。因为梅毒螺旋体缺乏某些物质代谢的关键酶,所以必须依赖宿主提供的营养成分才能增殖和致病,利用与动物细胞在体外共同培养的方法可延长梅毒螺旋体的存活时间和毒力保持时间[9-11]。我们在暗视野显微镜下观察到粘附在细胞上的梅毒螺旋体仍具有活力,部分梅毒螺旋体甚至呈高速螺旋式运动,而部分未粘附的梅毒螺旋体也具有活力,混合培养16 h后粘附的梅毒螺旋体仍具有较高的活性。
在体内,当梅毒螺旋体引起播散性系统感染时,倾向粘附于具有高浓度糖胺聚糖的组织或代谢旺盛的组织,如真皮、睾丸、主动脉、眼、胎盘、脐带等[12]。梅毒螺旋体离开宿主后迅速失去活力,逐渐丧失对细胞的粘附能力,数小时后死亡。将梅毒螺旋体与不同来源的细胞混合培养时,梅毒螺旋体倾向粘附于生长活跃的细胞上,而粘附于细胞的梅毒螺旋体比未粘附的梅毒螺旋体的存活时间更长,提示梅毒螺旋体与细胞的粘附情况还依赖于宿主的代谢状态。虽然粘附在梅毒螺旋体感染过程中的作用尚未完全清楚,但研究者推测,一方面粘附于宿主细胞可以为梅毒螺旋体提供必要的营养物质和生长因子,减少氧气对梅毒螺旋体的毒性,另一方面粘附可能直接与梅毒螺旋体的增殖有关[13]。HBMEC作为血脑屏障的重要组成部分,其代谢旺盛,生化特性不同于外周血管内皮细胞,梅毒螺旋体粘附于HBMEC的分子机制尚需深入研究和探索。
扫描电镜观察,发现了一些暗视野显微镜和相差显微镜下无法观察到的粘附细节。混合培养0.5 h后就观察到梅毒螺旋体粘附于HBMEC上,随着混合培养时间的延长,HBMEC表面粘附的梅毒螺旋体数量逐渐增加,且呈现出群集吸附于细胞膜上的现象。粘附的聚集现象可能与细胞膜的流动性有关,细胞受到梅毒螺旋体刺激后,表面的受体随细胞膜的流动聚集于最初的粘附部位,进而吸引更多的梅毒螺旋体粘附于该处细胞膜表面。Fitzgerald等[14]利用扫描电镜观察梅毒螺旋体与兔睾丸细胞和人皮肤上皮细胞的粘附情况,发现在粘附部位梅毒螺旋体本身和细胞表面均未观察到结构和形态的变化,指出梅毒螺旋体与细胞的粘附似乎是一种物理靠近。研究证实,梅毒螺旋体粘附于细胞之上并不破坏细胞的物理结构,不影响细胞的活性,也不引起细胞凋亡[15]。但我们在电镜下观察到1条梅毒螺旋体的大部分已与细胞膜融合,而剩余部分仍位于细胞外(图1E),有2条梅毒螺旋体的末端已经与细胞膜部分融合(图1F)。我们猜测梅毒螺旋体可能具有溶解HBMEC细胞膜的能力,但溶解过程并不引起细胞的活性改变,细胞可通过自我修复使细胞膜再度恢复完整。梅毒螺旋体也可能是通过其尖端吸附于HBMEC后,利用菌体螺旋运动产生的动力从细胞边缘“钻”入细胞下方,进而通过HBMEC单层。HBMEC是一种终末微血管内皮细胞,是血脑屏障的重要组成部分,梅毒螺旋体粘附HBMEC的方式可能与梅毒螺旋体粘附于其他组织细胞的方式不同。梅毒螺旋体的粘附是否会破坏HBMEC膜的物理完整性、影响细胞的活性,是否会引起细胞的生化特性改变,还需进一步深入探讨。
本研究结果显示,梅毒螺旋体可粘附于体外培养的HBMEC表面,粘附数量在混合培养4 h达到最大值。梅毒螺旋体与HBMEC的粘附可能涉及细胞膜表面的融合,这在神经梅毒发病中可能起一定的作用。本研究存在两点不足,一方面,利用暗视野显微镜进行粘附计数不够精确,仅能粗略地反应每个细胞上大概粘附的梅毒螺旋体数量;另一方面,扫描电镜照片不能观察亚细胞水平的变化。因此,后续研究中需进一步使用qPCR等分子生物学方法进行验证,同时可以利用透射电镜深入分析梅毒螺旋体与HBMEC粘附的作用方式。
[1]龚向东,岳晓丽,滕菲,等.2000-2013年中国梅毒流行特征与趋势分析[J].中华皮肤科杂志,2014,47(5):310-315.
[2]张利贞,滕弘,李薇,等.神经梅毒的临床特点[J].临床神经病学杂志,2013,26(4):272-274.
[3]毛晨晖,高晶,黄颜,等.伴颞叶内侧病变的神经梅毒三例临床、影像特点和机制探讨[J].中华神经科杂志,2013,46(1):22-25.
[4]GeorgievaJV,HoekstraD,ZuhornIS.Smugglingdrugsintothebrain:an overview of ligands targeting transcytosis for drug delivery across the blood-brain barrier[J].Pharmaceutics,2014,6(4):557-583.
[5]Yang T,Tong M,Xi Y,et al.Association between neurosyphilis and diabetes mellitus:resurgence of an old problem [J].J Diabetes,2014,6(5):403-408.
[6]ThomasDD,NavabM,HaakeDA,etal.Treponema palliduminvades intercellular junctions of endothelial cell monolayers[J].Proc Natl Acad Sci U S A,1988,85(10):3608-3612.
[7]Lee JH,Choi HJ,Jung J,et al.Receptors forTreponema pallidumattachment to the surface and matrix proteins of cultured human dermal microvascular endothelial cells[J].Yonsei Med J,2003,44(3):371-378.
[8]Hayes NS,Muse KE,Collier AM,et al.Parasitism by virulentTreponema pallidumof host cell surfaces[J].Infect Immun,1977,17(1):174-186.
[9]Fitzgerald TJ,Miller JN,Sykes JA.Treponema pallidum(Nichols strain)in tissue cultures:cellular attachment,entry,andsurvival[J].Infect Immun,1975,11(5):1133-1140.
[10]Graves SR,Sandok PL,Jenkin HM,et al.Retention of motility and virulence ofTreponema pallidum(Nichols strain)in vitro[J].Infect Immun,1975,12(5):1116-1120.
[11]Sykes JA,Miller JN.Intracellular location ofTreponema pallidum(Nichols strain)in the rabbit testis[J].Infect Immun,1971,4(3):307-314.
[12]Fitzgerald TJ.Pathogenesis and immunology ofTreponema pallidum[J].Annu Rev Microbiol,1981,35:29-54.
[13]Wong GH,Steiner B,Faine S,et al.Factors affecting the attachment ofTreponema pallidumto mammalian cellsin vitro[J].Br J Vener Dis,1983,59(1):21-29.
[14]Fitzgerald TJ,Cleveland P,Johnson RC,et al.Scanning electron microscopy ofTreponema pallidum(Nichols strain)attached to culturedmammaliancells[J].JBacteriol,1977,130(3):1333-1344.
[15]Fitzgerald TJ,Johnson RC,Sykes JA,et al.Interaction ofTreponema pallidum(Nichols strain)with cultured mammalian cells:effects of oxygen,reducingagents,serum supplements,and different cell types[J].Infect Immun,1977,15(2):444-452.

