适用于本科教学的新酶促反应动力学实验研究
吴梅芬, 王晓岗, 刘亚菲, 许新华
(同济大学 化学系, 上海 200092)
实验教学研究
适用于本科教学的新酶促反应动力学实验研究
吴梅芬, 王晓岗, 刘亚菲, 许新华
(同济大学 化学系, 上海 200092)
通过严格的化学反应动力学推导,得到了-糜蛋白酶催化三甲基乙酸对硝基苯酯水解反应相关的动力学参数的表达式,包括表观米氏常数KM、酶-底物络合物稳定常数K、催化速率常数kcat、以及基元反应步骤速率常k2和k3等。实验在25 ℃,pH =8.5的三羟基氨基甲烷缓冲液中进行,用分光光度法测定反应的动力学曲线。数据经过非线性拟合和线性拟合,得到相关的动力学参数,该参数与理论预测一致。该实验酶制剂价格低廉,活性稳定,实验方法简单,可作为本科物理化学实验课程中复杂反应动力学测量的一个很好的实例,加深学生对化学反应动力学相关理论和概念的理解和掌握。
酶催化; 复杂反应; 化学反应动力学; 实验教学
酶催化反应动力学实验能够生动展示复杂反应过程的细节,是学生理解化学反应动力学理论的良好实例[1-2]。国内高校在生化专业实验课程中开设的酶促反应动力学实验,实验方法均以生化实验技术为主[3-8]。但是,这些实验的设计根据的是并不准确的米开利-蒙顿(Mechaelis-Menten)机理[9],也并不严格遵循化学反应动力学的原则,实验测定时往往以产物浓度对反应时间的比值作为瞬时反应速率,不够严谨。在国内高校的物理化学实验教材中,酶催化反应的实验项目比较少[10],实验对象以蔗糖酶为主。由于实验课时有限等原因,酶的提取和纯化过程重现性较差,实验教学效果不够理想。
本文提出一种适用于高校本科教学的酶促反应动力学新实验——-糜蛋白酶催化酯类化合物水解反应实验。实验采用物理化学实验的常用方法——分光光度法,催化剂是商品化的酶制剂,品质有保证且价格较低,能够满足众多学生实验的成本控制需求。更为重要的是,经过对该反应机理的深入研究,该方法不符合简单的米开利-蒙顿机理,这就使得学生在分析实验数据时,必须严格按照化学动力学原则进行逻辑分析。由于该反应机理足够复杂,包含多种常见复杂反应类型(如对峙反应、连续反应等),对学生全面理解和掌握化学动力学原理和计算方法是一个很好的训练。
1 反应机理和动力学模型
本文采用的酶催化底物为三甲基乙酸对硝基苯酯(4-nitrophenyl-trimethylacetate,用S表示),在-糜蛋白酶(-Chymotrypsin,用E表示)的催化下水解生成对硝基苯酚(4-nitrophenol,用P1表示)和三甲基乙酸(trimethylacetic acid,用P2表示),反应在pH=8左右的碱性缓冲水溶液中进行,生成的产物以其共轭碱的形式存在。反应方程如下:
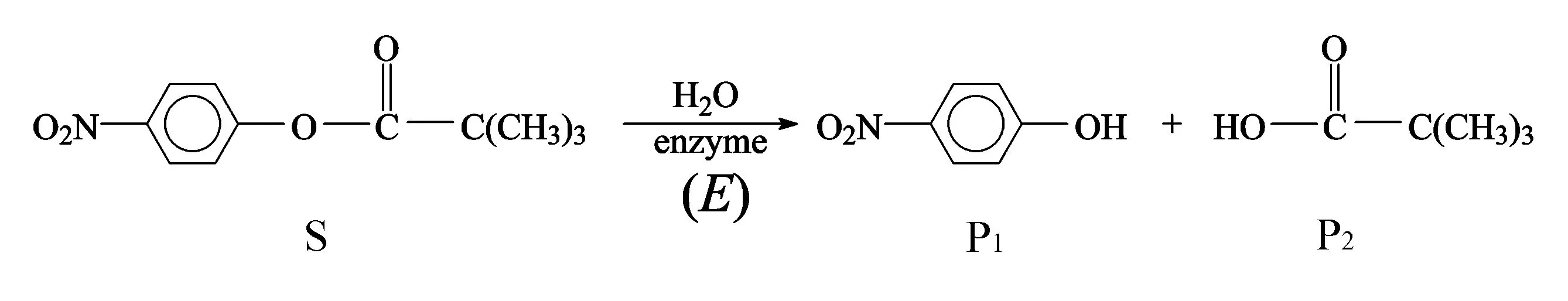
实验测得,当酶与底物混合后,产物P1立刻有“爆发性”的增长,然后P1的浓度进入平缓增长期。这个现象不符合传统的米开利-蒙顿机理。根据Bender及其同事提出的-糜蛋白酶催化反应动力学模型[11-13],可以假设如下反应机理:
可逆酶-底物键合
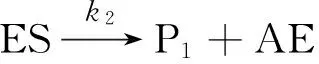

AE表示乙酰化酶假定底物初始浓度远远大于酶初始浓度,即C0(S)≫C0(E),为推导P1浓度C(P1)与时间t之间的关系,写出微分方程:
(1)
(2)
(3)
酶的物质平衡关系为
C0(E)=C(E)+C(ES)+C(AE)
(4)
第一步快速预平衡步骤有
(5)
根据式(1)—式(5),可以得到:
(6)
(7)
式中参数
(8)
将方程(7)代入方程(1),积分后得到
C(P1)=mt+n(1-e-b t)
(9)
式中
(10)
图1是根据方程(9)绘制的曲线,与实验测定结果完全相符。

图1 产物P1浓度与时间关系曲线
2 动力学参数计算方法
如果底物同时进行着酶催化水解反应和非催化水解反应,这两个反应都产生P1,能够被光谱仪检测。当计算酶催化动力学参数时,必须先扣除非催化水解反应的本底数据。
C0(E)act=xC0(E)total
(11)
式中x是粗酶原料的纯度百分数。通过动力学测量,可以估算x值。
如果固定粗酶浓度C0(E)total,然后测定一系列初始浓度C0(S)下的C(P1)-t关系曲线,通过曲线拟合得到一系列m、n、b参数。
首先考虑m,将参数a、b的定义式(8)代入方程(10),并变形为
(12)
式中
(13)
m的量纲是“浓度时间-1”(如mol·dm-3·s-1),与反应速率量纲相同。以作图得一直线,由直线的斜率和截距可以计算出表观米氏常数KM;如果已知活性酶浓度C0(E)act,则可以计算出催化速率常数kcat。
n≈C0(E)cat
(14)
即由参数n能够直接得到活性酶浓度C0(E)act,根据方程(11)可以估算粗酶的纯度百分数x,并可计算出kcat。
若仅测量一个底物初始浓度的实验曲线,在C0(S)≫KM条件下,m可以简化为
m=kcatC0(E)act
(15)
如果已知活性酶浓度C0(E)act,就可以由m直接计算出kcat。
按同样方法将b参数也表达成双倒数形式
(16)
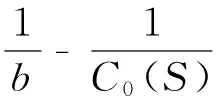
3 仪器与试剂
紫外可见分光光度计(Agilent 8453),三羟甲基氨基甲烷(A.R.),盐酸(A.R.),三甲基乙酸对硝基苯酯(A.R.),对硝基苯酚(A.R.),-糜蛋白酶(800 usp unit/mg,阿拉丁试剂)。
4 实验步骤
(1)配制溶液。溶液a:浓度为0.01 mol·dm-3、pH=8.5的三羟甲基氨基甲烷(TRIS)缓冲液,pH值用盐酸调节;溶液b:用乙腈溶解三甲基乙酸对硝基苯酯,配成浓度约为3×10-3mol·dm-3的溶液;溶液c:取50 mg-糜蛋白酶用水稀释至1 mL,酶浓度2.0×10-3mol·dm-3,冰水浴冷却备用。
(2) 测定实验条件下对硝基苯酚的吸光系数。用TRIS缓冲液配制浓度约为3×10-5mol·dm-3的对硝基苯酚溶液,在分光光度计上测定溶液的吸光度,并计算吸光系数,测定波长400 nm,以TRIS缓冲液为参比。
(3) 测定非催化条件下酯水解反应的本底曲线。在干净的石英比色皿中加入3 mL溶液a,然后加入100 μL溶液b,混合均匀。在25C下定波长400 nm测量溶液的吸光度随时间变化曲线,共计记录约2 000 s。
(4) 测定酶催化条件下酯水解反应的动力学曲线。在干净的石英比色皿中加入3 mL溶液a和40 μL溶液b,混合均匀,然后立即注入80 μL溶液c并混合均匀。25C下定波长400 nm测量溶液的吸光度随时间变化曲线,共计记录约2 000 s,起始时间为注入溶液c的时刻。反应条件下粗酶浓度为5×10-5mol·dm-3。
控制其他条件不变,将溶液b的加入体积依次改变为50、60、70、90、100 μL,测定不同底物浓度下的酶催化酯水解反应动力学曲线。
5 结果与讨论
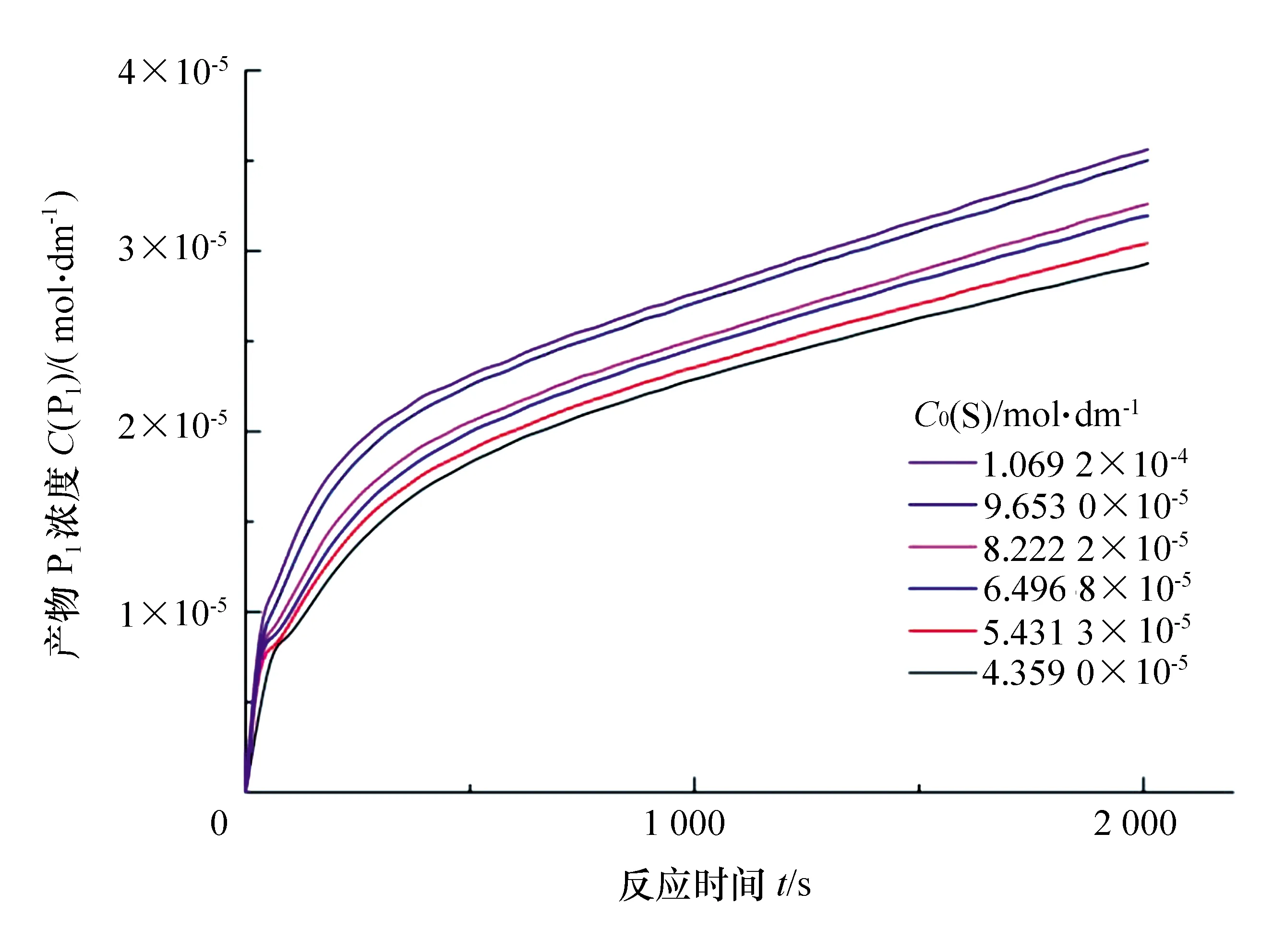
图2 不同初始底物浓度条件下产物对硝基苯酚(P1)浓度随反应时间变化曲线

表1 不同初始底物浓度下的拟合参数
校正确定系数Adj.R2=0.975 48
校正确定系数Adj.R2= 0.943 86

图3 1/m-1/C0(S)关系线性拟合曲线
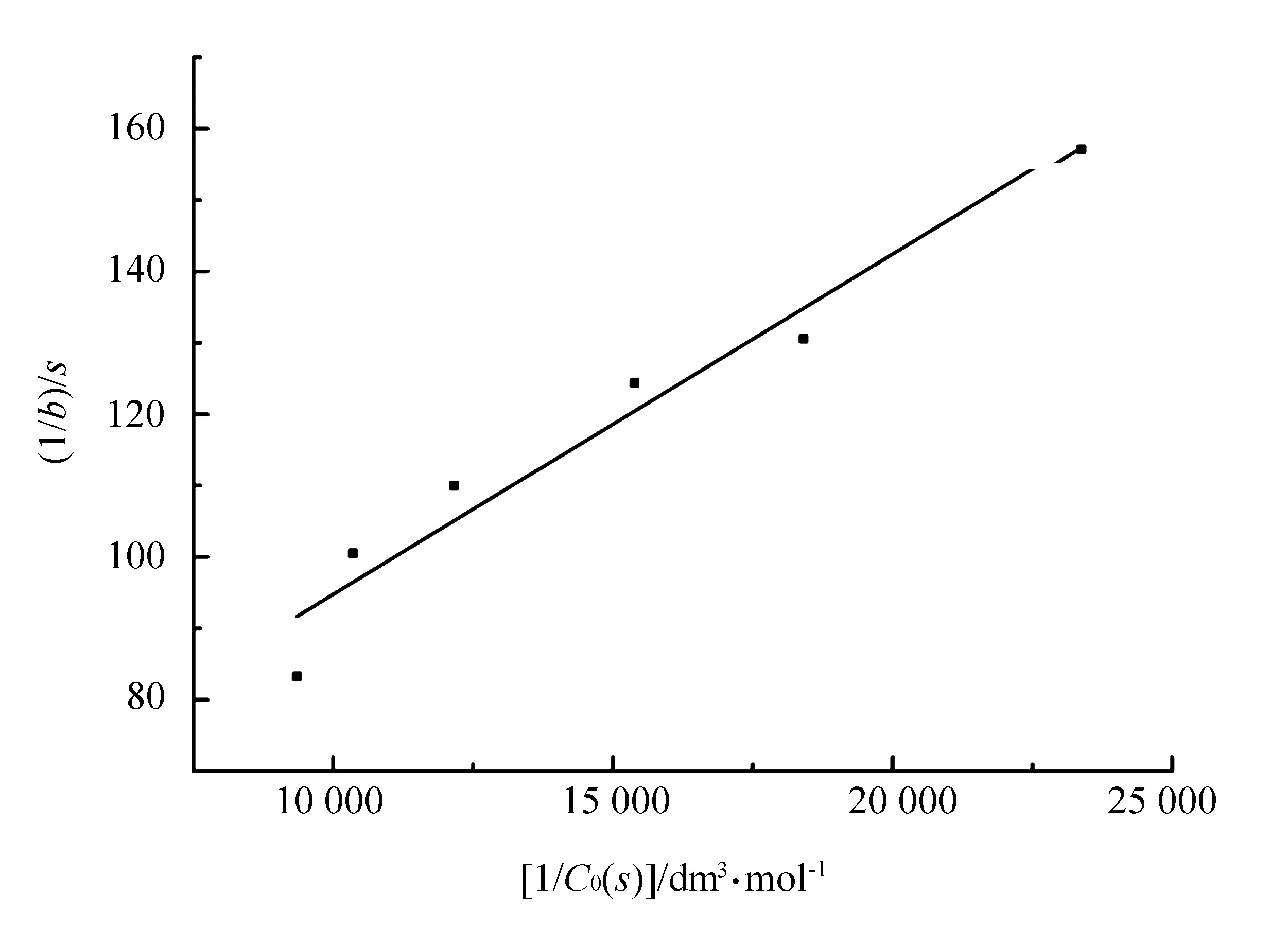
图4 1/b-1/C0(S)关系线性拟合曲线
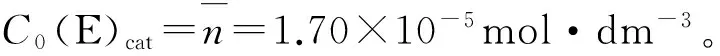
KM=1.86×10-5mol·dm-3
kcat=5.90×10-4s-1
K=1.01×10-4mol·dm-3
k2=2.06×10-2s-1
k3=6.32×10-4s-1
由此可见k2≫k3,kcat≈k3,且kcat略小于k3,与理论预测一致。
根据方程(11),可以估算粗酶的纯度x= 34%。
6 结论
(
)
[1] Murray R K, Granner D K, Mayes P A,et al. Harper’s Illustrated Biochemistry[M]. 26th ed. New York: McGraw-Hill Co,2003.
[2] Atkins P, Paula J. Physical Chemistry[M].7th ed.New York: W H Freeman and Company,2002.
[3] 蒋立科,杨婉身.现代生物化学实验技术[M].北京:中国农业出版社,2003:267-281.
[4] 张蕾,刘昱,蒋达和,等.生物化学实验指导[M].武汉:武汉大学出版社,2011:142-183.
[5] 何献君,吕光璞,陈雅惠.过氧化物酶酶促动力学实验的设计[J].实验技术与管理,2009,26(6):33-35.
[6] 胡晓倩,陈雅蕙,邓爱平,等.谷胱甘肽转硫酶酶促动力学实验设计[J].实验技术与管理,2002,19(1):27-31.
[7] 周海梦,周广业.兔肌肌酸激酶分离纯化和部分性质的测定:努力将科研成果转化为高水平的教学实验[J].实验技术与管理,1999,16(2):30-33.
[8] 袁昕,吕锴林,赵立青.糖原磷酸化酶b分离纯化方法的建立及其在本科实验教学中的实践[J].实验室科学,2008,11(6):84-85,87.
[9] 彭笑刚.物理化学讲义[M].北京:高等教育出版社,2012:660-668.[10] 蔡显鄂,项一非,刘衍光.物理化学实验[M].2版.北京:高等教育出版社,1992:121-126.
[11] Zerner B, Bender M L. The Kinetic Consequences of the Acyl-Enzeme Mechanism for the Reactions of Specific Substrates with Chymotrypsin[J].Journal of the American Chemical Society, 1964,86:3669-3673.
[12] Zerner B, Bond R P M. Kinetic Evidence for the Formation of Acyl-Enzyme Intermediates in the-Chymotrypsin-Catalyzed Hydrolyses of Specific Substrates[J]. Journal of the American Chemical Society, 1964,86:3674-3679.
[13] Bender M L, Clement G E, Kézdy F J,et al. The Correlation of the pH(pD) Dependence and the Stepwise Mechanism of-Chymotrypsin-Catalyzed Reactions[J]. Journal of the Amrican Chemical Society, 1964,86:3680-3690.
[14] Bender M L, Kézdy F J, Wedler F C.-Chymotrypsin: Enzyme Concentration and Kinetics[J].Journal of Chemical Education, 1967,44:84-88.
Research on a novel kinetics experiment of enzyme-catalyzed reaction presented for undergraduate teaching
Wu Meifen, Wang Xiaogang, Liu Yafei, Xu Xinhua
(Department of Chemistry,Tongji University,Shanghai 200092,China)
The mechanism of-chymotrypsin-catalyzed hydrolysis of 4-nitrophenyl trimethylacetate includes the following steps: the reversible enzyme-substrate binding and the enzyme acylation and enzyme deacylation. This mechanism is quite different from the conventional Michaelis-Menten mechanism for enzyme-catalyzed reactions. The corresponding kinetic parameters can be expressed precisely on the basis of chemical kinetics theory, such as Michaelis constantKM, equilibrium constantK, catalytic rate constantkcat, and the rate constants of the elementary reactionsk2andk3. The reaction is carried out at 25C in a pH = 8.5 buffer of tris(hydroxymethyl)aminomethane (TRIS) by means of spectrophotometry. The kinetic curves are fitted linearly and non-linearly. The kinetic parameters are in agreement with the theoretical prediction. The enzyme product used in this experiment is cheap and the activity is stable. The experimental method is simple enough to be applied in undergraduate physical chemistry laboratory courses. As an ideal model of complex reaction, the experiment will help the students to enhance the understanding and knowledge of chemical kinetics theories.
enzyme-catalysis; complex reaction; chemical kinetics; experimental teaching
2015- 04- 07
同济大学第八期精品实验项目建设(1380104084);同济大学实验教改项目建设(1380104081)
吴梅芬(1970—),女,上海,博士,高级工程师,从事物理化学实验教学工作
E-mail:wumf@tongji.edu.cn
许新华(1967—),男,浙江黄岩,博士,副教授,从事物理化学及实验的教学工作.
E-mail:xxh01@tongji.edu.cn
O642; TG146
A
1002-4956(2015)11- 0170- 04

