油橄榄鲜果中多酚提取工艺优化及不同成熟度含量变化分析
刘 露,邓俊琳,王寒冬,丁春邦*,李 天
1 四川农业大学生命科学学院,雅安 625014;2 四川农业大学农学院,成都 611130
油橄榄(Olea europaea L.)是木犀科木犀榄属常绿乔木,为世界著名油料作物,原产地中海沿岸国家[1]。中国从1956 年开始引种油橄榄,到2013 年栽植面积达到3 万余公顷,主要分布于甘肃、四川以及云南西北部金沙江流域等地区[2]。油橄榄是一种油果兼用的独特树种,用鲜果榨取的橄榄油,是最为理想的健康食用油之一;用鲜果制成的果用油橄榄更是世界流行的高质量食品,营养成分保存完整,具有促消化、预防心血管疾病和抗肿瘤等多种功能[3]。植物多酚是一类广泛存在于植物体内的天然大分子化合物,具有抗氧化、抗衰老、抗辐射、抗肿瘤、杀菌等多种生物活性[4,5]。多酚是油橄榄果的主要活性物质之一,其含量也是评价油橄榄制品的指标之一[6]。
目前植物多酚的提取方法主要有溶剂提取法、生物酶解提取法、微波辅助提取法、超临界流体萃取法、膜技术提取法和超声波辅助提取法等[7]。其中,超声波辅助提取法是利用空化效应促进样品和溶剂的分子运动,具有提取效率高、成本低、便于大规模生产等优点[8],现已广泛应用于植物天然产物的提取[9,10]。因此,本试验采用响应面法(response surface methodology,RSM)优化油橄榄果中多酚的超声波辅助提取工艺,并分析8 个油橄榄品种5 个成熟度的多酚含量变化,为油橄榄果中多酚化合物的进一步研究提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
油橄榄鲜果于2014 年7~10 月采自四川西昌的北河油橄榄种植基地,共选取8 个品种(皮瓜尔、弗奥、克罗莱卡、卡林、鄂植、云台、配多灵和科拉蒂)5 个成熟度,成熟度以果皮、果肉色泽区分[11],洗净冷冻储存备用。无水碳酸钠、没食子酸标准品、甲醇、福林酚显色试剂溶液等。所有试剂均为分析纯。
微量移液枪;BT-124S 电子天平,德国Sartorius公司;RM-220 试验室超纯水机,四川沃特尔科技发展有限公司;KQ-300GDV 恒温数控超声波清洗器,昆山舒美超声仪器有限公司;高速冷冻离心机,德国Thermo 公司;UV-1750 分光光度计,日本岛津公司。
1.2 试验方法
1.2.1 油橄榄鲜果多酚提取
将冷冻的油橄榄果实去核,用液氮研磨至均匀粉末,迅速称取0.5 g,加入80%甲醇进行超声辅助提取,提取液高速冷冻离心(8000 rpm,4 ℃,10 min),收集上清液。
1.2.2 油橄榄鲜果多酚含量测定
多酚含量的测定采用Folin-Ciocalteu 法[12],稍加改进:取上清液100 μL,加3 mL 蒸馏水,再加0.2 mL 福林酚试剂混匀,约5 min 后加0.8 mL 10%的Na2CO3溶液混匀,避光反应1 h,于765 nm 检测吸光值。以没食子酸为标准品,标准曲线为Y=0.0029X,R2=0.9989,其中X 为没食子酸质量浓度(μg/mL),Y 为吸光值。
多酚提取量(mg/g)=样品液中多酚质量浓度×样品液体积×1000/油橄榄粉末质量
1.2.3 单因素试验
料液比分别以1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),于40 ℃的条件下超声辅助提取30 min,探讨料液比对油橄榄多酚提取量的影响;超声时间分别以10、20、30、40、50 min,在料液比1∶20(g/mL)、40℃的条件下进行超声辅助提取,探讨超声时间对油橄榄多酚提取量的影响;超声温度分别以20、30、40、50、60 ℃,在料液比1∶20(g/mL)的条件下超声辅助提取30 min,探讨超声温度对油橄榄多酚提取量的影响。
1.2.4 响应面法优化试验设计
在单因素试验结果的基础上,选择料液比(A)、超声时间(B)、超声温度(C)为自变量,以油橄榄多酚提取量(Y)为响应值。根据Box-Behnken 的中心组合试验设计原理[13],设计三因素三水平响应面试验(表1),预测油橄榄多酚超声辅助提取的最佳工艺。

表1 响应面分析因素及水平表Table 1 Factors and levels of RSM experiments
1.2.5 不同成熟度油橄榄鲜果多酚含量测定
采用优化的提取工艺,提取测定8 个品种5 个成熟度的油橄榄鲜果多酚含量,每个成熟度重复3次,以探讨多酚含量在油橄榄果实不同成熟阶段的变化。
1.2.6 数据处理
所有数据均为3 次重复试验的平均值,应用Microsoft Excel 2010、SPSS 20.0、Design-Expert 8.0、Origin 9.0 对数据进行处理、分析和作图。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对油橄榄多酚提取量的影响
由图1A 可知,当料液比在1∶10~1∶30(g/mL)时,油橄榄多酚的提取量随着料液比的增加而增加,当料液比达到1∶30(g/mL)时,多酚提取量达到最大值为5.6306 mg/g,之后随着料液比增加多酚提取量缓慢下降。考虑到节约成本和后续浓缩工作,将优化料液比选为1∶20、1∶30、1∶40(g/mL)。
2.1.2 超声时间对油橄榄多酚提取量的影响
由图1B 可知,当超声时间在10~30 min 时,油橄榄多酚的提取量随着超声时间的增加而增加,当超声时间达到30 min 时,多酚提取量达到最大值为5.8970 mg/g,之后随着超声时间的增加多酚提取量迅速下降。这可能是因为超声时间过长,引起多酚结构变化,从而导致提取量下降。因此,将优化超声时间选为20、30、40 min。
2.1.3 超声温度对油橄榄多酚提取量的影响
由图1C 可知,当超声温度在20~40 ℃时,油橄榄多酚提取量随着超声温度的增加迅速增加,当超声温度达到40 ℃时,多酚提取量达到7.0496 mg/g;之后随着超声温度的增加多酚提取量缓慢增加。考虑到多酚的稳定性和能耗等因素,将优化超声温度选为30、40、50 ℃。

图1 料液比(A)、超声时间(B)及超声温度(C)对油橄榄多酚提取量的影响Fig.1 Effect of solid-liquid ratio(A),ultrasonic time(B)and ultrasonic temperature(C)on the extraction yield of polyphenols
2.2 响应面法优化油橄榄多酚提取工艺
2.2.1 响应面试验设计与结果
以单因素试验结果为基础,根据Box-Behnken中心组合试验设计原理,设计响应面试验(表2)。利用Design-Expert 8.0 软件对表2 中的试验结果进行二次多元回归拟合,得到油橄榄多酚提取量(Y)与料液比(A)、超声时间(B)和超声温度(C)之间的回归模型为:
Y=6.77+0.28A+0.16B+0.27C-0.037AB+0.19AC-0.18BC-0.86A2-0.37B2-0.22C2
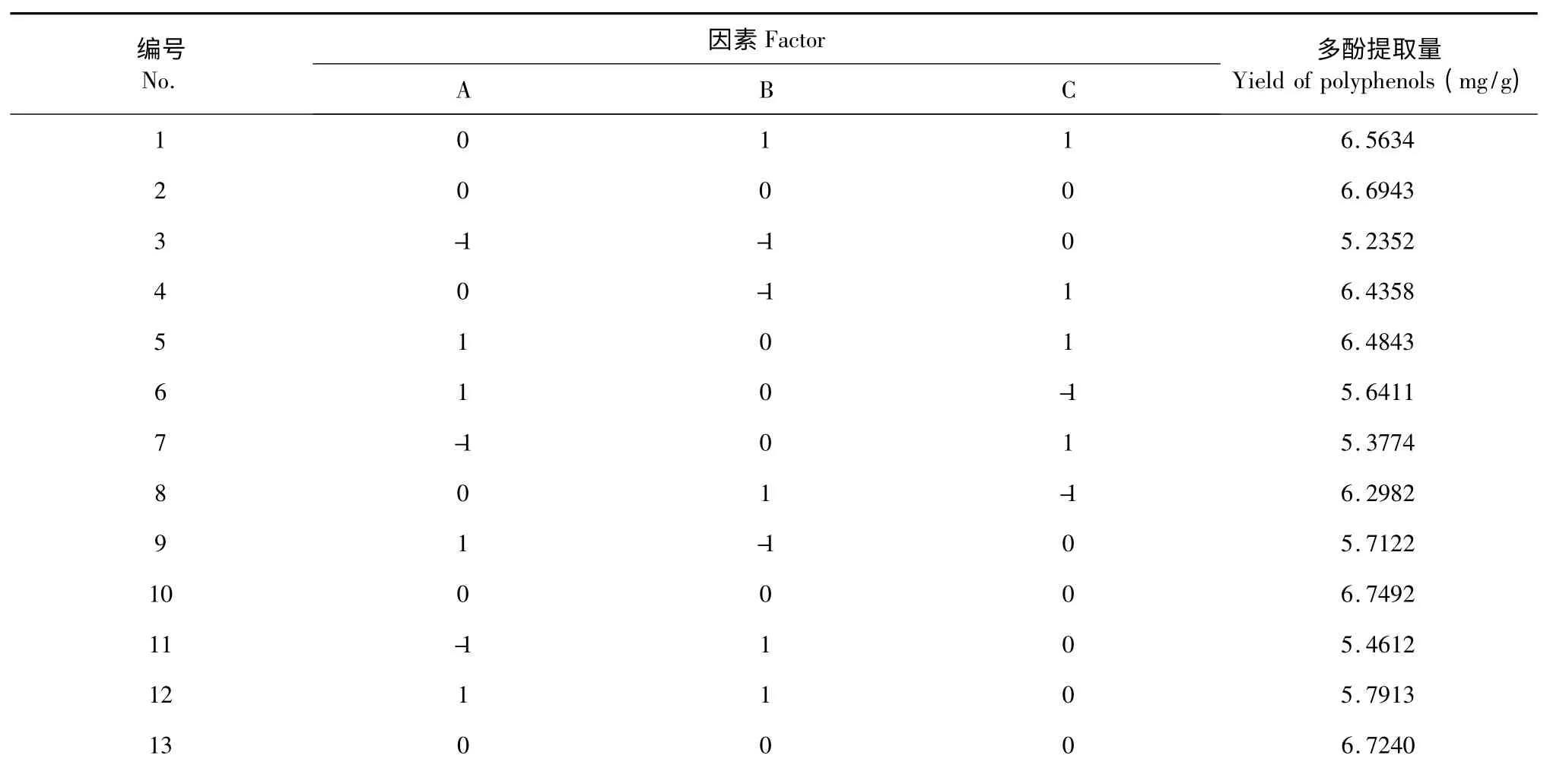
表2 响应面试验设计及结果Table 2 Results of response surface experiments

2.2.2 回归模型方差分析与显著性检验
利用Design-Expert 8.0 软件对回归模型进行方差分析(analysis of variance,ANOVA)(表3),结果显示,模型极显著(P<0.01),失拟项不显著(P>0.05),相关系数R2=0.9755,说明该模型拟合度较好,可以用于预测超声辅助提取油橄榄多酚的最佳工艺参数。另外,该模型的变异系数C.V 为2.38%,说明试验结果重复性好、可信度高。
A、C、A2、B2 影响极显著,B、AC、BC、C2影响显著,因此,各因素对油橄榄多酚提取量的影响并不是简单的线性关系。根据F 值的大小,可以得出三个因素对油橄榄多酚提取量的影响大小为料液比>超声温度>超声时间。
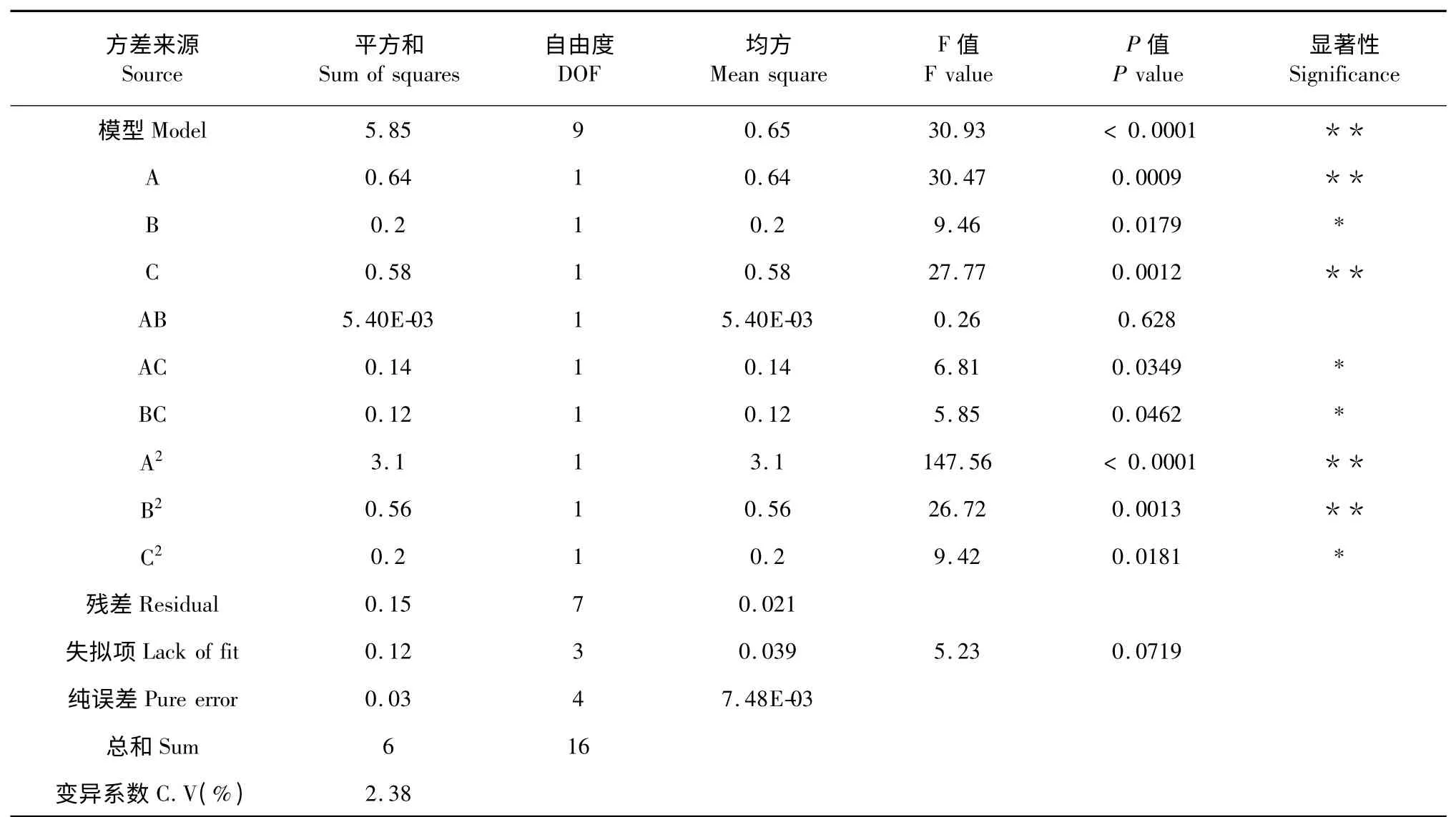
表3 回归模型方差分析和显著性检验Table 3 Estimated regression coefficients and analysis of variance(ANOVA)for the model
2.2.3 响应面分析
根据试验结果,利用Design-Expert 8.0 软件作图,得到三个因素交互作用的响应面和等高线图(图2),可直观反映试验因素的交互作用。由响应面图可知,当超声温度为40 ℃时,油橄榄多酚提取量随着料液比的增加先增加后减少,随着超声时间的增加先增加后趋于稳定(图2A);超声时间为30 min 时,油橄榄多酚提取量随着料液比的增加先增加后减少,随着超声温度的增加先增加后趋于稳定(图2B);料液比为1∶30 g/mL 时,油橄榄多酚提取量随着超声时间和超声温度的增加逐渐增大(图2C)。等高线的形状可以反映交互作用的强弱,椭圆形表示交互作用显著,而圆形则与之相反,同时闭合的椭圆形或圆形表示有最大值[14]。料液比和超声时间的等高线呈圆形(图2a),表明这两者交互作用不显著;料液比与超声温度以及超声时间与超声温度的等高线呈椭圆形(图2b 和2c),表明这些因素间的交互作用显著;这与方差分析一致。

图2 各因素间交互作用对多酚提取量影响的响应面(A、B 和C)及等高线图(a、b 和c)Fig.2 Response surface plots(A,B and C)and contour plots(a,b and c)showing the effects of different factors on extraction yield of polyphenols
2.2.4 验证试验
通过响应面优化,得到超声辅助提取油橄榄多酚的最佳工艺条件为料液比1∶22.4(g/mL)、超声时间30.3 min、超声温度47.2 ℃,在此条件下油橄榄多酚提取量为6.9074 mg/g。
考虑到实际操作的可行性,将优化的工艺条件修改为料液比1∶22(g/mL)、超声时间30 min、超声温度47 ℃,在此条件下进行3 次重复试验,油橄榄多酚实际平均提取量为6.8145 mg/g,与预测值的相对误差为1.35%。表明回归模型拟合度高,可用于优化超声辅助提取油橄榄多酚的工艺条件,具有实用价值。
2.3 不同成熟度油橄榄鲜果多酚含量的变化
油橄榄鲜果多酚含量因品种不同而有差异。从总体变化趋势来看,第一成熟度油橄榄鲜果中多酚含量最高,之后随着成熟度增加多酚含量逐渐下降,在第三成熟度达到最低,之后略有增加,最终趋于相对稳定(图3)。8 个油橄榄品种鲜果中的多酚含量平均值从第一成熟度的17.1281 mg/g 减少到第三成熟度的5.6273 mg/g(降幅超过60%),之后小幅增长到第五成熟度的6.5807 mg/g。随着油橄榄鲜果成熟度的增加,果肉中水解酶活性持续增强,导致橄榄苦甙含量的逐渐下降,而橄榄苦甙是油橄榄果肉中多酚的主要成分,其含量的变化将影响多酚含量[15]。这可能是油橄榄多酚含量从第一成熟度到第三成熟度逐渐下降的主要原因。油橄榄果实在第三成熟度后,花青素逐渐增加,果皮和果肉颜色逐渐变深,这可能是油橄榄后期成熟过程中多酚含量有所增加的原因[16,17]。油橄榄果中的多酚类物质的代谢是一个复杂的代谢途径,需要更进一步的研究探索其代谢机制。

图3 油橄榄不同品种果实中多酚提取量随成熟度的变化Fig.3 Content variation on polyphenols of O.europaea fruits during different ripening stages
3 结论
本试验以油橄榄鲜果为原料,甲醇为溶剂,经单因素试验和响应面法优化,得到超声辅助提取油橄榄鲜果中多酚的最佳工艺条件为料液比1∶22 g/mL、超声时间30 min、超声温度47 ℃,在此条件下进行3 次平行重复试验,得到油橄榄鲜果多酚实际平均提取量为6.8145 mg/g,与预测值的相对误差为1.35%。说明模型拟合度好,提取工艺稳定可行,具有实用价值。
油橄榄鲜果多酚含量因品种不同而有差异,在总体变化趋势上,第一成熟度油橄榄鲜果中多酚含量最高,之后随着成熟度增加多酚含量逐渐下降,在第三成熟度达到最低,之后略有增加,最终趋于相对稳定。
1 Li JZ(李聚桢).The research of the development of the Chinese olive industry.Sci Tech Cereal Oil Food(粮油食品科技),2012,20:23-26.
2 Wang CZ(王成章),Chen Q(陈强),Luo JJ(罗建军),et al.Development and industrial prospect of China’s olive.Biomass Chem Eng(生物质化学工程),2013,47:41-46.
3 Xu WY(徐纬英).Chinese Olive(中国油橄榄).Jilin:Changchun Publishing House,2001.230-242.
4 Manach C,Scalbert A,Morand C,et al.Polyphenols:food sources and bioavailability.Am J Clin Nutri,2004,79:727-747.
5 Arts ICW,Hollman PCH.Polyphenols and disease risk in epidemiologic studies.Am J Clin Nutri,2005,81:317S-325S.
6 Obied HK,Karuso P,Prenzler PD,et al.Novel secoiridoids with antioxidant activity from Australian olive mill waste.J Agric Food Chem,2007,55:2848-2853.
7 Pang DR(庞道睿),Liu F(刘凡),Liao ST(廖森泰),et al.Research progress and application of plant polyphenols compounds.Guangdong Agri Sci(广东农业科学),2013,40:91-94.
8 Chen F,Sun Y,Zhao G,et al.Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry.Ultrason Sonochem,2007,14:767-778.
9 Wang J,Sun B,Cao Y,et al.Optimisation of ultrasound-assisted extraction of phenolic compounds from wheat bran.Food Chem,2008,106:804-810.
10 Khan MK,Abert-Vian M,Fabiano-Tixier AS,et al.Ultrasound-assisted extraction of polyphenols(flavanone glycosides)from orange(Citrus sinensis L.)peel.Food Chem,2010,119:851-858.
11 Dabbou S,Dabbou S,Chehab H,et al.Content of fatty acids and phenolics in coratina olive oil from Tunisia:influence of irrigation and ripening.Chem Biodivers,2015,12:397-406.
12 He ZY(何志勇),Xia WS(夏文水).Study on determination of polyphenol content in Canarium album(Lour.)rauesch.By Folin-Ciocalteucolorimetry.Chem Ind For Prod(林产化学与工业),2006,26:15-18.
13 Ferreira SLC,Bruns RE,Ferreira HS,et al.Box-Behnken design:an alternative for the optimization of analytical methods.Anal Chim Acta,2007,597:179-186.
14 Mao JX(毛俊霞),Zhang WJ(张文君),Li XM(李曦默),et al.Optimization of extraction conditions of resveratrol from grape surface methodology.Nat Prod Res Dev(天然产物研究与开发),2014,26:2027-2032.
15 Baccouri O,Guerfel M,Baccouri B,et al.Chemical composition and oxidative stability of Tunisian monovarietal virgin olive oils with regard to fruit ripening.Food Chem,2008,109:743-754.
16 Menz G,Vriesekoop F.Physical and chemical changes during the maturation of Gordal sevillana olives(Olea europaea L.,cv.Gordal Sevillana).J Agric Food Chem,2010,58:4934-4938.
17 Wang W(王伟),Ma YT(马雨婷),Zhang T(张婷).Study on microwave extraction technology and stability of pigment from Xinjiang munage grape skin.China Condiment(中国调味品),2011,36:92-97.

