穿心草属药用植物研究进展
黄焜慧,龙春林,2*
1中央民族大学生命与环境科学学院,北京 100081;2 中国科学院昆明植物研究所,昆明 650201
龙胆科(Gentiannaceae)穿心草属(Canscora Lam.)植物全球约30 余种,为一年生草本,模式种为贯叶草(C.perfoliata Lam.),主要分布于非洲、亚洲及大洋洲的热带和亚热带地区。我国有3 种,分布于华南地区,为铺地穿心草[Canscora diffusa(Vahl)R.Br.ex Roem.& Schult.]、穿心草[C.lucidissima (Levl.& Vaniot)Hand.-Mazz.]和罗星草(C.andrographioides Griffi.ex C.B.Clarke)[1,2]。印度、中国等多个地区将其中几个种作为传统药用植物广泛使用,治疗癫痫、神经衰弱、肝炎、胆囊炎、蛇虫咬伤等疾病,是重要的民间药材。随着科研技术的发展,科研人员从该属植物中分离得到口山酮(xanthones)、三萜(triterpenoids)、黄酮(flavonoids)等具有良好生物活性的化学成分。研究表明口山酮类化合物具有多种的药理活性,如抗疟、保肝及治疗急慢性肝炎的、抗氧化、抗结核、抗抑郁等[3,4],是一类具有较大发展空间的活性天然产物。随着研究的深入,从该属植物中分离得到的口山酮类成分不断增多,同时进一步开展了对该属多个种不同成分生物活性的检验与分析。本文综述了穿心草属药用植物的传统利用、化学成分及药理活性研究进展,以期为该属植物的开发利用提供参考。
1 穿心草属植物的传统药用
穿心草属(Canscora)最早由拉马克于1785年命名[5]。该属植物在亚洲、非洲以及大洋洲的热带和亚热带地区均有分布,不同种类各个部分被用于治疗不同的疾病,各个地区的原住民部落的药用方法有所不同(表1)。
在穿心草属的30 多种植物中,有4 种是最为常用的传统药物,他们分别是C.decussata (Roxb.)Schult.& Schult.f.,C.diffusa,C.perfoliata 和C.lucidissima。其用法也因地而异,主要有煎煮后口服和外敷两种方法。不同的地区对该属的不同种用法不同,但是在用途方面有极大的相似性。印度的大部分地区将该属植物用于口腔疾病、胃肠炎症以及精神性疾病的治疗。阿育吠陀是印度地区最古老的传统医学之一,自公元前12 世纪沿用至今[6,7]。C.decussata 是阿育吠陀Medhya rasayana 类别中Shankhpushpi 的基源植物,使用地区广泛,药效确切,通常用于治疗精神错乱、癫痫、神经衰弱等疾病[8,9]。中国大部分地区用于肝炎、胆囊炎的治疗,如穿心草,主要分布于贵州、广西等地,民间用于肺热咳嗽、胃痛、黄疸、毒蛇咬伤等。壮族、仫佬族等少数民族同样作为治疗黄疸型肝炎、胃炎、跌打内伤的常用药材而广泛使用。罗星草(C.Andrographioides)全草用于急性胆囊炎、泄泻、乳蛾、跌打骨折、关节肿痛等疾病的治疗[10,11]。综合上述记载,该属植物多有抗菌消炎作用,主要用于肝炎、胃肠道疾病及精神性疾病等的治疗。
植物作为药物来使用的历史最早可以追溯到人类进化的初期,不管是在传统医学还是现代医学中,药用植物都在减轻人类的疼痛上都起到了重要的作用[12,13]。基于少数民族及当地原住民的民族药物学已被认为是新药发现的一个工具[14-16]。对于穿心草属植物药用传统知识,需要进行更多科学研究,以便进一步验证其传统知识的正确性与有效性。
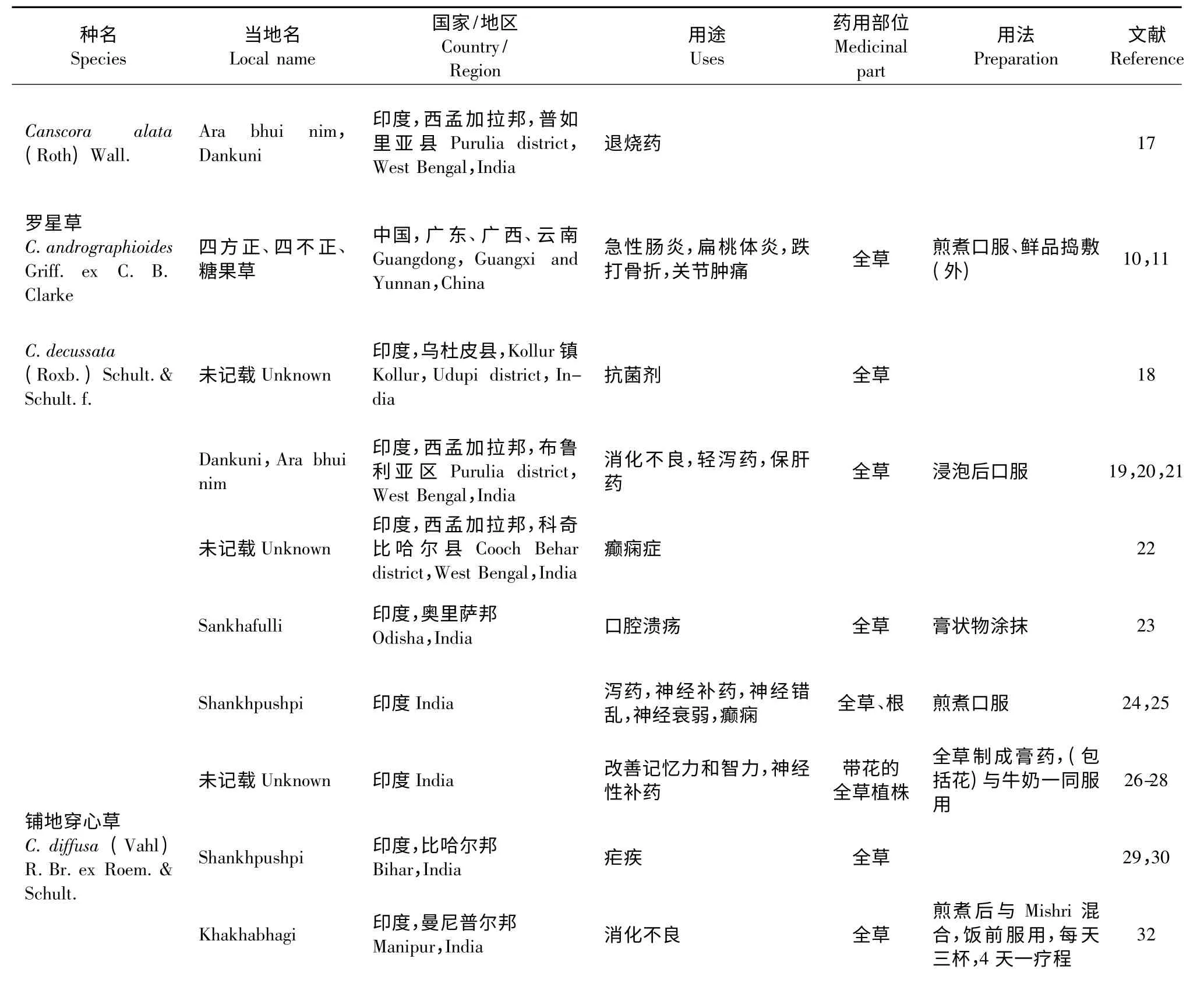
表1 穿心草属植物的传统药用Table 1 Traditional medicinal uses of Canscora Lam.

2 化学成分研究
2.1 口山酮类(Xanthones)化合物
1821年,Henry 等[37]从龙胆科植物Gentiana lutea L.中分离得到第一个口山酮化合物,即1,7-二羟基-3-甲氧基口山酮。据不完全统计,研究工作者已提取分离得到200 多个口山酮化合物,其中从穿心草属植物中分离得到31 个口山酮化合物(表2,图1)。酮为黄色或无色化合物,与黄酮类化合物(flavonoids)有相似的颜色反应及色谱特征。天然口山酮主要是一些高等植物、真菌和地衣产生的次生代谢产物,其药理性质和在分类学上的重要性引起研究人员极大的兴趣[38]。酮的母核为苯并色原酮,有8 个可被取代的位置。根据取代基的不同,提取分离得到口山酮衍生物有简单的氧代口山酮(simple oxygenated xanthones)、酮糖苷(xanthone glycosides)、异戊烯基取代的口山酮(prenylated and related xanthones)、酮木质素(xanthonolignoids)及其它口山酮化合物(miscellaneous xanthones)等五大类[39]。酮甙类化合物则根据连接的糖苷原子的不同分为口山酮氧苷和口山酮碳苷两种类型。酮甙类化合物对于龙胆科的植物有着重要的化学分类的意义,绝大部分的口山酮甙都分布于龙胆科的各个属中。

表2 穿心草属中口山酮类化合物Table 2 Xanthone compounds of Canscora Lam.

注:A:Canscora decussata (Roxb.)Schult.& Schult.f.;B:C.lucidissima (H.Lév.& Vaniot)Hand.-Mazz.

图1 穿心草属中口山酮类化合物Fig.1 Xanthone compounds of Canscora Lam.
2.2 其他类化合物
目前研究从穿心草属植物中还分离得到了25个其它结构类型的化合物,包括三萜、黄酮、倍半萜、固醇等化合物(表3)。

表3 穿心草属中其他类型化合物Table 3 Other compounds (excluding xanthones)of Canscora Lam.
3 药理作用研究
药理实验发现穿心草属植物有很强的抗菌、抗炎、抗氧化等作用,印度和我国民间用该属植物作抗菌药、轻泻药、利胆药和抗炎药,治疗口腔溃疡、胆囊炎、肝炎、胃炎、疟疾、结核病、蛇虫咬伤等;该属植物对中枢神经系统具有一定作用,印度传统用法将其作为神经强壮剂,治疗精神错乱、癫痫、神经衰弱等疾病,实验研究在一定程度为其传统用法的合理性和科学性提供了解释。
研究表明,穿心草属植物含有丰富的口山酮类化合物,具有较好的抗炎、保护心血管、降低血糖、抗氧化、抗菌等药理作用。近期研究表明某些被羟基、环氧基和不饱和烯键等活性基团取代的口山酮衍生物具备较好的抗肿瘤活性[50,51]。另外,研究发现穿心草属植物中提取得到的其他化合物类型也具有抗菌、抗氧化、抗炎等多种药理作用。
3.1 抗菌作用
Ghosal 等人[52]研究发现,用C.decussata 中产生的天然芒果苷(xanthone-C-glucoside)处理红花种子,将其幼苗栽培在受感染的土壤中,幼苗在长达两周内能避免因3 种真菌感染而导致红花枯萎病;芒果苷能引起真菌菌丝的溶解,减缓菌丝的生长,对尖孢镰刀菌有很好的抑制作用。Sujogya Kumar Panda等[14]在印度奥丽萨邦Similipal 生物圈保护区进行民族植物学调查发现,当地使用C.decussata 来治疗口腔溃疡,实验证明C.decussata 的甲醇提取物(800 μg/mL)对绿脓杆菌和葡萄球菌具有抑制作用,能防止口腔黏膜破损后受到细菌感染,为阐明当地的传统用法提供了科学依据。Ghosal 等[41]通过实验证明C.decussata 中提取分离得到的口山酮化合物有较强的抗结核杆菌活性,具有与链霉素一样的抑制效果。Mungole 等[53]实验证明C.decurrens 的各有效提取部位都具有明显的抗菌活性;其根部氯仿提取物对假单胞菌、枯草芽孢杆菌、红球菌有较强的抑菌作用;叶和根的各溶剂提取物对变形杆菌、除大肠杆菌外的所有测试菌种都体现出较强的抗菌活性,其丙酮提取物对红球菌有明显的抑制作用;其乙醇提取物对变形杆菌有明显的抗菌活性;其水提取物对金黄色葡萄球菌、假单胞菌和红球菌有明显的抑制作用。Ghosal 等[41]对C.decussata 和Swertia purpurascens 中的口山酮化合物进行抑制结核杆菌H37RV 的最小抑菌浓度测试,其MIC 数据显示,口山酮内核1 位和3 位被含氧基团取代、5 位和6 位被含氧基团取代以及8 位被含氧基团取代的化合物具有中度至高度抗结核杆菌活性,其中1.3.5.6.7 位的氢被取代(22、23、27)和1.3.6.7.8 位的氢被取代口山酮化合物的抑菌活性最强,并且其取代基为羟基的口山酮化合物比取代基为甲氧基或者糖苷的口山酮化合物抑菌作用更强。
3.2 抗炎作用
Aarnika Chaure 等[54]对C.decussata 叶子的乙醇-水提取物进行药理实验,将其作用于注射40%甲醛溶液诱导的Wistar 大鼠后爪肿胀模型中,结果显示200~400 mg/kg 提取物对炎症大鼠有明显的抑制作用,同时随剂量增加其抑制率作用也随之增加,其中醇水提取物为400 mg/kg b.w.时的抑制率高达60%,证明C.decussata 的乙醇-水提取物对由40%甲醛溶液引起的炎症有很强抑制作用。Babita Mandan[55]通过观察C.decussata 的乙醇提取物对脂多糖(LPS)诱导的人内皮细胞间黏附分子-1(ICAM-1)和E 选择素(E-selectin)表达影响,探讨C.decussata 乙醇提取物的抗炎作用。实验结果显示,其乙醇提取物降低了ICAM-1 和E-selectin 的表达,最高的抑制率达到75%,首次证实C.decussata 的乙醇提取物能够显著降低LPS 诱导的ICAM-1 和E-selectin 表达。同时进一步进行角叉菜胶诱导的SD大鼠后爪肿胀模型实验,其乙醇提取物分别为40、55 和70 mg/kg 时,对SD 大鼠的后爪肿胀的抑制率分别为21.8%、39.0%和59.0%,存在一定的剂量相关性,并且剂量为70 mg/kg 时,其抑制作用不随时间而衰减,证明C.decussata 乙醇提取物具有很强的抗炎活性。
3.3 抗氧化作用
杨东梅等[56]研究从穿心草中提取的1,6-二羟基-3,5-二甲氧基口山酮(10)的抗脂质过氧化作用。以正常大鼠组织匀浆、线粒体为材料,观察其对组织匀浆、线粒体体外脂质过氧化产物丙二醛(MDA)生成量的影响及对邻苯三酚自氧化产生的O-·2及Cu2+-Vit C 自由基产生系统产生的OH-的清除作用。实验结果表明,1,6-二羟基-3,5-二甲氧基呫吨酮(10)能有效抑制正常大鼠脑、肝、心、肾匀浆的体外过氧化脂质生成,其抑制作用随剂量增加而增强(1~100 μmol/L);同时,1,6-二羟基-3,5-二甲氧基口山酮(10)还能抑制Vit C 和FeSO4激发的线粒体膨胀,清除O-·2和OH-离子。何泉华等[57-60]研究从穿心草中得到的1,8-二羟基-3,5-二甲基口山酮(18)、1-羟基-3,5-二甲氧基口山酮(7)和1-羟基-3,7,8-三甲氧基口山酮(14)的抗氧化作用,发现这三种口山酮均能抑制过氧化脂质的生成,显著减少SD 大鼠红细胞(RBC)自氧化过程中MDA 的含量;连续20 天腹腔注射这三种化合物0.2 μmol/L 和0.02 μmol/L,能不同程度地增加老年小鼠体内多种抗氧化酶的含量,并且对外源性自由基发生系统加重缺血-再灌注损伤有不同程度的保护作用。De-Jian Jiang 等人[61]发现了口山酮具有抗氧化、抗炎、抑制血小板聚集、抗血栓形成和扩张血管等活性,从而对心脑血管系统产生保护作用,其中来自C.lucidissima 的三个口山酮化合物明显减弱体内由于心肌缺血再灌注导致的心律不齐,同时提高了由于缺氧复氧毁伤的心肌细胞的存活率,并减少其乳酸脱氢酶的释放率
3.4 降血糖、血脂作用
Soundrapandian Thangakrishna Kumari 等[62]采用C.perfoliata 全草乙醇提取物对四氧嘧啶引起的糖尿病小鼠进行给药,发现其乙醇提取物具有显著的降血糖和降血压作用,且剂量在2000 mg/kg 以内对小鼠无明显毒副反应;实验采用同样剂量的C.perfoliata 全草乙醇提取物对糖尿病小鼠及对照组小鼠进行处理,并对其体重、血糖、糖化血红蛋白、血清血脂(总胆固醇、甘油三酯、低密度脂蛋白胆固醇、极低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和磷脂、血清蛋白、白蛋白、球蛋白、血清酶丙谷转氨酶、血清谷氨酸草酰乙酸转氨酶、碱性磷酸酶)等生化参数进行测定,发现经C.perfoliata 乙醇提取物处理后的糖尿病小鼠与对照组相比,其血脂已基本降至正常水平。Nadeem Irshad 等[63]系统研究了C.decussata 甲醇提取物对四氧嘧啶诱导的糖尿病家兔的降血脂和肾脏保护作用。实验分别采用400、600 mg/kg 甲醇提取物及吡格列酮(3 mg/kg)对治疗组及阳性对照组连续30 d 给药,并对各组家兔体内甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白、白蛋白、球蛋白、总蛋白等生化参数的变化进行检测。结果表明,给药后糖尿病家兔的甘油三酯、总胆固醇、低密度脂蛋白胆固醇、动脉粥样硬化指数、冠状动脉风险指数等指数能够得到显著降低(P<0.01),且已接近正常组的数值。
3.5 抗焦虑作用
Neeraj[64]利用C.decussata 地上部分乙醇提取物对Wistar 大鼠进行高架十字迷宫实验、开放空间勘探行为及旋转行为实验。在高架十字迷宫实验中,根据小鼠张开双臂的时间和张开的次数,证明随乙醇提取物的剂量增加(100、200 和400 mg/kg),其抗焦虑作用随之增强,同时小鼠开放领域探索行为也增加;此外神经肌肉的协调性测试结果显示,其剂量为400 mg/kg 时能显著降低大量活动后小鼠的肌肉紧张,证明该提取物对中枢神经系统有一定作用。Bhattacharya 等人[65]通过小鼠实验发现,从C.decussata 中提取得到的芒果苷具有单胺氧化酶抑制活性,对中枢神经系统有一定作用,其结果一定程度上能够对印度阿育吠陀医药系统中将C.decussata 用于精神疾病治疗的传统用法加以佐证。
3.6 其他作用
Muhammad Shoaib Akhtar 等[66]对C.decussata全草水、甲醇提取物的保肝作用进行研究。实验用C.decussata 全草水、甲醇提取物对CCl4诱导的肝损伤小兔进行处理,通过对小兔血清谷氨酸草酰乙酸氨基转移酶、血清谷丙转氨酶、碱性磷酸酶和胆红素的酶活性进行检测分析,发现甲醇提取物具有显著保肝作用,其作用较水提取物更为明显。
Spelman 等人[67]对具有细胞粘附分子调控作用的不同植物进行研究,结果表明C.decussata 具有明显的细胞粘附分子调控作用,并在不同情况下表现出刺激或抑制等不同调控效果,研究结果表明C.decussata 可作为治疗细胞粘附分子相关疾病的潜在药物来源。
4 展望
以中药及民族药物为代表的传统药物正成为新药研究领域的热点,无论是药用植物的传统用法还是分离的活性成分都成为研发现代药物的重要源泉,通过对药效确切的植物进行有针对性的研究可以节省大量的人力、物力及财力。国外学者对穿心草属植物的传统医药用途及生物活性进行了较多的研究,发现其粗提物或是单体具有多样良好的生物学活性。尤其是从该属植物中提取到的口山酮成分,在抗炎、抗菌、抗氧化及对中枢神经系统等方面都具有良好的活性。穿心草属植物在我国分布有3 种,均为药用植物,民间用药和临床应用十分广泛。该属植物的化学成分及药理活性的研究在一定程度上印证其药用功效。我们应重视对穿心草属植物在抗炎及抗癌活性方面的研究与开发,从而促进该属植物的可持续利用。
1 Wu Z,et al.Flora of China.Beijing:Science Press,and St.Louis:Missouri Botanical Garden Press,1995.Vol 16,5.
2 Editorial Board of Flora Republicae Popularis Sinicae,Chinese Academy of Sciences(中国科学院中国植物志编辑委员会).Flora Republicae Popularis Sinicae (中国植物志,第62 卷).Beijing:Science Press,1988.
3 Peres V,et al.Tetraoxygenated naturally occurring xanthones.Phytochemistry,2000,55:683-710.
4 Wang LL (王丽莉),et al.Advances in studies on xanthones.Chin Tradit Herb Drugs (中草药),2010,41:1196-1206.
5 Lamarck J.Encyclopedie Methodique Botanique.Paris:Panckouck,1785.Vol I,601.
6 Negi DS,et al.Disease-prevention or treatment:A justification.Guru Drone J Pharm Res,2014,2(2):42-47.
7 Patwardhan B.Ethnopharmacology and drug discovery.J Ethnopharmacol,2005,100:50-52.
8 Patwardhan B,et al.Ayurveda and traditional Chinese medicine:a comparative overview.Evid-Based Compl Alt,2005,2:465-473.
9 Kokate CK,et al.Pharmacognosy.Pune:Nirali Prakashan,2002,524-525.
10 Chinese Materia Medica Commission of State Administration of Traditional Chinese Medicine (国家中医药管理局中华本草编委会).Chinese Materia Medica (中华本草).Shanghai:Shanghai Science and Technology Press,1999.
11 Song WZ (宋万志).Studies on Medicinal Plants of Gentianaceae (China).Chin J Chin Mater Med (中国中药杂志),1986,11(11):3-7.
12 Dattner AM.From medical herbalism to phytotherapy in dermatology:back to the future.Dermatol Ther,2003,16:106-113.
13 Akerele O.Nature’s medicinal bounty,don’t throw it away.B World Health Organ,1993,14:390-395.
14 Cox PA,et al.The ethnobotanical approach to drug discovery.Sci Am,1994,270(6):60-65.
15 Farnsworth NR.Ethnopharmacology and future drug development:the North American experience.J Ethnopharmacol,1993,38:137-143.
16 Fabricant DS,et al.The value of plants used in traditional medicine for drug discovery.Environ Health Persp,2001,109:69-75.
17 Dey A,et al.Traditional use of medicinal plants as febrifuge by the tribes of Purulia district,West Bengal,India.Asian Pac J Trop Dis,2012,2:800-803.
18 Rajkumar HG,et al.Diversity of arbuscular mycorrhizal fungi associated with some medicinal plants in Western Ghats of Karnataka region,India.World J Sci Technol,2012,2:13-20.
19 Dey A,et al.Ethnobotanical survey of Purulia district,West Bengal,India for medicinal plants used against gastrointestinal disorders.J Ethnopharmacol,2012,143:68-80.
20 Jain SK.Credibility of traditional knowledge-The criterion of multilocational and multiethnic use.Indian J Tradit Know,2004,3:137-153.
21 Sethiya NK,et al.Phytopharmacologic aspects of Canscora decussata Roem.& Schult.Pharmacogn Rev,2010,4(7):49-57.
22 Goswami G,et al.Studies on the physicochemical characteristics,macrophyte diversity and their economic prospect in Rajmata Dighi:a wetland in Cooch Behar district,West Bengal,India.NeBIO,2010,1(3):21-27.
23 Panda SK.Ethno-medicinal uses and screening of plants for antibacterial activity from Similipal Biosphere Reserve,Odisha,India.J Ethnopharmacol,2014,151:158-175.
24 Aulakh GS,et al.Phyto-chemistry and pharmacology of shankapushpi-four varieties.Ancient Sci Life,1988,7:149-156.
25 Ghosal S,et al.Chemical constituents of roots of Canscora decussata Part II.Indian J Chem Soc,1971,48:589-592.
26 Jain SK,et al.Botanical distribution of psychoactive plants of India.Ethnobotany,1994,6:65-75.
27 Adams M,et al.Plants traditionally used in age related brain disorders-a survey of ethnobotanical literature.J Ethnopharmacol,2007,113:363-381.
28 Parrotta JA.Healing Plants of Peninsular India.UK:CABI Publishing,2001.167-169.
29 Varma SK,et al.Ethnobotany of Santhal Pargana.Indian:Narendra Publishing House,1999.28-33.
30 Muthukumarasamy S,et al.Herbal remedies of palliyar tribe of Grizzled giant squirrel wildlife sanctuary,Western Ghats,Srivilliputhur,Tamil Nadu for poisonous bites.J Econ Taxon Bot,2003,27:761-764.
31 Thakur B,et al.Ethenomedicinal plant diversity in Mainpur Block,District Gariaband,Chhattisgarh,India.Int J Innov Res Stud,2013,2(6):10-24.
32 Ray S,et al.Ethnomedicinal plants used by tribes of East Nimar region,Madhya Pradesh.Indian J Tradit Know,2011,10:367-371.
33 Patil MV,et al.Ethnomedicinal practices of Nasik district,Maharashtra.Indian J Tradit Know,2005,4:287-290.
34 Deshmukh VR,et al.Exotic medicinal plants from West Vidarbha Region VIth.Biolife J,2013,2:387-391.
35 Rajendran A,et al.Plant genetic resources and knowledge of traditional medicine in Tamil Nadu.Ancient Sci Life,2000,20:25-28.
36 Ganesan S.Traditional oral care medicinal plants survey of Tamil Nadu.Nat Prod Radian,2008,7:166-172.
37 Afzal M,et al.Flavone glycosides from Lawsonia inermis.Heterocycle,1980,14:1973-1976.
38 Cardona ML,et al.Xanthones from Hypericum reflexum.Phytochemistry,1990,29:3003-3006.
39 Mandal S,et al.Naturally occurring xanthones from terrestrial flora.J Indian Chem Soc,1992,69:611-636.
40 Chaudhuri RK,et al.Xanthones of Canscora decussata Schult.Phytochemistry,1971,10:2425-2432.
41 Ghosal S,et al.Chemical constituents of Gentianaceae XXIV:Anti-Mycobacterium tuberculosis activity of naturally occurring xanthones and synthetic analogs.J Pharm Sci-US,1978,67:721-722.
42 Deng QY(邓芹英),et al.Studies on the xanthones from Chinese herbal medicine Canscora lucidissima.Acta Sci Nat Univ Sunyatseni (中山大学学报,自科版),1997,36(2):62-66.
43 Ghosal S,et al.New 1,3,5-trioxygenated xanthones in Canscora decussata.Phytochemistry,1976,15:1041-1043.
44 Ghosal S,et al.Chemical constituents of gentianaceae.Part 22.Structures of new 1,3,5-tri-and 1,3,5,6,7-penta-oxygenated xanthones of Canscora decussata Schult.J Chem Soc Pakistan,1977,14:1597-1601.
45 Ghosal S,et al.Chemical constituents of Gentianaceae IV:new xanthones of Canscora decussata.J Pharm Sci-US,1973,62:137-139.
46 Ghosal S,et al.New tetraoxygenated xanthones of Canscora decussata.Phytochemistry,1973,12:2035-2038.
47 Ghosal S,et al.Chemical constituents of the Gentianaceae.Part XII.Structure of the pentaoxygenated xanthones of Canscora decussata Schult.J Chem Soc Pakistan,1974,11:2538-2541.
48 Thanga KK,et al.GC-MS determination of bioactive components of Canscora perfoliata Lam.(Gentianaceae).J Appl Pharm Sci,2012,2:210-214.
49 Ghosal S,et al.Lanostane triterpenes of Canscora decussata.Phytochemistry,1973,12:1763-1766.
50 Castanheiro RA,et al.Antitumor activity of some prenylated xanthones.Pharmaceuticals,2009,2(2):33-43.
51 Mckeagea MJ,et al.Phase II study of ASA404 (vadimezan,5,6-dimethylxanthenone-4-acetic acid/DMXAA)1800 mg/m(2)combined with carboplatin and paclitaxel in previously untreated advanced non-small cell lung cancer.Lung Cancer,2009,65:192-197.
52 Ghosal S,et al.Control of Fusarium wilt of safflower by mangiferin.Phytopathology,1977,67:548-550.
53 Mungole A,et al.Active phytochemical and antibacterial potentiality of in-vitro regenerated plantlets of Canscora decurrens (Dalzell).Indian J Sci Techn,2010,3:679-683.
54 Chaure A,et al.Evaluation of anti-Inflammatory activity of hydro-alcoholic extract of Canscora decussata Roxib.leaves.Glob J Pharmacol,2014,8:36-38.
55 Madan B,et al.Canscora decussata (Roxb.)Schult.(Gentianaceae)inhibits LPS-induced expression of ICAM-1 and Eselectin on endothelial cells and carageenan-induced paw-edema in rats.J Ethnopharmacol,2003,89:211-216.
56 Yang DM(杨东梅),et al.Effect of Canscora lucidissima xanthones on antioxidation.Chin Tradit Herb Drugs (中草药),2000,31:358-360.
57 He QH(何泉华),et al.Effects of Canscora lucidissima Xanthones on antioxidation in vitro.Chin Pharm Bull (中国药理学通报),1998,14:130-132.
58 He QH(何泉华),et al.Mechanism of Canscora lucidissima xanthones against arrhythmia induced by myocardial ischemia-reperfusion in rats.Chin J Chin Mater Med (中国中药杂志),1998,23:556-557.
59 He QH(何泉华),et al.Effects of xanthone on rat heart mitochondria injury induced by vitamin C and FeSO4.Chin Pharm J (中国药学杂志),2000,35:381-383.
60 He QH(何泉华),et al.Protective effects of xanthones on ischemia/reperfusion injury exaggerated by activation of Na+/H+exchange system.Chin Pharm Bull (中国药理学通报),2000,16:642-644.
61 Jiang DJ,et al.Pharmacological effects of xanthones as cardiovascular protective agents.Cardiovasc Drug Rev,2004,22:91-102.
62 Kuanri ST,et al.Hypoglycemic and hypolipidemic effects of ethanol extract of Canscora perfolata Lam.(Gentianaceae)whole plant in alloxan induces diabetic rats.Int J Pharm Pharmaceutic Sci,2013,5:518-522.
63 Irshad N,et al.Antihyperlipidemic and renoprotective activities of methanolic extract of Canscora decussata extract in alloxan-induced diabetic rabbits.Bangl J Pharmacol,2013,8:323-327.
64 Sethiya NK,et al.Anxiolytic activity of Canscora decussata in albino rats.J Compl Integr Med,2010,7:19.
65 Bhattacharya SK,et al.Monoamine oxidase-inhibiting activity of mangiferin isolated from Canscora decussata.Naturwissenschaften,1972,59:651.
66 Akhtar MS,et al.Studies on hepatoprotective properties of different extracts of Canscora decussata (Schult.)against carbon tetrachloride induce hepatotoxicity.Int J Curr Pharm Res,2013,5:36-37.
67 Spelman K,et al.Traditional herbal remedies that influence cell adhesion molecule activity.Phytother Res,2011,25:473-483.

