蛇足石杉的药学研究进展
蔡龚莉,方 帅,张起辉
重庆大学化学化工学院药学系,重庆 400044
蛇足石杉Huperzia serrata (Thunb.ex Murray)Trev,又名千层塔、蛇足草、宝塔草、千金虫,民间主要用于治疗跌打损伤、瘀血肿痛、内伤出血、肿痈疔毒、毒虫叮咬、烧伤烫伤等症[1],其在世界范围内均有散在分布,资源有限,且近年来,随着研究的不断深入,人们加强了对其的开发和利用,因此其种群遭到了严重的破坏,野生资源将无法满足医疗需求[2]。吴荭[3]等调查发现,我国的蛇足石杉资源系散在分布,且多位于自然保护区和风景区范围内,不宜规模化采摘。因此,欲解决药源的问题,唯有寻求更加科学的,更加合理的方法。蛇足石杉因具有显著的药用价值而备受关注,各国研发人员对其进行了深入而广泛的研究。其主要成分石杉碱甲是强效的胆碱酯酶抑制剂,临床试验已证实石杉碱甲对治疗重症肌无力和阿尔茨海默病具有很好的疗效,且其制剂——哈伯因已在国内上市,主要用于治疗老年人记忆减退和早年痴呆等。
本文将对蛇足石杉的相关研究内容进行综述,逻辑顺序为:有效成分——药理活性——分析和分离方法——组培方法,希望借此为其可持续利用提供科学依据和参考。
1 蛇足石杉中的有效成分
19 世纪中期,人们开始对蛇足石杉中的化学成分进行研究,其主要化学成分为生物碱类、三萜类和黄酮类等。其中生物碱类成分又以石松生物碱为主,且骨架均是由C16N 或C16N2组成的三环或四环结构,按照Ayer[4]的研究结果又可将其划分成lycopodine、lycodine、fawcettimine 和miscellaneous 等四种类型。
马小军[5]老师课题组已对2007 年以前报道的蛇足石杉化学成分研究进行了系统综述,因此,本文将在此基础上,对2007~2014 年间蛇足石杉的国内外研究成果进行概述。
1.1 石松生物碱类
1.1.1 Lycopodine 型石松生物碱
2007~2014 年间,新发现10 个Lycopodine 型石松生物碱[6-9],按结构特征又可划分为五种母核,详见图1 和表1。
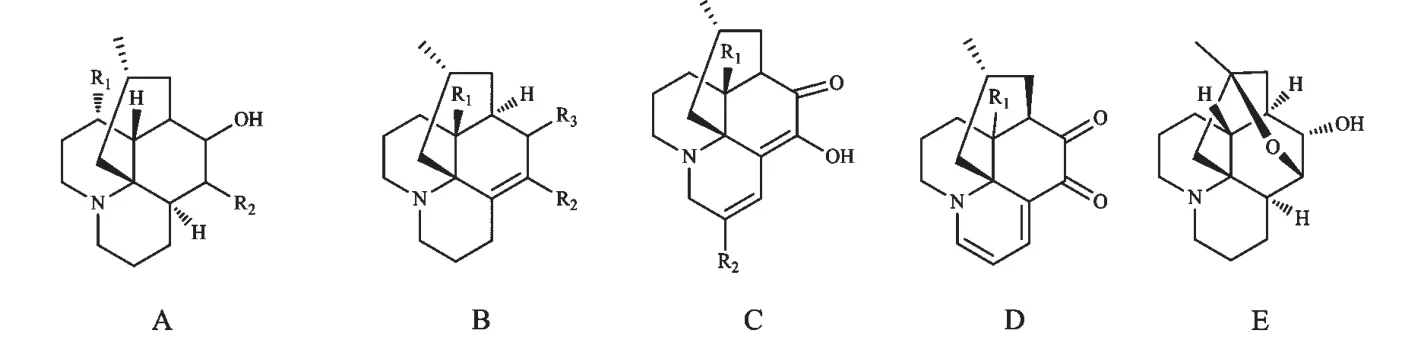
图1 蛇足石杉中的Lycopodine 型石松生物碱母核Fig.1 Skeleton of Lycopodine-type lycopodium alkaloids from H.serrata
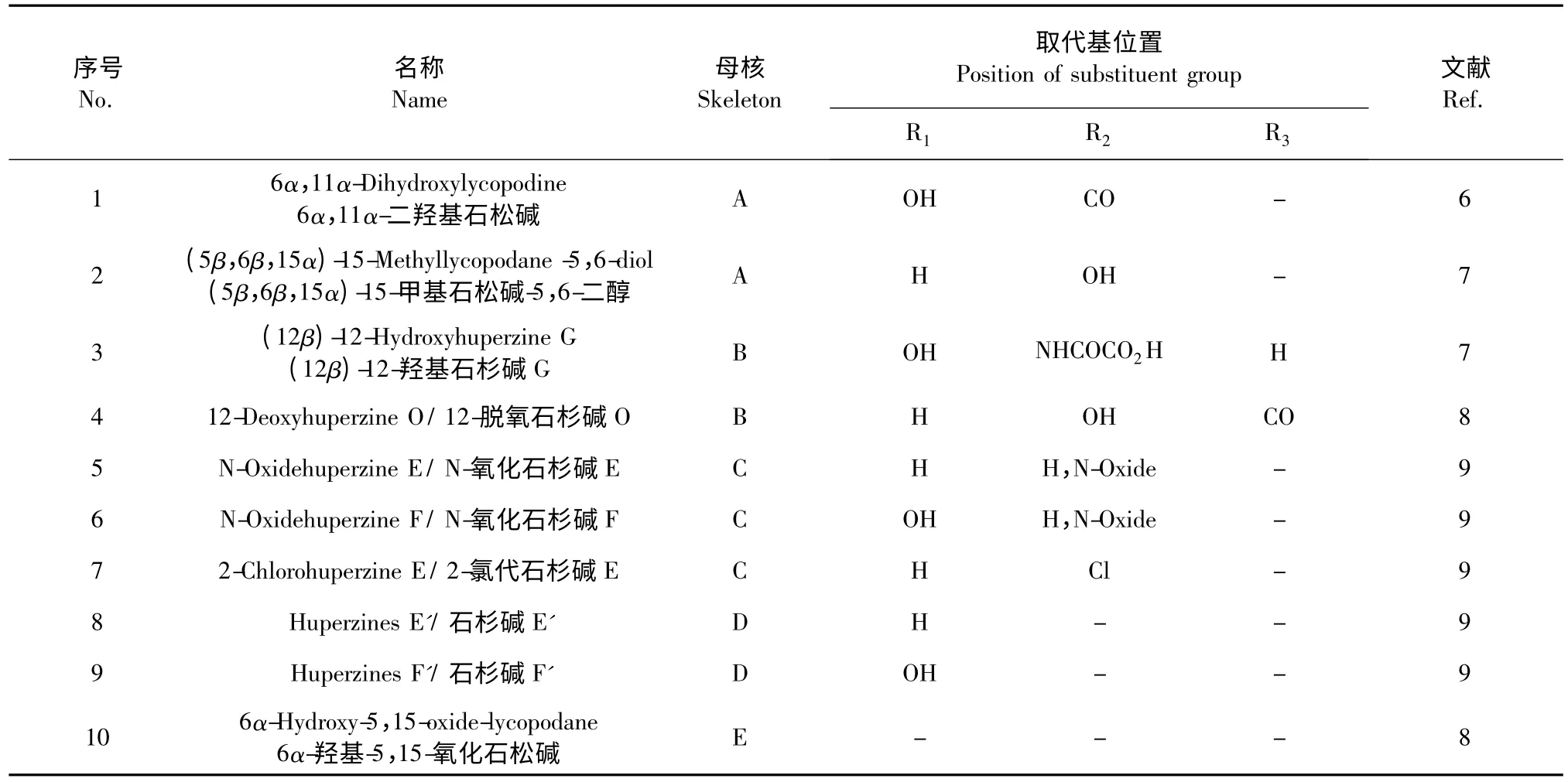
表1 蛇足石杉中的Lycopodine 型石松生物碱Table 1 Lycopodine-type lycopodium alkaloids from H.serrata
1.1.2 Fawcettimine 型石松生物碱
2007~2014 年间,新发现Fawcettimine 型石松生物碱18 个[10-12],按其结构特征分为以下6 种母核,有关物质见图2 和表2。

图2 蛇足石杉中的Fawcettimine 型石松生物碱的母核Fig.2 Skeleton of Fawcettimine-type lycopodium alkaloids from H.serrata

表2 蛇足石杉中的Fawcettimine 型石松生物碱Table 2 Fawcettimine-type lycopodium alkaloids from H.serrata
1.1.3 Miscellaneous 型石松生物碱
Gao 等2008 年在蛇足石杉中发现两个生物碱Huperzine M 和Huperzine N[13];Kubota 等2009 年在长柄蛇足石杉中发现两种石松生物碱Serratezomines D 和Serratezomines E[14];此外Katakawa 等2009年在长柄蛇足石杉中发现一种具有新的骨架的生物碱Lycoposerramine R[11],结构分别如图3。
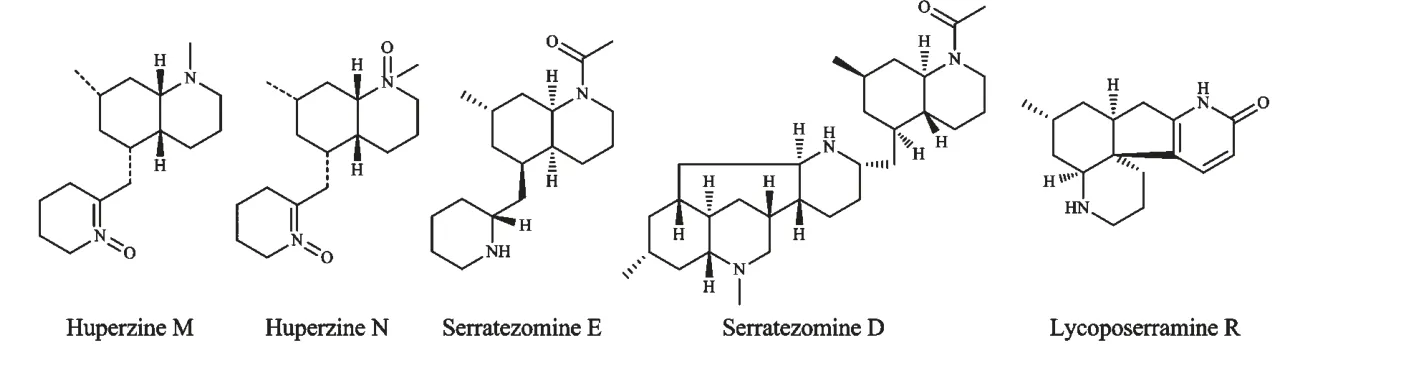
图3 蛇足石杉中的miscellaneous 型石松生物碱Fig.3 Miscellaneous-type lycopodium alkaloids from H.serrata
1.1.4 其它成分
杨亚滨等从蛇足石杉中分离到2 个二萜类成分和一个黄酮糖苷类成分,分别是3β-Hydroxysandaracopimaric acid (I),(15R)-12,16-epoxy-11,14-dihydroxy-8,11,13-abietatrien-7-one (II),5,5'-dihydroxy-2',4'-dimethoxy-flavone-7-O-β-D-(6''-O-Z-p coumaroyl)-glucopyranoside (III)[15,16],结构如图4。

图4 蛇足石杉中的黄酮类和二萜类Fig.4 Diterpenoid and flavone glycoside from H.serrata
2 生物碱类成分的药理学研究
迄今为止已从蛇足石杉中分离并鉴定了超过90 种生物碱类成分,和超过30 种的三萜类成分[5],本文着重对其活性成分——生物碱的药理作用进行了综述。
石杉碱甲(Hup A)作为代表性成分,主要有抑制脑内AchE 的活性、加快氧自由基的清除、减少自由基损伤、加强肌肉收缩、保护神经、增强学习记忆、改善记忆功能障碍和镇痛等作用[17]。成敬[18]等对分别用生理盐水和石杉碱甲灌胃的老鼠进行电击实验,发现石杉碱甲可减轻电休克模型中老鼠的记忆损害。以小鼠、大鼠、兔子和狗进行石杉碱甲的毒理学研究,实验结果表明Hup A 由于选择性较高,因此,相对于加兰他敏和他克林等同类药物,其不良反应较少,且症状较轻[19]。
随着近年研究的不断深入,Hup A 作为一种高效高选择性的中枢乙酰胆碱酯酶抑制剂,不仅有调控神经生长因子的表达与分泌、抗谷氨酸受体的作用,还可以通过对抗谷氨酸引发的兴奋毒性、抗细胞凋亡、抗氧化等多条途径保护细胞,对多种神经退行性疾病有潜在的治疗作用[20]。
Hup A 在军事方面也有一定的应用,张瑞华[21]等发现Hup A 联合苯二氮卓类药物可以对中枢神经系统形成很强的保护体系,在预防NA 中毒时有较高的应用价值。
蛇足石杉中的其它生物碱类成分也体现了较强的活性,如lycojapodine A、lycoperine A、cryptadines A、cryptadines B、carinatumins A、carinatumins B 和sauroine 等都具有一定的乙酰胆碱酯酶抑制活性;Lycojapodine A 具有较好的抗艾滋病毒活性;Lycovatine A、complanadines C 和D 等体现了一定的抗菌活性;lyconadins A 和B、annotinidines B-F、complanadine D 等具有促进mRNA 过表达的作用;Nankakurine A 可促进PC-12 细胞的分化;Huprie X、Huprie Y 和6-β-羟基Hup A 的乙酰胆碱酯酶抑制活性优于Hup A[19,22-25]。
3 有效成分的分析和分离方法
3.1 石杉碱甲的分析方法
3.1.1 紫外分光光度及薄层检测法
Hup A 具有特殊的空间环和酰氨基,与一般生物碱不同,用酸性乙醇-FeCl3染色呈黄绿色,利用此性质可以进行紫外扫描测定其含量。一般选择311 nm 左右的波长进行紫外分析检测[26]。紫外分光光度法测定蛇足石杉中总生物碱含量方法简便、稳定性好。
周汉华[27]等采用硅胶G 薄层板薄层扫描法分析了贵州产皱边石杉中Hup A 的含量,以氯仿—甲醇—氨水为展开剂,高锰酸钾水溶液为显色剂,测得Hup A 含量为0.1324 mg/g,该方法可以用于Hup A的含量测定。
3.1.2 高效液相色谱(HPLC)
蛇足石杉中石杉碱甲含量测定一般采取HPLC,该方法简单、准确、重现性好。王峻[28]等利用HPLC 测定了石杉属和马尾杉属总共23 种拟蕨类原植物中的Hup A 含量,发现伏帖石杉中Hup A的含量最高,为0.2004%。杜次[29]等利用HPLC 测定湘西蛇足石杉植株中不同部位的石杉碱甲含量,发现有显著差异,并且通过对蛇足石杉根、茎、叶中的赖氨酸脱羧酶基因(LDC)进行半定量RT-PCT 分析推测出赖氨酸脱羧酶在石杉碱甲的生物合成中不起关键作用。张敬彩[30]等用X-Charge C18柱,采用0.1%三氟乙酸和含0.09%三氟乙酸的乙腈为流动相进行梯度洗脱,在短时间内完成了Hup A 的快速分析。
3.1.3 毛细管电泳色谱(CE)
CE 技术,因其超微量进样、分离效率高、废液少、分析快,特别是无需考虑复杂组分对价格昂贵的色谱柱引起污染的特点,越来越受到药物研究工作者的重视。余宇燕[31]等用毛细管电泳法测定了石杉碱甲片样品中Hup A 的浓度,电解质溶液为pH为4.6 的乙酸盐溶液,在波长310 nm 处进行紫外检测,得出样品中Hup A 的质量浓度与峰面积的线性范围为5.0~60.0 mg/L。
3.1.4 酶联免疫法检测(ELISA)
邹艳辉[32]等取自制纯化后人工抗原Hup ABSA 免疫Balb/c 纯种雌性小鼠的脾细胞与SP2/0骨髓瘤细胞进行融合,筛选后得到杂交瘤细胞,取腹水进行间接竞争ELISA 检测效价后选择OD450值接近1.0 的抗体稀释倍数作为ELISA 工作条件,IC10最低的单克隆抗体作为最佳抗体,建立ELISA 检测方法,该测定方法快速而且灵敏。
3.2 蛇足石杉中有效成分的提取方法
3.2.1 常规提取法
许慧[26]等用酒石酸、盐酸、磷酸、柠檬酸、醋酸5 种酸水溶液冷浸样品20 h 之后分析发现5 种方法的回收率无明显差异。通过比较甲醇热回流、1.0%盐酸冷浸、超声、渗漏4 种制备Hup A 的方法,发现甲醇热回流和超声的回收率较冷浸和渗漏高,但纯度较低。同时,发现1∶30 为提取石杉碱甲的最佳料液比。
3.2.2 超声波辅助提取法
Hup A 的含量通常含量低于0.01%,因此对该有效成分的提取分离方法的探寻从未停止。黎万奎[33]等以1∶20 料液比酸水提取并超声40 min 的提取工艺,改善了蛇足石杉内生真菌2F09P03B 发酵培养物中Hup A 的提取率。该条件下内生真菌石杉碱甲提取率约为其他传统提取方法的1.5~2 倍。黄晖[34]等对传统的提取工艺进行了综合的分析和优化,经比较确定最佳提取方法是超声辅助的酸液浸提工艺,该工艺操作简捷,安全性高。
3.2.3 索氏提取法
黄晖[34]等将长柄石杉粉末(40 目,约3 g)置于索氏提取器中,加乙醇回流提取,旋转蒸发浓缩得浸膏,过滤,调节pH 后萃取至Dragendorffor’s 反应呈阴性,浓缩萃取液得产品。结果显示乙醇浓度较回流时间、回流次数的影响更为显著。
3.2.4 酶提法
易学文[35]等开发了酶提法工艺,用纤维素酶酶解细胞壁,用正交试验确定提取工艺。蛇足石杉中Hup A 的提取率为0.589‰,该方法的提取率比普通酸提法提高了40.3%。但提取液中含有较多淀粉、纤维素、蛋白质、鞣质等杂质,为分离造成了一定的困难。
3.2.5 壳聚糖絮凝澄清法
李俊[36]等开发了壳聚糖澄清石杉碱甲的提取工艺,用正交试验法优选出最佳工艺条件,该条件下蛇足石杉提取液的透光率达81.6%。此法可减少上柱前杂质,提高产品纯度。
3.2.6 萃取和反萃取相结合法
曾汉元[37]等使用萃取和反萃取相结合的方法,通过利用变换pH 的办法获得很好的除杂效果,从而达到去杂浓缩富集石杉碱甲的目的。
3.2.7 石杉碱甲印迹聚合物吸附法
李志平[38]等首次将硅胶作为载体,甲基丙烯酸作为功能载体,偶氮二异丁腈作为引发剂,二乙烯基苯作为交联剂制备了石杉碱甲分子印迹聚合物,研究该聚合物的结构特征和识别能效。当用该聚合物微固相萃取蛇足石杉提取液时,Hup A 的回收率为93.5%,富集效果较好。
3.2.8 超临界流体萃取(SFE)
李俊[39]等通过对夹带剂种类及用量等方面的研究,使用95%的乙醇为夹带剂,并把原料用氨水碱化预处理,得到最佳萃取条件,用超临界萃取法提取Hup A,发现其提取率可达11.44%。
3.3 石杉碱甲的分离制备方法
3.3.1 活性炭脱色
沈生荣[40]等利用Hup A 存在形态受pH 影响的性质,同时使用活性炭脱色的方法,然后在适当低温下(约5 ℃)进行氯仿的重结晶,可得到纯度大于99%的高纯度石杉碱甲。
3.3.2 制备型高效液相色谱
目前在实验室中一般是选择溶剂萃取、硅胶柱层析等分离方法从蛇足石杉提取液中分离出较高纯度的Hup A,但制备量小、耗时多、溶剂耗费量大、污染大且难以规模化生产。而工业生产需要更合适的工艺使其在纯度和产量上达到最佳平衡。为了解决这个问题,赵新燕[41]采用制备型高效液相色谱分离了Hup A,此法分离工艺简单,所得Hup A 质量分数较高(95%以上),该方法为利用制备型HPLC 工业化生产石杉碱甲提供了实验依据。
3.3.3 常压正相柱色谱
徐朝晖[42]等采用碱性氧化铝柱和硅胶柱组合的方法对Hup A 进行分离纯化,此工艺下总回收率达76.1%。李玉山[43]则改进了柱色谱法,以中性氧化铝为填料,在优选的最佳条件下Hup A 回收率达97.6%。该工艺条件简单,且产品有很高纯度,在工业上具有很大的应用价值。
3.3.4 阳离子交换树脂
李俊[44]等分别用5 种离子交换树脂研究其对Hup A 的吸附量和解吸率。通过条件优化,发现用C004 阳离子交换树脂制备的Hup A 含量可达5%,效果最好。
3.3.5 高速逆流色谱(HSCCC)
樊希望[45]将高速逆流色谱中的流动相和固定相的组成进行优化,采取的溶剂体系为正己烷-正丁醇-甲醇-水,体积比为1∶3∶2∶6,对蛇足石杉粗提物进行分离,建立了新的纯化工艺。
4 与蛇足石杉相关的微生物学研究
蛇足石杉植株生长缓慢,且配子体和孢子体阶段均需要与土壤中的特定真菌共生,形成菌根才能生长,同时内生真菌的存在使得蛇足石杉的组织培养较为困难,灭菌相对容易的孢子又难以萌发[46]。为了应对药源紧缺的问题,相关学者对蛇足石杉的内生真菌进行了研究性探索。由于真菌长期与植物共生,基于生物模拟等效应,真菌中的酶系开始发生转变,因此在内生真菌的次生代谢产物中也会发现植物体内的许多有效成分,内生真菌的研究将有利于解决珍稀药用植物的资源问题。
此前已有众多研究者已分离到可以产生石杉碱甲的真菌,如汪涯[47,48]运用平板分离法分离出127株内生真菌,有39 株内生真菌显示出了乙酰胆碱酯酶抑制活性,其中11 株表现出较强的抑制活性,又从叶中分离到1 株内生真菌LF40,在PDB 培养基中进行发酵培养,提取液中石杉碱甲的含量达80.1 μg/gdcw;苏经迁[49]等筛选出8 株产生物碱的真菌,其中有1 株炭角菌SY-02 能够产生石杉碱甲;闵长莉[50]等从蛇足石杉的茎叶中分离纯化得到15 株内生真菌,其中镰刀菌属菌株WX13 产石杉碱甲;鞠錾[51]研究了4 种石杉科植物——蛇足石杉、长柄石杉、伏贴石杉、柳杉叶马尾杉,总共得到的32 株内生真菌中,从柳杉叶马尾杉中得到的2 株内生真菌可以产生石杉碱甲;延安大学生科院杨晓军[52]等自蛇足石杉的茎部分离到1 种交链孢霉属真菌YD-01,对该菌株进行了发酵培养,并从中分离得到石杉碱甲。
此外,还有许多内生真菌可以产生石杉碱甲,能够可逆性抑制抗胆碱酯酶,如胶胞炭疽菌Colletotrichum gloeosporioide、Colletotrichum gloeosporioides ES026、Shiraia sp.Slf14[53-55],这些研究可能会为寻找治疗阿尔兹海默病的药源提供新的方向。
随着研究的不断深入,从产石杉碱甲的内生真菌出发,研究者正在尝试采用基因工程学方法,对这些真菌进行生物学改造,如:胥锦桦[56]也对内生真菌做了大量的研究:首先用TLC、HPLC 等方法对皱边石杉体内99 株真菌的代谢产物进行分析,用多种方法提取了真菌菌丝体DNA,最终筛选出19 株可产Hup A 潜力内生菌并加以分类鉴定,这为后续的研究提供了大量宝贵的资料;周树良[57]用多种方法对能合成石杉碱甲的内生真菌SHB 进行诱变,最终成功地得到稳定遗传的高产菌株wB3,其石杉碱甲产量为原菌株的3.04 倍,并探究得到了其发酵的最佳条件,此时再提取突变菌株的DNA 进行PCR 扩增,分析发现了其与原始菌株之间的明显差异特征带,为利用相关功能基因生产石杉碱甲找到了一个切入点;而罗红梅[58]等探究了蛇足石杉HsDXR1 基因在体内不同部位的表达情况及其编码区序列,是研究石杉碱甲生物合成的理论奠基。
5 蛇足石杉的组织培养研究
由于石杉碱甲在蛇足石杉中含量极低且资源日益减少,人工栽培难以成活且生长速度极其缓慢,人们便转向探索组织培养,以获取石杉碱甲。然而蛇足石杉体内存在着内生真菌,故在组织培养中,需3~4 次灭菌才能将真菌除净。对外植体进行灭菌主要用次氯酸钠或升汞溶液,而所用的培养基多为MS培养基;在培养过程中,除了真菌反复污染外,外植体褐化、白化、水渍化等现象较为多见。
5.1 培养基及外源物质的选择
在蛇足石杉的组织培养中,研究者探究了各种不同培养基对其愈伤组织形成的影响,以找出最适方法扩大蛇足石杉的生产,如孙玉强[59]等经初培养和继代培养,在SN6(2,4-D 2.0 mg/mL)上培养70~80 d 后诱导出愈伤组织块;包日双[60]等用蛇足石杉孢子囊培养出原叶体,进而在最佳增殖培养基(无激素的MS 培养基)上诱导出孢子体;Freiburg 大学的学者[61]对粗糙马尾杉进行了成功的试管繁殖,使石杉科植物的组培看到了希望;最近,吉枝单[62,63]等探究培养基种类、植物激素配比及蔗糖含量等条件,发现最佳叶状体诱导培养基为6,7-V +IAA0.5 mg/L,进一步的研究发现外源激素不利于蛇足石杉离体叶状体的增殖,蔗糖最佳用量为20 g/L,在此条件下于MS 培养基中培育出了生长状况良好的叶状体,且增殖率达到了1362.6%,该方法首次获得了蛇足石杉再生叶状体,使工业批量生产蛇足石杉向前迈进了一步。
5.2 外植体取材部位及灭菌方法
外植体灭菌的成功率与取材部位有必然的联系,较幼嫩的部位含菌较少成活率高,如沈晓霞[64]等分别用1/5 倍饱和次氯酸钠灭菌15 min,0.1%升汞灭菌3 min,收到了很好的结果;马华升[65]等用0.1%(w/v)升汞,处理茎尖外植体5~6 min 进行消毒灭菌。
也有实验对植物不同部位(茎尖、茎部、叶片、侧叶、腋芽、孢子囊等)取材,发现次氯酸钠并不适合千层塔外植体灭菌处理。利用升汞进行茎尖消毒灭菌时,要求茎尖是新生的0.5~1 mm 左右、维管组织还没有到达的部位。孢子囊可以用次氯酸钠灭菌5 min 或升汞灭菌2~3 min,以解决染菌问题。
杨雪飞[66]等发现外植体的最佳灭菌方法为70%乙醇灭菌40 s,0.1%升汞溶液灭菌8 min,70%双氧水溶液灭菌10 min。另外,李贵[67]等发现,消毒剂结合温度处理是消除内生茵的良好方法,用于组培的理想外植体是含内生菌极少的孢子囊和茎尖。
6 石杉碱甲的临床应用研究
石杉碱甲是一种强效的可逆性胆碱酯酶抑制药,具有脂溶性高,易通过血-脑屏障等特点,对真性胆碱酯酶有选择性抑制作用。最早于1994 年被应用于临床,临床可用于治疗阿尔茨海默病、血管性痴呆、重症肌无力、小儿智力发育迟缓、早老性痴呆、记忆障碍、慢性失眠症等,具有改善记忆的功能。另外还可预防和治疗多梗死性痴呆、辅助治疗精神分裂症的阴性症状以及治疗脑卒中后的尿失禁等[68,69]。
近年来,为了避免石杉碱甲的毒副作用,联合用药已成为临床用药的一种新趋势,例如:石杉碱甲联合天智颗粒治疗血管性痴呆时,体现了疗效显著,安全无毒的特点[70];石杉碱甲片和尼莫地平联合治疗脑血管性痴呆,可显著改善患者的认知能力,临床效果确切安全,副作用少[71]。
7 结语
随着社会老龄化程度的加剧,AD 症已成为危害老年人健康的主要疾病之一,同时社会压力的扩散使中、青年群体对益智产品的需求不断增大,因此对石杉碱甲的需求也随之增大,这加剧了自然资源的耗竭,会造成资源破坏和种群退化等问题。据报道,全国蛇足石杉资源量为1 ×106kg,主产地广西在1990 年时蕴藏量为1.77 ×105kg,目前已下降至2 ×104kg。千层塔植株矮小,生长缓慢,野生资源有限,人工繁殖困难,组培未获成功,扦插成活率很低,资源恢复期长达15 年。而国内制药企业生产石杉碱甲制剂存在较大缺口,难以满足国内外市场需求(目前仅美国年需求就达100 kg),因此,开发新技术解决千层塔可持续利用问题迫在眉睫。本文较为系统的总结了蛇足石杉的活性成分、药理活性、分析方法和组培等研究内容,希望为进一步研究奠定基础,提供素材。
1 Luo YC(罗迎春),et al.黔产石杉科·石松科药用蕨类植物的种类和分布研究.J Anhui Agric Sci(安徽农业科学),2008,36:12729,12752.
2 Huang XF(黄馨凤),Li WC(李万成).The growth environmental and symbiotic relation between fungi and Huperzia serrata.Forest By-Product Special China(中国林副特产),2011,2:73-76.
3 Wu H(吴荭),et al.Resource investigation and assessment of Huperzia serrata.J Nat Res(自然资源学报),2005,20:59-67.
4 Ayer WA,et al.Macleanine,a unique type of dinitrogenous Lycopodium alkaloid.Can J Chem,1994,72:128-130.
5 Yuan JQ(袁经权),et al.Advance in studies on chemical constituents of Huperzia serrata and their pharmacological effects.Chin Tradit Herb Drugs(中草药),2012,43:399-406.
6 Shan WG,Ren FY.A new Lycopodine alkaloid from Huperzia serrata.J Chem Res,2012,36:15-16.
7 Jiang HJ,Lin Y.Two new Lycopodine alkaloids from Huperzia serrata.Helv Chim Acta,2010,93:1187-1191.
8 Yang YF,Qu SJ.Lycopodium alkaloids from Huperzia serrata.J Asian Nat Prod Res,2010,12:1005-1009.
9 Wang HB,Tan CH.Two new N-oxide Lycopodium alkaloids from Huperzia serrata.Nat Prod Res,2009,23:1363-1366.
10 Kazuaki K,Akiko N.Fawcettimine-related alkaloids from Lycopodium serratum.J Nat Prod.2007,70:1024-1028.
11 Kazuaki K,Noriyuki K,A new Lycopodium alkaloid,lycoposerramine-R,with a novel skeleton and three new fawcettimine-related alkaloids from Lycopodium serratum.Helv Chim Acta,2009,92:445-452.
12 Kazuaki K,Hiroko M.Ten new fawcettimine-related alkaloids from three species of Lycopodium.Tetrahedron,2011,67:6561-6567.
13 Gao WY,Li YM.Two new nitrone alkaloids from Huperzia serrata.Helv Chim Acta,2008,91:1031-1035.
14 Kubota T,Yahata H.Serratezomines D and E,new Lycopodium alkaloids from Lycopodium serratum var.Serratum.Bio Med Chem Let,2009,19:3577-3580.
15 Yang YB(杨亚滨),Yang XQ(杨雪琼).Two diterpenoids from herbs of Huperzia serrata.Chin J Chin Mater Med(中国中药杂志),2009,34:987-988.
16 Yang YB,Yang XQ.A new flavone glycoside from Huperzia serrata.Chin J Nat Med(中国天然药物),2008,6:408-410.
17 Yang WP(杨维平),Wu RY(吴瑞云).Summary of the study progress on Huperziaceae utilization.Chin Wild Plant Res(中国野生植物资源),2013,32(2):2-4.
18 Cheng J(成敬),et al.The effects of huperzine A on memory and ARC of ECT rats.Prog Mod Biomed(现代生物医学进展),2013,27:5230-5233.
19 Xu M(许明),et al.Advances in research on Huperzine A.Drug Eval Res(药物评价研究),2010,33:442-446.
20 Chen ZH(陈中华),Zhang XZ(张秀珍).Advances in research on Huperzine A.Life Sci Instr (生命科学仪器),2008,6:42-44.
21 Zhang RH(张瑞华),et al.Progress in drugs of prophylaxis and treatment of nerve agent damage.Mil Med Sci(军事医学),2013,37:784-788.
22 Choo CY,et al.Carinatumins A-C,newalkaloids from Lycopodium carinatum inhibiting acetylcholinesterase.Bioorg Med Chem,2007,15:1703-1707.
23 Chen YG(陈业高),et al.New progress in the study of Lycopodium alkaloids.J Yunnan Normal Univ(云南师范大学学报),2010,30(6):12-23.
24 He J,et al.Lycojapodine A,a novel alkaloid from Lycopodium japonicum.Org Lett,2009,11:1397-1400.
25 Zhang JC(张君诚),et al.Recent advances in studies on herb biological of Huperzia serrata.Chin Wild Plant Res(中国野生植物资源),2008,27(2):1-5.
26 Xu H(许慧),Li DW (李多伟).The extraction and purification of Huperzine A in Huperzia serrata.Xi’an:Northwest University (西北大学),MSc.2007.
27 Zhou HH (周汉华),et al.Determine the content of Huperzine A in Huperzia crispata (Ching ex H.S.Kung)Ching by thin layer chromatogram scanner.Chin Med Mat(中药材),2008,31:235-237.
28 Wang J(王峻),Pang SL (潘胜利).Content of Huperzine A in 23 species from Chinese herbal medicine Qiancengta.Chin Pharm J (中国药学杂志),2009,44:1212-1214.
29 Du C (杜次),et al.Determination of Huperzine A and semiquantitative RT-PCR analysis of lysine decarboxylase gene in different parts of Huperzia serrata from western Hunan.Chin Med Mat(中药材),2013,36:361-364.
30 Zhang JC (张敬彩),et al.Determination of Huperzine A in the extract of Huperzia serrata by high performance liquid chromatography.Chin J Chromatogr (色谱),2013,31:79-82.
31 Yu YY(余宇燕),et al.High performance capillary electrophoretic determination of Huperzine A in Huperzine A tablets.Physic Testing Chem Anal,Part B:Chem Anal(理化检验:化学分册),2012,48:1392-1394.
32 Zou YH(邹艳辉),et al.Establishment of ELISA method for Hup A in Huperzia serrata.2013 年中国药学大会暨第十三届中国药师周论文集.2013.
33 Li WK(黎万奎),et al.Study on ultrasonic extraction of Huperzine A from an endophytic fungus 2F09P03B of Huperzia serrata.Chin Pharm J (中国药学杂志),2008,43:578-581.
34 Huang H(黄晖),et al.Research on the extraction of Huperzine A from Huperzia serrata.J Sanming Univ(三明学院学报),2010,27:1112-1115.
35 Yi XW(易学文),et al.Study on the extraction of Huperzine A from Huperzia serrata by enzymatic method.J Anhui Agric Sci(安徽农业科学),2011,39:19798-19799.
36 Li J(李俊),et al.Technology of Huperzia serrata extract by chitosan clarification.Chin J Spectr Lab(光谱实验室),2012,1:18-19.
37 Zeng HY(曾汉元),et al.The extraction and assay of alkaloids from Huperzia serrata.J Huaihua Univ(怀化学院学报),2007,26:30-32.
38 Li ZP(李志平),et al.Preparation,characterization and adsorption behavior of Huperzine A imprinted polymers.Chin J Appl Chem(应用化学),2013,30:915-921.
39 Li J(李俊).Study on extraction process of Huperzine A from Huperzia serrata and pilot scale experiment.Jishou:Jishou University(吉首大学),MSc.2012.
40 Shen SR(沈生荣),et al.Isolation and purification of Huperzine A.J Zhejiang Univ(浙江大学学报),2002,21:591-595.
41 Zhao XY(赵新燕).Isolation of Huperzine A from Huperzia serrata by PHPLC.Mech Electr Inf (机电信息),2011,14:1-3.
42 Xu CH(徐朝晖),et al.Preparation of Huperzine A by manufacturing technique of assembling column chromatograph at normal pressure.Chin J New Drugs Clin Remed (中国新药与临床杂志),2012,31:732-736.
43 Li YS(李玉山).Study on the separation and purification technics of Huperzine A.Chin J Hosp Pharm(中国医院药学杂志),2012,32:688-691.
44 Li J(李俊),et al.Study on separation and purification of Huperzine A by cation exchange resin.Appl Chem Ind(应用化工),2012,41:424-426.
45 Fan XW(樊希望),et al.Preparation of Huperzia A from Huperzia serrata (Thunb.)Trev.by high-speed countercurrent chromatography.2013 年中国药学大会暨第十三届中国药师周论文集.2013.
46 Li N(李娜).Study on the effect of promote growth on host and fermentation products of endophytic fungi from Huperzia serrata.Zhenjiang:Jiangsu University(江苏大学),PhD.2007.
47 Wang Y(汪涯),et al.Isolation of endophytic fungi from Huperzia serrata and their acetylcholinesterase inhibitory activity.Chin J Chin Mater Med(中国中药杂志),2011,36:734-740.
48 Wang Y(汪涯),et al.Producing Huperzine A by an endophytic fungus from Huperzia serrata.Mycosystema (菌物学报),2011,30:255-262.
49 Su JQ(苏经迁),et al.Alkaloid and Huperzine A-producing endophytic fungi isolated from Huperzia serrata.Chin J Chin Mater Med(中国中药杂志),2011,46:1477-1481.
50 Min CL(闵长莉),Wang XJ(汪学军).Isolation and identification of a Huperzine A-producing endophytic fungi from Huperzia serrata.Nat Prod Res Dev (天然产物研究与开发),2013,25:590-593.
51 Ju Z(鞠錾),et al.Isolation and preliminary identification of the endophytic fungi which produce Hupzine A from four species in Hupziaceae and determination of Huperzine A by HPLC.Fudan Univ J Med Sci(复旦学报,医学版),2009,36:445-449.
52 Yang XJ(杨晓军),et al.Studies on the secondary metabolism of endophytes YD-01I.Chin J Chin Mater Med(中国药科大学学报),2006,37:479.
53 Xu SF(徐世芳),et al.Research on isolation of endophytic fungi DSJ5 from Huperzia serrata (Thunb.)Trev and screening on its metabolic products by HPLC-DAD.Chin Arch Tradit Chin Med(中华中医药学刊),2012,8:1697-1701.
54 Wang M(王沫),Xu XM(徐晓苗).Huperzine A-producing endophytic fungi colletotrichum gloeosporioides ES026 of Huperzia serrata.CN201110050525,2012-9-5.
55 Zhu D,Wang J.A novel endophytic Huperzine A-producing fungus,Shiraia sp.Slf14,isolated from Huperzia serrata.J Applied Micro,2010,109:1469-1478.
56 Xu JH(胥锦桦).Analysis Huperzia crispata's endophytic fungi RAPD and ISSR molecular fingerprintings which could produce Hup A and identification theirs genus.Changsha:Hunan Agricultural University (湖南农业大学),MSc.2012.
57 Zhou SL(周树良).Isolation and characterization of endophytic fungi of Huperzia serrata and mutation and molecule detection of fungi fermenting Hup A.Changsha:Hunan Agricultural University (湖南农业大学),MSc.2009.
58 Luo HM(罗红梅),et al.Cloning and expression Analysis of HsDXR1 in Huperzia serrata.World Sci Technol/Modern Tradit Chin Med Mater Med(世界科学技术—中医药现代化),2013,15:342-348.
59 Sun YQ(孙玉强),et al.Research on explants of Huperzia serrata in culture.J Hangzhou Agric Sci Tech (杭州农业科技),2008 (4):10-12
60 Bao RS(包日双),et al.Prothallium culture and sporophyte induction of Huperzia serrata (Thunb.)Trev.Plant Phys J(植物生理学报),2012,48:393-396.
61 Ma X,et al.A survey of potential Huperzine A natural resources in China:the Huperziaceae.J Ethnopharmacol,2006,104:54.
62 Ji ZD(吉枝单),et al.In vitro culture of Huperzia serrata thallus for the medicinal component production.Nat Prod Res Dev(天然产物研究与开发),2014,26:645-649.
63 Zhou Y(周颖),et al.Tissue culture of Huperzia Serrata.J Jishou Univ,Nat Sci(吉首大学学报,自科版),2009,30(2):90-93.
64 Shen XX(沈晓霞),et al.Research on tissue culture technology for Huperzia serrata.Chin J Chin Mater Med(中国中药杂志),2002,27:458-459.
65 Ma HS (马华升),et al.千层塔组织培养中外植体消毒灭菌研究初报.Hangzhou Agric Sci Tech (杭州农业科技),2008,3:15-18.
66 Yang XF(杨雪飞),et al.Studies on tissue culture and sterilization method of Huperzia serrata.J Anhui Agr Sci(安徽农业科学),2008,36:4947-4948.
67 Li G(李贵),et al.Sterilization of explants and elimination of endophytesin Huperzia serrata.J Jishou Univ(吉首大学学报),2009,30:100-103.
68 Ma XJ(马小军),et al.Research review of rare source plant Huperzia serrata (Qian Ceng Ta).Lishizhen Med Mater MedRes (时珍国医国药),2009,20:2858-2860.
69 Yuan DX (袁带秀),Entomack B.Advances in studies on chemical constituents of Huperzia serrata and their pharmacological effects.Chin Wild Plant Res(中国野生植物资源),2011,30(3):1-13.
70 Chen XH(陈献红),et al.石杉碱甲联合天智颗粒治疗血管性痴呆的疗效观察.Clin Med(临床医学),2009,29(7):57-58.
71 Huang BR(黄宝荣).石杉碱甲片和尼莫地平联合治疗脑血管性痴呆临床观察.Pharm Res (药物研究),2012,54:21-23.

