亳芍总生物碱提取及抑菌活性的研究
陈乃东,朱旺生,杨小东
1皖西学院生物与制药工程学院,六安 237012;2皖西中药与天然药物工程技术研究中心,六安 237012;3安徽医科大学药学院,合肥 230032
亳芍(Bozhou Peony Paeonia lactiflora),即亳白芍,主产安徽省亳州地区,为安徽道地药材之一,是芍药科植物芍药(Paeonia lactiflora)或其变种毛果芍药(Paeonia trichocarpa)栽培品的根,夏秋季采挖其根部,去净泥土和支根,沸水浸或略煮至受热均匀,再经晒干等处理后即炮制成中药亳芍,具有抗炎、免疫调节、抗病毒、抗氧化、抗惊厥、护肝等作用,对胃肠道疾病和心血管疾病也有一定的疗效[1-3]。植物化学研究表明,白芍主要含有单萜[4]、倍半萜及三萜[5]、单宁[6]、挥发油[7]、黄酮[8]、多酚类[9]、多糖[10]等活性成分。
在我们的前期研究中发现,亳芍中含有微量生物碱[11]。本文在前期研究的基础上,以乌头碱为标准品,采用紫外分光光度法测定生物碱的含量,对亳芍总生物碱的最佳提取工艺条件及其抑菌活性进行研究,为后续的亳芍生物碱深度药理学研究和开发利用奠定基础。
1 材料、仪器和试剂
1.1 材料
实验材料亳芍购于安徽省亳州市,品种经皖西学院陈乃东博士鉴定为亳芍(Radix Paeoniae Alba)。
1.2 仪器
GJ14-DGF3006 型电热恒温干燥箱(金坛市荣华仪器制造有限公司),HH-4 型数显恒温水浴锅(金坛市国华电器有限公司),RE-52D 型旋转蒸发器(上海浦沪仪器厂),FA-1004 型电子天平(上海精科天平厂),超净工作台(苏州净化设备有限公司),灭菌锅(上海三申医疗器械有限公司),TU-1901 双光束紫外-可见分光光度计(北京普析通用仪器有限公司)。
1.3 试剂
氨水、氯仿、二氯甲烷、乙酸乙酯、甲醇、浓盐酸、牛肉膏、蛋白胨、氯化钠、硫酸镁、葡萄糖、硫酸二氢钾、淀粉等均为国产分析纯。
标准品乌头碱购自城都吉欧特生物科技有限公司,纯度≥98%(HPLC 检测)。
1.4 供试菌种
金黄色葡萄球菌(Staphyloccus aureus),大肠杆菌(Escherichia coli),酵母菌(Saccharomyces cerevisiae),黑曲霉菌(Aspergillu nigers)由植物细胞工程安徽省工程技术研究中心内生真菌研究室汪学军副教授提供。
2 实验方法
2.1 亳芍总生物碱的提取
2.1.1 总生物碱提取方法
称取100g 干燥至恒重的亳芍粉末,分别在不同条件下(乙醇浓度、料液比、提取液盐酸、提取温度)进行回流提取,过滤,滤液减压浓缩至干获总生物碱粗提物。将亳芍生物碱粗提物以5%(V/V)盐酸捏溶,等体积二氯甲烷萃取萃三次除杂,酸水相中缓慢滴加氨水至溶液pH=8.5~9.5(精密pH 试纸测定),等体积氯仿萃取三次,减压回收氯仿,得亳芍总生物碱。
2.1.2 总生物碱含量测定方法
亳芍总生物碱的含量测定参照陈美川等[12,13]方法改进而来,操作步骤如下:
2.1.2.1 标准对照品溶液的配制
精密称取乌头碱对照品5 mg 置50 mL 容量瓶中,加0.01 mol/L 盐酸溶液使溶解,并稀释至刻度,摇匀,作为标准溶液,备用。
2.1.2.2 醋酸-醋酸钠缓冲液及溴甲酚绿溶液的配制
取0.2 moI/L 醋酸溶液250 mL,用0.20 mol/L醋酸钠溶液调节pH 至3.1 10 mL,备用。取溴甲酚绿50 mg,加0.50 mol/L 氢氧化钠液1.6 mL 研磨使溶解,加水至100 mL,用三氯甲烷提取3 次,每次30 mL,弃去三氯甲烷液,备用。
2.1.2.3 标准曲线测定方法
精密量取乌头碱标准溶液0.00、0.25、0.50、0.75、1.00、1.50、2.00 mL 分别置分液漏斗中,各依次加入0.01 mol/L 盐酸溶液2.00、1.75、1.50、1.25、1.00、0.50、0.00 mL,各精密加醋酸-醋酸钠缓冲液10 mL、漠甲酚绿液2 mL、三氯甲烷10 mL,振摇3 min,静置,分取三氯甲烷液,于412 nm 处测定吸光度值(A)。然后以吸光度为纵坐标(y),标准溶液浓度(x)为横坐标绘制标准曲线,求得回归方程为:y=0.410x-0.009(R2=0.9940)。
2.1.2.4 亳芍总生物碱的含量测定
0.01mol/L 盐酸溶液配制0.1 mg/mL 总生物碱提取物溶液,按测定标准曲线相同方法测定亳芍生物碱的含量。
2.1.3 亳芍生物碱提取条件的优化
2.1.3.1 单因素实验
从温度、乙醇浓度、料液比、提取时间四个方面探讨影响亳芍总生物碱提取率的因素。其中,温度考察范围为:40、50、60、70、80 ℃;乙醇浓度考察范围:30%、50%、70%、90%、100%;料液比考察范围:1∶5、1∶10、1∶20、1∶30、1∶40;提取时间考察范围:1、2、3、4、5 h。提取次数均为一次。当考察其中一个因素时,其它因素选择五个水平中的中位数,例如,考察温度影响时,另三个条件分别选择:70%乙醇浓度、料液比1∶20、提取时间3 h。
2.1.3.2 正交实验
根据单因素实验结果,选择合适的因素水平,进行4 因素3 水平正交实验。
2.2 抑菌活性的测定
培养大肠杆菌与金黄色葡萄球菌采用牛肉膏蛋白胨培养基,培养酵母菌、黑曲霉菌采用PDA 培养基。
2.2.1 样品配制
精密配制2.5、5.0、10.0、15.0 mg/mL 亳芍总生物碱乙酸乙酯溶液各5 mL,密封,备用。以2.5 μg/mL 青霉素和克霉唑乙酸乙酯溶液为阳性对照、乙酸乙酯为阴性对照。
2.2.2 菌悬液的制备
供试菌种斜面培养基活化后,取适量用生理盐水稀释,制成菌悬液备用。
2.2.3 抑菌活性测定——滤纸片法
在无菌操作台上将灭菌后的固体培养基,每皿精确加入0.5 mL 菌液,涂布棒涂布均匀。将直径8 mm 的滤纸圆片灭菌后在不同浓度生物碱提取液中浸泡2 h 后取出,贴于平板上,以无菌水作为对照。大肠杆菌、金黄色葡萄球菌于37 ℃恒温培养24 h,黑曲霉菌和酵母于28 ℃恒温培养24 h。上述实验每组设3 个重复,测定滤纸片的抑菌圈直径大小,记录实验结果。
3 实验结果
3.1 亳芍总生物碱提取工艺单因素试验结果
单因素实验结果如图1 所示。液料比1∶20,提取时间为3 h,提取温度为60 ℃条件时,分别以30%、50%、70%、90%、100%浓度的乙醇进行回流提取,随乙醇浓度的增加测得的生物碱含量也升高(图1A),表明总生物碱的提取率随乙醇浓度的增高而增加,当浓度超过70%时,提取率下降,可能是亳芍中水溶性总生物碱在高浓度醇中溶解度下降所致,故选择50%、70%、90%为继续优化提取条件的乙醇浓度。
当提取时间为3 h、提取温度为60 ℃、乙醇浓度为70%,考察料液比对总生物碱提取的影响,实验结果见图1B。实验测定的生物碱含量(提取率)随料液比的增加而增加,当料液比超过1∶20 时,生物碱得率增加缓慢。但料液比越小,耗费的试剂越多,后处理工作量增大,综合考虑,选择料液比1∶10~1∶30,作为进一步优化提取条件的料液比考察范围。
温度对总生物碱提取的影响如图1C 所示,采用70%乙醇、料液比1∶20 提取3 h 时,随着温度的升高,总生物碱提取率增加,当温度达60 ℃时,提取率最高,然后随着温度的升高生物碱的提取率下降。故实验选择50、60、70 ℃作为进一步优化提取条件的温度范围。
提取时间对总生物碱提取的影响见图4,随提取时间的升高,总生物碱提取率增加,而时间为3 h时,随着时间推移,提取率增加缓慢,故选2、3、4 h为作为进一步优化提取条件的时间范围。
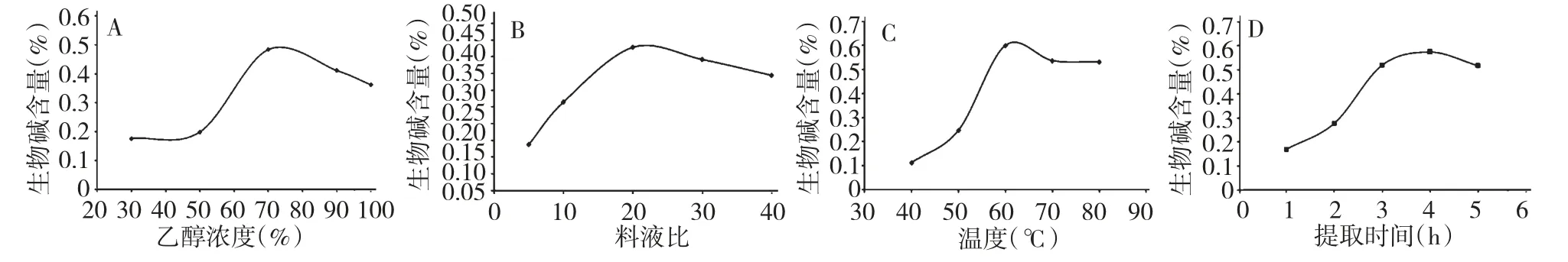
图1 乙醇浓度(A)、料液比(B)、提取温度(C)及提取时间(D)对亳芍总生物碱提取率的影响Fig.1 Effects of ethanol concentration (A),solid-liquid ratio (B),extraction temperature (C)and extraction time (D)on the extraction yield of total alkaloids from Bozhou Peony P.lactiflora
3.2 提取工艺优化
通过单因素实验,确定了每个因素的三个水平(表1),以L9(43)正交实验设计对亳芍总生物碱提取工艺进行优化(表2)。
由表2 可知影响亳芍生物碱提取因素中,对生物碱提取率影响由大到小依次为:提取温度(D)>提取时间(C)>乙醇浓度(A)>料液比(B),提取亳芍总生物碱的最佳提取工艺条件为A1B2C2D2,即乙醇浓度为60%,料液比为1∶20,提取时间为3 h,提取温度为60 ℃,在此条件下,测得亳芍总生物碱含量为0.58‰。
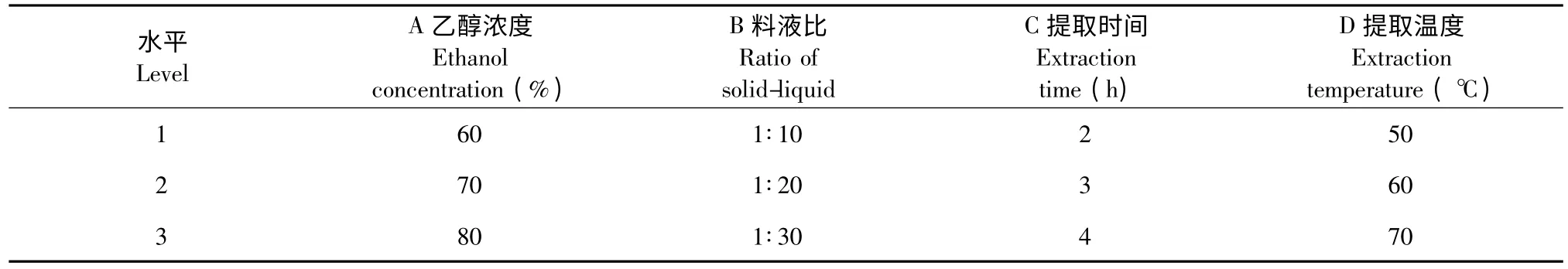
表1 正交因素水平表Table 1 Factors and levels of the orthogonal experiments
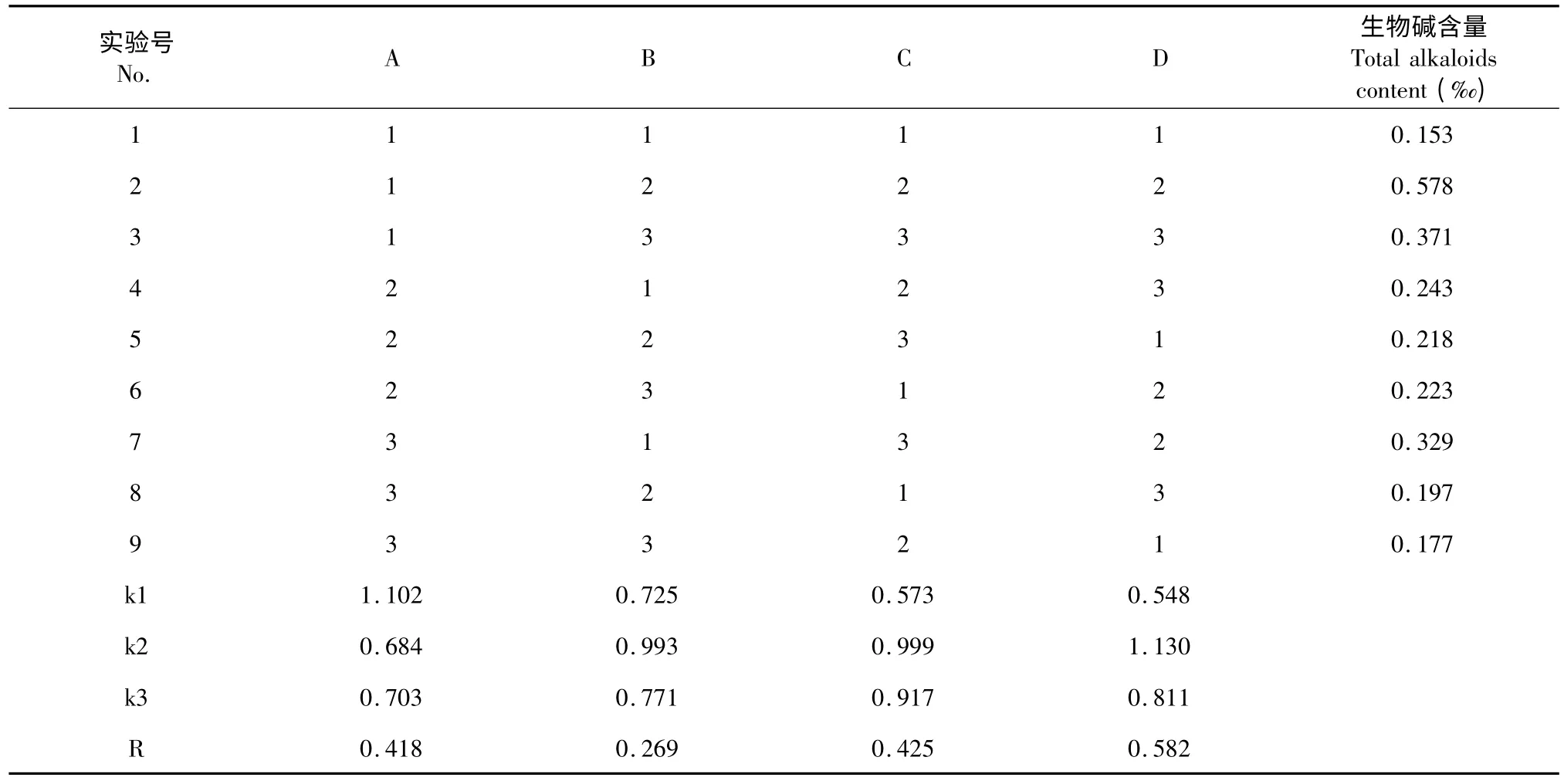
表2 正交实验与结果Table 2 Results of orthogonal experiments
3.3 不同浓度的亳芍总生物碱抑菌效果
不同浓度的亳芍总生物碱抑菌活性如表3 所示,亳芍总生物碱对大肠杆菌、枯草芽孢杆菌、金色葡萄球菌和酵母菌均表现出抑菌活性(图2),且生物碱提取液浓度与抑菌圈大小具有量效关系,抑菌圈随生物碱提取液浓度增大而扩大,对金黄色葡萄球菌、黑曲霉抑菌效果尤为显著。
4 结论
亳芍生物碱的最佳提取工艺为:60%乙醇,提取温度为60 ℃,提取时间为3 h,料液比为1∶20。亳芍总生物碱提取物对大肠杆菌、酵母菌、黑曲霉菌及金色葡萄球菌均表现出一定的体外抑菌活性,抑菌作用由大到小依次为:金色葡萄球菌>黑曲霉菌>酵母菌>大肠杆菌本研究结果可为中药亳芍质量控制、药理学研究及资源开发提供参考依据。
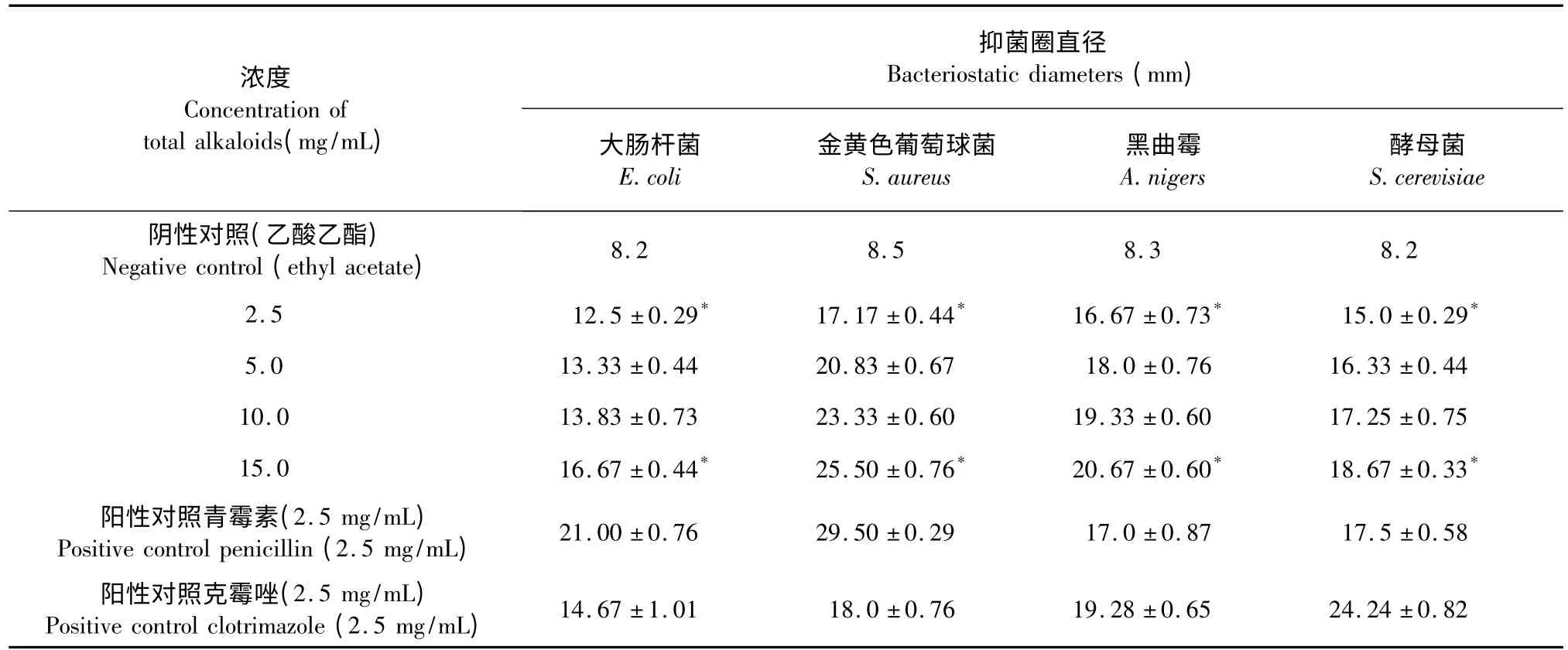
表3 亳芍生物碱的体外抑菌活性Table 3 Antibacterial activity of different concentrations of total alkaloids from Bozhou Peony P.lactiflora

图2 亳芍总生物碱提取物的抑菌效果Fig.2 Antibacterial effects of total alkaloids from Bozhou Poeny P.lactiflora
1 Lee B,Shin YW,Bae EA,et al.Antiallergic effect of the root of Paeonia lactiflora and its constituents paeoniflorin and paeonol.Arch Pharm Res,2008,31:445-450.
2 Lee SC,Kwon YS,Son KH,et al.Antioxidative constituents from Paeonia lactiflora.Arch Pharm Res,2005,28:775-783.
3 Jia N,Shu QY,Wang LS,et al.Analysis of petal anthocyanins to investigate coloration mechanism in herbaceous peony cultivars.Sci Hortic,2008,117:167-173.
4 Wang HB,Gu WF,Chu WJ,et al.Monoterpene glucosides from Paeonia lactiflora.J Nat Prod,2009,72:1321-1324.
5 Kim N,Park KR,Park IS,et al.Application of novel HPLC method to the analysis of regional and seasonal variation of the active compounds in Paeonia lactiflora.Food Chem,2006,96:496-502.
6 Ikuta A,Kamiya K,Satake T,et al.Triterpenoids from callus tissue cultures of Paeonia species.Phytochem,1995,38:1203-1207.
7 Kamiya K,Yoshioka K,Saiki Y,et al.Triterpenoids and flavonoids from Paeonia lactiflora.Phytochem,1997,44:141-144.
8 Tanaka T,Fukumori M,Ochi T,et al.Paeonianins A-E,New dimeric and monomeric ellagitannins from the fruits of Paeonia lactiflora.J Nat Prod,2003,66:759-763.
9 Lee SC,Kwon YS,Son KH,et al.Antioxidative constituents from Paeonia lactiflora.Arch Pharm Res,2005,28:775-783.
10 Tomoda M,Matsumoto K,Shimizu N,et al.An acidic polysaccharide with immunological activities from the rooot of Paeonia lactiflora.Biol Pharm Bull,1994,17:1161-1164.
11 Chen ND(陈乃东),Zhou F(周飞).The primary research of the extracting and assaying of the alkaloids from Bozhou Peony Paeonia lactiflora.Chin J Inf TCM (中国中医药信息杂志),2013,10(20):49-50.
12 Chen MC(陈美川).Determination of total content of aconitine Tongxuekang capsule by acid dye colorimetry.Strait Pharm J (海峡药学),2012,22:106-107.
13 Xu HY(许怀勇),Li HC(李含春).Study on the determination method of rib vigorously to alcohol content of Aconitine.China Mod Med (中国现代医药),2012,19:70.

