添加碳源提高卤虫生物量和改善水质
隋丽英,王 娇,高美荣,曾 衍
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
生物絮团技术(biofloc technology,BFT)是在高密度和限制性水交换养殖系统中,通过投放碳源或直接投喂高碳低氮饵料来提高水体中的碳氮比(C/N),促进异养微生物将氨氮转化成微生物蛋白,供养殖动物再摄食,以达到净化水质和降低饵料成本的目的[1].已经报道的适用于BFT 的养殖品种包括凡纳滨对虾(Litopenaeus vannamei)[2-5],罗非鱼(Oreo-chromis niloticus)[6-7],日本囊对虾(Marsupenaeus japonicas)[8]和罗氏沼虾(Macrobrachium rosenburgii)[9]等.
卤虫(Artemia)主要分布于内陆盐湖和日晒盐场蒸发池等高盐度水体中,其生活史包括幼体、成虫和休眠卵3 个阶段.卤虫休眠卵易于保存和运输,经过加工处理去休眠后,可孵化为幼体,是海水鱼和甲壳类育苗的极佳生物饵料[10].卤虫卵的产量和质量受种、品系和自然条件的影响较大[11].随着水产养殖业的发展,卤虫卵需求量逐年增加,卵径小、营养质量高和易于休眠的高品质卤虫的人工增养殖日益受到关注.
卤虫为非选择性滤食动物,主要以单胞藻和有机碎屑为食,摄食量大.高盐条件下藻类生长受到限制,同时蒸发浓缩作用使卤水中氮磷含量较高[12].将生物絮团技术应用于卤虫人工增养殖,通过调节C/N,促进异养细菌的繁殖,为卤虫提供充足的饵料蛋白[13-14].本文研究较高盐度下,碳源和C/N 对卤虫产量、水质和卤虫营养组成的影响及其对生物饵料单胞藻的替代作用,为生物絮团技术在卤虫人工增养殖中的应用提供依据.
1 材料与方法
1.1 实验设计
实验一研究不同单胞藻投喂水平下碳源对卤虫成虫产量和水质的影响.实验共设3 大组,实验组分别添加蔗糖和淀粉(C/N 20),对照组不添加任何碳源.每组设3 个单胞藻投喂水平,即正常投喂水平(NF)、较低投喂水平(LF,60%,,NF)和极低投喂水平(VLF,30%,NF).
实验二研究C/N 对卤虫成虫产量、营养组成和水质的影响.实验设5 组,分别添加蔗糖和淀粉,C/N分别为20 和40,对照组不添加任何碳源.单胞藻投喂水平为正常投喂量的60%,.
卤虫养殖条件为:温度24~25,℃,盐度50,连续充气.实验周期为14,d.每组3 个平行样,单位养殖水体为1,000,mL,卤虫初始密度为1.5,mL-1.
正常单胞藻投喂水平参考Vanhaecke 等[15]提出的杜氏盐藻(Dunaliella salina)最佳投喂量,并根据养殖密度进行适当调整.碳源添加量参考Avnimelech[16]提出的式(1)计算.
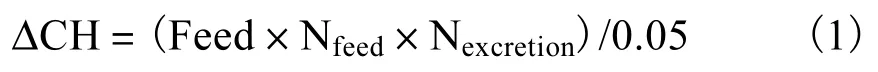
式中:ΔCH 为碳源添加量;Feed 为投喂量;Nfeed为饲料氮含量;Nexcretion为养殖动物排泄氮占投喂饲料氮的比例(一般为50%,);0.05 为常数.
杜氏盐藻最适投喂水平及碳源添加量(C/N 20)的计算结果见表1.
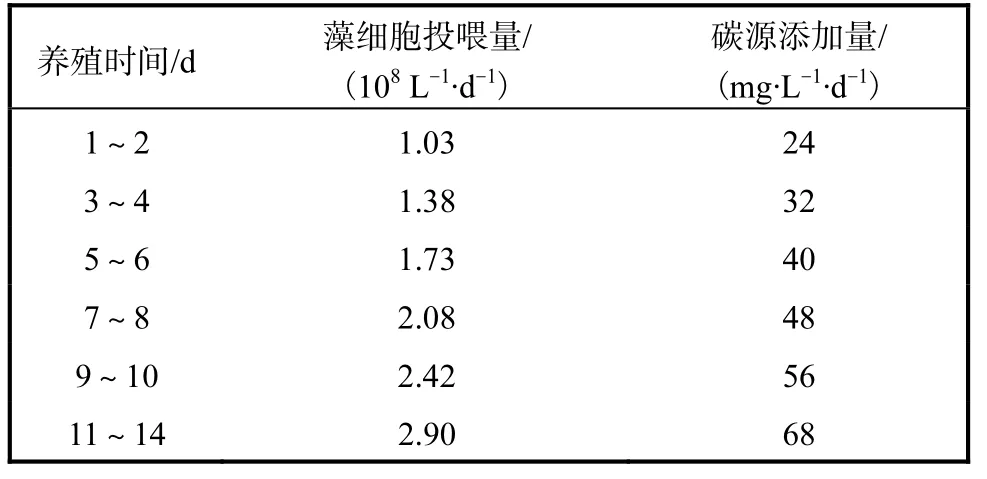
表1 杜氏盐藻最适投喂水平及碳源添加量(C/N 20)Tab.1 Optimal feeding level of Dunaliella salina and the supplementing amount of carbon source(C/N 20)
1.2 实验材料
日晒盐场卤水(盐度200)经过消毒、曝气和过滤处理后备用.养殖卤虫为两性生殖品系Artemia fransiscana Vinhchau strain.卤虫卵经过18,h 孵化(温度27~28,℃,盐度30,光照度1,000,lx,连续充气),将初孵无节幼体转至1,L 锥形管中暂养5,d(温度24~25,℃,盐度50,连续充气),卤虫密度为5,mL-1,每天早晚适量投喂浓缩杜氏盐藻.杜氏盐藻用5,L 三角瓶培养(24~25,℃,盐度50,光照度10,000,lx,连续充气),7,d 后将藻液浓缩离心(6,℃、6,000,r/min 离心10,min),4,℃贮藏备用.
1.3 指标测定
1.3.1 卤虫生物量
实验结束时,用筛绢收集卤虫,用蒸馏水除去虫体表面盐分,用滤纸吸干虫体表面水分,称质量,获得卤虫生物量.
1.3.2 卤虫粗蛋白及脂肪酸含量
将每组各平行样中收集的卤虫合并.采用凯氏定氮法测定粗蛋白,脂肪酸的测定参照Lepage 等[17]提出的方法,甲酯化脂肪酸(FAME)组成和含量用气相色谱测定(Shimatzu)[11].
1.3.3 养殖水体细菌总数
实验结束时,每个实验组随机选取1 个平行样,采用平板培养法估算水体中细菌总数.营养琼脂培养基配方为:蛋白胨10.0,g/L,牛肉浸粉3.0,g/L,琼脂15.0,g/L,用盐度为50 的卤水配制.37,℃培养48,h,计数菌落数目.
1.3.4 养殖水体理化指标
水体pH 采用pH 计(Mettler)测定,黏度用乌氏黏度计测定,溶解氧采用YSI 溶氧仪测定.取平行样中卤水各50,mL 合并(体积共150,mL),用0.25 μm微孔滤膜抽滤.根据GB/T 12763.4—2007《海洋调查规范·第4 部分:海水化学要素调查》[18]方法,分别采用重氮-偶氮法、锌镉还原法、次溴酸钠氧化法和过硫酸钾氧化法测定滤液中总铵盐(TAN)、亚硝酸盐()、硝酸盐()和总氮(TN)浓度.
1.4 数据分析
实验数据采用SPSS Statistics(version 19)软件进行统计分析.所有组间数据用单因素方差分析(ANOVA)进行比较,采用Tukey’s multiple range test检验显著性差异(P<0.05).图中不同字母上标表示统计学上的显著性差异(P<0.05).
2 实验结果
2.1 不同单胞藻投喂水平下碳源对卤虫生长和水质的影响
添加蔗糖和淀粉组别的卤虫生物量(以湿质量计)均显著高于对照组(P<0.05)(图1),而且添加碳源的LF 和VLF 组分别与未添加碳源的较高单胞藻投喂量对照组(NF 和 LF)卤虫生物量接近(P>0.05).蔗糖和淀粉组没有显著差异(P>0.05).
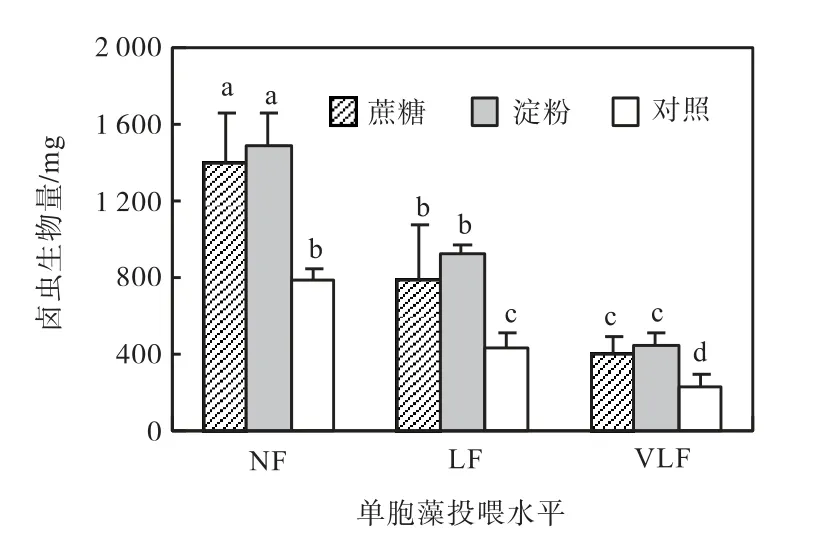
图1 不同单胞藻投喂水平和添加碳源条件下卤虫生物量Fig.1 Total Artemia biomass at different feeding levels and supplemented with different carbon sources
表2 不同单胞藻投喂水平和添加碳源条件下养殖水体TAN、、和TN浓度Tab.2 Content of TAN,, and TN in Artemia culture area at different feeding levels and supplemented with different carbon sources
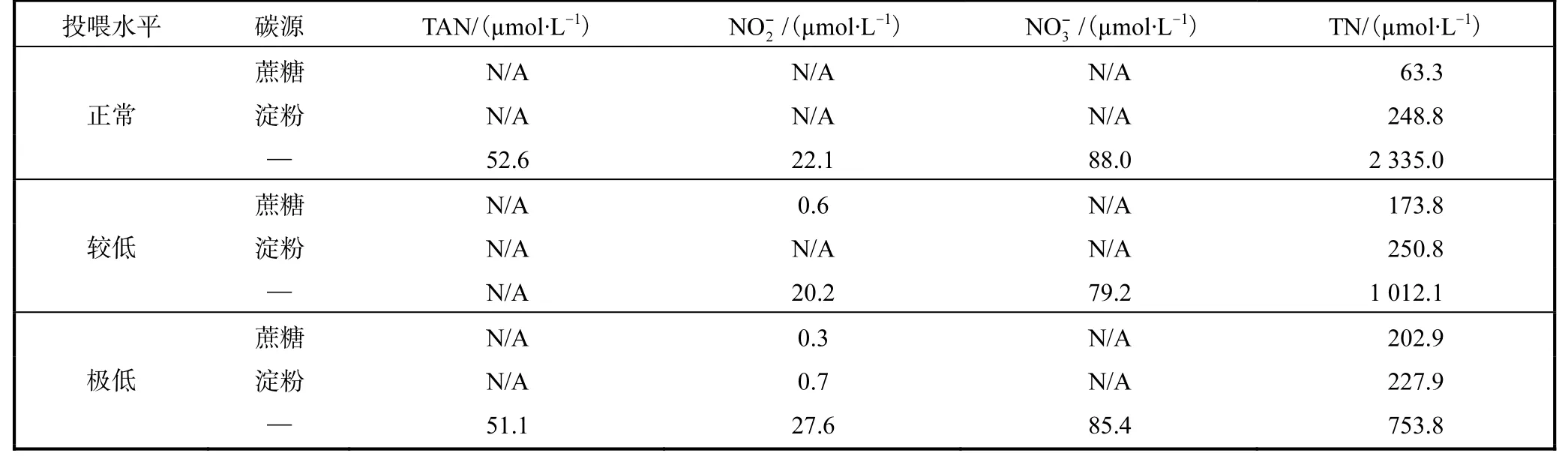
表2 不同单胞藻投喂水平和添加碳源条件下养殖水体TAN、、和TN浓度Tab.2 Content of TAN,, and TN in Artemia culture area at different feeding levels and supplemented with different carbon sources
注:—表示不加任何碳源,N/A 表示浓度低于检测限.
实验过程中水体溶解氧水平在6.5~7.5,mg/L 范围.不同单胞藻投喂水平下,未添加碳源的对照组水体pH 最高(P<0.05)(图2).添加碳源对卤水黏度的影响不显著(P>0.05).
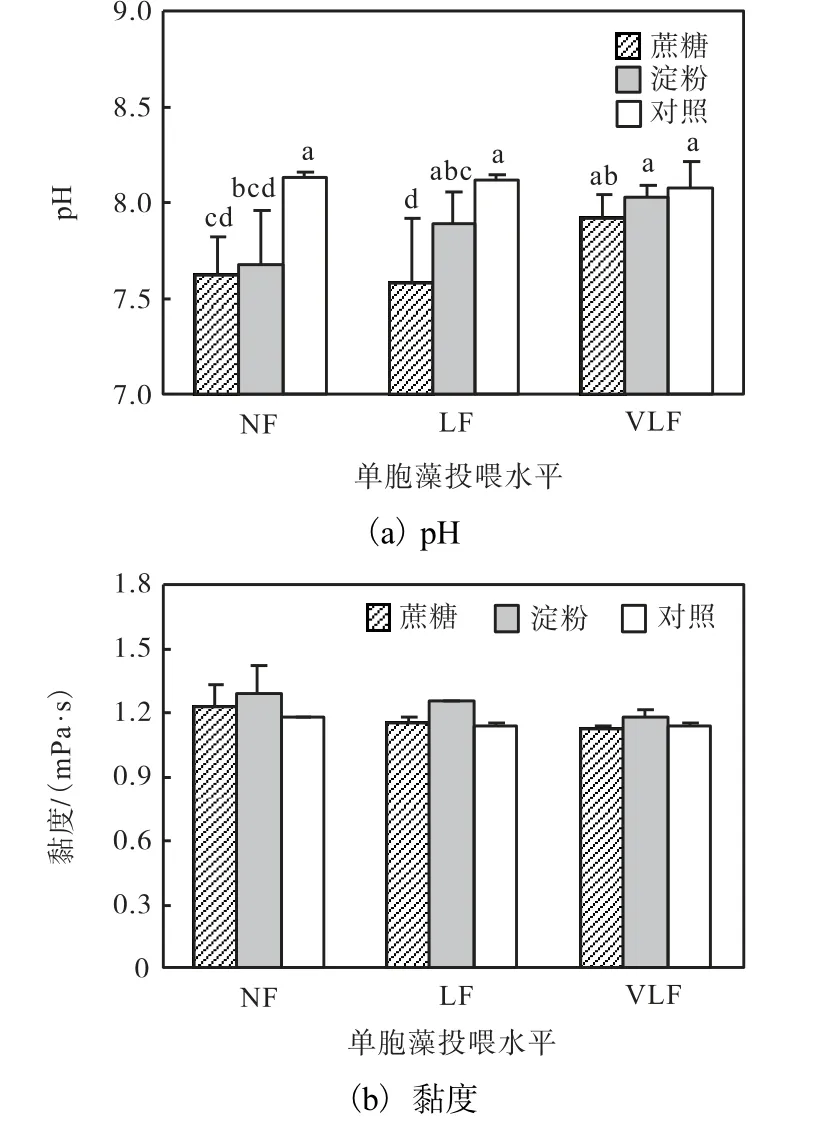
图2 不同单胞藻投喂水平和添加碳源条件下养殖水体pH与黏度Fig.2 pH and viscosity of Artemia culture column at different feeding levels and supplemented with different carbon sources
2.2 不同碳源和C/N 对卤虫生长、营养组成和水质的影响
添加蔗糖和淀粉显著提高卤虫生物量(以湿质量计)(P<0.05),与2.1 中的结果一致(图3).C/N 对卤虫生物量的影响不显著(P>0.05).
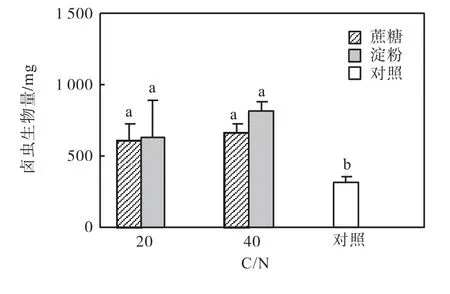
图3 添加不同碳源和不同C/N条件下的卤虫生物量Fig.3 Total biomass of Artemia supplemented with different carbon sources and at different C/N ratios
蔗糖组养殖水体中细菌总数均高于淀粉组和对照组(表3).蔗糖组卤虫粗蛋白含量(以干质量计)最高,淀粉组最低.添加碳源使脂肪酸(以干质量计)C20∶5n3 含量明显降低,C16∶1n7 含量明显升高.与C/N 20 相比,C/N 40 条件下蔗糖组卤虫粗蛋白和脂肪酸含量有所上升,而淀粉组则有所降低.
在C/N 20 和C/N 40 条件下,添加蔗糖使水体pH 显著低于对照组(P<0.05),淀粉组介于二者之间(图4).添加碳源对卤水黏度无显著影响(P>0.05).
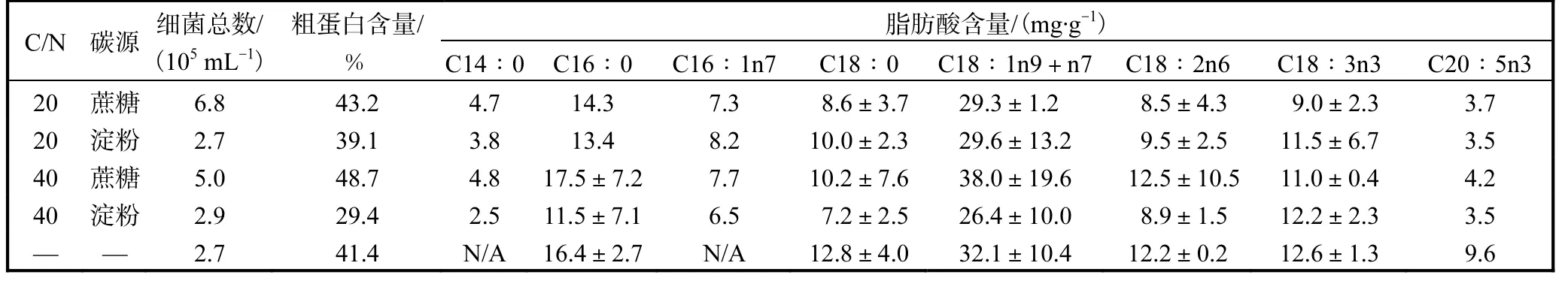
表3 添加不同碳源和不同C/N条件下细菌总数、粗蛋白和卤虫脂肪酸含量Tab.3 Total bacterial count,crude protein content and fatty acid profile of Artemia supplemented with different carbon sources and at different C/N ratios
表4 不同碳源和不同C/N条件下卤虫养殖水体TAN、、和TN 浓度Tab.4 Content of TAN,,and TNinArtemiaculture columnsupplementedwith different carbon sources and atdifferent C/N ratios
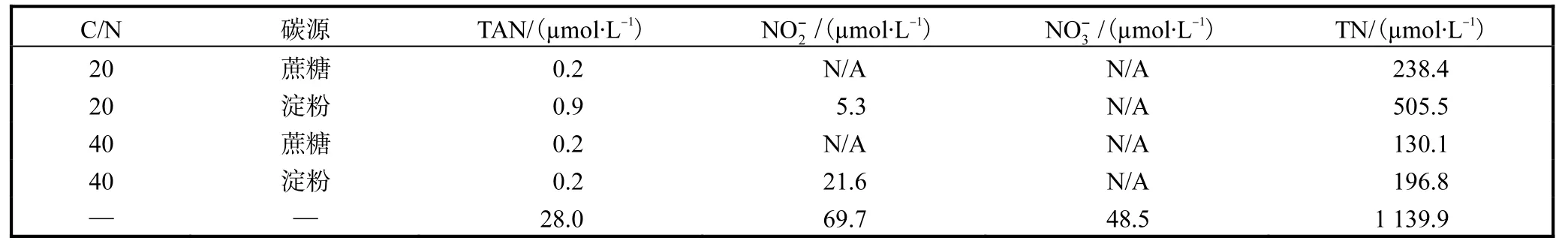
表4 不同碳源和不同C/N条件下卤虫养殖水体TAN、、和TN 浓度Tab.4 Content of TAN,,and TNinArtemiaculture columnsupplementedwith different carbon sources and atdifferent C/N ratios
注:—表示不加任何碳源,N/A 表示浓度低于检测限.
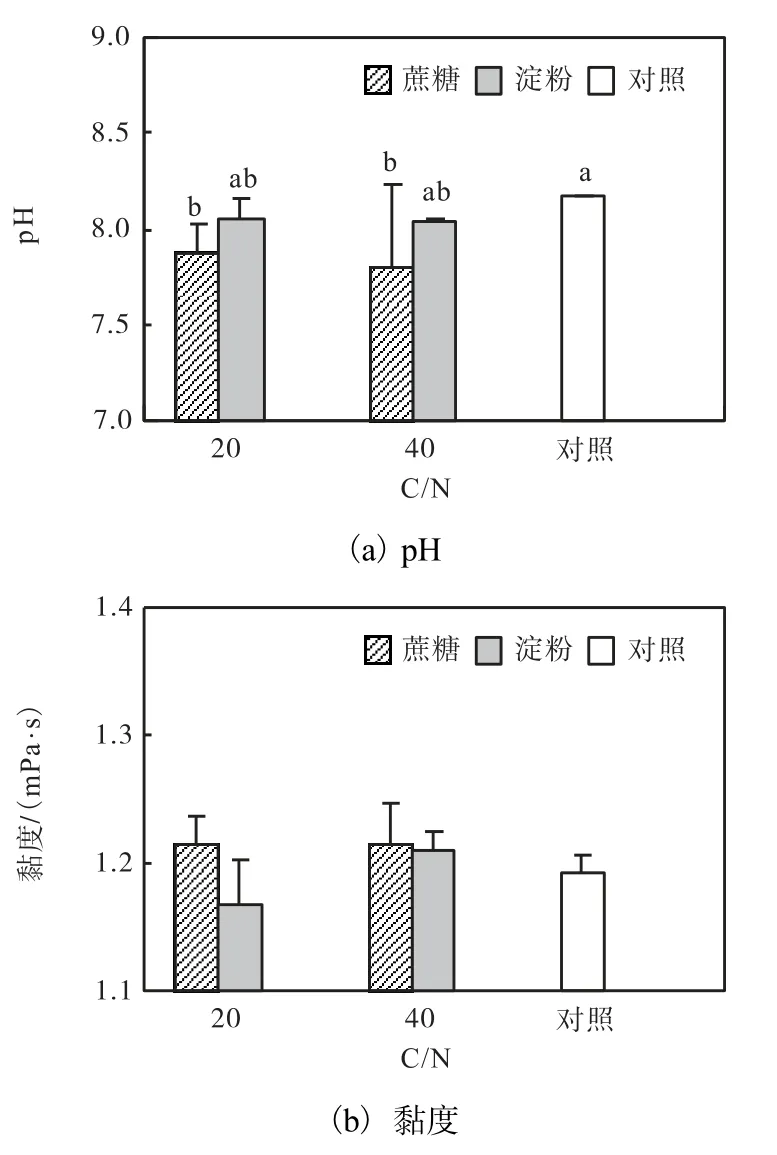
图4 不同碳源和不同C/N 条件下卤虫养殖水体pH 和黏度Fig.4 pH and viscosity of Artemia culture column supplemented with different carbon sources and at different C/N ratios
3 讨论
集约化水产养殖中,养殖动物的高密度和大量投放饵料使水体中氨氮大量积累.在各种氮形式中,NH3和对养殖动物的毒害作用最强,特别是不带电和脂溶性的非离子态NH3,比更容易通过生物膜,对动物的毒害作用更大[19].微生物对水体中氨氮的移除主要通过3 种途径:浮游植物的光合自养作用、自养细菌的亚硝化和硝化作用、异养细菌的同化作用[20].异养细菌对氨氮的固定能力是自养微生物的10 倍[21],适当添加碳水化合物可促进异养细菌的生长,当C/N>10 时异养细菌对氮同化作用更强[22].通过适当降低饵料中氮含量或向系统中添加碳源,促进以异养细菌为主的生物絮团的形成,对动物生长和水质调节有明显促进作用.
大多数微生物在高盐条件下不能存活或生长较慢,但卤水中存在的嗜盐微生物(如嗜盐细菌或嗜盐古菌等)具有适应高盐环境的特殊细胞结构和代谢机制[23],盐度不是其生长和存活的限制因子.本研究向卤虫养殖系统中添加碳源,显著降低单胞藻投喂量和水体中氮含量,提高卤虫产量,推测与碳源促进水体中嗜盐微生物对氮源(尤其是氨氮)的固定、形成微生物菌体蛋白替代部分生物饵料和水质改善有关.该结果与Toi 等[24]的研究一致,他们利用15,N 同位素标记证实,添加碳源可促进卤虫生长,而且在单胞藻投喂水平较低时,细菌被用作卤虫食物的比例较高.
卤虫的营养组成,尤其是脂肪酸组成与饵料密切相关[25].细菌中富含C16∶1n7 和C18∶1n7 脂肪酸,但是缺乏多不饱和及高不饱和脂肪酸[26],而杜氏盐藻则相反[27].本研究中添加碳源使卤虫脂肪酸C16∶1n7 显著升高,而C20∶5n3 含量有所降低,说明卤虫摄食了菌体,并将其转化为自身的脂肪酸.Avnimelech 等[28]利用15N 同位素标记NH4Cl 和淀粉,研究高密度罗非鱼养殖系统中氨的同化作用,发现25%,的絮团蛋白质可被鱼类利用.本研究中添加蔗糖使卤虫粗蛋白含量有所提高,与卤虫对生物絮团菌体蛋白的摄食有关.淀粉组卤虫的粗蛋白含量较仅投喂单胞藻的对照组低,与部分淀粉颗粒被卤虫滤食存在于消化道中,使相对于卤虫总干质量计算的粗蛋白含量相对较低有关.
有机碳源的种类决定生物絮团形成、大小和营养组成(取决于微生物组成和细胞代谢产物)[1,29].比较蔗糖和淀粉两种碳源,虽然卤虫生物量无显著差别,但蔗糖组养殖水体中各种氮源浓度较低,且细菌总数较高,说明分子结构简单的蔗糖更容易被异养细菌利用,有利于生物絮团的形成.本研究中提高C/N 对卤虫生物量的影响不显著,但使水体中氮浓度有所降低,说明提高C/N 有利于异养细菌的同化作用.
卤虫属小型浮游滤食性甲壳动物,幼体摄食粒径为6.8~27.5,µm[30],成虫摄食粒径不大于50,µm[31].卤虫游泳能力较差,水体中较小的生物絮团可被卤虫摄食利用,促进卤虫的生长;而较大的絮团不仅不能被摄食,反而可能黏附于卤虫复肢,不利于卤虫生长.本研究中碳源的添加显著降低养殖水体pH,可能与异养细菌大量繁殖产生酸性代谢物有关.自然条件下卤虫生长在盐湖和盐田蒸发池中,卤水pH 为8 左右.而在偏酸性(pH<6)水体中卤虫的生长、存活和生殖均受到影响[32],因此将BFT 应用于卤虫养殖系统中,有必要对絮团大小和卤水pH 进行调控.
碳源种类的选择与 BFT 的应用成本密切相关.本研究中选用了实验室常备的蔗糖和可溶性淀粉为碳源,但从经济效益考虑,选择低成本的碳源(如糖蜜、麦麸和木薯粉等高碳农副产品)是BFT 在水产养殖中推广应用的必由之路.
综上所述:在高盐卤虫养殖系统中,在相同单胞藻投喂水平下,添加碳源(蔗糖和淀粉)显著提高卤虫生物量,使养殖水体氮含量大幅降低,pH 有所下降.添加碳源使卤虫粗蛋白和脂肪酸C16∶1n7 含量有所升高,C20∶5n3 含量有所降低.提高C/N 对卤虫生物量的影响不显著.总体而言,蔗糖的效果好于淀粉.
[1]Crab R,Defoirdt T,Bossier P,et al.Biofloc technology in aquaculture :Beneficial effects and future challenges[J].Aquaculture,2012,356/357:351-356.
[2]Avnimelech Y.Bio-filters:The need for an new comprehensive approach[J].Aquaculture Engineering,2006,34(3):172-178.
[3]Burford M A,Thompson P J,McIntosh R P,et al.The contribution of flocculated material to shrimp (Litopenaeus vannamei)nutrition in a high-intensity,zeroexchange system[J].Aquaculture,2004,232(1/2/3/4):525-537.
[4]邓应能,赵培,孙运忠,等.生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J].渔业科学进展,2012,33(2):69-75.
[5]Xu W J,Pan L Q.Effects of bioflocs on growth performance,digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J].Aquaculture,2012,356/357:147-152.
[6]Crab R,Kochva M,Verstraete W,et al.Bio-flocs technology application in over-wintering of tilapia[J].Aquaculture Engineering,2009,40(3):105-112.
[7]李彦,刘利平,赵广学,等.养殖水体中添加碳源对水质及罗非鱼生长的影响[J].大连海洋大学学报,2013,28(1):55-60.
[8]Zhao Pei,Huang Jie,Wang Xiuhua,et al.The application of bioflocs technology in high-intensive,zero exchange farming systems of Marsupenaeus japonicus[J].Aquaculture,2012,354/355:97-106.
[9]刘杜娟,潘晓艺,尹文林,等.生物絮团在罗氏沼虾育苗中的应用[J].上海海洋大学学报,2013,22(1):47-53.
[10]Sorgeloos P,Dhert P,Candreva P.Use of the brine shrimp,Artemia spp.,in marine fish larviculture[J].Aquaculture,2001,200(1/2):147-159.
[11]隋丽英,王娇.不同品系卤虫卵的生物学测定值和营养组成分析[J].天津科技大学学报,2014,29(1):46-50.
[12]王婧,隋丽英,贺华,等.山东埕口盐场海欣分场卤虫种群生态调查[J].生态学杂志,2012,31(11):2848-2854.
[13]Ronald L,Van Stappen G,Van Hoa N,et al.Effect of carbon/nitrogen ratio manipulation in feed supplements on Artemia production and water quality in solar salt ponds in the Mekong Delta,Vietnam[J].Aquaculture Research,2014,45(12):1906-1912.
[14]Sui L Y,Wang J,Nguyen V H,et al.Increased carbon and nitrogen supplementation in Artemia culture ponds results in higher cyst yields[J].Aquaculture International,2013,21(6):1343-1354.
[15]Vanhaecke P,Siddall S E,Sorgeloos P.International study on Artemia.XXXII.Combined effects of temperature and salinity on the survival of Artemia of various geographical origin[J].Journal of Experimental Marine Biology &Ecology,1984,80(3):259-275.
[16]Avnimelech Y.Carbon/nitrogen ratio as a control element in aquaculture systems[J].Aquaculture,1999,176(3/4):227-235.
[17]Lepage G,Roy C C.Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J].Journal of Lipid Research,1984,25(12):1391-1396.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12763.4—2007 海洋调查规范·第4 部分:海水化学要素调查[S].北京:中国标准出版社,2007.
[19]Körner S,Das S K,Veenstra S,et al.The effect of pH variation at the ammonium/ammonia equilibrium in wastewater and its toxicity to Lemna gibba[J].Aquatic Botany,2001,71(1):71-78.
[20]Crab R,Avnimelech Y,Defoirdt T,et al.Nitrogen removal techniques in aquaculture for a sustainable production[J].Aquaculture,2007,270(1/2/3/4):1-14.
[21]Hargreaves J A.Photosynthetic suspended-growth systems in aquaculture[J].Aquaculture Engineering,2006,34(3):344-363.
[22]Schneider O,Sereti V,Eding E H,et al.Analysis of nutrient flows in integrated intensive aquaculture systems[J].Aquaculture Engineering,2005,32(3/4):379-401.
[23]Oren A.Diversity of halophilic microorganisms :Environments,phylogeny,physiology,and applications[J].Journal of Industrial Microbiology and Biotechnology,2002,28(1):56-63.
[24]Toi H T,Boeckx P,Sorgeloos P,et al.Bacteria contribute to Artemia nutrition in algae-limited conditions:A laboratory study[J].Aquaculture,2013,388/389/390/391:1-7.
[25]Zhukova N V,Imbs A B,Yi L F.Diet-induced changes in lipid and fatty acid composition of Artemia salina[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(3):499-506.
[26]Intriago P,Jones D A.Bacteria as food for Artemia[J].Aquaculture,1993,113(1/2):115-127.
[27]El-Baky H H A,El-Baz F K,El-Baroty G S.Production of lipids rich in omega 3 fatty acids from the halotolerant alga Dunaliella salina[J].Biotechnology,2004,3(1):102-108.
[28]Avnimelech Y,Kochba M.Evaluation of nitrogen uptake and excretion by tilapia in biofloc tanks,using15N tracing[J].Aquaculture,2009,287(1/2):163-168.
[29]De Schryver P,Crab R,Defoirdt T,et al.The basics of bio-flocs technology:The added value for aquaculture[J].Aquaculture,2008,277(3/4):125-137.
[30]Fernández R G.Artemia bioencapsulation I.Effect of particle sizes on the filtering behavior of Artemia franciscana[J].Journal of Crustacean Biology,2001,21(2):435-442.
[31]D'agostino A.The vital requirements of Artemia:physiology and nutrition[M]// Persoone G,Sorgeloos P,Roels O,et al.The Brine Shrimp Artemia.Vol 2.Physiology,Biochemistry,Molecular biology.Belgium :Universa Press,1980:55-82.
[32]Sui Liying,Deng Yuangao,Wang Jing.Impact of brine acidification on hatchability,survival and reproduction of Artemia parthenogenetica and Artemia franciscana in salt ponds,Bohai Bay,China[J].Chinese Journal of Oceanology and Limnology,2014,32(1):81-87.

