基于化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺
罗蓓尔,诸奇滨,成有为,王丽军,李 希
浙江大学化学工程与生物工程学院,浙江 杭州 310027
基于化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺
罗蓓尔,诸奇滨,成有为,王丽军,李 希
浙江大学化学工程与生物工程学院,浙江 杭州 310027
提出了一种以MgO为吸附剂,以化学环法分解氯化铵的工艺为核心,将纯碱与氯乙烯两大过程集成为一个无CO2排放又无电解过程的清洁生产新工艺。使用HSC热力学软件分析了MgO与NH4Cl两步反应分别释放NH3和HCl的可能性,并确定了释氨反应和释氯反应的温度、水氨物质的量比等相关条件。使用固定床装置对此过程进行了验证,并得到了较高的NH3和HCl的单程收率;评价了作为反应吸附剂的不同氧化镁的活性,粉末状轻质MgO因为其比表面积和孔容的优势而活性最高;实验进一步验证了MgO吸附剂在多次循环利用下的表现,结果表明其在11次的循环利用后仍然有较高的活性。
氯化铵 氧化镁 化学环 纯碱 氯乙烯 过程集成
氯乙烯是重要的大宗化工原料,其工业生产方法主要是乙烯氧氯化法和电石乙炔法。全球范围内,北美和欧洲通常采用乙烯氧氯化法生产氯乙烯,而中国由于油气资源不足,煤炭资源相对丰富,主要采用电石乙炔法。中国每年氯乙烯产量约1 500万吨,其中75%以上采用电石乙炔法生产[1-3]。
电石的原料氧化钙由煅烧石灰石而得,每生产1吨氧化钙,需排放约0.8吨高浓度(38%~42%)CO2气体,不但容易引起环境问题,而且浪费了宝贵的碳资源。与此同时,CO2气体却是另一种大宗化工产品纯碱的生产原料,CO2通过氨盐水吸收后生成纯碱与氯化铵。因此,电石联产纯碱可以共用一套石灰石煅烧单元:氧化钙供电石生产,CO2供纯碱生产使其得到资源化利用。然而,纯碱生产过程的副产物氯化铵的利用却是一个瓶颈问题[4]。
如能将氯化铵分解为NH3和HCl两种产物,NH3返回制碱过程循环使用,HCl供给氯乙烯合成单元,取代氯碱工艺中电解法制HCl步骤,则传统的纯碱和氯乙烯两大工艺可以集成为一个清洁生产的新工艺。因此,电石法制氯乙烯与联碱法生产纯碱两大过程的集成,关键技术是氯化铵的分解与分离。
氯化铵在330~350 ℃下分解为NH3与HCl气体,这两种气体的分离十分困难,一般是采用酸性或碱性的反应物质先固定其中一种,然后使两种气体先后被释放出来,文献中对此有过大量报道[5,6]。例如,Hiromi等[7,8]采用酸性化合物先与NH3反应生成不易挥发的铵盐,释放出氯化氢气体,再加热得到的铵盐,释放出氨气。Andel等[9,10]将有机胺作为载体,与氯化铵反应在较低温度下释放出氨气,再在较高温度下释放出氯化氢。但这两类方法反应速率过慢、副反应多,难以在工业上应用。Fuchsman[11]、翟广伟[12]、罗弦[13]、李渝生[14]等采用碱性金属氧化物先与HCl反应形成不易挥发的氯化物,释放出氨气,再加热氯化物得到HCl。在曾经筛选过的多种金属氧化物中,氧化镁被认为是最合适的固体介质,它可以在较低的温度下吸收HCl放出NH3,在较高的温度下再生释放HCl。但现有的文献与专利仅仅提出了利用氧化镁为化学吸附剂来分解氯化铵的可能性,对进一步的工业化应用问题,如过程的热力学条件、吸附剂的筛选与评价、吸附与再生工艺、纯碱-氯乙烯过程集成等方面,缺少系统而深入的研究。
利用氧化镁分解氯化铵的思想与近年来采用金属氧化物通过化学环(chemical looping)进行清洁燃烧或分离酸性气体的概念类似。化学环是指将某一特定的化学反应借助于某种化学介质的循环作用分多步完成的过程。目前文献中报道的化学环主要有两类:一类是氧化-还原循环,采用金属氧化物颗粒作为载氧体,在一个反应器中与燃料接触,被还原为金属或低价态氧化物后,再输送到另一个反
应器中与空气或水蒸气接触,被氧化回高价态氧化物,这类循环多用于清洁燃烧、气化和空气分离[15-21];另一类是化学吸附-再生循环,采用氧化钙等固体颗粒为高温吸附剂,在一个反应器中吸附CO2、H2S等酸性气体后输入再生器加热释放酸性气体,用于吸附强化制氢、合成气脱硫等过程[22-24]。化学环的要点是氧载体(固体吸附剂)的筛选及其循环再生条件。
本研究将化学环的概念与方法用于氯化铵的分解与分离,目的是开发纯碱与氯乙烯联产的清洁生产新过程,两大工艺的过程集成示于图1。氯乙烯采用电石乙炔法工艺生产,纯碱采用联合制碱法生产。首先,CaCO3煅烧得到CaO和CO2,前者送至氯乙烯过程作为电石原料,后者用于纯碱生产。随后将纯碱过程副产物氯化铵用化学环法分解为NH3和HCl,其中释氨反应器得到的NH3直接送至纯碱过程用于制备氨盐水,释氯反应器得到的HCl送至氯乙烯过程与乙炔反应。基于氧化镁分解氯化铵的化学环工艺,每吸收0.43吨CO2生产1吨纯碱,联产0.58吨氯乙烯,并获得0.68吨HCl产品。纯碱与氯乙烯两大过程集成后,无CO2的排放,同时CO2与氯化铵都可以全部得到资源化利用,电解盐水制氯化氢的过程可完全省去,因此本工艺是一种绿色清洁的新工艺。
本研究首先从热力学的角度对过程进行分析以判断其可行性与合适的热力学条件,随后在固定床反应器中实验评价4种氧化镁固体吸附剂对氯化铵分解的性能与指标,考察吸附剂再生与重复使用的条件,为其进一步的工业应用提供依据。
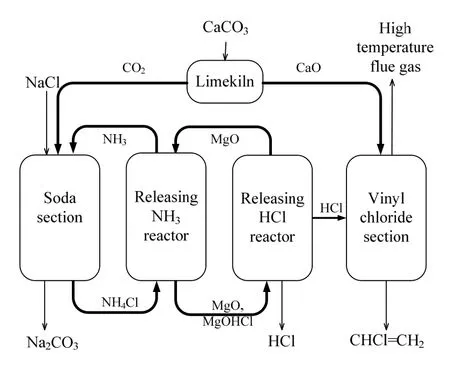
图1 纯碱-氯乙烯工艺的过程集成Fig.1 Integration of the soda ash and vinyl chloride processes
1 化学环分解氯化铵
1.1 MgO循环分解NH4Cl过程的热力学分析
在进行吸附剂筛选与评价之前,首先利用HSC热力学软件计算氧化镁与氯化铵分解反应的各步吉布斯自由能与平衡组成以确定反应的方向与条件。氯化铵分解过程主要包括两个步骤:氧化镁吸收HCl同时放出NH3(释氨反应),氯氧镁化合物在更高温度下释放出HCl(释氯反应)。
释氨步骤可能的化学反应有:

如图2所示,氯化铵的分解反应(1)为吸热反应,ΔG随温度升高而线性减小,表明温度越高反应越容易发生。氧化镁吸氯反应(2)与(3)为放热反应,二者的ΔG几乎重合且随温度升高线性增大,水合反应(4)对温度不敏感。考虑到氯化铵的分解温度为337.8 ℃,为了使NH4Cl能够汽化,同时有利于所有各步反应的进行,释氨反应温度取350 ℃左右为宜。

图2 释氨反应的ΔG随温度的变化Fig.2 ΔGvstemperature of the releasing NH3reaction
图3给出了常压下温度对释氨反应平衡组成的影响。MgO和NH4Cl的进料量分别为1.5,1 kmol。图3(a)中无水蒸气存在,图3(b)中水蒸气与NH4Cl的物质的量比为0.6:1。由图可见,HCl被氧化镁吸收生成了MgOHCl,而氨气被释放出。在350 ℃以上,水蒸气的存在与否对释氨反应没有明显影响。

图3 释氨反应的平衡组成随温度的变化Fig.3 Effects of temperature on the equilibrium of the releasing NH3reaction products
根据热力学计算,可以判断出350 ℃下释氨反应发生的可能机理为:氯化铵分解反应(1)首先发生;分解而得的HCl被MgO吸收,发生反应(2)或(3)分别生成MgOHCl或MgCl2;而反应(3)的产物MgCl2和水蒸气又会发生反应(4),再次生成MgOHCl,放出HCl并重新被MgO吸收。因此,在释氨反应完成时,理论上的固体产物为MgOHCl。
释氯步骤可能的化学反应有:

如图4所示,反应(5)至(7)均为吸热反应,ΔG均随温度的升高而减小,温度越高越有利于反应,其中反应(5)和(7)在570 ℃以上,反应(6)在490 ℃以上其ΔG大于0,因此可将释氯反应的温度取为570 ℃。
图5给出了有无水蒸气存在条件下的平衡组成计算,给定系统的压力为常压,MgOHCl的进料量为1 kmol。可以看到,MgOHCl首先分解成MgO和HCl,同时还能与HCl反应生成MgCl2和H2O。在520 ℃左右,部分MgCl2和H2O发生反应生成MgO和HCl。由于副产物MgCl2的生成,570 ℃时HCl的收率仅为45.9%,而当水蒸气与MgOHCl的物质的量比为0.6:1时,570 ℃时平衡组分中只有MgOHCl和HCl,副反应的产物MgCl2并不存在。由此可知,对于释氯反应,水蒸气的存在抑制了MgCl2的生成,有利于HCl收率的提高。

图4 释氯反应的ΔG随温度的变化Fig.4 ΔGvstemperature of the releasing HCl reaction
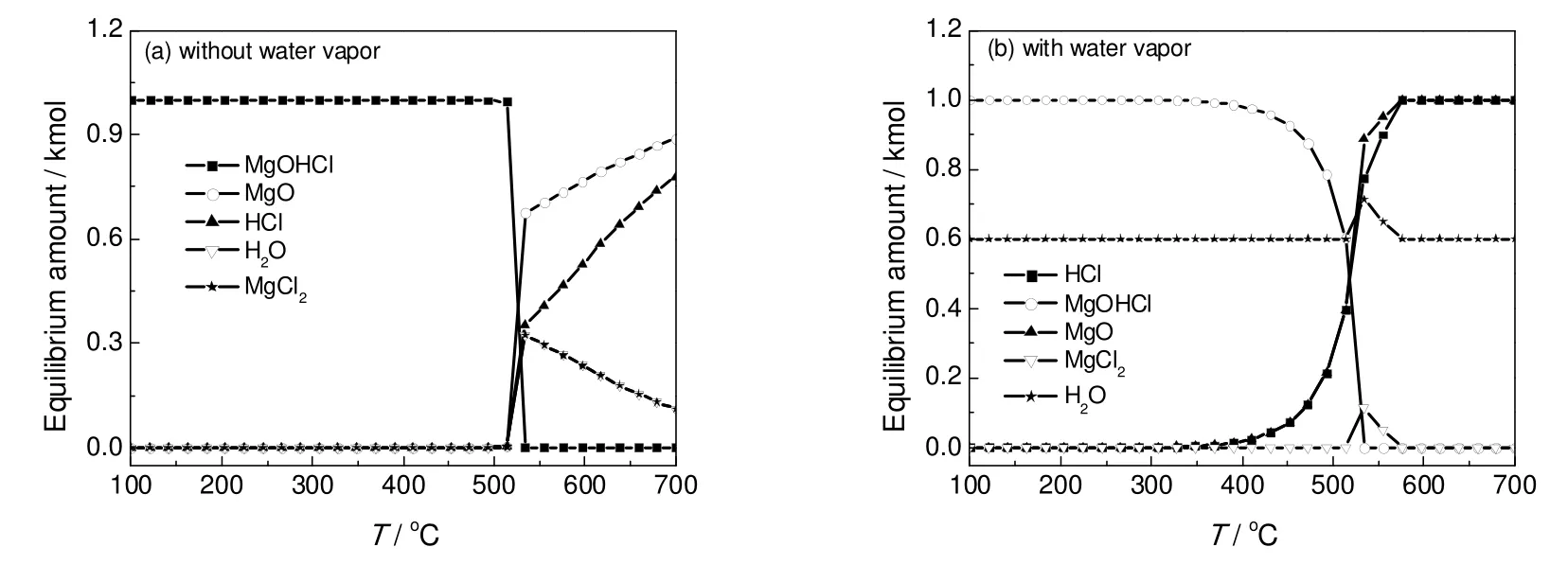
图5 释氯反应的平衡组成随温度的变化Fig.5 Effects of temperature on the equilibrium of the releasing HCl reaction products
通过调节加入的水蒸气量可以获得570 ℃时合适的水蒸气加入量,HSC软件计算结果如图6所示。HCl气体的生成量随着水蒸气量的增大而增大,当无水蒸气时,HCl气体的收率仅为54.9%;而当水蒸气与MgOHCl的物质的量比为0.6:1时,产物中没有MgCl2,HCl气体收率理论上达到100%。
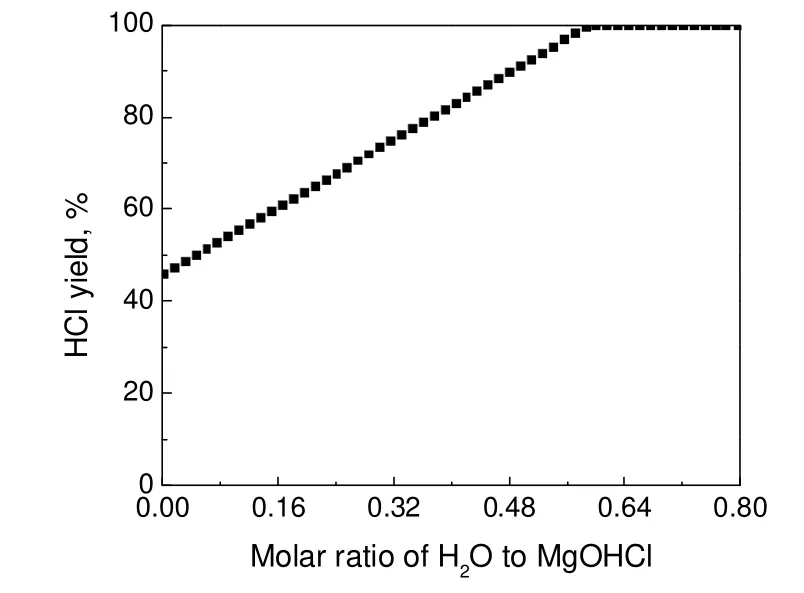
图6 水蒸气量对HCl气体收率的影响Fig.6 Effects of water vapor amount on the yield of HCl
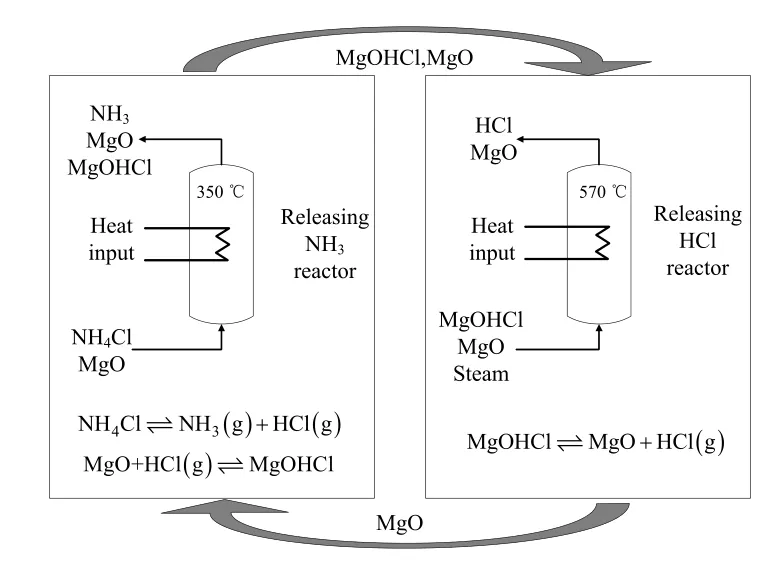
图7 MgO化学环Fig.7 Schematic diagram of MgO looping process
1.2 氧化镁化学环过程
采用氧化镁化学环分解氯化铵的过程可用图7来表示,以MgO为化学吸附剂,分别在低温释氨反应器和高温释氯反应器中进行吸附-再生化学环,依次释放出NH3和HCl。在释氨反应器中,MgO吸收HCl生成MgOHCl,分离释放出NH3,释氨反应所需热量可由高温释氯反应器提供的再生固体和高效的天然气燃烧提供。在释氯反应器中,MgOHCl固体在水蒸气气氛中由外部热源加热释放出HCl,再生的氧化镁吸附剂输送至释氨反应器进行循环使用。图7中的两个反应器可采用流化床、移动床或回转炉进行粉料输送或气体切换。
2 实验部分
2.1 氧化镁吸附剂的制备与分析
实验考察的氧化镁吸附剂有4种:粉末状轻质氧化镁(PL)、粉末状重质氧化镁(PH)、颗粒状轻质氧化镁(GL)和颗粒状重质氧化镁(GH)。粉末氧化镁用于回转炉加热输送,粒状氧化镁用于流化床或移动床输送。不同吸附剂的物理参数列于3.3节的表1。粉状吸附剂直接从市场采购,使用前经过干燥与活化步骤后用于评价实验。粒状吸附剂制备方法如下:在适量粉末状氧化镁中加入少量拟薄水铝石(AlOOH)与稀硝酸制成的凝胶,混合均匀后在30 MPa下停留数分钟压片成型,110 ℃下烘2 h,之后在马弗炉中700 ℃下焙烧4 h,升温速率3 ℃/min,最后取出研磨、过筛(20~60 目),即得到所需样品。
为了对比实验所用的不同来源的MgO吸附剂的晶型结构和孔结构,分别对其进行X射线衍射分析(XRD)和比表面积分析(BET)。其中XRD的衍射角度为10~90 °,扫描步长为0.26 (°)/步,每步时间为18.87 s。BET分析是由氮气作为吸附剂在-197 ℃下完成。
2.2 氧化镁分解氯化铵实验
采用热重实验对氧化镁分解氯化铵的实验可行性进行预判。分别取9.7 mg的NH4Cl放入坩埚中,以10 ℃/min的升温速率从室温升到500 ℃;取4.3 mg的MgO与4.8 mg的NH4Cl(物质的量比为1.2:1)放入坩埚中,以10 ℃/min的升温速率从室温升到450 ℃;将释氨反应后的固体混合物放入坩埚,在经水饱和的氮气氛围内,以10 ℃/min的升温速率从室温升到700 ℃进行热重分析。
2.3 释氨反应产物分析
采用XRD分析对释氨反应产物的组成进行判断。将一定量的NH4Cl和MgO混合物在350 ℃下加热1 h,产物进行XRD分析,衍射角度为10~90 °,扫描步长为0.26 (°)/步,每步时间为18.87 s。
2.4 吸附剂评价实验装置及步骤
吸附剂的评价与条件实验采用固定床装置,如图8所示。将一定量的NH4Cl和MgO在固定床中混合装填,加热管式反应炉到350 ℃反应一定时间,同时通入小流量的惰性气体,放出的NH3用水吸收,用电导率仪实时监测反应终点。NH3吸收结束后,升高炉温到570 ℃,通入一定量的水蒸气,反应一定时间,放出的HCl同样用水吸收,反应结束后用少量惰性气体进行吹扫。NH3和HCl分别用水吸收后,采用酸碱滴定法进行浓度测定,并用电导率仪进行交叉验证。
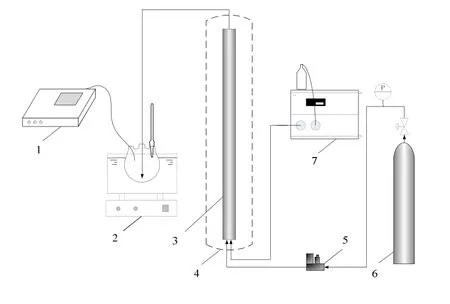
图8 实验装置Fig.8 Experimental apparatus
在进行吸附剂评价实验时,粉末氧化镁与氯化铵的物质的量比取为1.5:1,颗粒氧化镁与氯化铵的物质的量比取为5:1,氧化镁过量是为了使氯化铵分解与吸收更为完全,颗粒吸附剂取更大的物质的量比一方面是因为颗粒的反应活性低于粉末,同时也为了便于将吸附剂作为热载体使用。实验表明,更大的物质的量比对改进分解反应的转化率与选择性作用不大。
3 结果与讨论
3.1 氯化铵热分解曲线分析
氯化铵分解反应、释氨反应的热重分析结果(TGA)如图9(a)和9(b)所示。由图可以看出,NH4Cl在升温到320 ℃左右全部分解完;而图9(b)中,失重主要发生在190~410 ℃,且在300 ℃分解速率最大。若NH4Cl完全分解,且HCl不被MgO吸收,则失重百分数应为52.7%;若HCl完全被MgO吸收,则失重百分数应为16.7%。图中400 ℃以下反应物失重30%,说明在热重实验中由于两种物质接触不充分,NH4Cl放出的HCl只有63.2%被MgO吸收。因此,失重的温度范围与之前的热力学分析吻合,而MgO吸收HCl的效率取决于两种反应物的混合与接触效率。

图9 氯化铵分解反应、释氨反应和释氯反应的热重分析结果Fig.9 TGA curves of NH4Cl decomposition, releasing NH3and releasing HCl reactions
释氯反应的结果如图9(c)所示。可以看到,固体的热分解主要发生在410~570 ℃,失重百分数为32%左右,且在490 ℃分解速率最大。计算得到HCl全部释放的失重为32.4%,因此几乎全部的HCl在加热后被释放出,MgOHCl失重的温度范围也与之前的热力学分析一致。
3.2 释氨反应产物测定结果及分析
NH4Cl和MgO混合物在350 ℃下加热1 h所得产物的XRD结果如图10所示。可以看出,只有MgOHCl(A)和MgO(B)特征峰存在。因此,释氨反应结束后,产物只有MgOHCl和过量的MgO,并无MgCl2存在,结果与之前的热力学分析一致。
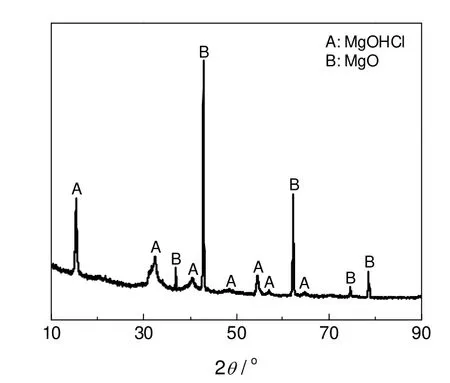
图10 NH4Cl-MgO的XRD图谱Fig.10 X-ray diffraction pattern of NH4Cl-MgO
3.3 氧化镁吸附剂的物理性质
3.3.1 氧化镁吸附剂的XRD分析
轻质氧化镁一般由MgCl2、MgSO4、MgHCO3经溶解、沉淀、煅烧而得,重质氧化镁主要由菱镁矿、水镁石矿直接煅烧而成。
各MgO吸附剂的XRD谱图示于图11。由图可知,它们的XRD衍射峰几乎完全相同,由此可以认为不同氧化镁在氯化铵分解反应中的活性差别不是由晶型结构引起的。
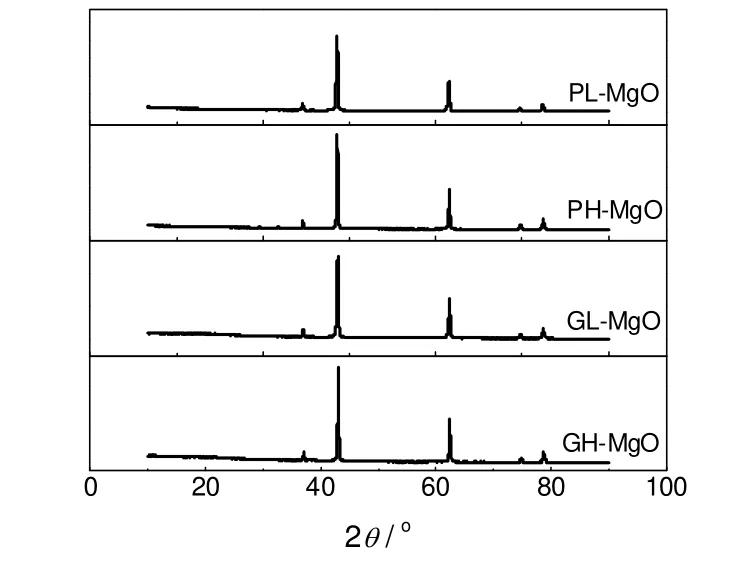
图11 各氧化镁吸附剂的XRD图谱Fig.11 XRD diffractograms of different MgO absorbents
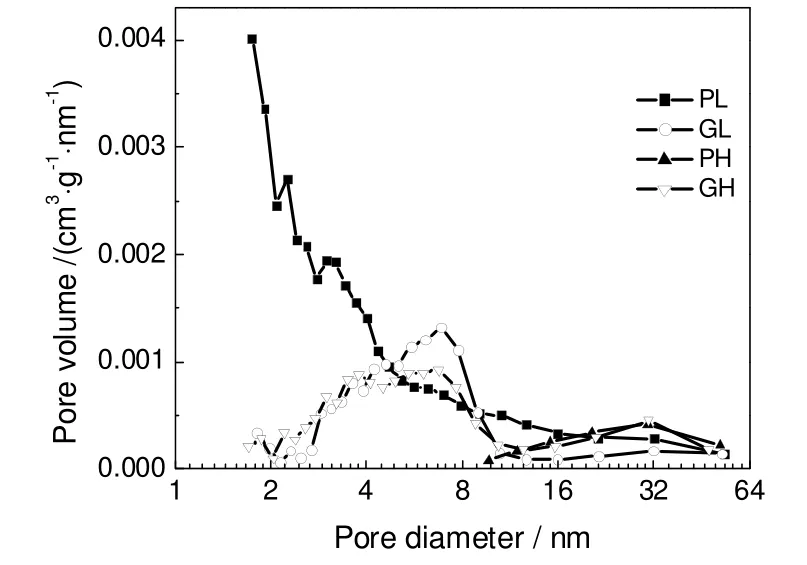
图12 各MgO吸附剂的孔径分布Fig.12 Morphological properties of various MgO absorbents
3.3.2 氧化镁吸附剂的孔结构
表1列出了各MgO的比表面积与孔容,图12为其孔径分布图。由比表面积数据可以看出,粉末状轻质MgO(PL)的比表面积相对较高,而粉末状重质MgO(PH)的比表面积最低。从孔径分布图中可以观察到,粉末状轻质MgO(PL)的孔径分布主要集中在15 nm以下,且有部分小于2 nm的微孔存在。颗粒状轻质MgO(GL)和颗粒状重质MgO(GH)的孔径分布较窄,主要集中在2~10 nm,属中孔的范围。而粉末状重质MgO的孔径分布较宽,主要在2~50 nm。由于微孔吸附剂的主要参数是微孔孔径和微孔容积,而中孔吸附剂最重要的参数是比表面,它决定了吸附量的大小。因此可以认为是比表面积的大小决定了不同MgO吸附剂与NH4Cl反应吸收HCl气体的能力。
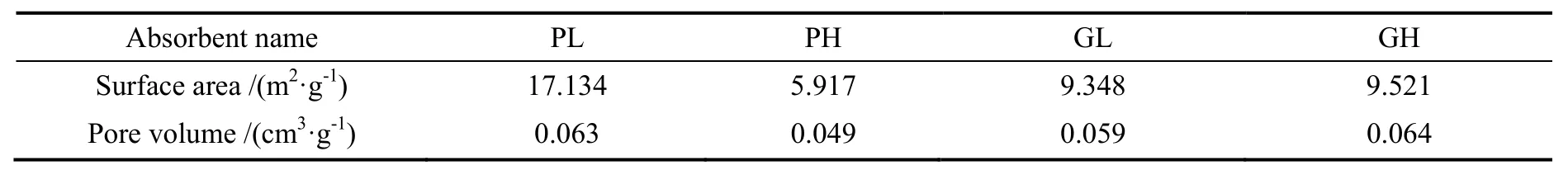
表1 各MgO吸附剂的比表面积与孔容Table 1 Morphological properties of various MgO absorbents
3.4 氧化镁吸附剂的反应活性
采用物质的量比1.5:1的粉末状氧化镁和氯化铵,以及5:1的颗粒状氧化镁和氯化铵进行氯化铵分解实验评价。由图13可以看出,粉末状轻质氧化镁作为吸附剂时,NH3和HCl的收率和反应速率均为最高,两种气体的收率均达到90%左右;其次是颗粒状轻质氧化镁,粉末状重质氧化镁表现出的反应活性最低。由此可知,轻质氧化镁的反应活性总体高于重质氧化镁。
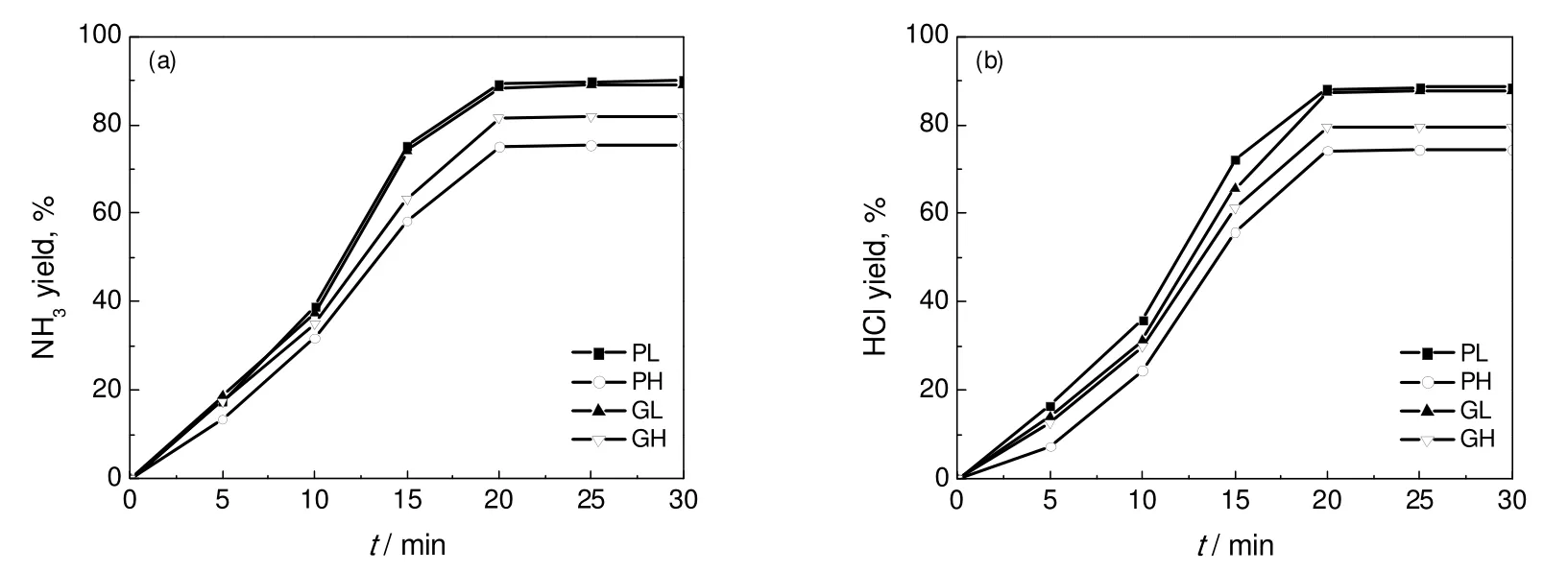
图13 采用不同MgO所得的NH3和HCl收率Fig.13 NH3and HCl yields by using different MgO absorbents
3.5 含水量的影响
实验选择反应活性最高的粉末状轻质氧化镁在固定床中与氯化铵反应来确定水蒸气气氛对气体收率的影响。由于微量泵最小量程的限制,水蒸气与NH4Cl比从1.2:1开始增大。由图14可以看出,随着水蒸气与NH4Cl比值的增大,NH3的收率并无明显变化,均在85%以上;而HCl的收率则从11%增加到80%以上,当物质的量比在1以上时,HCl收率变化不大。这与之前的热力学分析吻合,水蒸气气氛对释氨反应无明显影响,但在释氯反应过程中起着至关重要的作用。
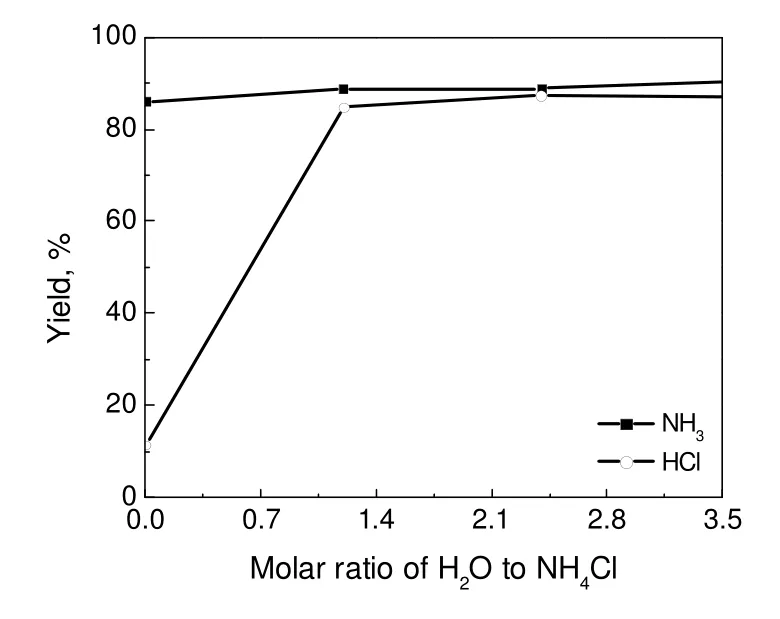
图14 水蒸气量对NH3和HCl收率的影响Fig.14 Effects of water vapor amount on the NH3and HCl yields
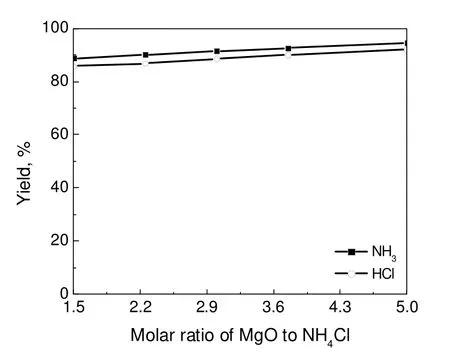
图15 MgO与NH4Cl的物质的量比对NH3和HCl收率的影响Fig.15 Effects of molar ratios on the NH3and HCl yields
3.6 氧化镁与氯化铵物质的量比的影响
图15给出了两种气体收率与粉末状轻质MgO:NH4Cl(物质的量比)之间的关系。随着物质的量比增大,NH3和HCl的收率逐渐增加,其原因可能是MgO的增加提高了NH4Cl在MgO中的分散程度,同时提供了更多的接触表面积供HCl气体的吸收。这也进一步说明提高MgO的比表面积及其与NH4Cl的混合与接触效率是化学环过程的关键工程因素。
3.7 氧化镁吸附剂循环次数的影响
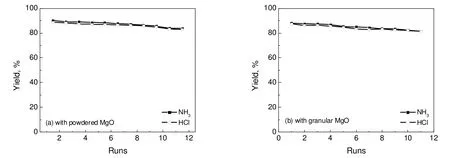
图16 循环使用次数对NH3和HCl收率的影响Fig.16 Effects of cyclic times on the NH3and HCl yields
图16为吸附剂循环次数对NH3和HCl收率的影响。第1次反应后的每次实验都加入与第1次相同量的氯化铵,混合均匀进行反应,粉末氧化镁与氯化铵的物质的量比保持1.5:1,颗粒状的物质的量比保持5:1。由图16可知,在11次循环使用过程中,吸附剂反应活性在逐渐降低但幅度不大。循环11次后,粉末氧化镁产生的氨气与氯化氢收率分别为83.8%和83.0%,与新鲜吸附剂相比分别降低了6.9%和6.3%;使用颗粒状氧化镁时,氨气与氯化氢收率分别为81.5%和81.3%,与新鲜吸附剂相比分别降低了7.6%和6.9%。因此,在连续化工业分离过程中,只需要抽出一小部分吸附剂进行再活化后返回系统,就可以保持吸附剂的活性恒定。常用的活化方法是沉淀煅烧法,即先将部分失活的MgO水化反应生成Mg(OH)2,随后在高温下煅烧使Mg(OH)2分解为MgO[25],反应式为

4 结 论
通过热力学分析与固定床实验,提出了化学环法分解氯化铵的工艺,以此为核心,将纯碱与氯乙烯两大过程集成为一个无CO2排放又无电解过程的清洁生产新工艺。主要结论有:
a)热力学分析表明,采用MgO与NH4Cl进行两步反应分别释放出NH3和HCl气体的过程是可行的。释氨反应的合适温度为350 ℃,释氯反应的合适温度为570 ℃,同时需要添加适量水蒸气(水氨比大于0.6)以防止MgCl2的生成。
b)针对4种MgO吸附剂的评价与表征表明:粉末状轻质MgO活性最高,而颗粒状重质MgO活性最低,粉末MgO与NH4Cl比应大于1.5,颗粒状比应大于5,这种条件下NH3和HCl的单程收率分别可以达到90与85%左右。吸附剂可以多次循环使用,其活性虽略有降低,但可通过再活化予以提高。
c)实验表明,决定吸附剂活性的关键因素是比表面积与孔容,提高分离效率的主要工程措施是强化吸附剂与NH4Cl的混合效率与气固接触效率。
[1] 陈 杰. 国内外聚氯乙烯工业生产技术进展 [J]. 当代石油石化, 2002, 10(3):17-22. Chen Jie. Process in PVC production technologies home and abroad [J]. Petroleum & Petrochemical Today, 2002, 10(3):17-22.
[2] 高旭东. 电石路线氯乙烯生产技术新进展 [J]. 聚氯乙烯, 2011, 39(9):1-8. Gao Xudong. Recent technological progress in production of vinyl chloride by calcium carbide process [J]. Polyvinyl Chloride, 2011, 39(9):1-8
[3] 薛祖源. 电石法/乙烯法生产聚氯乙烯技术经济分析, 建议和展望 [J]. 现代化工, 2009, 29(12):12-19. Xue Zuyuan. Techno-commercial evaluation,advice and outlook of PVC production by two process routes using carbide/ethylene as raw materials [J]. Modern Chemical Industry, 2009, 29(12):12-19.
[4] 王旭东, 吴 敏. 氯化铵转化与资源综合利用 [J]. 化工生产与技术, 2008, 15(1):41-43. Wang Xudong, Wu Min. Conversion of ammonium chloride and resource comprehensive utilization [J]. Chemical Production and Technology, 2008, 15(1):41-43.
[5] 曾凤春. 氯化铵转化技术现状及展望 [J]. 无机盐工业, 2009, 41(9):1-3. Zeng Fengchun. Current situation and prospect for conversion technology of ammonium chloride [J]. Inorganic Chemicals Industry, 2009, 41(9):1-3.
[6] 邵玉昌. 氯化铵的反应及应用 [J]. 纯碱工业, 2008, (4):3-12. Shao Yuchang. Reaction and application of ammonium chloride [J]. Soda Industry, 2008, (4): 3-12
[7] Hiromi S, Yoshiyuki T. Process for producing hydrogen chloride and ammonia: US, 154,469[P]. 1981-10-06.
[8] 刘长飞. 一种分解氯化铵制取氨及氯化氢气体的方法: 中国, 200710143384.2 [P]. 2008-01-09.
[9] Andel E. An electrolysis-free route to vinyl chloride monomer and soda ash [J]. Chemistry and Industry, 1983, 21(1):139-141.
[10] Alfred C, Dieter B, Kurt K, et al. Method for preparing ammonia and hydrogen chloride from ammonium chloride: US, 191269 [P]. 1981-12-15.
[11] Fuchsman C H. Method of recovering ammonia from ammonium chloride: US, 2823981 [P]. 1958-02-18.
[12] 翟广伟, 韩明汉, 梁耀彰, 等. 氯化铵分解制氨气和氯化氢工艺 [J]. 过程工程学报, 2009, 9(1):59-62. Zhai Guangwei, Han Minghan, Liang Yaozhang, et al. Decomposition of ammonium chloride for production of ammonia and hydrogen chloride [J]. The Chinese Journal of Process Engineering, 2009, 9(1):59-62.
[13] 罗 弦, 曾 波, 赵 香. 利用氧化镁热分解氯化铵制氨气工艺的研究 [J]. 现代化工, 2011, 31(9):83-85. Luo Xian, Zeng Bo, Zhao Xiang. Research of NH3 production by thermal decomposition NH4Cl with MgO [J]. Modern Chemical Industry, 2011, 31(9):83-85
[14] 李渝生, 张光友, 蔺学猛. 分解氯化铵的新方法: 中国, 85108709.4 [P]. 1986-09-03.
[15] Lyngfelt A, Leckner B, Mattisson T. A fluidized-bed combustion process with inherent CO2separation; application of chemical-looping combustion [J]. Chemical Engineering Science, 2001, 56(10):3101-3113.
[16] Moghtaderi B. Application of chemical looping concept for air separation at high temperature [J]. Energy & Fuels, 2010, 24(1):190-198. [17] Ishida M, Takeshita K, Suzuki K, et al. Application of Fe2O3-Al2O3composite particals as solid looping material of the chemical-looping combustor [J]. Energy & Fuels, 2005, 19:2514-2518.
[18] Qin C, Yin J, Liu W, et al. Behavior of CaO/CuO based composite in a combined calcium and copper chemical looping process [J]. Industrial & Engineering Chemistry Research, 2012, 51(38):12274-12281.
[19] Fan L S, Li F. Chemical looping technology and its fossil energy conversion applications [J]. Industrial & Engineering Chemistry Research, 2010, 49(21):10200-10211.
[20] Mattisson T, Lyngfelt A, Leion H. Chemical-looping with oxygen uncoupling for combustion of solid fuels [J]. International Journal of Greenhouse Gas Control, 2009, 3(1):11-19.
[21] Noorman S, Gallucci F, Sint A M, et al. Experimental investigation of a CuO/Al2O3oxygen carrier for chemical-looping combustion [J]. Industrial & Engineering Chemistry Research, 2010, 49(20):9720-9728.
[22] Ramkumar S, Phalak N, Fan L S. Calcium looping process (CLP) for enhanced steam methane reforming [J]. Industrial & Engineering Chemistry Research, 2012, 51(3):1186-1192.
[23] Phalak N, Ramkumar S, Deshpande N, et al. Calcium looping process for clean coal conversion: design and operation of the subpilot-scale carbonator [J]. Industrial & Engineering Chemistry Research, 2012, 51(30):9938-9944.
[24] Ramkumar S, Iyer M V., Fan L S. Calcium looping process for enhanced catalytic hydrogen production with integrated carbon dioxide and sulfur capture [J]. Industrial & Engineering Chemistry Research, 2010, 50(3):1716-1729.
[25] Sun Z, Yu F, Li F, et al. Experimental study of HCl capture using CaO sorbents: activation, deactivation, reactivation, and ionic transfer mechanism [J]. Industrial & Engineering Chemistry Research, 2011, 50(10):6034-6043.
The Integrated Cleaning Process of Soda and Vinyl Chloride on the Chemical Looping of NH4Cl Decomposition
Luo Bei’er, Zhu Qibin, Cheng Youwei, Wang Lijun, Li Xi
College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
Based on the chemical looping decomposition of NH4Cl, soda ash and vinyl chloride processes can be integrated as a new clean process with no CO2emission and free of electrolysis. Thermodynamic analysis (with HSC software) using MgO for NH4Cl two-step decomposition reaction to release NH3and HCl was conducted. The calculation results verified the feasibility of the process, and the optimum conditions were found to be as follows: 350 ℃ for releasing NH3reaction, 570 ℃ for releasing HCl reaction, the molar ratio of water vapor to NH4Cl is above 0.6. Experiments were carried out in a fixed-bed reactor, and various MgO absorbents were screened. The results show that high yield of NH3and HCl can be obtained, and the powdered light MgO has the highest activity, while the powdered heavy MgO has the lowest, which is mainly affected by their morphological properties, such as surface area and pore structure. Moreover, MgO absorbents can be repeatedly used for several times with relatively high activity.
ammonium chloride; magnesium oxide; chemical looping; soda ash; chlorethylene; process integration
TQ126.2; TQ113.7
A
1001—7631 ( 2015 ) 05—0449—10
2014-04-18;
: 2014-05-13。
罗蓓尔(1989—),女,硕士研究生;成有为(1977—),男,副教授,通讯联系人。E-mail:ywcheng@zju.edu.cn。

