图像引导自适应放疗在肺癌治疗中剂量学研究
方金梅,王凡
图像引导自适应放疗在肺癌治疗中剂量学研究
方金梅,王凡
收集6例肺癌患者,在放疗过程中每完成10次分次治疗后,重新扫描、设计计划,并将新计划应用于下一阶段治疗。经过3个阶段放疗后,肿瘤体积缩减(65.59± 17.09)%。3种计划中肿瘤靶区的剂量差异无统计学意义。自适应放疗计划(ART)与调强放疗(IMRT)相比,全肺V20、V30、肺平均剂量(MLD)分别减少2.01%、2.66%、241.78 cGy(P=0.005、0.039、0.026);ART2同ART1相比,全肺V20、V30、MLD分别减少3.21%、2.97%、288.64 cGy(P=0.005、0.013、0.046)。患侧肺V20、V30、MLD减少差异有统计学意义(P<0.05),而健侧肺指标差异无统计学意义。心脏的V50和Dmean、食管的V55差异无统计学意义。ART1与IMRT、ART2与ART1相比,食管的Dmean平均分别减少261.98 cGy(P=0.002)、300.43 cGy(P=0.008)。脊髓的D2%和Dmean也依次降低,差异有统计学意义(P<0.05)。
自适应放疗;肺癌;剂量学
目前,放疗已成为很多不能耐受或不愿接受手术治疗、局部晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的治疗手段。高剂量放疗可提高局部控制率和总生存率,但周围正常组织对射线的敏感性限制了放疗剂量。另外,治疗过程中肿瘤与周围组织相对位置改变,使初始计划与实际肿瘤不再适形,剂量分布的精准性下降,得不到满意的局控率,并产生更多的放疗不良反应。自适应放疗计划(adaptive radiotherapy,ART)是一种四维治疗过程,即在三维适形放疗的基础上再考虑时间相位,多次采集患者的图像资料,旨在根据治疗过程中的变化修改放疗计划[1],动态实现剂量验证、剂量重建和剂量再优化。
1 材料与方法
1.1 病例资料 收集安徽医科大学第一附属医院肿瘤放疗科2013年8月~2014年2月6例男性肺癌患者,年龄52~87(65.6±13.1)岁。其中2例病
理证实(1例低分化癌、1例鳞癌),4例PET-CT支持[肿块SUV 8.3~24.6(13.2±6.6)]。左肺1例,右肺4例,纵隔型1例。周围型3例,中央型2例,纵隔型1例。按照2010年NCCN分期,ⅡB期2例,ⅢA期1例,ⅢB期2例,Ⅳ期1例。
1.2 体位固定、CT扫描及勾画靶区采用真空垫体膜固定,仰卧位,双手上举交叉抱肘放于额头上,采用西门子滑轨CT系统扫描,层厚为5 mm,范围由锁骨头上5 cm至肋膈角。扫描CT通过网络传输至Pinncle39.2 TPS计划工作站,勾画靶区定义:①大体肿瘤体积(gross tumor volume,GTV)为肺窗(窗宽1 600,窗位-600)中所见的肿瘤范围和纵隔窗(窗宽400,窗位20)中所见的纵隔受累范围,根据PET-CT、CT等勾画原发病灶及纵隔阳性淋巴结,淋巴结短径>10 mm定义为阳性淋巴结。②临床靶区(clinical tumor volume,CTV):鳞癌患者将GTV外扩6 mm形成CTV,病理类型不详的根据肿瘤部位外扩6~8 mm形成CTV,纵向外放10 mm,可根据靶区周围正常结构情况适当修改。③计划靶区(planning target volume,PTV):PTV=CTV+内在靶体积(internal target volume,ITV)+外放5 mm。其中ITV为CTV在头尾方向、内外方向、前后方向的随呼吸运动幅度。④危及器官(organ at risk,OAR)包括双肺、心脏、脊髓和食管。肺和心脏作为并型器官,勾画全器官、食管和脊髓视为串型器官,在肺部肿瘤及纵隔阳性淋巴结的PTV上下界各放4层即2.0 cm。
1.3 计划设计及调整计划6例患者均行常规分割放疗,200 cGy/次,一周6次,处方剂量为58~66 Gy,中位剂量为63 Gy。采用逆向设计,设4~5个固定适形野,射野角度尽可能避开周围重要剂量限制器官。计划优化限制条件:①靶区剂量限制:95%PTV达到处方剂量。②OAR剂量限制:双肺V20<30%、V30<20%、心脏V40<30%、食管V55<50%、脊髓Dmax<40 Gy。③不进行淋巴结引流区域预防性照射。初始10次分次治疗为调强放疗(intensity modulated radiation therapy,IMRT),于10次分次治疗后、20次分次治疗后重新扫描CT、制定计划,限制条件同上,分别记为ART1和ART2,并应用于第2阶段(第11~20次)和第3阶段(第21次~结束)的治疗。治疗采用SIEMENS Artiste医用电子直线加速器。
1.4 计划评价指标利用剂量-体积直方图对3个阶段计划的靶区和OAR予以评估。①肺部病灶:GTV体积、近似最大剂量(D2%),近似最小剂量(D98%),平均剂量(Dmean),中位剂量(D50%),至少接受相应处方剂量水平照射的体积百分比(V95)。靶区剂量均匀性指数(homogeneity index,HI):HI=D5%/D95%。②OARs:正常肺组织V10~V30、肺平均剂量(mean lung dose,MLD),心脏Dmean和V50,食管V55、Dmean,脊髓Dmax、D2%和Dmean。其中D50%表示待评价器官50%体积所接受的剂量值,V20表示待评价器官接受20 Gy的体积百分比,以此类推。
1.5 统计学处理采用SPSS 19.0统计软件进行分析,数据以±s表示,每两组间使用配对t检验分析。
2 结果
2.1 肿瘤靶区体积1例患者经过IMRT治疗后靶区体积增加1.62%,考虑为肿瘤细胞水肿所致,其余均逐渐缩小。治疗前及经IMRT、ART1、ART2治疗后,GTV体积分别为(320.78±250.12)、(248.90 ±256.90)、(166.10±148.38)、(102.50±100.77)cm3;同治疗前相比,经IMRT、ART1、ART2治疗后,肿瘤缩减幅度分别为(30.54±24.07)%、(47.93± 22.76)%、(65.59±17.09)%。
2.2 靶区剂量分布3个阶段计划肿瘤靶区的D2%、D50%、D95%、D98%、Dmean、HI差异无统计学意义,HI有逐渐减小的趋势。见表1。
表1 3种治疗计划中靶区的剂量学指标(±s)
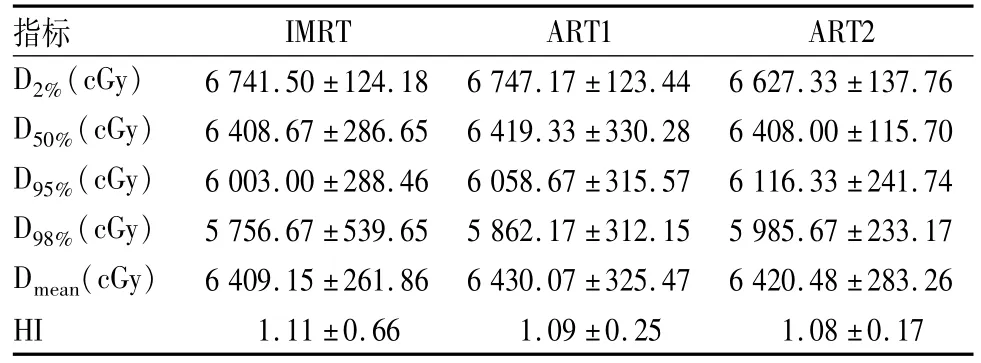
表1 3种治疗计划中靶区的剂量学指标(±s)
指标IMRTART1ART2 D2%(cGy)6 741.50±124.186 747.17±123.446 627.33±137.76 D50%(cGy)6 408.67±286.656 419.33±330.286 408.00±115.70 D95%(cGy)6 003.00±288.466 058.67±315.576 116.33±241.74 D98%(cGy)5 756.67±539.655 862.17±312.155 985.67±233.17 Dmean(cGy)6 409.15±261.866 430.07±325.476 420.48±283.26 HI1.11±0.661.09±0.251.08±0.17
2.3 OAR剂量分布患侧肺和全肺V10~V30、MLD结果显示ART2<ART1<IMRT,差异有统计学意义(P<0.01,P<0.05);而健侧肺指标差异无统计学意义。心脏V50和Dmean差异无统计学意义。食管V55有逐渐下降的趋势,但差异无统计学意义;食管Dmean在3个阶段治疗中逐渐降低,差异均有统计学意义(P<0.01)。脊髓Dmax、D2%及Dmean也依次降低,差异有统计学意义(P<0.05)。见表2。
表2 3次计划中OAR的剂量学指标(±s)

表2 3次计划中OAR的剂量学指标(±s)
与IMRT比较:*P<0.05,**P<0.01;与ART1比较:#P<0.05,##P<0.01
OARIMRTART1ART2患侧肺V10(%)54.94±9.7650.41±8.01*47.38±8.37*##V20(%)38.62±7.8332.62±5.20*28.25±7.43*##V30(%)28.17±4.5721.20±4.12*17.31±4.48*##MLD(cGy)1 935.68±332.691 658.54±242.31*1 461.74±229.74*##健侧肺V10(%)17.24±11.8310.97±8.5211.40±9.49#V20(%)2.22±2.880.84±1.060.98±1.39 V30(%)0.72±1.430.13±0.250.11±0.20 MLD(cGy)532.52±243.77465.92±212.74425.68±195.79##全肺V10(%)35.12±9.9932.05±10.65*27.34±9.36*##V20(%)18.39±4.8116.38±4.35**13.17±4.12**##V30(%)13.23±2.8310.57±1.88*7.60±1.49*##MLD(cGy)1 369.72±213.971 127.94±274.07*839.30±222.44*##心脏V50(%)2.04±2.361.69±3.130.66±1.28 Dmean(cGy)728.28±290.10812.48±395.04681.08±302.29食管V55(%)11.11±19.167.26±13.123.27±7.84 Dmean(cGy)2 359.98±928.452 098.00±884.28**1 797.57±793.84**##脊髓Dmax(cGy)3 868.13±1 628.013 315.95±1 295.17*2 856.45±1 255.52#D2%(cGy)3 408.00±1 302.512 946.00±1 147.58*2 554.67±1 162.58*#Dmean(cGy)2 046.57±918.451 733.30±781.34*1 399.65±689.65*#
3 讨论
以放疗为主的综合治疗已成为不能手术的NSCLC患者的首选治疗方案,但肺癌患者的5年生存率仅为5%~40%[2],三维造形放疗及IMRT技术广泛应用于NSCLC患者,提高了放疗的精准性,但却未考虑到靶区及周围正常组织在治疗过程中的动态变化。ART技术突破局限性,根据治疗过程中的反馈信息重新计划,保护正常组织的同时,使靶器官剂量和局控率达到最大[3]。
6例患者经过3个阶段治疗后GTV体积逐渐缩小。研究[4]中NSCLC患者在15次分次治疗及疗程结束后GTV体积分别缩减40.2%、51.1%。本研究的3个阶段中肿瘤靶区D2%、D95%、D98%及Dmean差异无统计学意义。侯勇等[5]对5例肺癌患者分别行ART及3DCRT治疗,发现肿瘤Dmean、D95%相似。本研究中HI逐渐减小,表明ART技术使剂量分布更加均匀,HI差异无统计学意义,可能与样本量小有关。肺部肿瘤放疗剂量的主要限制因素是射线对正常组织造成的损伤,包括肺、食管、心脏及脊髓。Tucker et al[6]指出全肺的Dmean与放射性肺损伤的发生及严重程度密切相关,王谨等[7]则认为全肺V5、V10、V20、V30是预测放射性肺损伤的良好指标,而健侧肺MLD、V20、V30无预测价值,并指出预测时需多种参数联合使用。本研究的3个阶段计划中,患侧肺及全肺V10、V20、V30、MLD逐渐减少,差异有统计学意义,健侧肺剂量指标差异无统计学意义。提示ART降低全肺的剂量主要通过减少患侧肺的剂量来实现。心血管损伤的发病率与剂量呈正相关[8]。本研究结果显示心脏V50和Dmean差异无统计学意义,在6例患者共18个阶段治疗中,心脏V50最大值为8.00%,Dmean最大值为1 264.0 cGy,远远小于心脏剂量限制。本研究采用V55[9]及Dmean作为评价食管损伤的指标,结果显示3个阶段食管V55差异无统计学意义,但食管Dmean逐渐降低,且差异有统计学意义,表明在肺癌放疗中应用ART技术可以保护食管。脊髓剂量参数中,除ART1与IMRT的Dmax相比差异无统计学意义,其余差异均有统计学意义,说明ART技术可以减少脊髓剂量。本研究中有1例患者实行在线ART,总用时50 min,若能进一步减少在线计划时间,将给患者带来怎样的益处,值得进一步探讨和研究。
ART技术利用治疗过程中的反馈信息,重新制定计划,在未降低靶区剂量的同时,有效减低了正常组织的剂量,但最终能否增加局控率及改善预后,需要更大样本的研究和长期随访结果验证。
[1] Simone C B 2nd,Ly D,Dan T D,et al.Comparison of intensitymodulated radiotherapy,adaptive radiotherapy proton radiotherapy,and adaptive proton radiotherapy for treatment of locally advanced head and neck cancer[J].Radiother Oncol,2011,101(3):376-82.
[2] Sonke J J,Belderbos J.Adaptive radiotherapy for lung cancer[J].Semin Radiat Oncol,2010,20(2):94-106.
[3] Kataria T,Gupta D,Bisht S S,et al.Adaptive radiotherapy in lung cancer:dosimetric benefits and clinical outcome[J].Br J Radiol,2014,87(1038):20130643.
[4] Lim G,Bezjak A,Higgins J,et al.Tumor regression and positional changes in non-small cell lung cancer during radical radiotherapy[J].J Thorac Oncol,2011,6(3):531-6.
[5] 侯 勇,尹 勇,王鹏程,等.基于KVCBCT形变配准的肺癌自适应计划与静态3DCRT计划的比较研究[J].中华放射肿瘤学杂志,2012,21(3):267-70.
[6] Tucker S L,Jin H,Wei X,et al.Impact of toxicity grade and scoring system on the relationship between mean lung dose and risk of radiation pneumonitis in a large cohort of patients with non-small cell lung cancer[J].Int J Radiat Oncol Biol Phys,2010,77(3):691-8.
[7] 王 谨,庄婷婷,何智纯,等.非小细胞肺癌同期放化疗后重度急性放射性肺炎的预测因素[J].中华放射肿瘤学杂志,2012,21(4):326-9.
[8] Gagliardi G,Constine L S,Moiseenko V,et al.Radiation dosevolume effects in the heart[J].Int J Radiat Oncol Biol Phys,2010,76(3 Suppl):S77-85.
[9] Zhang Z C,Xu J,Li B S.et al.Clinical and dosimetric risk factors of acute esophagitis in patients treated with 3-dimensional conformal radiotherapy for non-small-cell lung cancer[J].Am J Clin Oncol,2010,33(3):271-5.
Dosimetric study of adaptive radiotherapy in lung cancer
Fang Jinmei,Wang Fan
(Dept of Radiation Oncology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Six patients with lung cancer treated with therapy were included.They were retrieved the image and replanned by fraction 10.The volume of GTV was reduced(65.59±17.09)%after three-stage treatments.The doses of target tumor were the same in three-stage treatments.Compared with IMRT,ART1 reduced V20,V30,MLD of whole lung by 2.01%,2.66%,241.78 cGy(P=0.005,0.039,0.026).Compared with ART1,ART2 further reduced the indexes by 3.21%,2.97%,288.64 cGy(P=0.005,0.013,0.046).The doses of ipsilateral lung were reduced significantly(P<0.05).But this was not for opposite lung.The dose V50,Dmeanof heart and V55of esophagus were similar to each plan.Dmeanof esophagus with ART1 was smaller than with IMRT(261.98 cGy,P=0.002)and Dmeanof esophagus with ART2 was smaller than with ART1(300.43 cGy,P=0.008).D2%and Dmeanof spinal cord were reduced in turn significantly(P<0.05).
adaptive radiotherapy;lung cancer;dosimetry
R 730.55
1000-1492(2015)02-0247-03
2014-09-28接收
安徽医科大学第一附属医院肿瘤放疗科,合肥 230022作者简介:方金梅,女,硕士研究生;
王 凡,男,教授,主任医师,硕士生导师,责任作者,E-mail:wangfan1965@126.com

