广州地区6 000例羊水细胞染色体核型分析及其产前诊断价值探讨
刘海波,丘文君,郑育红,赖炜强,孙筱放
(广州医科大学附属第三医院妇产科研究所实验室/广东省产科重大疾病实验室,广州 510150)
·论 著·
广州地区6 000例羊水细胞染色体核型分析及其产前诊断价值探讨
刘海波,丘文君,郑育红,赖炜强,孙筱放△
(广州医科大学附属第三医院妇产科研究所实验室/广东省产科重大疾病实验室,广州 510150)
目的 分析羊水细胞染色体,比较不同异常核型的发生率及其在产前诊断中的应用价值。方法选择2010年1月至2013年9月到该院就诊有产前诊断指征的孕妇6 000例,行羊膜腔穿刺术、传代法羊水细胞培养及胎儿染色体核型分析。结果6 000例羊水培养成功5 994例(99.90%),异常核型193例(3.22%)。其中,染色体数目异常108例,占异常核型的55.96%,以21三体为主,占数目异常的67.59%(73/108);结构异常60例,占异常核型的31.09%,其中平衡性结构重排38例(19.69%),非平衡性结构重排22例(11.40%);嵌合体25例(12.95%)。将孕妇按进行穿刺的首要指征分为6组,血清学筛查高风险组和高龄组分别占受检人数41.62%和33.70%,B超检查示胎儿异常组和夫妇一方染色体异常组的核型异常检出率分别为5.56%和20.00%,与其他组比较差异有统计学意义(P<0.05)。结论传代法羊水细胞体外培养对核型分析具有实用性。羊水染色体核型分析是安全、有效的诊断胎儿染色体病的方法。
产前诊断;羊水;细胞培养;核型分析
染色体病是一种常见的遗传病,新生儿的染色体异常率为0.5%~0.7%[1-2]。产前诊断是早期发现遗传异常胎儿的有效措施之一,其中羊水细胞核型分析是目前国内应用最广泛、结果最直观可靠的方法之一,可以有效减少染色体病胎儿的出生。本文总结了因有产前诊断指征而在本院进行羊膜腔穿刺的广州地区6 000例孕妇的羊水细胞培养结果,以探讨传代法在羊水细胞培养中的应用及胎儿染色体异常核型出现的频率和类型与产前诊断指征的关系。
1 资料与方法
1.1 一般资料 选择2010年1月至2013年9月在本院产前诊断及遗传咨询门诊就诊,并经羊膜腔穿刺行产前诊断的孕妇6 000例,年龄19~47岁,孕周16~33周;在告知孕妇及家属进行羊水细胞染色体分析的产前诊断范围及风险,孕妇及家属签署知情同意书后,在B超定位下经腹羊膜腔穿刺;取羊水20 mL。
1.2 仪器与试剂 CO2细胞培养箱购自美国Thermo Fisher Scientific公司;染色体分析仪购自德国蔡司公司,Ikaros核型分析软件购自德国Metasystems公司;羊水培养基购自美国Gibco公司及美国Irvine Scientific公司;秋水仙素及姬姆萨染液购自广州达晖生物技术公司。
1.3 方法
1.3.1 羊水细胞培养 抽取羊水20 mL注入2个15 mL 无菌离心管中,离心弃上清液,留0.5 mL制成细胞悬液,接种于3 mL羊水培养基中,37 ℃、5%CO2培养箱中常规培养,第7天换液,第9天取出培养瓶在倒置显微镜下观察,见到较多的圆而亮的克隆细胞时进行传代,第10~13天当传代细胞长至70%~80%满度时收获。
1.3.2 染色体制片与G显带 加入秋水仙素至终浓度为0.25 μg/mL,置于37 ℃、5%CO2培养箱中继续培养3~4 h后取出细胞。0.05%胰酶消化,收集细胞。加入0.4%枸橼酸钠与0.4% Kcl按1∶1配制的低渗液1 mL,于37 ℃水浴中低渗5 min之后,进行预固定、固定、滴片。在65 ℃的烤箱中老化过夜。常规进行胰酶消化,姬姆萨染色。
1.3.3 核型分析 显带后油镜下至少计数30个分散良好的中期分裂相,同时分析至少5个染色体带纹清晰的细胞,如果发现嵌合体,至少计数100个分裂相,并收获第2瓶细胞再次进行染色体分析。对于出现染色体结构异常的病例,有必要时进行家系调查及父母染色体核型分析。诊断标准按照人类细胞遗传学国际命名(ISCN2009)标准进行。
1.3.4 分组 将6 000例胎儿根据其母亲(孕妇)不同检查指征进行分组:当孕妇年龄大于或等于35岁时,无论是否出现其他指征,均列为高龄孕妇组(2 022例);当孕妇年龄小于35岁,血清学筛查提示高危时,无论是否出现其他指征,均列为唐氏筛查高风险组(2 497例);当孕妇年龄小于35岁,血清学筛查提示低危,而超声筛查出现异常征象时,无论是否合并其他指征,均列为B超提示异常组(486例);已知夫妇中有一方为染色体异常并以该指征就诊者,列为夫妇染色体异常组(55例);曾经生育过或流产过有出生缺陷或者染色体异常胎儿的,列入不良孕产史组(491例);进行X连锁单基因遗传病诊断、辅助生殖技术怀孕后染色体检查、孕期有害物接触史、低智家族史、错过血清学及超声筛查机会且孕妇要求做胎儿染色体检查者,其胎儿均列为其他因素组(449例)。
1.4 统计学处理 采用SAS9.0软件进行数据统计分析,采用Bootstrap法进行多组率的重复比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 羊水细胞培养成功率 羊水培养病例最小孕周16周,最大孕周33周,胎粪样羊水29例,血性羊水103例。6 000例羊水有6例培养失败,成功率为99.90%。培养失败的6例患者2周后再次进行穿刺抽取羊水培养,核型分析结果均为正常。
2.2 各组胎儿异常核型种类、构成及检出率 由表1可见,6 000例受检孕妇中,共检出异常核型193例,检出率为3.22%。高龄组和唐氏筛查高风险组的受检人数分别占33.70%和41.62%。B超提示异常组和夫妇染色体异常组的异常核型检出率分别为5.56%和20.00%,明显高于其他各组(P<0.05)。高龄组检出异常核型68例,血清学筛查高风险组检出异常核型72例,分别占总异常核型的35.23%和37.31%,占总异常核型的72.54%。
2.3 异常核型种类及发生率 由表2可见,在检出的193例异常核型中,染色体数目异常108例,占异常核型的55.96%,非整倍体占绝对优势,共104例,占异常核型的53.89%。其中21三体73例(37.82%),18三体14例(7.25%),13三体3例(1.55%),性染色体三体10例(5.18%),性染色体单体4例(2.07%)。三倍体3例(1.55%),标记染色体1例(0.52%)。结构异常的病例共60例,占异常核型的31.09%。其中平衡性结构重排38例(19.69%),包括常染色体平衡易位20例,常染色体倒位7例,罗伯逊平衡易位2例和Y染色体臂间倒位9例。非平衡性结构重排22例(11.40%),其中包括常染色体增加、缺失或重复等非平衡性结构重排13例,罗伯逊易位型三体5例,X染色体非平衡性结构重排4例。嵌合体25例,占异常核型的12.95%,其中包括染色体数目异常的嵌合9例,结构异常的嵌合15例,46,XX/46,XY嵌合体1例。
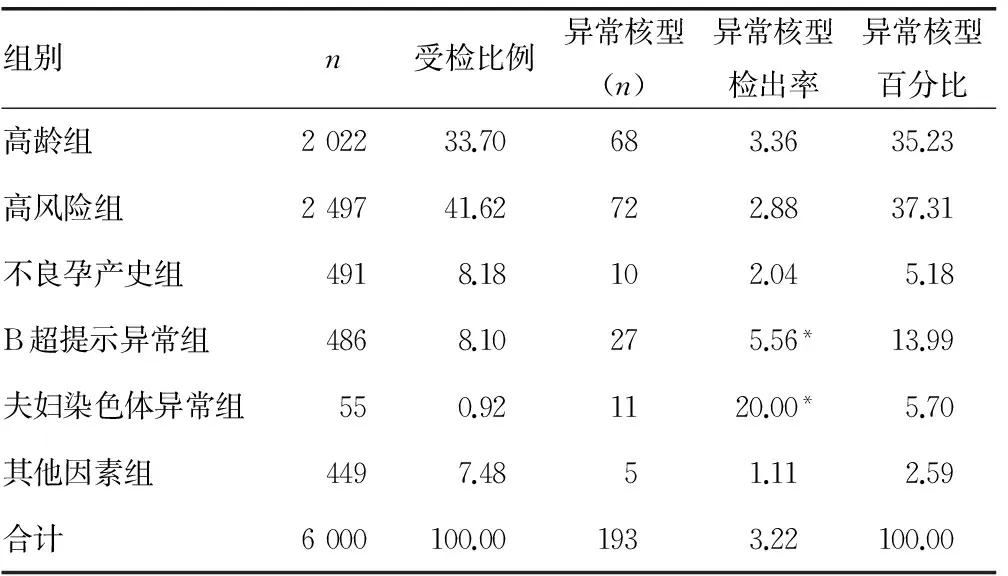
表1 6 000例产前诊断指征的分布构成比及检出率(%)
*:P<0.05,与其他各组比较。
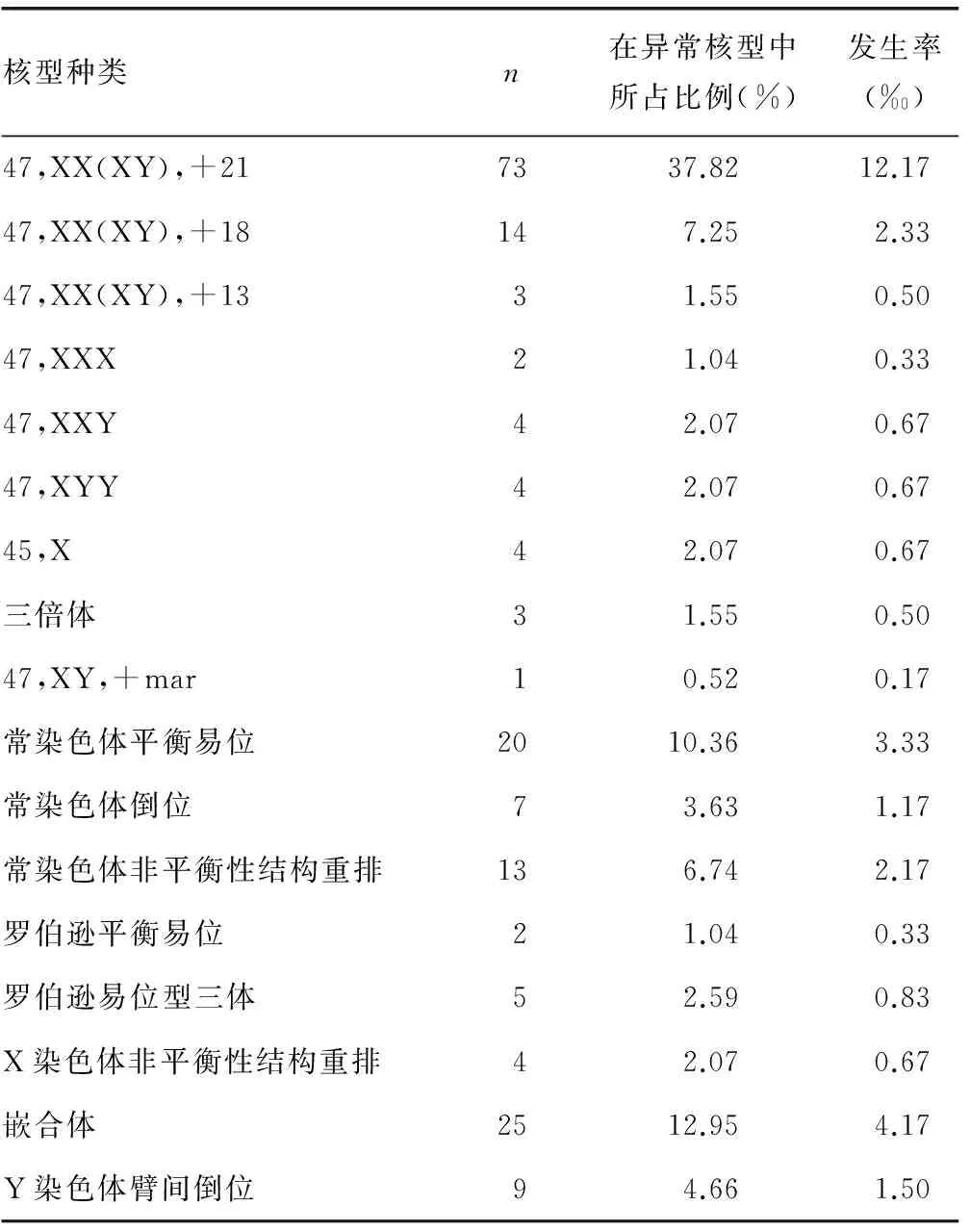
表2 193例异常核型种类和比例及其在6 000例胎儿中的发生率
2.4 按孕妇分娩年龄分组比较 按照孕妇分娩年龄分为:<35岁组,35~40岁组、>40岁组,比较3组异常核型比例,结果见表3。孕妇随年龄增加,发生染色体异常的比例增加。>40 岁组,其胎儿出现异常核型的比例高于其他两组,尤其是三体的发生率明显增加。但采用Bootstrap法进行多组率的重复比较,差异无统计学意义(P>0.05)。将35~40、>40岁两组合并为大于或等于35岁组,与小于35岁组比较,差异仍无统计学意义(P>0.05)。

表3 不同年龄组异常核型检出情况比较(n)
3 讨 论
本研究中胎儿羊水染色体异常检出率为3.22%,与汤丽霞等[3]报道佛山地区的异常检出率3.4%,李丹等[4]报道北京地区的异常检出率2.84%,陈雪等[5]报道兰州地区的异常检出率3.89%,孙立宁等[6]报道山东潍坊地区的异常核型检出率3.32%,张月萍等[7]报道上海地区的异常检出率2.81%,以及文献[8]报道相似,高出新生儿染色体异常率5~6倍。说明以上各地区之间符合产前诊断指征的孕中期羊水的染色体异常率相近。与本院2年前报道的2.75%的检出率相比较有所提高。说明有针对性的产前诊断可有效地诊断染色体病,减少出生缺陷的发生,严格把控羊膜腔穿刺的指征,可提高染色体异常的检出率,进一步提高产前诊断的效率。
本研究中的6种高危因素均与染色体病密切相关。其中血清学筛查高风险的孕妇在受检人群中所占比例最大,检出染色体异常的人数也最多,因此孕早期血清学筛查是产前诊断必不可少的方法。随着中国生育年龄的不断推迟,高龄孕妇越发增多。在本研究中35周岁及以上的高龄孕妇与其他具有产前诊断指征的孕妇相比,染色体核型异常的检出率差异无统计学意义。而且,有随年龄增长而异常率上升的趋势。因此,对于超过35周岁的孕妇,可以不必经孕早期血清学筛查,直接于孕中期行羊水穿刺检查。B超是检测胎儿遗传病的重要手段,在本研究中B超检测出的胎儿异常包括了颈项透明层增厚、羊水过多、羊水过少、脑积水、肾积水、心包积液、单脐动脉等及各种胎儿畸形,B超异常组的异常核型检出率为5.56%,与文献[4,9]报道的相似,明显高于血清学筛查高风险组与高龄组。因此,B超检查异常是羊水穿刺检查的一个重要指征。夫妇染色体异常是异常核型检出率最高的一组,虽然大多数检出的异常为来源于父母的平衡性结构异常,可以正常发育并分娩,但羊水穿刺检查仍是检出少数异常胎儿所必需的。不良孕产史组中,异常核型检出率为2.04%,也较新生儿染色体异常率明显增高,说明不良孕产史也是羊水穿刺检查的指征。
非整倍体,尤其是21三体,在异常核型中占绝对优势。通过无创等快速基因检查方法,可以检出一半以上的染色体异常,但是结构异常依旧需要羊水穿刺后的核型分析才能检出[10]。对于染色体结构异常的胎儿,需要双亲行外周血染色体检查,以确定结构异常染色体的来源。若异常核型来源于双亲之一且双亲表型正常,说明此突变并无遗传物质的增减,应建议妊娠妇女行超声检查,密切观察胎儿生长发育情况,如无异常可继续妊娠;若双亲染色体正常,则染色体结构异常为胎儿新发突变,应建议行基因芯片检查,以确定结构异常有无造成基因的重复或者缺失。
本研究中嵌合体25例,发生率4.17‰,略高于张月萍等[7]报道的3.48‰ ,主要来自于血清学筛查高风险组、高龄组及B超检查异常组。嵌合体是羊水培养中经常出现的现象,虽然原位培养可以排除部分假性嵌合的现象,但由于羊水细胞本身为胎儿脱落细胞,包含淘汰的异常细胞,且经过体外培养,突变概率增加[8,11-12]。故当羊水出现嵌合体时,作者建议采集孕妇脐带血复查,再次进行核型分析后再下结论。
高质量的羊水细胞培养及收获技术对于染色体核型分析极为重要。羊水的最佳采集时间为孕20~22周,此时羊水中活性细胞较多、细胞易贴壁、生长旺盛。孕周过小,活细胞尚少,不易贴壁形成克隆;孕周过大,羊水中胎脂和上皮细胞增多,形成克隆也较少。但本研究发现,通过个体化的换液与传代操作,晚至33周的羊水也可以培养并收集到足够多分裂相细胞,但培养时间明显延长。本研究中6 000例羊水标本培养成功率为99.90%,培养失败的6例病例,主要是由于羊水污染所造成。因此,在操作的各个步骤严格执行无菌操作,做好各个环境指标的质控尤为重要。
新近基因芯片检测也成为了产前诊断的一线检验方法,与染色体核型分析相比,其检验标本更为广泛,能够发现更微小的基因片段增加和缺失,但其应用也有一定的限制[13-14]:(1)不能够检测除相对拷贝数变异之外的事件,如平衡性结构重排。(2)由于敏感度所限,无法检测低水平的嵌合体、不平衡易位和非等倍体。(3)无法检测四倍体或其他的双倍体性异常。(4)无法检测芯片上所未覆盖区域的基因拷贝数变异。(5)无法像核型分析一样阐明基因不平衡性变异产生的机制或来源。因此,进行基因芯片检测的同时,仍需进行染色体核型分析以相互补充。相信随着科技的进步,多种技术相结合,将使产前诊断越来越精确与完善。
[1]Neagos D,Cretu R,Sfetea RC,et al.The importance of screening and prenatal diagnosis in the identification of the numerical chromosomal abnormalities[J].Maedica (Buchar),2011,6(3):179-184.
[2]陆国辉.产前遗传病诊断[M].广州:广东科技出版社,2002:265-292.
[3]汤丽霞,禤洁甜,梁彩红,等.2 054例中期妊娠产前诊断染色体核型分析[J].重庆医学,2013,42(30):3678-3680.
[4]李丹,张秋芳,常亮,等.5 949例中期妊娠羊水细胞染色体核型分析结果[J].计划生育学杂志,2013,21(2):120-122.
[5]陈雪,郝胜菊,闫有圣,等.兰州地区2 411例孕妇羊水细胞染色体核型产前诊断分析[J].中国优生与遗传杂志,2014,22(5):49-51.
[6]孙立宁,孙明强,王兰玲,等.潍坊地区5 540例孕妇胎儿羊水染色体核型分析[J].中国优生与遗传杂志,2014,22(5):59-60.
[7]张月萍,伍俊萍,李笑天,等.孕中期羊水细胞染色体核型分析及其异常核型发生率的比较[J].中华妇产科杂志,2011,46(9):644-648.
[8]BizzocoD,GabrielliI,TamburrinoC,et al.Discordance between karyotype from amniotic fluid and postnatal lymphocyte cultures[J].J Prenat Med,2012,6(2):34-35.
[9]高雪峰,邵敏杰,杨丽萍,等.羊水细胞培养染色体核型分析在产前诊断中的意义[J].中国优生与遗传杂志,2009,17(2):45-46.
[10]侯巧芳,吴东,楚艳,等.孕妇外周血中游离胎儿DNA检测在无创产前诊断中的临床应用[J].中华妇产科杂志,2012,47(11):813-817.
[11]Shalev E,Zalel Y,Weiner E,et al.The role of cordocentesis in assessment of mosaicism found in amniotic fluid cell culture[J].Acta Obstet Gynecol Scand,1994,73(2):119-122.
[12]潘小英,钟燕芳,傅文婷,等.3 405例产前诊断的指征及其结果评价[J].生殖与避孕,2008,28(5):268-272.
[13]Breman A,Pursley AN,Hixson P,et al.Prenatal chromosomal microarray analysis in a diagnostic laboratory;experience with >1 000 cases and review of the literature[J].Prenat Diagn,2012,32(4):351-361.
[14]South ST,Lee C,Lamb AN,et al.ACMG Standards and Guidelines for constitutional cytogenomic microarray analysis,including postnatal and prenatal applications:revision 2013[J].Genet Med,2013,15(11):901-909.
Investigation on 6 000 cases of chromosomal karyotypes of amniotic fluid cells and their prenatal dianostic values in Guangzhou area*
LiuHaibo,QiuWenjun,ZhengYuhong,LaiWeiqiang,SunXiaofang△
(KeyLaboratoryforMajorObstetricDiseasesofGuangdongProvince/ThirdAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou,Guangdong510150,China)
Objective To analyze the chromosoms of amniotic fluid cells,to compare the occurrence rate of different karyotypes an dto investigate their application values in prenatal diagnosis.Methods A total of 6 000 pregnant women with the prenatal diagnostic indications came to our hospital from January 2010 to September 2013 were performed the amniocentesis,amniotic fluid cell passage culture and fetal chromosomal karyotypes analysis.Results Among 6 000 cases of amniotic fluid cell culture,5 594 cases(99.90%) were succeeded and 193 cases(3.22%) were abnormal karyotypes,in which 108 cases were the chromosomal numberical abnormality,acounting for 55.96% of abnormal karyotypes,Down′s syndrome was predominant and accounted for 67.59% of chromosomal numberical abnormality.There were 60 cases(31.09%) of chromosomal structural abnormality including 38 cases(19.69%) of balanced structural rearrangements and 22 cases(11.40%) of non-balanced structural rearrangements.There were 25 cases(12.95%) of chimera.The pregnant women were divided into 6 groups according to the amniocentesis chief indication,the high risk group and high age group of serological screening accounted for 41.62% and 33.70% of the detected person number.The detection rates of karyotype abnormality in the fetal B ultrasonographic abnormality group and the couple one party chromosomal abnornality group were 5.56% and 20.00%,respectively,which were significantly different from other groups (P<0.05).Conclusion The amniocyte subculture in vitro is practicable for the karyotype analysis.The karyotype analysis of amniotic fluid chromosomes is a safe and effective method for diagnosing the fetal chromosomal diseases.
prenatal diagnosis;amniotic fluid;cell culture;karyotype analysis
:10.3969/j.issn.1671-8348.2015.15.001
国家自然科学基金资助项目(81302079);广州医科大学青年基金资助项目(2012C10);广州医科大学附属第三医院青年基金资助项目(2012Y15)。
刘海波(1973-),博士,讲师,主要从事遗传学方面的研究。
△通讯作者,E-mail:xiaofangsun@hotmail.com。
R446
A
1671-8348(2015)15-2017-03
2014-10-08
2015-02-13)

