低温胁迫下植物响应机理的研究进展
许英,陈建华,朱爱国,栾明宝,王晓飞,孙志民
(中国农业科学院麻类研究所,长沙410205)
低温胁迫下植物响应机理的研究进展
许英,陈建华*,朱爱国,栾明宝,王晓飞,孙志民
(中国农业科学院麻类研究所,长沙410205)
本文阐述了低温胁迫下植物伤害机理,综述了低温胁迫下植物形态特征、叶结构、植物抗氧化系统、丙二醛、可溶性蛋白、叶绿素及基因表达响应研究,并且探讨了今后低温胁迫研究方向。目的是为植物主要是农作物耐寒性种质资源的筛选和新品种选育提供重要的理论依据。
植物;低温胁迫;响应机理
1 植物低温胁迫伤害机理
植物对低温胁迫的研究早在19世纪30年代就开始了,至今已经有近180多年的历史[4]。低温胁迫,根据低温程度和受害情况分为冷害(>0℃)和冻害(≤0℃)。低温胁迫下,植物的细胞的结构发生变化,细胞膜的相变发生改变,而且膜脂和膜蛋白的相互作用的构型也发生变化;细胞核的核膜孔的数量减少和关闭,减少和切断了核与细胞质之间的物质交换,进而停止细胞的分裂和生长活动,使得细胞的代谢转变到抗寒锻炼的途径,抗寒基因得到启动和表达,抗寒力得到增强;水分代谢失衡,导致植株叶片萎缩、焦化、凋谢。抗氧化酶活性和非酶抗氧化剂含量发生变化,导致植株活性氧中毒,甚至死亡。根据研究报道低温胁迫造成植物伤害的机理有3种模式[5]。
膜的伤害:细胞膜又称质膜,是由脂双分子层和蛋白质及外表面的糖被(糖蛋白)组成,蛋白质镶嵌在双分子层中。质膜重要功能之一是使植物细胞与外界环境隔离,保持细胞内部环境相对稳定性,起着重要的屏障作用,行使细胞与外界环境的物质交换和信息传递。低温胁迫时,研究表明细胞膜最先感知低温刺激,并且做出反应[6,7]。上世纪70年代Lyons等研究表明[8],低温胁迫时,细胞膜相变从液晶状态变成凝胶状态,脂肪链由无序变为有序,蛋白质变性,膜的通透性增大,溶质大量外流,膜内离子和基质失去平衡,膜质相变使得一部分与膜结合的酶游离而失去活性,光合磷酸化和氧化磷酸化解偶联,ATP形成明显下降,引起代谢紊乱,严重时则可使受胁迫的植株死亡。
结冰伤害:冻害严格的说是冰晶的伤害,也就是说当温度下降到0℃以下,植物体内会发生冰冻,组织会结冰。低温会产生胞外结冰和胞内结冰两种胁迫方式。胞外结冰是指温度下降时,细胞间隙和细胞壁附近的水分结冰。胞内结冰是指温度迅速下降时,除了胞外结冰外细胞内的水分也结冰,一般先在原生质内结冰,后来在腋泡内结冰。胞外结冰引起植物受害主要原因是: 1)由于胞外结冰,细胞间隙内水蒸汽压降低,但细胞内水分不断被夺取,使原生质发生严重脱水,造成蛋白质或原生质不可逆的凝胶化;2)逐渐膨大的冰晶体给细胞造成机械压力,使得细胞变形,甚至可能将细胞膜和质膜挤碎,原生质暴露于细胞外而受冻害,同时细胞亚微结构遭受破坏,区域化被打破,酶活动无秩序,影响代谢的正常进行;3)若遇温度骤然回升,冰晶迅速融化,细胞壁吸水膨胀,而原生质体来不及吸水膨胀,就有可能被撕裂。胞内结冰对细胞的危害更为直接,因为原生质是有高度精细结构的组织,冰晶形成及融化时会对质膜与细胞器甚至整个细胞质产生破坏作用,胞内结冰常给植物带来致命的伤害。
硫氢基假说:1962年Levitt提出当组织结冰脱水时,硫氢基(-SH)减少,而二硫键(-S -S-)增加。二硫键由蛋白质分子内部失水或相邻蛋白质分子的硫氢基失水而成。当解冻再度吸水时,肽链松散,氢键断裂但二硫键还在,使得肽链的空间位置发生变化,蛋白质分子的空间构象改变,因而蛋白质结构被破坏,引起植物伤害甚至死亡。
2 低温胁迫下植物形态特征及叶结构响应
低温胁迫下,植物最直观的影响是引起生物学特性的变化,外部形态表现为组织柔软,叶色褐化,出现脱水症状,甚至干枯死亡。低温胁迫将会对植物整个生长发育均会造成不利的影响,如植物苗弱、生长缓慢或者受阻产量低及品质差等[9]。于文颖等[10]对“丹玉39”和“丹玉42”两个玉米品种进行了苗期的低温胁迫,研究发现低温胁迫抑制了玉米的生长,导致叶面积增值率均小于正常生长,后期生长中发现“丹玉39”叶面积逐渐接近并最终在乳熟期达到正常水平,而“丹玉42”的后期恢复能力较差,生育期方面两个品种玉米均表现营养生长阶段延长而生殖生长阶段缩短,导致后期的玉米生物产量和产量下降。苗永美等[11]对不同基因型黄瓜幼苗进行低温胁迫研究发现黄瓜叶片表现出首先萎蔫脱水的冷害症状,不同基因型黄瓜脱水程度存在差异,处理期间SWCC12的冷害指数始终高于另外2份材料,EC1最低。相对叶长、叶宽、下胚轴长和株粗均能反映萎蔫程度,而SWCC12在低温处理2 d时发生明显的脱水现象,4个相对指标都小于另外2种黄瓜。冷害指数和4个相对形态指标变化趋势一致,研究结果说明根据植株萎蔫程度可简单直观地反映不同基因型黄瓜的耐冷差异情况。
叶片是植物光合作用和蒸腾作用的主要器官[12],在低温胁迫下,水分代谢失去平衡,导致叶片萎缩、焦化及凋谢等。气孔是植物进行气体交换的重要门户,也是植物进行光合作用和水分蒸腾的通道。何洁等[13]研究认为低温胁迫会发生气孔关闭,净光合速率降低。叶片总厚度、栅栏组织厚度或海绵组织厚度往往会随植物所处生态条件和生理状态的不同而发生改变。唐立红等[14]研究发现紫斑牡丹品种的抗寒性与叶片结构紧密度(CTR)呈正相关,与疏松海绵组织厚度的指数呈负相关。冯美利[15]低温胁迫芒果,解剖观察发现低温胁迫的栅栏组织厚度增大,结构紧密度增大并且不同品种中存在显著差异。
3 低温胁迫下植物抗氧化系统响应
活性氧(ROS)是高等植物代谢过程的产物,在植物体内主要包括以下几种类型:超氧根阴离子(O2-),氢氧根离子(OH-),羟基自由基(-OH)、过氧化氢(H2O2)等[16,17]。植物细胞中产生ROS的部位有细胞膜、叶绿体、线粒体和过氧化物体等(见图1),其中叶绿体和线粒体是产生ROS的主要部位[18]。ROS在线粒体和叶绿体的产生途径主要通过电子传递,除此之外,ROS也可以通过代谢产生,如脂肪酸B-氧化等,研究表明,ROS是植物正常生长发育过程中重要的信号分子,参与植物和细胞内的分子、生化和生理反应,尤其在植物的防卫反应和细胞程序性死亡过程中发挥重要作用[19,20]。

图1 光合作用植物细胞内电子传递及H2O2产生(Bob B.Buchanan and Yves Balmer,2005)Fig.1Hydrogen peroxide generation in a photosynthetic plant cell
同时,研究发现ROS具有极高的活性和毒性[21],能够对蛋白质、脂质、碳水化合物和DNA造成伤害,最终导致细胞死亡。植物正常生长情况下,ROS分子能够被各种抗氧化防御机制清除[22]。然而,在低温、盐、干旱等逆境胁迫下,ROS产生和清除间的平衡被打破,导致ROS急剧增加。高等植物的抗氧化酶主要包括超氧化物歧化酶(SOD),过氧化物酶(POD),过氧化氢酶(CAT),抗坏血酸还原酶(APX),谷胱甘肽还原酶(GR)等;非酶抗氧化剂主要有抗坏血酸(AsA)、谷胱甘肽(GSH)等。植物对低温胁迫的耐性与其抗氧化系统清除ROS的能力密切相关。低温胁迫下,水稻[23]、玉米[24]、黄瓜[25]、棉花[26]、甘蔗[27]等的研究表明抗氧化酶活性和抗氧化剂的含量都表现先升高后下降,在品种比较试验中发现,耐冷性强的品种在低温胁迫下的抗氧化酶活性高于冷敏感的品种。
3.3 福山大樱桃的物流信息化水平不高 在物流信息化技术方面,福山农产品物流主体基础薄弱,一些刚开始使用的技术应用不够熟练,一些新型物流技术在其他领域应用已经较为成熟,而在农产品物流层面仍然处于初级水准。在信息平台方面,没有一个相对权威的物流信息平台作为信息共享的桥梁,种植户和小型企业无法快速得到准确的物流信息[6]。不仅如此,产销链中各个环节缺乏有效的交流,极大地降低了物流水平。在物流信息标准方面,因为农产品具有很多类别,而且物流途中又要经历很多繁杂的程序,导致福山的农产品物流信息标准体系尚未完善。
SOD、POD、CAT是植物对膜脂过氧化的酶促防御系统中重要的保护酶。SOD作为植物抗氧化系统的第一道防线[28,29],在细胞保护酶系统中的作用是清除超氧根阴离子O2-,同时产生歧化产物H2O2,避免超氧自由基对膜的伤害。POD和CAT在保护酶系统中主要是起到酶促降解H2O2的作用,避免细胞膜的过氧化伤害。CAT主要存在于过氧化物酶体和乙醛酸还原体中,逆境胁迫期时细胞内CAT增高,主要是清除多余的ROS,特别是H2O2,使之处于一个低水平状态。POD是一种功能较复杂,种类较多的酶,POD除了清除H2O2等ROS,主要功能是与木质素的合成有关,并与细胞的抗病相联系[30]。正常生长情况下,植物通过超氧化物歧化酶(Superoxidedismatase,SOD)、过氧化物酶(Peroxidases,POD)、过氧化氢酶(Catalase,CAT)等保护酶的协同作用,使氧自由基维持在一个低水平,从而防止氧自由基伤害[31]。
研究表明,低温胁迫下,SOD、POD、CAT活性随胁迫温度的降低总体呈先升高后下降的趋势,说明这三种酶是逐渐适应环境而变化的,低温胁迫可诱发酶活性上升,随着胁迫增高,酶活性降低,使活性氧和防御系统的动态平衡遭到了破坏,从而加剧了膜脂过氧化作用[32,33]。研究同时也发现,SOD、POD、CAT三种酶,SOD和CAT对低温锻炼比较敏感,在低温处理中两者的变化趋势也比较相似,而POD在低温处理中活性并没有表现出太大变化反而略微有些下降,这可能是植物适应低温逆境在代谢上补偿性调节作用的结果,即某种或某些代谢过程的增强,导致另外的代谢途径或过程的抑制或降低,这可能是植物适应逆境条件的一种积极的代谢适应对策[34,35]。马兰涛等[36]研究还发现不同耐寒性的G.amplexfolia品种,SOD、POD、CAT三种酶的变化幅度稍有变化,抗寒性强的品种三种酶活下降的速度,与和植物的耐寒性有着显著的相关性。
抗坏血酸一谷胱甘肽循环(Ascorbate-glutahione cyele,AsA-GSH cycle)存在于叶绿体、线粒体和过氧化物酶体等各种细胞器中,在清除活性氧,特别是清除H2O2的过程中发挥着重要的作用[37,38]。抗坏血酸还原酶(APX)、谷胱甘肽还原酶(GR)、抗坏血酸(AsA)及谷胱甘肽(GSH)是植物AsA-GSH循环重要组成部分。在AsA-GSH循环中,APX以AsA为底物将H2O2还原成H2O和MDHA。脱氢抗坏血酸(DHA)以GSH为还原型底物,DHAR的作用下还原成AsA,GSSG在NADPH的作用下又被GR还原为GSH。AsA的再生受到MDHAR、DHAR和GR三种酶的调节,MDHA被MDHAR还原生成AsA,或进一步氧化成DHA,DHA与电子供体GSH在DHAR酶的作用下生成AsA和GSSG,GSSG又可在GR的催化下被还原成GSH。
APX被认为是高等植物中清除H2O2的关键酶之一[39],在细胞内它的同工酶定位于4各不同的区域:叶绿体中的基质APX(sAPX)、类囊体膜APX(tAPX)、微体APX(mbAPX)及胞质APX(cAPX)[40]。叶绿体中不存在CAT和GSH-POD,因此叶绿体中清除H2O2的关键酶为APX。APX活性增加有助于植物抗性的提高[41]。罗娅[42]低温胁迫草莓研究发现,APX对低温非常的敏感,APX活性伴随着H2O2的升降而升降,APX在清除的过程中发挥着重要作用。范博[43]低温胁迫小麦研究发现叶片中的APX随着胁迫的加剧达到一个峰值后降低。
GR是一种黄素蛋白氧化还原酶,它在真核和原核生物中都有存在[44]。GR是植物细胞内将氧化型谷肤甘肤(GSSG)还原为还原型谷肤甘肤(GSH)的重要酶。研究表明,逆境初期常引发GR相关基因的快速上调,过度表达GR能提高植物对氧化胁迫的抗性[45,46]。罗娅[42]低温胁迫草莓研究发现,0°C的低温处理2小时,“章姬”与“丰香”GR活性较对照提高了69.54%和25%,随着低温处理时间的延长,“章姬”叶片GR活性呈波浪式变化,而“丰香”叶片GR活性逐渐增加,在24h时达到最大值,之后有所下降,但仍高于对照。
AsA、GSH是重要的非酶抗氧化剂。AsA可还原O2-,清除OH-,清除H2O2等ROS。GSH含有活性的巯基,极易被氧化。GSH可以抑制不饱和脂肪酸生物膜组分及其他敏感部位氧化分解,防止细胞膜过氧化,从而保持细胞膜系统的完整性,延缓细胞的衰老和增强植物抗逆性。AsA和GSH在低温胁迫中起着重要作用,Jin等[47]研究表明,在低温胁迫下AsA的含量增加,Kocsy C等[48]报道,GSH水平的变化是低温处理的玉米茎中诱导抗冷基因表达的信号,同时GSH/GSSG比率的迅速变化可诱导GR活性迅速提高,从而增强植物的抗寒能力。郭丽红等[49]低温胁迫小麦幼苗研究发现AsA和GSH含量均随着低温胁迫呈上升趋势,恢复阶段下降。罗娅[42]低温胁迫草莓研究发现,草莓在受到低温胁迫时,抗氧化酶与抗氧化剂将共同协调作用,减轻低温对草莓造成的伤害。
4 低温胁迫下植物丙二醛、可溶性蛋白及叶绿素响应
低温引起细胞器膜结构的破坏是导致植物寒害损伤和死亡的根本原因,而在低温胁迫下细胞膜系统的损伤可能与自由基和活性氧引起的膜脂过氧化有关[50]。膜脂过氧化的中间产物-自由基和最终产物是丙二醛(MDA),研究表明MDA能够引发非特异性的氢抽提作用及由此而产生化学加成作用,使生物膜中的结构蛋白和酶发生聚合和交联,丧失了原有的结构和催化功能,抑制细胞保护酶活性和降低抗氧化物的含量,从而加剧了膜脂过氧化[51]。MDA含量越高,膜脂过氧化程度越高,说明膜受伤越严重。徐田军等[52]研究发现随低温胁迫时间的延长,两品种玉米叶片中MDA含量呈增加趋势。低温胁迫0~2 d时,郑单958(ZDCK)和丰单3号(FDCK)的MDA含量缓慢上升;低温胁迫3~7 d,急剧上升。低温胁迫7d的ZDCK和FDCK的MDA含量与低温胁迫前相比分别增加了83.03%和80.01%。陈禹兴等[53]研究发现冬小麦随着低温胁迫的加剧,MDA含量呈上升趋势,细胞膜透性增大,相对电导率相应增加,丙二醛和相对电导率可在一定程度上反映冬小麦品种抗寒性的强弱,抗寒性强的品种(品系)质膜的稳定性大于抗寒性弱的品种(系)。同样,刘艳阳等[54]低温胁迫小麦研究结果发现冻害程度低的株系,MDA含量较低,低温逆境下MDA积累少,膜脂过氧化程度低,抗寒性强;冻害程度高的株系,MDA含量较高,低温逆境下MDA积累多,膜脂过氧化程度高,抗寒性弱。
可溶性蛋白质的亲水性很强,其含量的增加导致细胞内束缚水含量增加、细胞保水能力提高,同时提高细胞质内浓度,降低结冰的可能性[55]。可溶性蛋白质含量是植物抗寒性研究中重要指标之一[56]。研究结果表明,低温胁迫对植物体内可溶性蛋白含量的影响,一方面,低温胁迫会诱导植物体内生成一些其它的可溶性蛋白,如冷响应蛋白,表现为对植物体内可溶性蛋白的正效应,另一方面,低温胁迫条件下,植物细胞产生自溶水解酶或溶酶体,释放出水解酶,加速了蛋白质的分解而无等速的合成,导致蛋白质匮乏,表现为对植物体内可溶性蛋白的负效应[57-59]。王树刚等[60]低温胁迫不同小麦品种,发现不同冬小麦品种功能叶和茎中可溶性蛋白的含量均下降,说明低温胁迫条件对拔节期小麦功能叶和茎内可溶性蛋白含量的影响,其负效应已远远超过了正效应,导致小麦功能叶和茎内蛋白质匮乏,进而导致束缚水的含量下降以及原生质的弹性下降。罗娅[42]研究发现低温胁迫的草莓品种“章姬”和“丰香”可溶性蛋白含量均高于对照,可溶性蛋白在抗低温胁迫过程中发挥积极作用。朱政等[61]低温胁迫茶树研究发现可溶性蛋白含量先下降后上升,处理到第10天时均超过了原始水平(处理前),诱导新蛋白的产生,增加了可溶性蛋白含量,有利于提高茶树抗寒性。
低温对光合作用影响有两个方面:第一,低温直接影响叶绿素的合成、光合器官的结构和活性;第二,低温影响植物体内的其它生理过程,从而间接地影响光合作用,如低温引起水分胁迫,气孔对CO2扩散阻力的增加,光合产物运输受阻等。叶绿体是光合作用的重要场所,也是植物体内冷敏感性很强的一个亚细胞器。叶绿素是植物进行光合作用的主要色素,是绿色叶片进行光合作用时捕获光能的重要物质,其含量的高低在某种程度上与光合作用有关[5]。低温使叶绿体的形成和叶绿素的合成速率受到抑制,叶绿素含量明显下降,幼嫩叶片易发生缺绿或黄化,低温胁迫可造成叶绿素降解[62]。低温诱导类囊体膜上叶绿素a/b蛋白质构象发生改变,直接影响光合作用[63]。徐田军等[52]研究同样发现低温胁迫,玉米幼苗的光合作用抑制,Fv/Fm降低,叶绿素含量下降。
5 低温胁迫下植物基因表达响应
植物在遭受低温胁迫的过程中,形成一套感知和传导信号的通路,并且产生一系列的变化以增强自身的抗低温冷害。研究表明,植物冷驯化和耐寒性能力的获得,是植物体内分子水平上对逆境产生迅速应答、转导逆境信号,调控应答和抵御基因表达综合作用的结果。拟南芥低温胁迫研究发现冷调基因占基因组的4%-20%[64,65],并且阐明了拟南芥冷驯化转录水平调控网路(图2)。

图2 拟南芥冷应答转录组调控网络(Viswanathan Chinnusamy et al.,2007)Fig.2Diagram of cold-responsive network in Arabidopsis
低温应答途径是个复杂的过程,由许多成分组成。目前,研究发现低温应答途径主要由胞外信号、信号的跨膜传递、胞内第二信使、转录因子、功能基因、效应因子等多种成分组成[66]。植物中抗逆相关的转录因子,包括CBF、MYC/MYB、bZIP、WRKY、NAC、bLHL类等,在低温信号转导中发挥着不同程度的作用。
低温信号转导途径中研究较为清楚的是植物中低温应答主效途径——CBF/DREB信号途径,该途径属ABA非依赖型,主要成员包括CBF1/DREB1B、CBF2/DREBlC、CBF3/DREB1A、CBF4/DREBlD、DREB1E、DREB1F,其中CBF1、CBF2和CBF3是目前研究的热点,且CBF2能阻遏调节CBF1及CBF3的表达,从而保证低温下CBF信号途径中个物质在植物体内表达的瞬时性及可控性。拟南芥CBF调控路径中,ICE1(Inducer of CBF Expression 1)位于CBF途径的上游,属bHLH类转录激活因子,主要通过与CBF/DREBls成员特异性作用,将信号传递,对下游低温相关基因的表达进行调控,ICE1过表达能够增加拟南芥的耐寒性[67]。在拟南芥ice1种质冷驯化研究中发现ICE1与CBF3/DREBlA启动子中MYC识别cis-元件(CANNTG)结合,诱导CBF3/DREBlA表达和调控(图3)。Lee B.H.等[66]研究发现ICE1调控了大约40%COR基因和46%的冷调控转录因子。Kenji Miura等[68]研究发现高等植物中都含有ICE1,ICE1在逆境胁迫中起着重要调控作用,具体见表1。
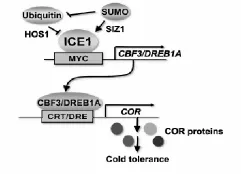
图3 ICE1与CBF3/DREBlA的冷信号传导途径(Kenji Miura et al,2013)Fig.3The cold signaling pathway,which involves ICE1 and CBF3/DREBlA
ROS-bZIP-CRT/DRE和MYC/MYB-MYCRE/MYBRE也是两条重要的传导通路。ROS-bZIP-CRT/DRE通路通过启动低温信号转导过程中早期低温应答基因的表达发挥作用。JERF3是一个乙烯应答因子(ERF),低温下JERF3即可通过激活下游bZIP等转录因子的转录调控,降低氧化胁迫伤害,使植株对非生物胁迫的耐受性增强[69]可通过与下游靶基因启动子区TAACTG核心序列结合来启动下游胁迫相关基因的表达[70]。拟南芥中过量表达水稻的OsMYB3R-2基因,可使转基因拟南芥对冷、旱和盐胁迫的耐受力增强,播种转基因拟南芥T1代种子,萌发时发现转基因拟南芥具有比野生型更强的耐受逆境胁迫的能力[71]。

表1 植物耐寒性中ICE1-CBF3/DREBl信号元件功能(Kenji Miura et al,2013)Tab.1 ICE1-CBF/DREB1-dependent signaling components conferring plant cold tolerance
低温胁迫过程中,通过信号传导,植物体内会产生一系列应答基因表达产物,以此减少低温胁迫的伤害和增加耐寒性。根据低温胁迫下植物应答基因表达产物功能分为三类[66]:功能蛋白、调节蛋白及其他(表2)。功能蛋白主要功能是直接参与植物抗逆反应,包括渗透调节分子、脱水素及抗性蛋白等,其中脱水素是目前研究低温相关基因编码的最大一类多肽家族。脱水素中COR基因是冷调基因,在植物耐寒性及冷驯化中起着重要的作用,主要包括COR15A、COR47、COR6.6和COR78/RD29等,COR基因表达产物保护细胞膜稳定性,阻止蛋白聚合而造成膜结构损害[72-74]。LEA也是重要的脱水素蛋白,在低温、干旱等逆境中被表达,来增加植物抵御逆境的能力。调节蛋白主要是指一些转录因子,如Bzip,MYB及CBF等。其他基因表达产物主要指水通道蛋白等。

表2 低温胁迫下应答基因表达产物(计淑霞等,2013)Tab.2Cold-response gene expression
6 讨论
低温胁迫导致植物基因表达差异,细胞形态和功能的变化,构成细胞成分的生物大分子物质改变,进而导致植物在生理及代谢水平上受害,甚至死亡。植物冷驯化和耐寒性能力的获得,是植物体内分子水平上对逆境产生迅速应答、转导逆境信号,调控应答和抵御基因表达综合作用的结果。但是目前低温胁迫下植物响应机理方面的研究还不够深入,有必要进一步研究和发现低温胁迫诱导植物冷驯化和耐寒能力的关键基因,及其相关的信号途径,通过现代的分子育种技术应用,如分子标记、转基因等,将有目的改造植物种性,短时间提高植物的耐寒性。
在全球气温变暖的大趋势下,气温变化异常,极端天气频繁出现,人们难有足够的时间和能力做出有力的反应,农作物的寒冻灾害日趋严重,导致农作物的产量下降、品质降低,给种植业带来了巨大的损伤。为了减少损伤,筛选耐寒性的品种种植是人们对待低温胁迫采取的有效措施。不同物种间对低温的抵御能力不同,国内外的研究者为了快速、准确且容易评价植物的耐寒性筛选了许多指标,包括生态、形态、生理生化等方面,但是植物抵御低温是受多因子影响的复杂的过程,不同种质间对低温的响应机理不同,表型不同,单一指标难以全面准确地反映作物品种抗逆性的强弱,有必要针对不同的种质加大低温胁迫响应指标与耐寒性的相关性研究,有效指导不同植物种质耐寒性评价方法产生,为农作物种质资源耐寒性种质的评价、筛选以及耐寒品种的选育提供理论依据。
[1]Chinnusamy V.,Zhu Jianhua,Zhu Jiankang.Cold stress regulation of gene expression in plants[J].Trends in Plant Science,2007,12(10):444-451.
[2]Ohnishi S,Miyoshi T,Shirai S.Low temperature stress at different flower development stages affects pollen development,pollination,and pod set in soybean[J].Environmental and Experimental Botany,2010,69(1):56-62.
[3]唐月异.花生耐低温种质筛选及相关差异表达基因鉴定[D].上海:中国海洋大学,2011.
[4]Foyer C H,Noctor G.Redox homeostis and antioxidant signaling:a metabolic interface between stress perception and physiological responses[J].Plant Cell,2005,17(7):1866-1875.
[5]郑彩霞.高级植物生理学讲义[M].北京,2011:367.
[6]Lyons J M.Chilling injure in pIants[J].Annual Review Plant Physiology,1973,24:445-446.
[7]Bowler C,MontaguM V,Inze D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,3:83-116.
[8]Lyons J M,Graham D,Raison J K.Low temperature stress in crop plants:the role of membrane[M].London:Academic Press,1979.
[9]王毅,杨宏福,李树德.园艺植物冷害和抗冷性的研究[J].园艺,1994,21(03):239-244.
[10]于文颖,冯锐,纪瑞鹏,等.苗期低温胁迫对玉米生长发育及产量的影响[J].干旱地区农业研究,2013,31 (5):220-226.
[11]苗永美,宁宇,魏庆镇,等.低温对不同基因型黄瓜幼苗生长及生理特性的影响[J].华北农学报,2013,28 (6):140-146.
[12]陈晓亚,汤章城.植物生理与分子生物学[M].北京:高等教育出版社,2007:68-97.
[13]何洁,刘鸿先,王以柔,等.低温与植物的光合作用[J].植物生理学通讯,1986,(2):1-6.
[14]唐立红,赵雪梅,朱月,等.不同品种紫斑牡丹叶片结构与耐寒性的关系比较[J].江苏农业科学,2011,39(6) :283-285.
[15]冯美利.芒果叶片组织的细胞结构与耐寒性的初步研究[J].热带农业科技,2003,26(1):5-7 18.
[16]Vranova E,Inze D,Van Breusegem F.Signal transduction during oxidative stress[J].Journal of Experiment Botany,2002,53(372):1227-1236.
[17]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review Plant Biology,2004,55:373-399.
[18]Neill S,Desikan R,Hancock J.Hydrogen peroxide signaling[J].Current.Opinion.Plant Biology,2002,5(5):388-395.
[19]Christelle D,Marie G,Graham M,et al.Leaf mito chondria modulate whole cell redox homeostasis,set antioxidant capacity,and determine stress resistance through altered signaling and diurnal regulation[J].Plant Cell,2003,15(4):1212-1226.
[20]Buchanan B B,Balmer Y.Redox regulation:a broadening horizon[J].Annual Review Plant Biology,2005,56:187-220.
[21]Green R,Fluhr R.UV-B-Induced PR-1 Accumulation Is Mediated by Active Oxygen Species[J].Plant Cell,1995,7 (2):203-212.
[22]Foyer C H,Noctor G.Redox homeostis and antioxidant signaling:a metabolic interface between stress perception and physiological responses[J].Plant Cell,2005,17(7):1866-1875.
[23]王国骄,王嘉宇,苗微,等.强耐冷性水稻新品系JO7-23抗氧化系统对长期冷水胁迫的响应[J].作物学报,2013,39(4):753-759.
[24]Hodges D M,Andrews C J,Johnson D A,et al.Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines[J].Journal of Experimental Botany,1997,48(5):1105-1113.
[25]Shen W,Nada K,Tachibana S.Effect of cold treatment on enzymic and nonenzymic antioxidant activities in leaves of chillingtolerant and chilling-sensitive cucumber(Cucumis sativus L.)cultivars[J].Journal of The Japannese Society for Horticultur Sciences,1999,68(5):967-973.
[26]武辉,候丽丽,周艳飞,等.不同棉花基因型幼苗耐寒性分析及其鉴定指标筛选[J].中国农业科学,2012,45 (9):1703-1713.
[27]孙富,杨丽涛,谢晓娜,等.低温胁迫对不同抗寒性甘蔗品种幼苗叶绿体生理生化代谢影响[J].作物学报,2012,38(4):732–739.
[28]Ruth G A,Neval E,Lenwood S H.Role of superoxide dismutases(SODs)incontrolling oxidative stress in plants[J].Journal of Experimental Botany,2002,53(372):1331-1341.
[29]王玉刚,阿不来提,齐曼,等.两狗牙根品种对于旱胁迫反应的差异[J].草业学报,2006,15(4):58-64.
[30]魏颖颖,王凤龙,钱玉梅,等.活性氧及其清除酶类与烟草抗病性的关系研究[J].进展烟草科技/病虫害防治,2004,5:40-43.
[31]Kuk Y I,Jung H I,Kwo O D,et al.Sulfonylurea herbicide-resistant Monochoria vaginalis in Korean rice culture[J].Pest management Science,2003,59(9):949-961.
[32]曹慧,兰彦平.果树水分胁迫研究进展[J].果树学报,2001,18(2):110-114.
[33]王华,王飞,陈登文,等.低温胁迫对杏花SOD活性和膜脂过氧化的影响[J].果树科学,2000,17(3):197-201.
[34]罗军武,唐和平,等.茶树不同抗寒性品种间保护酶类活性的差异[J].湖南农业大学学报(自然科学版).2001,27(2):94-96.
[35]陈奕吟,陈玉珍.低温锻炼对胡杨愈伤组织抗寒性、可溶性蛋白、脯氨酸含量及抗氧化酶活性的影响[J].山东农业科学.2007,(3):46-49.
[36]马兰涛,陈双林,李迎春,等.低温胁迫Guadua amplexfo1ia耐寒性生理指标的影响[J].林业科学研究,2008,21(2):235-23.
[37]Asada K.The water-water cycle in chloroplasts:seavenging of active oxygen and dissipation of excess Photons[J].Annual Review of Plant Phsiology and Plant Molecular Biology,1999,50(1):601-639.
[38]Breusegem F V.The role of active oxygen species in plant transduction[J].Plant Science,2001,161(3):405-414.
[39]Asada K.Ascorbate peroxidase–a hydrogen peroxide scavenging enzyme in plants[J].Physiology Plantarum,1992,85 (2):235-241.
[40]孙卫红,王伟青,孟庆伟.植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J].植物生理学通讯,2005,41(2):143-147.
[41]Allen R D,Webb R P,Sehake S A.Use of transgenie plants to study antioxidant defenees[J].Free Radical Biology and Medieine,1997,23(3):473-479.
[42]罗娅.低温胁迫与锻炼对草苟生理特性的影响和草每几丁质酶基因的克隆[D].雅安:四川农业大学,2007.
[43]范博.低温胁迫下ABA诱导冬小麦抗氧化防护系统研究[D].黑龙江:东北农业大学,2012.
[44]Alscer R G.Biosynthesis and antioxidant funetion of glutathione in plant[J].Phsiologia Plantarum,1989,77(3):457-464.
[45]Edwards E A,Enard C,Creissen G P,et al.Synthesis and Properties of glutathione re-duetase in stressed peas[J].Planta,1994,192(1):137-143.
[46]Eshdat Y,Holland D,Faltin Z,et al.Plant glutathione peroxidases[J].Physiologia Plant,1997,100(2):234-240.
[47]Jin Y H,Tao D L,Hao Z Q,et al.Environmenial stresses and redox status of ascorbate[J].Acta Botanica Sinica,2003,45 (7):795-801.
[48]Kocsy G,Von Ballmoos P,Suter M,et al.Inhiti-tion of glutathione synthesis reduces chilling tolerance in maize[J].Planta,2000,211(4):528-536.
[49]郭丽红,王定康,王德斌,等.抗坏血酸和谷胱甘肽在小麦幼苗冷激诱导抗冷性中的变化[J].昆明师范高等专科学校学报,2007,29(4):66-68.
[50]郭玉双,李祥羽,任学良.植物体内活性氧(ROS)的产生及其作用研究进展[J].黑龙江农业科学,2011,(8): 146-148.
[51]李海林.低温胁迫对苜蓿幼苗存活及生理生化指标的影响[J].安徽农学通讯,2006,12(11): 50-53.
[52]徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012,38(2):352-359.
[53]陈禹兴,付连双,王晓楠,等.低温胁迫对冬小麦恢复生长后植株细胞膜透性和丙二醛含量的影响[J].东北农业大学学报,2010,41(10):10-16.
[54]刘艳阳,李俊周,陈磊,等.低温胁迫对小麦叶片细胞膜脂质过氧化产物及相关酶活性的影响[J].麦类作物学报,2006,26(4):70-73.
[55]刘大林.低温胁迫下番石榴叶片生理生化变化的探讨[J].林业科学,2003,39(1):38-41.
[56]王淑杰,王家民,李亚东,等.可溶性全蛋白、可溶性糖含量与葡萄抗寒性关系的研究[J].北方园艺,1996,(2):13-14.
[57]Gilmour S J,Audrey M S,Maite P S.Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J].Plant Physiology,2000,124(4):1854-1856.
[58]Karimzadeh G,Darvishzadeh R,Jalali-Javaran M,et al.Cold-induced accumulation of protein in the leaves of spring and winter barley cultivars[J].Acta Biologica Hungarica,2005,56(1-2):83-96.
[59]高媛,齐晓花,杨景华,等.高等植物对低温胁迫的响应研究[J].北方园艺,2007(10):58-61.
[60]王树刚,王振林,王平,等.不同小麦品种对低温胁迫的反应及抗冻性评价[J].生态学报,2011,31(4):1064 -1072.
[61]朱政,蒋家月,江昌俊,等.低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J].安徽农业大学学报,2011,38(1):24-26.
[62]Kratsch H A,Wise R R.The ultra structure of chilling stress[J].Plant,Cell&Environment,2000,23(4),337-350.
[63]刘鹏,刘庆忠,王勇,等.喜温作物的低温损伤及其抗冷性的研究进展[J].山东农业科学,2004,(1):74-78.
[64]Lee,B.H.,Henderson D.A.,Zhu,J.K.The Arabidopsis cold-responsive transcriptome and its regulation by ICE1[J].Plant Cell,2005,17(11):3155-3175.
[65]Hannah M A,Heyer A G,Hincha D K.A global survey of gene regulation during cold acclimation in Arabidopsis thaliana[J].PLoS Genetics,2005,1(8):26.
[66]计淑霞,戴绍军,刘炜.植物应答低温胁迫机制的研究进展[J].生命科学,2010,22(10):1013-1019.
[67]Chinnusamy V,Ohta M,Kanrar S,et al.ICE1:A regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J].Genes Development,2003,17(8):1043-1054.
[68]Miura K,Tsuyoshi F.Cold signaling and cold response in plants[J].International Journal of Mole-cular Sciences,2013,14(3),5312-5337.
[69]Wu L,Zhang Z,Zhang H,et al.Transcriptional modulation of ethylene response factor protein JERF3 in the oxidative stress response enhances tolerance of tobacco seedlings to salt,drought,and freezing[J].Plant Physiology,2008,148(4):1953-1963.
[70]Zhong R,Richardson E A,Ye Z H.The MYB46 transcription factor is a direct target of SND1 and regulates secondary wall biosynthesis in Arabidopsis[J].Plant Cell,2007,19(9):2776-2792.
[71]Dai X,Xu Y,Ma Q,et al.Overexpression of a R1R2R3 MYB gene,OsMYB3R-2,increases tolerance to freezing,drought and salt stress in transgenic Arabidopsis[J].Plant Physiol,2007,143(4):1739-1751.
[72]Thomashow M F.Role of cold-responsive genes in plant freezing tolerance[J].Plant Physiology,1998,118(1):1-8.
[73]Mahajan S,Tuteja N.Cold,salinity and drought stresses:an overview[J].Arch Biochem Biophys,2005,444(2):139-158.
[74]Hundertmark,M,Hincha D.LEA(Late Embryogenesis Abundant)proteins and their encoding genes in Arabidopsis thaliana[J].BMC Genomics,2008,9:118-139.
Research Progress on Response Mechanism of Plant under Low Temperature Stress
XU Ying,CHEN Jian-hua*,ZHU Ai-guo,LUAN Ming-bao,WANG Xiao-fei,SUN Zhi-min
(Institute of Bast fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205)
The damage mechanism of plant under low temperature is introduced in this paper.At the same time,the response mechanism of plant morphological characters,anatomical structure of leaves,anti-oxidant system,MDA,soluble protein,chorophyll and gene expression under low temperature were studied.At last,the development and emphasis of studies on plant response mechanism under low temperature stress are discussed.The aims are to provide important theoretical basis for screening germplasm resources with low temperature-resistant capability and breeding new varieties.
plant;low temperature stress;response mechanism
Q945.78
A
1671-3532(2015)01-0040-10
2014-09-25
物种资源保护(农作物)项目(2014NWB035);国家科技基础条件平台:苎麻种质资源共享服务;中国农业科学院科技创新工程(CAAS-ASTIP-2015-IBFC)
许英(1976-),女,副研究员,研究方向:苎麻种质资源。Email:xuying0420@163.com。
*通讯作者:陈建华(1963-),男,研究员,研究方向:苎麻种质资源。Email:cjhbt@sina.com。

