北冰洋海单胞菌β-D-半乳糖苷酶的异源表达及酶学特性研究
孙茜,廖丽,丁海涛,刘双,陈波*
(1. 华东理工大学 生物工程学院,上海 200237;2.中国极地研究中心 国家海洋局极地科学重点实验室,上海 200136)
北冰洋海单胞菌β-D-半乳糖苷酶的异源表达及酶学特性研究
孙茜1,2,廖丽2,丁海涛2,刘双1,陈波1,2*
(1. 华东理工大学 生物工程学院,上海 200237;2.中国极地研究中心 国家海洋局极地科学重点实验室,上海 200136)
初筛表明,一株分离自北极加拿大海盆海冰心芯样品的海单胞菌(Marinomonassp. BSi20584)具有较高的β-D-半乳糖苷酶活性,为了研究清楚其酶学性质,将经hiTAIL-PCR扩增得到的β-D-半乳糖苷酶基因(galt)与pET-28a(+)原核表达载体结合,转入大肠杆菌BL21(DE3)。经IPTG诱导后对重组β-D-半乳糖苷酶(GALT)的表达条件进行了优化,采用金属螯合亲和层析技术制备纯酶,并对重组GALT的酶学性质进行了研究。结果显示,重组酶的最适诱导温度为20℃,在IPTG浓度为0.07 mmol/L时诱导22 h后,酶活和产酶量达到最大值。GALT单体分子量约为6.6×104g/mol,天然酶为同源三聚体。GALT最适作用温度为35℃,其热稳定性较好,在60℃处理5 h后,仍可保持50%以上的相对活性。GALT的最适作用pH为9.0,在pH为6.0~11.0范围内比较稳定。GALT的最适NaCl浓度为0.5 mol/L,对盐度具有较高的耐受性。Mg2+、K+、DTT和EDTA对酶活不具有显著影响,而Mn2+、Fe2+对酶活有促进作用,Zn2+和L-谷胱甘肽对酶活有抑制作用。GALT对Gal β1-4 GlcNAc具有水解作用,而对Gal β1-3 GalNAc和Gal β1-3 GlcNAc糖苷键型没有水解能力。本研究实现了海单胞菌属菌株的β-D-半乳糖苷酶基因在大肠杆菌系统中的高效表达,并系统研究了重组酶的酶学特性,为后续开展该酶的代谢适应性和潜在应用研究提供详细的酶学数据基础。
北冰洋;海单胞菌;β-D-半乳糖苷酶;异源表达;酶学特性
1 引言
β-D-半乳糖苷酶(EC 3.2.1.23)能够催化水解半乳糖苷类物质,释放其末端的非还原性半乳糖分子,它存在于自然界很多微生物、动物和植物中,来源不同的β-D-半乳糖苷酶其酶学性质也不尽相同[1]。迄今,已有100多种β-D-半乳糖苷酶提交到各类数据库中,根据其功能的相似性可将其分为4个家族:GH1,GH2,GH35和GH42[2]。
多数β-D-半乳糖苷酶是由微生物产生的,包括中温菌、嗜热菌和嗜冷菌等[3]。随着β-D-半乳糖苷酶研究的不断深入,该酶的应用不再局限于乳糖水解,而是广泛应用于食品、医药、免疫、环境检测、基因诊断和基因治疗等多个领域,已取得了可观的经济和社会效益,具有广阔的市场前景[4]。
海单胞菌是一种海洋性细菌,目前已知有7个海单胞菌来源的β-D-半乳糖苷酶基因,均是通过基因组测序得到,其中Marinomonassp. MWYL1的基因组中含有两个β-D-半乳糖苷酶基因(http://www.ncbi.nlm.nih.gov/genome/?term=Marinomonas+sp.+MWYL1),分别属于GH42家族和GH2家族;Marinomonassp. MED121和Marinomonassp. D104[5]中各含有一个属于GH42家族的酶基因;MarinomonasposidonicaIVIA-Po-181[6]中含有两个β-D-半乳糖苷酶基因,分别属于GH42家族和GH1家族;MarinomonasmediterraneaMMB-1[7]中含有一个属于GH1家族的酶基因。
本研究以北极加拿大海盆海冰冰心中分离的Marinomonassp. BSi20584为研究菌株,通过hiTAIL-PCR技术获得该菌株产生的β-D-半乳糖苷酶基因galt,并将该基因克隆至大肠杆菌中进行原核表达,对重组酶的酶学特性进行了系统的研究,为该酶的代谢适应性和潜在应用研究提供详细酶学数据基础。
2 材料与方法
2.1 材料
海单胞菌Marinomonassp. BSi20584分离自北极加拿大海盆海冰上层冰心,现保存于中国极地研究中心极地微生物菌种保藏管理中心(BSi20584)和中国海洋微生物菌种保藏管理中心(MCCC 1C00250)。原核表达载体pET-28a(+)由中国极地研究中心极地微生物学实验室提供;大肠杆菌BL21(DE3)感受态细胞购自Biomed公司;蛋白Marker购自Thermo公司;Bradford蛋白定量试剂盒、DNA回收试剂盒、质粒抽提试剂盒、DNA marker、IPTG和卡那霉素购自上海捷瑞生物工程有限公司;Ni-NTA为Bio-rad公司产品;Taq酶购自上海生工生物公司;氨基色谱柱购自CNW;色谱纯试剂购自上海安谱科学仪器有限公司;PA-Sugar Chain 026(10 pmol/μL)、PA-Sugar Chain 028(10 pmol/μL)、PA-Sugar Chain 042(10 pmol/μL)、PA-Glc(1 pmol/μL)、Fastpfu高保真酶、BamHI、XhoI限制性内切酶购自TaKaRa公司;引物由上海生工生物公司合成。
2.2 方法
2.2.1 基因的扩增与原核表达载体的构建
基于hiTAIL-PCR技术扩增得到的β-D-半乳糖苷酶基因序列[8],设计全长扩增引物,同时引入BamHI、XhoI两个酶切位点和保护碱基,F584∶5′-CGCGGATCCATGAAATTAGGT GTGTGTTATT-3′,R584∶5′-CCGCTCGAGTTATTGTTTTTTCCAAATGG-3′。以野生型BSi20584全基因组DNA为模板,用Fastpfu高保真酶扩增β-D-半乳糖苷酶基因。PCR扩增程序:95℃ 5 min,1个循环;95℃ 30 s,55℃ 1 min,72℃ 1 min,30个循环;72℃ 10 min。将PCR产物通过0.8%琼脂糖凝胶电泳验证后割胶回收。使用BamHI、XhoI分别对pET-28a(+)质粒和PCR扩增产物进行双酶切处理,酶切产物割胶回收后于16℃过夜连接。将构建的原核表达载体命名为pET-28/galt。
2.2.2 β-D-半乳糖苷酶基因序列分析
将扩增得到的基因序列提交至NCBI进行BLAST(http://blast.ncbi.nlm.nih.gov)同源性比对,选取同源性大于70%的序列构建系统发育树,从而观察其进化上的相关关系。用Protean 5.01进行蛋白二级结构的分析[9],同时用Swiss-model(http://swissmodel.expasy.org/)进行三维结构的预测,用Swiss-pdbviewer 4.10对催化位点进行预测。
2.2.3 galt酶基因在大肠杆菌中的表达与纯化
将pET-28/galt重组质粒转入大肠杆菌BL21(DE3)感受态细胞,用50 μg/μL的卡那霉素抗性筛选,挑取阳性单克隆送测。将验证成功的重组菌于含50 μg/μl卡那霉素的LB培养基中培养至OD600为0.6~0.8,然后加入不同浓度IPTG进行诱导,对不同诱导条件下的样品取样,8 000 rpm离心10 min收集菌体,用PBS重悬,在400 W功率下超声破碎(超声2 s,停3 s)30 min后,于12 000 rpm下离心20 min,收集上清得到粗酶液,沉淀用PBS重悬,用以分析酶的可溶性表达情况。由于重组菌含有6×His-tag标签,因此对重组酶采用镍柱亲和层析纯化[10],用不同浓度的咪唑洗脱,将洗脱液中有酶活的部分收集,SDS-PAGE分析重组酶纯度。
2.2.4 酶活力测定
采用ONPG(邻硝基苯β-D-半乳吡喃糖苷)法测定酶活:将10倍稀释过的酶液10 μL与90 μL ONPG混合,于37℃下反应10 min后加入100 μL 1 mol/L Na ̄2CO3终止反应5 min,测定OD420,与ONP标准曲线对照得到酶活。酶活力定义:在37℃条件下,每催化产生1 μmol ONP所需要的酶量为1 U[10]。
2.2.5 蛋白质定量分析
用蛋白定量试剂盒进行蛋白量的测定,具体操作为:取20 μL酶液与200 μL Bradford试剂混合,室温下放置5 min后测定OD595,然后与BSA(牛血清白蛋白)标准曲线对照得到蛋白量。
2.2.6 酶学性质测定
(1)温度对酶的影响:将酶液与反应液混合后分别放置在0℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃下进行,ONPG法测定酶活以检测酶的最适作用温度;先将等量酶液分别放置在40℃、50℃、60℃中处理相应的时间(1 h、2 h、3 h、4 h、5 h)后再与底物ONPG反应,检测酶的热稳定性。
(2)pH对酶的影响:用Britton-Robinson缓冲液(磷酸、乙酸、硼酸、氢氧化钠混合液)将酶反应体系分别调成3、4、5、6、7、8、9、10、11、12,然后与ONPG反应,测定酶反应的最适pH;将等量酶液分别放在pH为3、4、5、6、7、8、9、10、11、12的Britton-Robinson缓冲液中处理1 h后ONPG法测定酶活,测定不同条件下酶的pH稳定性。
(3)NaCl对酶的影响:分别配制含0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 mol/L NaCl的酶反应体系,将酶反应放置在上述盐浓度梯度中进行,以检测酶的最适NaCl浓度;将等量酶液单独放置在上述盐浓度梯度中处理1 h后再与底物反应,检测酶的耐盐性。
(4)金属离子和化学物质对酶活的影响:在酶与底物ONPG的反应体系中分别加入浓度为0.1 mmol/L到5 mmol/L的Fe2+、Zn2+、Mg2+、Mn2+,分析不同浓度金属离子对酶活的影响;在酶与底物ONPG的反应体系中分别加入10、20、30、40、50 mmol/L的DTT、EDTA和L-谷胱甘肽,分析上述化学物质对酶活的影响。
(5)动力学参数:用PBS配制不同浓度的ONPG溶液,取等量酶液与不同浓度的ONPG底物反应,测定酶活,用OriginPro 8非线性拟合分析法作图,求出Km和Vmax。
2.2.7 SDS-PAGE和Native-PAGE
SDS-PAGE条件:12%的分离胶和5%的浓缩胶,Marker范围为14.4×103~116×103g/mol(Thermo);Native-PAGE∶8%的分离胶和5%的浓缩胶,Marker范围为5×103~250×103g/mol(Thermo),预电泳30 min,电泳在冷库中(4℃)进行,以防止蛋白质变性。用考马斯亮蓝G250进行凝胶染色。
2.2.8 水解底物键型分析
用具有PA(吡啶氨基)荧光修饰的多糖(Sugar Chain,Takara)对重组酶的水解底物键型进行分析。反应体系为:50 pmol底物,5×10-3U酶,10 mol/L DTT,10 mmol/L MgCl2,缓冲液为0.01 mol/L的PBS(pH=7.4)。反应20 h后将反应液短暂离心后煮沸5 min,14 000 r/min离心10 min去除酶蛋白,取上清作为检测样品。色谱条件:检测器:Waters 2475荧光检测器;流动相:200 mmol/L醋酸三乙胺(pH=7.3):乙腈=35∶65;流速:1 mL/min;上样量:30 μL;检测波长:Ex=310,Em=380[11]。

表1 糖标准品结构Tab.1 Structure of sugar standards
3 结果
3.1 galt基因原核表达载体的构建
以野生型海单胞菌BSi20584的全基因组为模板,F584和R584为引物,扩增得到约2 000 bp的条带。将目的片段割胶回收后用BamHI、XhoI双酶切,同时对pET-28a(+)质粒进行双酶切处理,然后将酶切后的目的片段与pET-28a(+)载体用T4 DNA连接酶于16℃过夜连接。对重组质粒进行双酶切验证,以检测是否正确插入目的基因片段。将阳性克隆送测结果显示,galt基因全长1 971 bp,共编码656个氨基酸,预测蛋白分子量大小约66×103g/mol。
3.2 galt基因序列分析
3.2.1 galt基因序列同源性分析
将galt基因序列提交至NCBI进行BLAST比对,结果显示,galt属于GH42家族,与海单胞菌Marinomonassp. MWYL1中GH42家族的β-D-半乳糖苷酶基因相似性最高,两者的基因序列一致性为93%,氨基酸序列一致性为95%。选取GenBank中与galt相似性高于70%的序列构建系统发育树(图1)。进化树主要分为3个大的分支A、B、C,分属于嗜热菌、亚栖热菌和海单胞菌属,galt与Marinomonassp. MWYL1中GH42家族的β-D-半乳糖苷酶亲缘关系最接近,与另外4个同是海单胞菌来源的β-D-半乳糖苷酶也具有极高的亲缘性,可推知海单胞菌GH42家族的β-D-半乳糖苷酶在进化上非常保守。
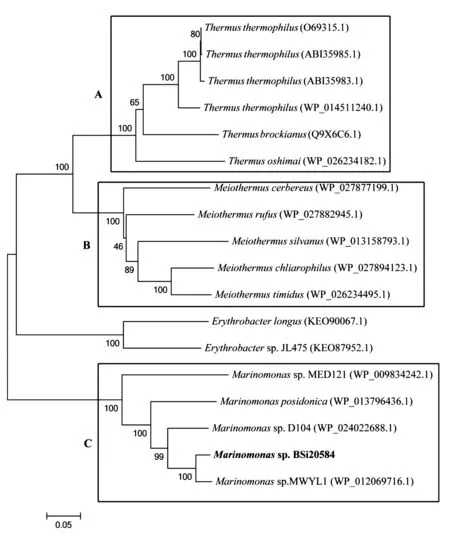
图1 galt产生菌Marinomonas sp. BSi20584系统发育树分析Fig. 1 Phylogenetic tree of galt from Marinomonas sp. BSi20584
3.2.2 GALT蛋白二级结构预测分析
分别用Garnier-Robson法和Chou-Fasman法对GALT酶蛋白二级结构组成和分布进行预测分析(图2)。用Garnier-Robson法得出特定氨基酸残基在特定结构内部的可能性结果为:有32个α螺旋区域,其中370~420之间有一个明显的α螺旋聚集区;有17个β折叠区域,与α螺旋相比,排列稀疏且数量较少;44个转角区域,45个无规则卷曲;用Chou-Fasman法预测酶蛋白的二级结构结果为:α螺旋区域有26个,β折叠区域有24个,比用Garnier-Robson法预测的数量要多,分布相对广泛,转角区域有42个。丰富的二级结构导致了空间结构的丰富性。
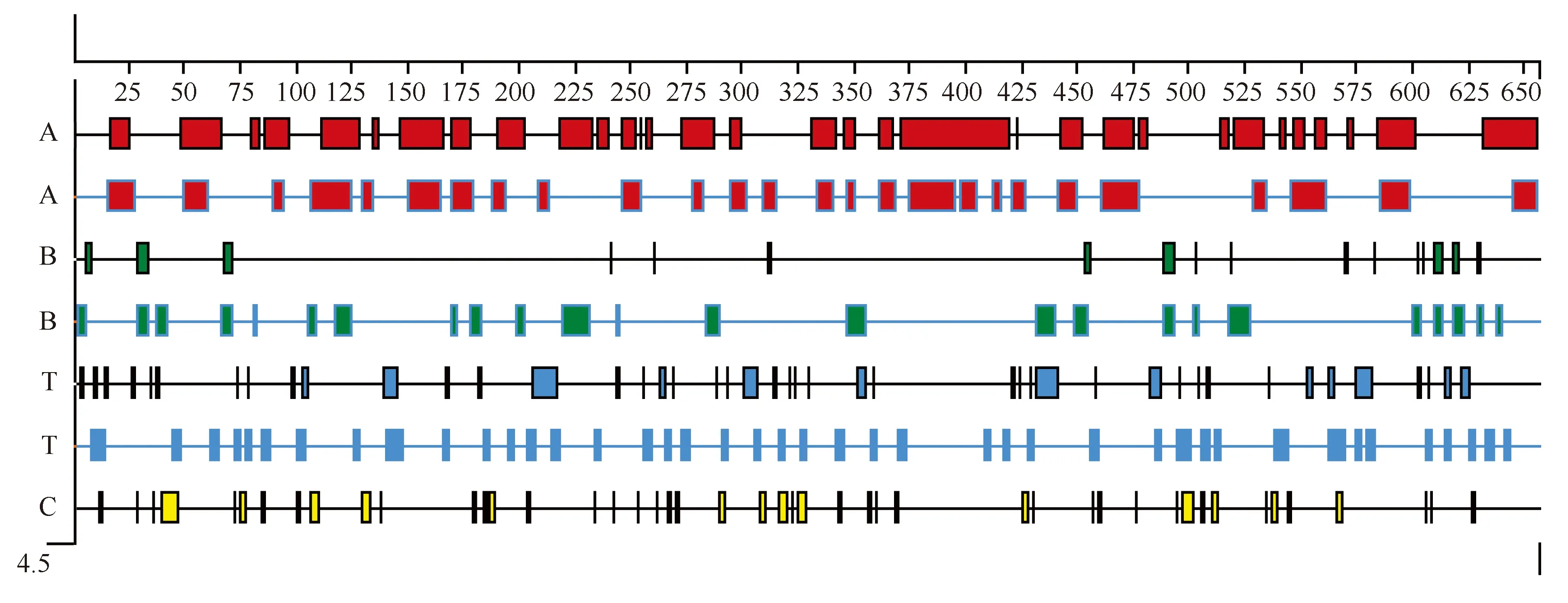
图2 Marinomonas sp. BSi20584 GALT酶蛋白二级结构预测Fig. 2 Marinomonas sp. BSi20584 GALT secondary structure prediction
用Kyte-Doolittle法对GALT蛋白的亲水性进行分析,如图3所示,GALT蛋白亲水性氨基酸分布于整个序列中,与不亲水的区域穿插分布,N端的亲水性氨基酸含量比较高,疏水性片段很少,而C端的疏水性区域相对较多,在375~425处有一个明显的疏水区,在蛋白质中,肽键上的酰胺氢和羰基氧既能形成内部α螺旋内的氢键,也能与水分子形成氢键,但疏水环境不利于氢键的形成,反而会促进形成α螺旋,所以在375~425处由于疏水区的存在,会极大提高α螺旋形成的概率,与用Garnier-Robson法和Chou-Fasman法对BGAL584-2酶蛋白二级结构组成和分布进行预测分析结果一致。
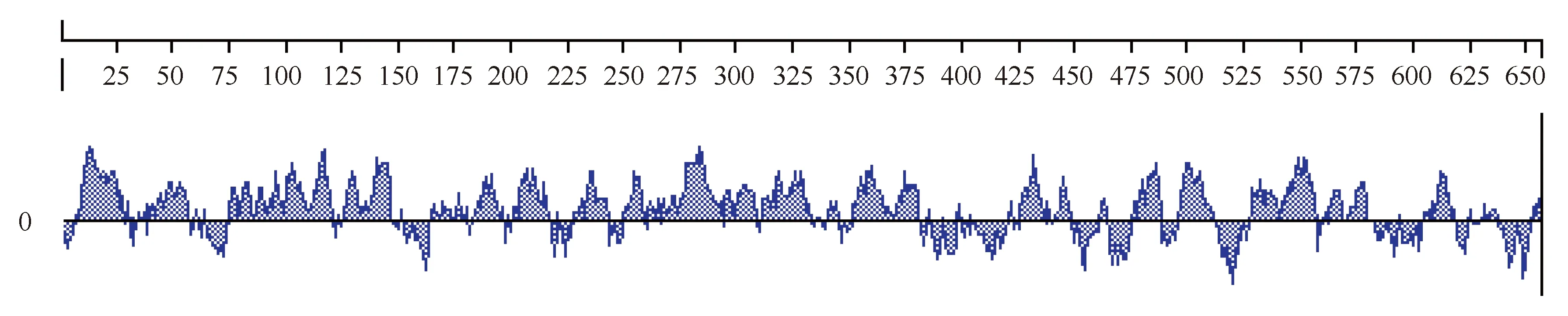
图3 Marinomonas sp. BSi20584 GALT蛋白亲水性分析Fig. 3 Hyrophilicity plot prediction of GALT from Marinomonas sp. BSi20584
用Emini法对GALT蛋白的表面可能性进行分析,如图4所示,发现该蛋白有相当一部分氨基酸位点位于蛋白表面的可能性非常高,例如106位的Tyr、140位的Asp、282位的Glu、503位的Thr等氨基酸位点。
3.2.3 GALT蛋白三维结构预测分析
用Swiss-model预测GALT酶蛋白的三维结构,序列比对显示该酶与同是GH42家族的ThermusthermophilusA4[12]的β-D-半乳糖苷酶氨基酸一致性最高(55.63%),因此选择ThermusthermophilusA4的β-D-半乳糖苷酶作为模板进行三维结构同源建模,建模结果显示GALT天然蛋白为同源三聚体结构。根据ThermusthermophilusA4的β-D-半乳糖苷酶的结构域分布特征,对GALT蛋白进行结构域的划分,结果显示在GALT单体中存在3个结构域,如图5所示,其中,domain A是由(β/α)8形成的TIM桶装结构,为催化结构域;domain B为α/β折叠结构域;domain C为β折叠构成的结构域。ThermusthermophilusA4的β-D-半乳糖苷酶催化位点为Glu141和Glu312,利用Swiss-pdbviwer[13]进行分析,发现在GALT蛋白结构中与其对应的是Glu142和Glu314。此外,ThermusthermophilusA4 β-D-半乳糖苷酶的第182位Trp是酶维持活性所必须的,它可以与其他亚基一起构成活性区域的一部分,而在GALT中与之对应的是Trp183,所以推测GALT的催化位点为Trp183、Glu142和Glu314(图6)。
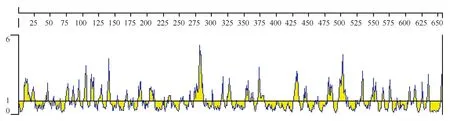
图4 Marinomonas sp. BSi20584 GALT蛋白表面可及性分析Fig.4 Surface probability prediction of GALT from Marinomonas sp. BSi20584
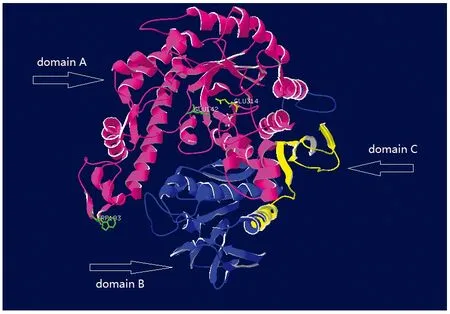
图5 Marinomonas sp. BSi20584 GALT三维结构的同源建模Fig.5 Homology modeling of GALT from Marinomonas sp. BSi20584
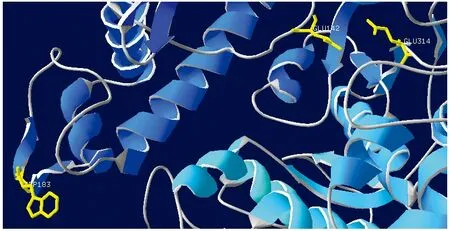
图6 Marinomonas sp. BSi20584 GALT催化位点预测Fig.6 Catalytic residues prediction of GALT from Marinomonas sp. BSi20584
3.3 重组蛋白的表达
将构建成功的重组载体pET-28/galt转入大肠杆菌BL21(DE3)感受态细胞,经LB培养基后,用含50 μg/μL卡那霉素的LB培养基培养到OD600为0.6~0.8,然后加入不同浓度IPTG诱导一定的时间。经过优化,发现重组菌在20℃,IPTG为0.07 mmol/L下诱导22 h时表达效果最好。如图7所示,重组菌可以正确表达重组蛋白,蛋白分子量约为66×103g/mol。
3.4 重组蛋白纯化
在最适诱导条件下(20℃,IPTG为0.07 mmol/L下诱导22 h)培养200 mL菌液,离心收集菌体,用150 mL PBS重置,超声破碎40 min得到粗酶,经镍柱一步纯化即可达到电泳纯,用Millipore的超滤浓缩管(15 mL,10×103g/mol)浓缩除盐,纯化前后酶活力结果如表2所示。
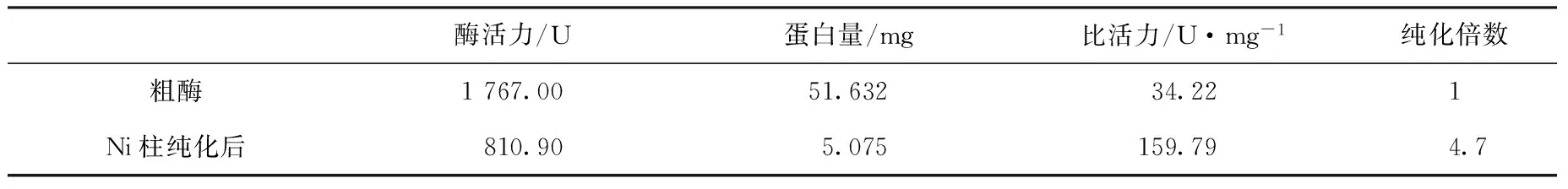
表2 重组酶GALT镍柱纯化前后酶活力比较Tab.2 Enzyme activity contrast of recombinant GALT after the Ni column purification
3.5 GALT蛋白酶学性质研究
3.5.1 最适作用温度与热稳定性
如图8A1所示,GALT最适作用温度为35℃,在30~40℃范围内相对酶活可保持在80%以上,高于40℃酶活水平急剧下降,为中温酶;如图8A2所示,在60℃以下呈现较好的稳定性,低于50℃时处理5 h后,能保持95%以上的相对酶活,60℃处理5 h后仍可保持近60%的相对酶活;70℃处理15 min后,酶完全失活。
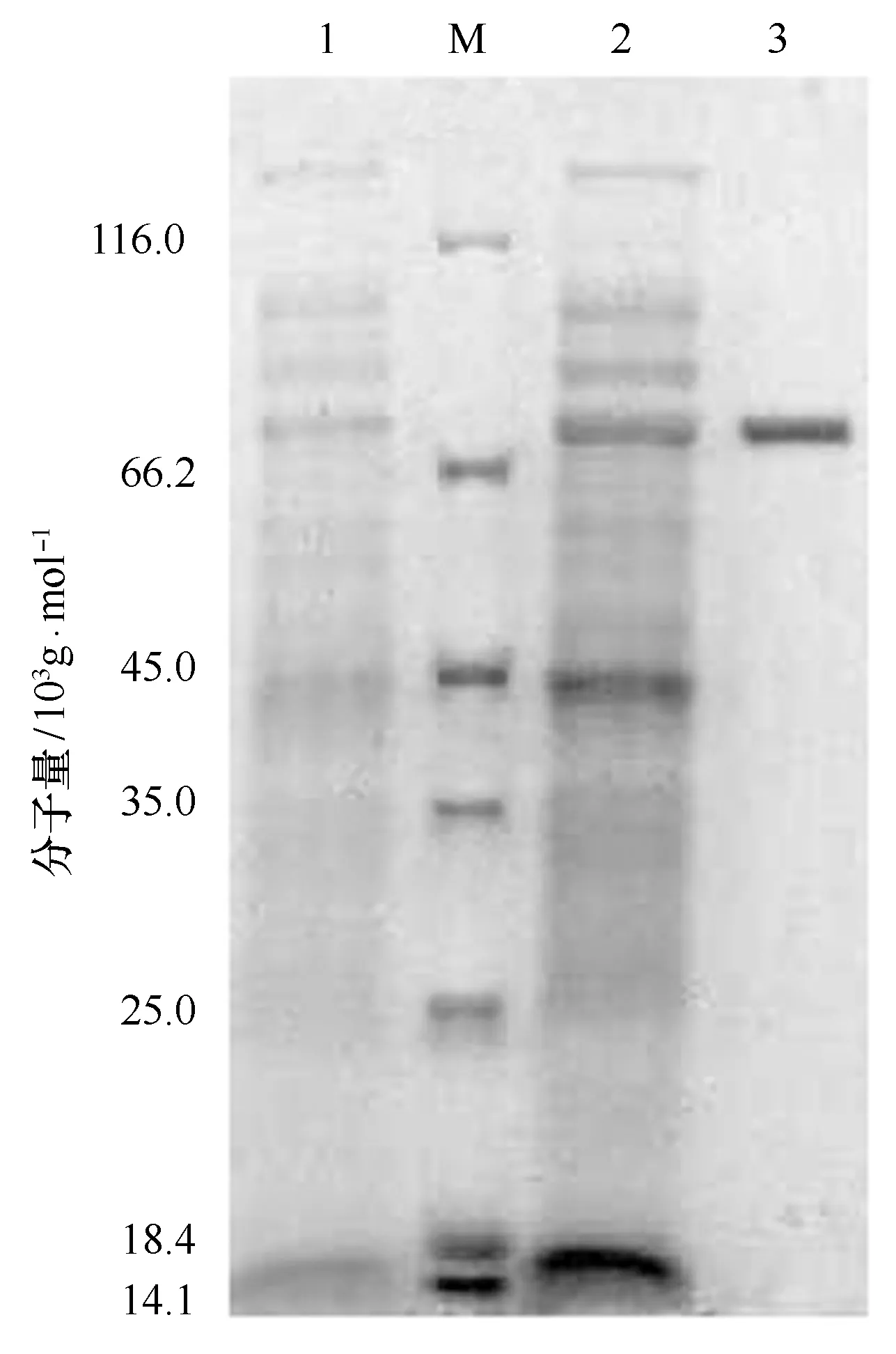
图7 Marinomonas sp. BSi20584 GALT 重组蛋白SDS-PAGE分析(M为蛋白Marker,1为重组菌未诱导样品,2为重组菌诱导后粗酶液,3为GALT纯酶)Fig.7 SDS-PAGE analysis of recombinant GALT from Marinomonas sp. BSi20584 (Lane M: Protein Molecular Weight Marker,Lane 1: non-induced recombinant sample,Lane 2: re-combinant enzyme after induction; Lane 3: purified GALT)
3.5.2 最适pH与pH稳定性
在25℃条件下,测定不同pH环境中酶活的变化,结果如图8B1所示,在pH为9.0时,GALT具有最高酶活,pH在6.0~9.0的范围内可保持60%以上的酶活。GALT的pH稳定性较好,如图8B2所示,pH在6.0~11.0范围内比较稳定,pH>11.0时酶活急剧下降。
3.5.3 NaCl耐受性
如图8C所示,GALT的最适NaCl浓度为0.5 mol/L,重组酶对盐度具有较高的耐受性,当NaCl浓度为3 mol/L时,仍有60%酶活。
3.5.4 化学物质对酶活的影响与金属离子对酶活的影响
如图8D所示,DTT和EDTA对酶活影响不大,而L-谷胱甘肽对酶活有明显的抑制作用,GALT在10 mmol/L的L-谷胱甘肽作用下仅能保持67%的相对酶活,而随着L-谷胱甘肽浓度升高,酶活水平急剧下降;金属离子对酶活的影响如图8E所示,一定浓度的Fe2+、Mn2+对重组酶的酶活有促进作用,其中Fe2+的促进效果最明显,最高可使相对酶活达到223%,而Mg2+离子对酶活的影响不大,Zn2+对酶活有抑制作用,相对酶活水平始终抑制在80%以下。
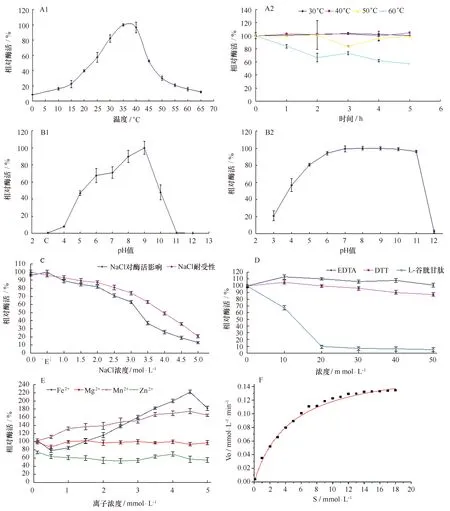
图8 GALT酶学性质研究Fig.8 GALT characterization analysis A1和A2分别表示GALT最适作用温度和热稳定性;B1和B2分别表示GALT最适pH值和pH稳定性;C表示NaCl浓度对酶活影响;D表示化学物质GALT对酶活影响;E代表金属离子对酶活的影响;F表示GALT对ONPG的动力学参数A1: the optimal temperature of GALT,A2: thermal stability of GALT; B1: the optimum pH of GALT,B2: pH stability of GALT; C: effects of different NaCl concentration on enzyme activity; D: effects of different chemicals on enzyme activity; E: effects of different metal irons on en-zyme activity; F: kinetics parameters of GALT towards ONPG
3.5.5 稳态动力学参数
配置不同浓度ONPG,按酶活测定程序测定酶液在50℃时的OD值,然后用非线性拟合法求出GALT的动力学参数,如图8F所示,GALT对ONPG的动力学参数为Vmax=0.172 27 mmol/(L·min),Km=4.586 4 mmol/L。
3.6 重组酶非变性电泳(Native-PAGE)分析
非变性电泳结果显示,该天然酶的分子量约为200×103g/mol(图9),而SDS-PAGE结果显示该酶分子量在66×103g/mol,推测其天然酶为三聚体结构,即该酶在三聚化的状态下起作用,这一结果与Swiss-model的预测结果相符合。
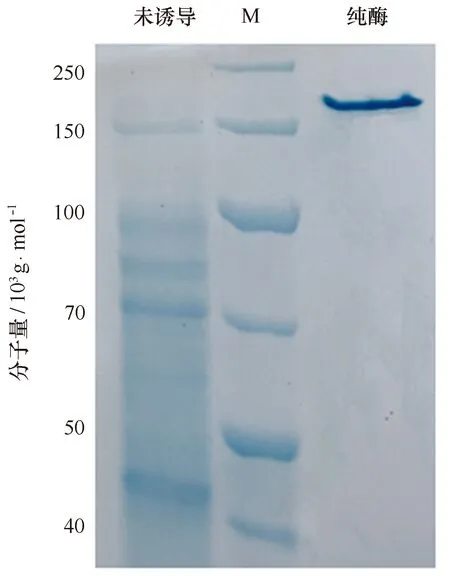
图9 Marinomonas sp. BSi20584重组酶GALT Native-PAGE电泳Fig.9 Native-PAGE result of GALT from Marinomonas sp. BSi20584
3.7 水解底物键型分析
将纯酶与不同键型的底物反应得到的产物进行HPLC分析。结果显示,PA Sugar Chain 026样品反应后在4 min出现了Glc-PA的峰,说明026样品被降解生成了Glc分子,表明该重组酶对β-1,4半乳糖苷键具有水解作用,而PA Sugar Chain 028 和PA Sugar Chain 042样品反应后均没有新物质峰的产生,说明GALT对Gal β1-3 GalNAc和Gal β1-3 GalNAc糖苷键型则没有水解能力(图10)。
4 结论
galt基因全长1 971 bp,共编码656个氨基酸,将galt基因与pET-28a(+)载体连接后导入大肠杆菌BL21(DE3)感受态细胞,用IPTG进行原核诱导表达。对该酶的三维结构预测显示,推测GALT含有3个结构域,domain A是由(β/α)8形成的TIM桶装结构,为催化结构域;domain B为α/β折叠结构域;domain C为β折叠构成的结构域,预测GALT的催化位点为Trp183、Glu142和Glu314。
酶学性质研究表明,该酶单体分子量约为66×103g/mol,天然酶分子量约为200×103g/mol,其天然酶为同源三聚体。GALT最适作用温度为35℃,在30~40℃范围内相对酶活可保持在80%以上,高于40℃酶活水平急剧下降,属于中温酶,该β-D-半乳糖苷酶的热稳定性较好,在60℃环境中处理5 h后,仍可保持近60%的相对酶活。GALT的最适作用pH为9.0,pH在6.0~9.0的范围内可保持60%以上的酶活,pH在6.0~11.0范围内比较稳定,在pH>11.0时酶活急剧下降。GALT的最适NaCl浓度为0.5 mol/L,对盐度具有较高的耐受性,当NaCl浓度为3 mol/L时,仍有60%酶活。DTT和EDTA对GALT活性影响不大,而L-谷胱甘肽对酶活有明显的抑制作用。一定浓度的Fe2+、Mn2+对GALT的活性有促进作用,其中Fe2+的促进效果最明显,最高可使相对酶活达到223%,而Mg2+离子对酶活的影响不大,Zn2+对酶活有抑制作用,相对酶活水平始终抑制在80%以下。GALT对ONPG的Vmax和Km分别为0.172 27 nmol/min和4.586 4 mmol/L。GALT对β-1,4半乳糖苷键具有水解作用(PA Sugar Chain 026),对Gal β1-3 GalNAc(PA Sugar Chain 028)和Gal β1-3 GlcNAc(PA Sugar Chain 042)糖苷键型没有水解能力。
5 讨论
蛋白质的结构与其功能具有密不可分的关系,因此,分析GALT的三维结构有利于进一步揭示其功能。三维结构预测发现,Glu142和Glu314为重组酶的催化位点,与ThermusthermophilusA4的β-D-半乳糖苷酶的催化位点Glu141和Glu312相对应[12]。Glu的催化位点在β-D-半乳糖苷酶中极为常见,例如,大肠杆菌β-D-半乳糖苷酶的Glu461和Glu537位点[13]、BacilluscircμlansATCC 31382中Glu447和Glu532[14]位点均为催化位点。对ThermusthermophilusA4 β-D-半乳糖苷酶的研究表明[12],Trp182是维持其天然活性所必须的,它可以与其他亚基一起构成活性区域的一部分,这也说明β-D-半乳糖苷酶并不是以单体状态起作用,必须与其他亚基一起才能形成有活性的酶蛋白,在本研究中通过建模预测和活性电泳确定了天然GALT全酶是以三聚体的形式发挥催化作用的,Trp作为重要的催化位点这种现象在其他β-D-半乳糖苷酶中同样存在,如大肠杆菌β-D-半乳糖苷酶中的Trp999[13]。
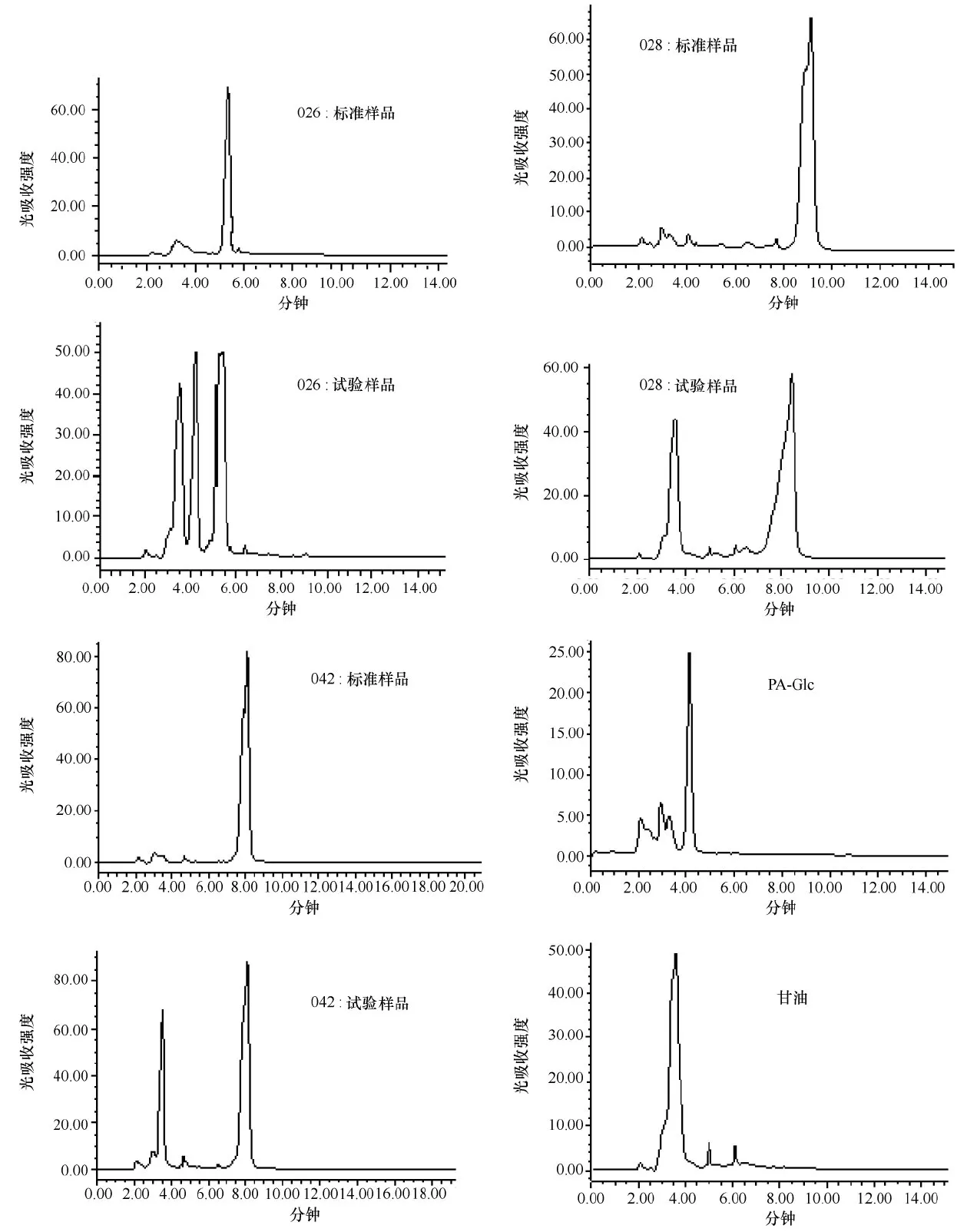
图10 Marinomonas sp. BSi20584 GALT重组酶的键型水解特异性Fig.10 The hydrolysis specificity of the recombinant enzyme GALT from Marinomonas sp. BSi20584
BSi20584产生的β-D-半乳糖苷酶的最适温度为35℃,属于中温酶的范畴,与一般中温微生物来源的酶相比具有较高的热稳定性,却低于一些嗜热菌来源的β-D-半乳糖苷酶,例如,Pyrococcusfuriosus[15]的最适温度能够达到90℃,Sulfolobussolfataricus[16]的最适温度为85℃。但是,南极地区也发现过不属于嗜热菌却有较高最适温度的酶,如发现于南极的嗜盐菌Halorubrumlacusprofundi[17]的β-D-半乳糖苷酶,其最适温度为50℃。
此外,我们在研究金属离子对酶活影响时发现,Fe2+对酶活有促进作用,推测原因可能为Fe2+对酶的催化作用位点起作用,而Zn2+对酶活有一定的抑制作用,并且随着浓度的增加,抑制作用增大,在其他β-D-半乳糖苷酶中也发现了类似的情况,在Lactobacillusdelbrueckii[18]和Arthrobactersp. ON14[19]中同样发现Zn2+会抑制酶活,推测原因可能是Zn2+的存在改变了半乳糖苷酶的构象,从而使酶活受到抑制。DTT和EDTA对GALT活性影响不大,而L-谷胱甘肽对酶活有明显的抑制作用,推测原因为L-谷胱甘肽破坏了酶蛋白的二硫键,从而影响其酶活。重组酶基因来源于北极海单胞菌,对NaCl具有一定的耐受性,但远远低于嗜盐菌的耐受性,例如分离自南极的Halorubrumlacusprofundi[17],在NaCl浓度为4.0 mmol/L时具有最高酶活。表3为不同来源的β-D-半乳糖苷酶性质比较。
生存于海洋低温环境中的微生物,往往是通过调节代谢来适应环境,适应性机制包括:能量传导和胞内环境新陈代谢调节的特殊机制;细胞膜、细胞壁结构成分和功能成分的稳定性;反应动力学和蛋白质构象及酶系的功能[31]。Marinomonassp. BSi20584来源于北冰洋海冰冰心,生长在低温环境,其产生的β-D-半乳糖苷酶为中温酶,这种现象可能与其进化和环境适应性有关,相关的机制尚不清楚。本研究中的Marinomonassp. BSi20584和嗜盐菌Halorubrumlacusprofundi[17]都是从极地寒冷环境中所分离,它们体内的酶若要在低温下发挥作用,需要具有足够的构象稳定性,因而进化出较高的构象稳定性,一般而言,构象稳定性高的酶也具有较高的热稳定性和最适反应温度。同理,酶若要在冰心内的低温环境下维持较高活性,就难以进化出高的构象稳定性,因为低温下过高的构象稳定性会导致酶活性中心柔性的降低,不利于实现活性中心与低温环境下底物结合和产物释放这两种构象的快速切换。因此,本研究中海单胞菌β-D-半乳糖苷酶的热稳定性和最适反应温度符合中温酶的特性,是细菌自身适应其生存环境的结果。
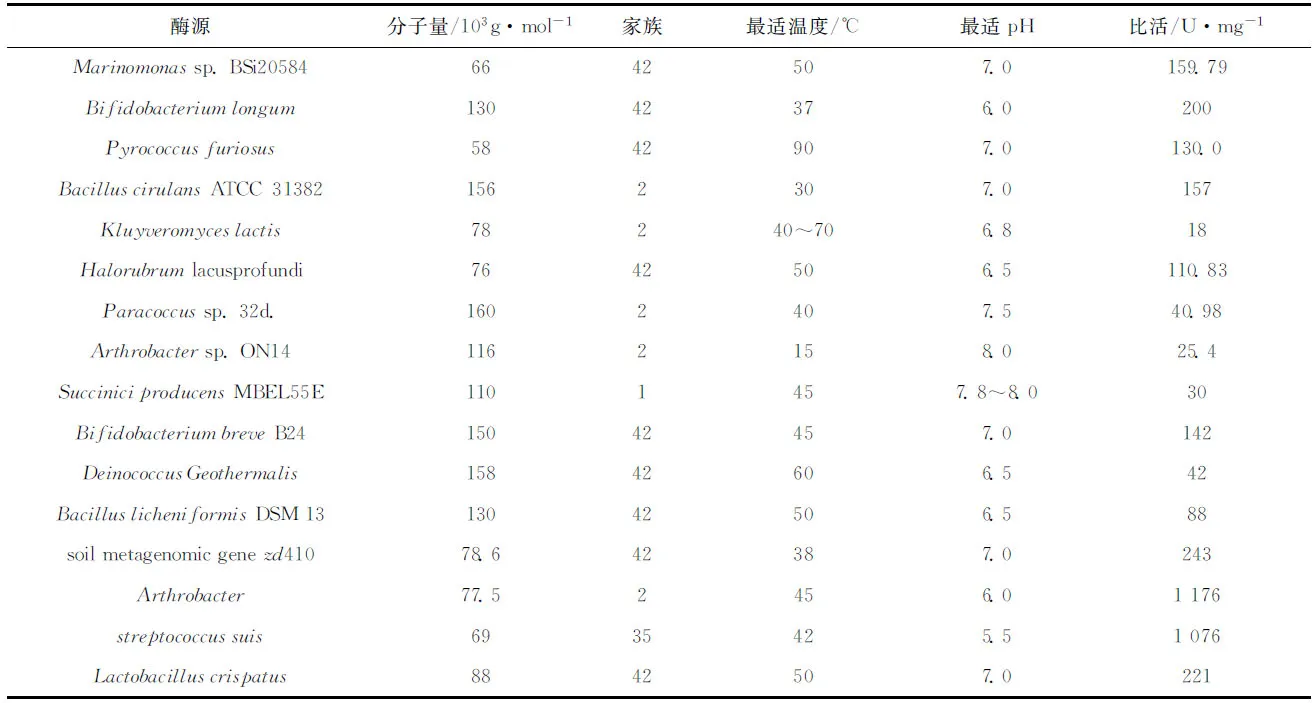
表3 不同来源β-D-半乳糖苷酶性质对比[14—29]Tab.3 Characterization contrast among different β-galactosidase
本文通过Marinomonassp.BSi20584重组表达所产生的β-D-半乳糖苷酶在基因序列、蛋白结构及酶学性质等方面进行了深入的研究,为进一步揭示基因序列与蛋白功能的关系,及酶蛋白结晶及结构解析奠定了基础。
[1] Khalid A A,Rahim,Byong H L,et al. Specifieity,inhibitory,studies and oligoaseeharide fomartoin by β-Galacotsidaes form psychrotorphieBacillussubtilisKL88[J]. J Dairy Sci,1991,74: 1773-1778.
[2] Cantarel B L,Coutinho P M,Rancurel C. The carbohydrate-active enzymes database(CAZy): an expert resource for glycogenomics[J]. Nucleic Acids Res,2009,37: 233-238.
[3] 张莉,李庆章,田雷. β-半乳糖苷酶研究进展[J]. 东北农业大学学报,2009,40(7): 128-131.
Zhang Li,Li Qingzhang,Tian Lei. Research advancement of β-Galacotsidaes[J]. Journal of Northeast Agricultural University,2009,40(7): 128-131.
[4] 林金资,卢蓉蓉,李强军,等. 中性乳糖酶高产菌的选育[J]. 中国乳品工业,1995(3): 113-116.
Lin Jinzi,Lu Rongrong,Li Qiangjun. Screening of high-yielding strains for neutral lactose[J]. China Dairy Industry,1995(3): 113-116.
[5] Dong C M,Bai X H,Lai Q L,et al. Draft genome sequence ofMarinomonassp. strain D104,a polycyclic aromatic hydrocarbon-degrading bacterium from the deep-sea sediment of the Arctic Ocean[J]. Genome Announcements,2014,2(1): 1211-1213.
[6] Lucas-Elío P,Goodwin L,Woyke T,et al. Complete genome sequence ofMarinomonasposidonicatype strain (IVIA-Po-181(T))[J]. Standards in Genomic Sciences,2012,7: 31-43.
[7] Lucas-Elío P,Goodwin L,Woyke T,et al. Complete genome sequence of the melanogenic marine bacteriumMarinomonasmediterraneatype strain (MMB-1T)[J]. Standards in Genomic Sciences,2012,5: 63-73.
[8] 周莉莉,陈瑞琴,陈秀兰,等. 应用hiTAIL-PCR技术克隆Marinomonassp.BSI20584菌株β-半乳糖苷酶基因[J]. 极地研究,2013,25(3): 250-256.
Zhou Lili,Chen Ruiqin,Chen Xiulan,et al. Cloning of beta-galactosidase genes fromMarinomonassp. BSI20584 by hiTAIL-PCR[J]. Polar Research,2013,25(3): 250-256.
[9] 郑海学,刘湘涛,尚佑军,等. 猪水泡病病毒结构蛋白基因的克隆及其蛋白二级结构和淋巴细胞表位的预测[J]. 中国兽医科学,2005,35(11): 843-850.
Zheng Haixue,Liu Xiangtao,Shang Youjun,et al. Cloning of SVDV structural protein gene and predictions of secondary structure and lymphocyte epitopes of structural protein[J]. Chinese Journal of Veterinary Science and Technology,2005,35(11): 843-850.
[10] 周莉莉. 北极海单胞菌β-半乳糖苷酶的原核表达及其转糖基活性检测[D]. 上海: 华东理工大学,2012.
Zhou Lili. Expression,purification and transgalactosylation of β-galactosidase from theMarinomonasstrain isolated from Arctic Ocean[D]. Shanghai: East China University of Science and Technology,2012.
[11] Vanessa S,Terra K A,Homer S G,et al. Characterization of novel beta-galactosidase activity that contributes to glycoprotein degradation and virulence inStreptococcuspneumoniae[J]. Infection and Immunity,2010,78(1): 348-357.
[12] Hidaka M,Fushinobu S,Ohtsu N,et al. Trimeric crystal structure of the glycoside hydrolase family 42 beta-galactosidase fromThermusthermophilusA4 and the structure of its complex with galactose[J]. Journal of Biochemistry and Molecμlar Biology, 2002,322(1): 79-91.
[13] Matthews B W. The structure ofE.coliβ-galactosidase[J]. Comptes Renndus Biologies,2005,328(6): 549-556.
[14] Bultema J B,Kuipers B J H,Dijkhuizen L. Biochemical characterization of mutants in the active site residues of the beta-galactosidase enzyme ofBacilluscircμlansATCC 31382[J]. FebS Open Bio,2014,11(4): 354-361.
[15] 段文娟,杨娇艳,李卓夫,等. 来源于嗜热古细菌Pyrococcusfuriosus乳糖酶基因的原核表达及酶学性质分析[J]. 中国农业科技导报,2008,10(2): 76-81.
Duan Wenjuan,Yang Yanyan,Li Zhuofu,et al. Expression of beta-galactosidase fromPyrococcusfuriosusinE.coliand Analysis of Lactose properities[J]. Journal of Agricultural Science and Technology,2008,10(2): 76-81.
[16] Sun X J,Duan X G,Wu D,et al. Characterization ofSulfolobussolfataricusbeta-galactosidase mutant F441Y expressed inPichiapastoris[J]. Journal of the Science of Food and Agriculture,2013,94(7): 94-97.
[17] DasSarma S,Capes M D,Karan R,et al. Amino acid substitutions in cold-adapted proteins fromHalorubrumlacusprofundi,an extremely halophilic microbe from Antarctica[J]. PLOS ONE,2013,8: 82-90.
[18] Wang C,Zhang C W,Yu Q,et al. Beta-galactosidase gene fromLactobacillusdelbrueckiisubsp.bulgaricusgets non-fusion expression inEscherichiacoli[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2008,39: 544-546.
[19] Xu K,Tang X A; Gai Y B,et al. Molecular characterization of cold-inducible beta-galactosidase fromArthrobactersp. ON14 isolated from Antarctica[J]. Journal of Microbilogy and Biotechnology,2011,21: 236-238.
[20] Dabrowski S,Sobiewska G,Maciunska J,et al. Cloning,expression,and purification of the His6-Tagged thermostable β-galactosidase fromPyrococcuswoeseiinEscherichiacoliand some properties of the isolated enzyme[J]. Protein Expression and Purification,2000,19(1): 107-112.
[21] Hildebrandt P,Wanarska M,Kur J. A new cold-adapted beta-D-galactosidase from the AntarcticArthrobactersp. 32c-gene cloning,overexpression,purification and properties[J]. BMC Microbiology,2009,9(1): 151-152.
[22] Halbmayr E,Mathiesen G,Nguyen T,et al. High-level expression of recombinant beta-galactosidases inLactobacillusplantarumandLactobacillussakeiusing a sakacin P-based expression system[J]. Agricultural and Food Chemistry,2008,56(12): 4710-4719.
[23] Maischberger T,Mierau I,Peterbauer C K,et al. High-level expression ofLactobacillusβ-galactosidases inLactococcuslactisusing the food-grade. nisin-controlled expression system NICE[J]. Journal of Agricultural and Food Chemistry,2010,58 (4): 2279-2287.
[24] Kim C S,Ji E S,Oh D K. Characterization of a thermostable recombinant β-galactosidase fromThermotogamaritima[J]. Journal of Applied Microbiology,2004,97 (5): 1006-1014.
[25] Li L,Zhang M,Jiang Z,et al. Characterisation of a thermostable family 42 β-galactosidase fromThermotogamaritima[J]. Food Chemistry,2009,112 (4): 844-850.
[26] Kang S K,Cho K K,Ahn J K,et al. Three forms of thermostable lactose-hydrolase fromThermussp. IB-21; cloning,expression,and enzyme characterization[J]. Journal of biotechnology,2005,116 (4): 337-346.
[27] Pessela B C C,Vian A,Mateo C,et al. Overproduction ofThermussp. Strain T2 β-galactosidase inEscherichiacoliand preparation by using tailor-made metal chelate supports[J]. Applied and Environmental Microbiology,2003,69(4): 1967-1972.
[28] 张凤玉,胡丹,龚秀芳,等. 2型猪链球菌β-D-半乳糖苷酶基因的克隆表达及酶活性测定[J]. 中国生物工程杂志,2014,34(2): 39-44.
Zhang Fengyu,Hu Dan,Gong Xiufang,et al. Cloning,expression and identification of gene encoding the β-Galactosidases ofStreptococcussuisserotype 2[J]. China Biotechnology,2014,34(2): 39-44.
[29] 聂春明. 乳酸杆菌β-D-半乳糖苷酶重叠基因的克隆、表达及酶学性质分析[D].呼和浩特市:内蒙古农业大学,2012.
Nie Chunming. The overlapping gene cloning,expression and characterization of a β-galactosidases fromLactobacilluscrispatus[D]. Hohhot: Inner Mongolia Agricultural University,2012.
[30] Hung M N,Xia Z,Hu N T,et al. Molecular and biochemical analysis of two β-galactosidases fromBifidobacteriuminfantisHL96[J]. Applied and Environmental Microbiology,2001,67 (9): 4256-4263.
[31] Cummings S P,Black G W. Polymer hydrolysis a cold climate[J]. Extremophiled,1999,3(2): 81-87.
Heterologous expression and its enzymatic properties of β-galactosidase from a Marinomonas strain isolated from the Arctic Ocean
Sun Xi1,2,Liao Li2,Ding Haitao2,Liu Shuang1,Chen Bo1,2
(1.CollegeofBioengineering,EastChinaUniversityofScienceandTechnology,Shanghai200237,China; 2.KeyLaboratoryforPolarScience,StateOceanicAdministration,PolarResearchInstituteofChina,Shanghai200136,China)
AMarinomonasstrain isolated from an ice core sample collected from Canada Basin,Arctic Ocean,displayed high β-galactosidase activity in the preliminary screening process. To get its overall understanding towards its enzymatic properties,thegaltgene obtained by hiTAIL-PCR amplification was inserted into plasmid pET-28a(+),then transformed intoE.coliBL21 (DE3). The recombinant enzyme was purified to electrophoretic homogeneity by one step Ni2+affinity chromatography. The highest yield was achieved with 0.07mM IPTG when cultivated in 20℃ for 22 h. The molecular weight of the monomeric GALT was estimated as about 6.6×104g/mol and the native GALT was confirmed as homologous trimer through native-PAGE. The optimum temperature of GALT was 35℃ and showed good thermal stability at the temperature of 60℃ below. The optimum pH of GALT was 9.0 and was stable between pH 6.0 and 11.0. GALT showed high tolerance to salinity and the optimum NaCl concentration was 0.5 mol/L. Mineral ions Fe2+and Mn2+were identified as enzyme activators,Mg2+,K+,DTT and EDTA showed no significant influence towards the enzyme activity,while Zn2+and L-glutathione inhibited the activity strongly. GALT was able to hydrolyse Gal β1-4 GlcNAc but unable to hydrolyze Gal β1-3 GalNAc and Gal β1-3 GlcNAc. In this study,the β-galactosidase gene fromMarinomonassp. BSi20584 was successfully expressed inE.colisystem,and a systematic understanding of the enzymatic properties of the recombinant GALT was acquired,which will provide the detailed enzymatic data for further studies on its metabolic adaptation and potential applications.
the Arctic Ocean; β-galactosidase;Marinomonas; heterologous expression; enzymatic properties
2015-04-10;
2015-06-15。
国家“863”计划(2012AA092105);海洋公益性行业科研专项经费项目(201005032-4);上海市自然科学基金项目(13ZR1462700);南北极环境综合考察与评估专项(CHINARE04-03/04-05/01-06)。
孙茜(1989—),女,山东省淄博市人,主要从事极地微生物功能基因及其克隆表达研究。E-mail:545379435@qq.com
*通信作者:陈波,研究员,主要从事极地微生物学研究。E-mail:chenbo@pric.org.cn
10.3969/j.issn.0253-4193.2015.11.016
TQ925
A
0253-4193(2015)11-0165-13
孙茜,廖丽,丁海涛,等. 北冰洋海单胞菌β-D-半乳糖苷酶的异源表达及酶学特性研究[J]. 海洋学报,2015,37(11): 165-177,
Sun Xi,Liao Li,Ding Haitao,et al. Heterologous expression and its enzymatic properties of β-galactosidase from aMarinomonasstrain isolated from the Arctic Ocean[J]. Haiyang Xuebao,2015,37(11): 165-177,doi:10.3969/j.issn.0253-4193.2015.11.016

