曲克芦丁微乳的处方筛选及含量测定*
许曼,余庆,赵倩茹,陈伟,林元节,金涌
(安徽医科大学药学院,合肥 230032)
曲克芦丁微乳的处方筛选及含量测定*
许曼,余庆,赵倩茹,陈伟,林元节,金涌
(安徽医科大学药学院,合肥 230032)
目的筛选亲水性药物曲克芦丁油包水型口服微乳的最佳处方,考察其形态、粒径大小、稳定性,并建立其含量测定方法。方法利用伪三元相图,以微乳形成区域大小为指标,筛选制备微乳的最佳处方。采用高效液相色谱法测定微乳中药物含量。结果筛选出的最佳处方是大豆磷脂/无水乙醇/肉豆蔻酸异丙酯/纯化水=23.30:11.67:52.45:12.59。所制得的微乳外观圆整,大小分布均匀,平均粒径为50.20 nm,具有良好稳定性。结论大豆磷脂/无水乙醇/肉豆蔻酸异丙酯/纯化水体系将曲克芦丁成功包载于水相,有望为曲克芦丁口服给药提供一种有效的新剂型。
曲克芦丁;伪三元相图;微乳;质量评价
曲克芦丁是芦丁经羟乙基化制成的半合成黄酮类化合物,具有抑制红细胞和血小板聚集、防止血栓形成的作用,临床用于治疗慢性静脉功能不全、静脉曲张、血栓症及脑血管疾病[1]。曲克芦丁口服后很少被吸收,生物利用度极低[2-3]。因此以提高生物利用度为目的对其进行剂型改造具有重要的意义。微乳是由表面活性剂、助表面活性剂、水相和油相组成的热力学稳定体系,具有保护药物避免胃肠道酶破坏、提高难溶性药物的溶解度以及增加药物生物利用度等优点。目前,国内外已有大量文献报道油包水W/O型微乳可以提高水溶性药物的生物利用度[4-5]。课题筛选最佳制备曲克芦丁W/O型微乳的处方并对其进行质量评价,为后续研究曲克芦丁微乳的吸收做准备。
1 仪器与试药
1.1 仪器 LC-20A型高效液相色谱仪(日本岛津);79HW-1型恒温磁力搅拌器(江苏金坛金城国胜实验仪器厂);DDS-11AW型电导率仪(上海般特仪器有限公司);PHS-3C型pH计(上海雷磁仪器厂);Nano ZS90型激光纳米粒度仪(英国马尔文公司);超纯水机(美国Millipore公司)。
1.2 试药 曲克芦丁对照品(中国食品药品检定研究院,批号:100416-201004);曲克芦丁原料药(批号:J1225037)、大豆油(批号:17532)为阿拉丁试剂上海有限公司提供;大豆磷脂(Lecithin,上海太伟药业有限公司,批号:20130404);司盘80、聚山梨酯80、聚乙二醇400、油酸乙酯、肉豆蔻酸异丙酯、无水乙醇、异丙醇、1,2-丙二醇均为国药集团化学试剂有限公司提供;氢化蓖麻油7(上海厚诚精细化工有限公司);辛癸酸甘油酯(西亚试剂);甲醇为色谱纯,水为纯化水,其余试剂为分析纯。
2 方法与结果
2.1 伪三元相图的绘制 精密称取表面活性剂和助表面活性剂于干燥洁净的小安瓿瓶中,按一定比例溶解混匀(表面活性剂/助表面活性剂=Km),即为混合表面活性剂,取此混合表面活性剂分别按9:1,8:2,7:3,6:4,5:5,4:6,3:7,2:8,1:9比例与油相混合,置于恒温磁力搅拌器上,缓慢滴加纯化水使体系充分混匀,肉眼观察体系由澄清透明变浑浊时,记录此时(临界点)加入的水量,并计算油相、水相、混和表面活性剂在临界点各自的质量百分数,利用Origin8.0绘制伪三元相图,确定微乳区。
2.2 微乳处方的初步筛选 选用氢化蓖麻油7、司盘80、大豆磷脂、司盘80和聚山梨酯80复配、司盘80和泊洛沙姆188复配为表面活性剂作为筛选对象,以无水乙醇、异丙醇、1,2-丙二醇、聚乙二醇400为助表面活性剂。考察不同种类表面活性剂和助表面活性剂的互溶情况,初步筛选混合表面活性剂的组成。固定Km值为1:1,混合表面活性剂与油相(肉豆蔻酸异丙酯、辛癸酸甘油酯、油酸乙酯、大豆油)以1:1混合后滴加水,考察各组合微乳形成难易及载水量大小。
实验结果显示,司盘80和泊洛沙姆188复配不易溶于各助表面活性剂,助表面活性剂1,2-丙二醇,聚乙二醇400对各表面活性剂溶解能力较弱,均不宜用于制备微乳。异丙醇作助表面活性剂较易形成微乳且载水量大,但无水乙醇更适用于药用载体的制备,并且可在一定范围内形成性质稳定的W/O型微乳。以大豆油为油相时,各体系不能形成微乳或形成的微乳载水量很小。因此,选择表面活性剂氢化蓖麻油7、司盘80、大豆磷脂、司盘80和聚山梨酯80复配,助表面活性剂无水乙醇和油相肉豆蔻酸异丙酯、辛癸酸甘油酯、油酸乙酯进一步筛选。
2.3 利用伪三元相图筛选微乳处方:
2.3.1 表面活性剂的选择 室温25 ℃下,固定Km值为1:1,助表面活性剂为无水乙醇,油相为肉豆蔻酸异丙酯,以微乳相图区域面积大小为指标,考察氢化蓖麻油7、大豆磷脂、司盘80、司盘80和聚山梨酯80复配所形成的微乳区域大小。由图1可知,大豆磷脂所形成微乳区域最大,氢化蓖麻油7其次,司盘80、司盘80和聚山梨酯80复配相差不大。 因此,选择大豆磷脂为表面活性剂制备曲克芦丁微乳。
2.3.2 油相的选择 固定Km值为1:1,表面活性剂为大豆磷脂,助表面活性剂为无水乙醇,分别考察肉豆蔻酸异丙酯、油酸乙酯和辛癸酸甘油酯作为油相时微乳区域大小。图2表明,肉豆蔻酸异丙酯作为油相形成的微乳区域面积大于油酸乙酯和辛癸酸甘油酯,故选择肉豆蔻酸异丙酯为油相进行处方优化。
2.3.3 温度对微乳形成区域的影响 分别于16,25和37 ℃,以大豆磷脂/无水乙醇(Km=1:1)为混合表面活性剂,肉豆蔻酸异丙酯作为油相,绘制伪三元相图。由图3可知,随着温度的升高,微乳区域面积增大。但是37 ℃条件下制成的微乳,冷却后常会变浑浊,且大豆磷脂对高温敏感,无水乙醇在温度较高时会挥发,兼顾微乳区域面积大小和微乳稳定性,选择室温(25 ℃)下制备微乳。
2.3.4 表面活性剂与助表面活性剂的质量比(Km)的选择 25 ℃条件下,在大豆磷脂/无水乙醇/肉豆蔻酸异

图1 4种表面活性剂的伪三元相图

图2 3种油相的伪三元相图
丙酯/纯化水体系中,分别采用Km为1:2,1:1,2:1和3:1制备相图,考察Km对微乳形成的影响。从图4看出,随着Km值由1:2增大到2:1,微乳区域的面积呈现出相应的增大,但当Km值为3:1时微乳区面积较2:1时有所减小,目视法可观察到此时微乳液的黏度大,极易形成粘稠的凝胶区。由于Km值为2:1时所制备的微乳既可以形成较大的微乳区域又满足低含量表面活性剂的原则,因此最终确定Km为2:1是最佳选择。
2.4 最优处方及曲克芦丁微乳的制备 根据最少表面活性剂用量的原则,结合微乳稳定性、载药量、制剂成本等因素考虑,选择混合表面活性剂与油相比例为4:6,纯化水加入量为此比例下最大载水量的70%,由此空白微乳处方确定为:大豆磷脂:无水乙醇:肉豆蔻酸异丙酯:双蒸水=23.30:11.67:52.45:12.59。在制备曲克芦丁微乳时,将其溶解于纯化水中,缓慢滴加进混和表面活性剂和油相组成的混合物中,在室温下搅拌30 min,混匀,即得到透明的曲克芦丁微乳。
2.5 曲克芦丁微乳的质量评价
2.5.1 性状 目视观察制备的曲克芦丁微乳的性状,由图5可见,本品为微乳制剂,常温下为黄色、透明的澄清液体,且流动性好。
2.5.2 曲克芦丁微乳的鉴别
2.5.2.1 染色法 取相同体积曲克芦丁微乳2份,置于试管中,同时各加入2滴苏丹Ⅲ和亚甲基蓝,静置观察扩散情况。如图6所示,油溶性染料苏丹Ⅲ在微乳中的扩散速度大于水溶性染料亚甲基蓝,所制备的微乳为W/O型微乳。
2.5.2.2 电导率法 取同体积空白微乳、曲克芦丁微乳、曲克芦丁水溶液和油相(肉豆蔻酸异丙酯),采用DDS-11AW电导率仪测定其电导率。实验测得空白微乳和
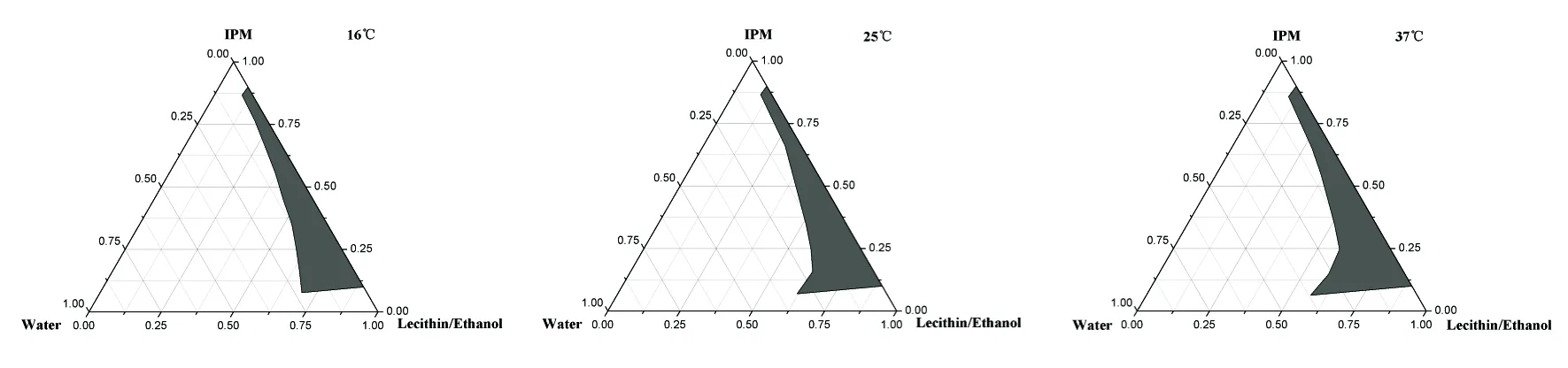
图3 3种温度下的伪三元相图
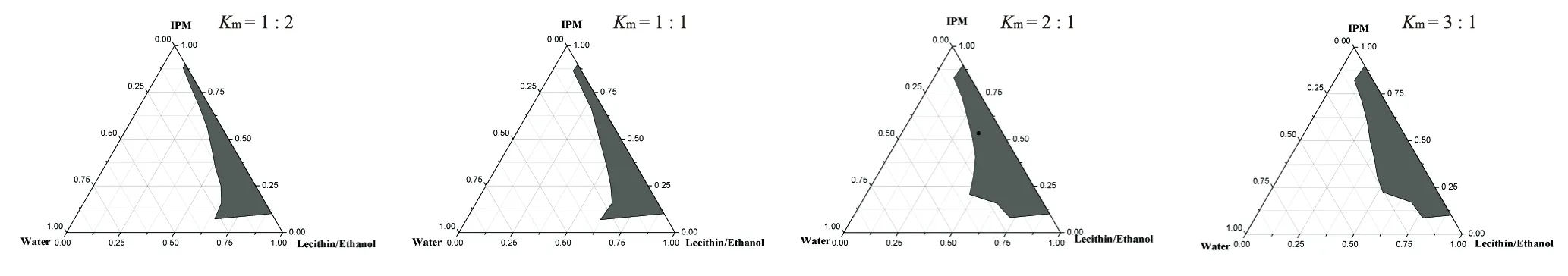
图4 4种Km值的伪三元相图

图5 曲克芦丁微乳外观
Fig.5 Appearance of troxerutin microemulsion

图6 曲克芦丁微乳类型
曲克芦丁微乳的电导率值接近于油相的电导率值,且明显小于曲克芦丁水溶液的电导率值,故可判定此微乳为以不是良导体的油相为外相的W/O型微乳。
2.5.3 曲克芦丁微乳显微形态观察 将曲克芦丁微乳稀释10倍,取适量滴在覆有支持膜的铜网上,静止10 min后用滤纸吸干多余液体,再滴加2%磷钨酸溶液于铜网上负染5 min,干燥后电镜下观察结果。如图7所示,在透射电镜下曲克芦丁微乳乳滴为圆球形,大小分布较均匀,且满足微乳粒径范围的要求。
2.5.4 微乳的粒径分布 取3批曲克芦丁微乳,采用马尔文激光纳米粒度仪测定其粒径和粒径分布。粒径测定结果见图8,平均粒径为(50.20±4.05) nm,多分散指数为(0.187±0.025),表明微乳的分布范围较窄,粒径大小较均匀。
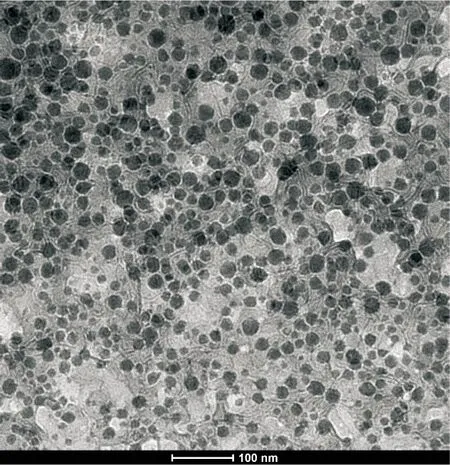
图7 曲克芦丁微乳的透射电镜观察(×62 000)
Fig.7 Observation of troxerutin microemulsion under transmission electron microphotography(×62 000)
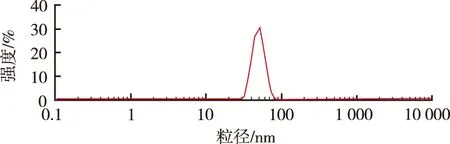
图8 曲克芦丁微乳的粒径分布
Fig.8 Size distribution of troxerutin microemulsion
2.5.5 稳定性实验 取曲克芦丁微乳10 mL,室温放置6个月,分别在 0,1,2,3,6个月对其电导率、pH值、药物含量进行检测,并观察是否澄清透明、分层及药物沉淀。如表1所示,在 0,1,2,3,6个月微乳仍维持澄清、透明,未出现相分层、沉淀和浑浊等现象,pH值、电导率及药物含量变化都不大,说明制备的微乳有较好的稳定性。
2.6 曲克芦丁微乳的含量测定
2.6.1 色谱条件 色谱柱:Shim-pack ODS C18柱(4 mm×250 mm);流动相:甲醇:水:冰乙酸=43:57:1;流速1 mL·min-1;柱温40 ℃;检测波长254 nm;进样量20 μL。
2.6.2 溶液制备
2.6.2.1 对照品溶液的制备 取曲克芦丁对照品约2.5 mg,精密称定,置25 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,即得100 μg·mL-1的曲克芦丁对照品储备液。
2.6.2.2 微乳供试品溶液 精密称取曲克芦丁微乳0.5 g于10 mL量瓶中,加适量甲醇摇匀破乳后,继续滴加甲醇至刻度,超声处理30 min,静置后精密吸取1 mL于10 mL量瓶中,加甲醇至刻度,摇匀,0.22 μm微孔滤膜滤过,得供试液。空白微乳供试品溶液同法制备。
表1 曲克芦丁微乳稳定性实验
Tab.1 Stability test on troxerutin microemulsion
2.6.3 方法学验证
2.6.3.1 专属性实验 分别吸取稀释的曲克芦丁对照品贮备液、空白微乳供试品溶液和微乳供试品溶液,按“2.6.1”项色谱条件进样测定。观察空白微乳中是否有物质干扰曲克芦丁色谱峰。结果如图9,曲克芦丁的测定不受空白辅料干扰,专属性良好,保留时间为12.9 min。
2.6.3.2 线性关系考察 精密吸取曲克芦丁对照品贮备液0.062 5,0.125 0,0.250 0,0.500 0,1.000 0,1.500 0,2.000 0 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,得0.625,1.250,2.500,5.000,10.000,15.000,20.000 μg·mL-1溶液,依次进样,记录曲克芦丁的峰面积,以曲克芦丁对照品溶液的浓度(μg·mL-1)为横坐标,峰面积为纵坐标,得回归方程为:Y=24 358X-1 822.2(R2=0.999 8),结果表明曲克芦丁在0.625~20 μg·mL-1范围内线性良好。
2.6.3.3 精密度实验 精密吸取曲克芦丁对照品溶液(5 μg·mL-1),按“2.6.1”项色谱条件重复进样6次测定峰面积,根据标准曲线求得浓度,计算精密度。结果RSD为0.62%,说明仪器精密度良好。
2.6.3.4 稳定性实验 取微乳供试品溶液,分别在0,2,4,6,8,10,12,24 h时进样,按“2.6.1”项下色谱条件测定峰面积,计算出RSD为0.56%,结果表明曲克芦丁微乳供试品溶液24 h内稳定性良好。
2.6.3.5 重复性实验 取同一批次的曲克芦丁微乳6份,按“2.6.2.2”项制成供试品溶液,按“2.6.1”项下色谱条件测定曲克芦丁峰面积,计算得RSD为0.84%,表明该方法重复性良好。
2.6.3.6 回收率实验 精密称取空白微乳0.5 g,3份,分别于10 mL量瓶中,再分别向其中加入曲克芦丁对照品低、中、高浓度(0.125,0.5,1.5 mg·mL-1)1 mL,按“2.6.2.2”方法处理,按“2.6.1”项下色谱条件进行测定,各平行进样3次,计算回收率。结果如表2,本法测定低、中、高浓度的回收率均符合要求,表明本方法准确度高。
2.6.4 曲克芦丁含量测定 取3批曲克芦丁微乳,按照“2.6.2.2”项供试品溶液制备方法制备供试品溶液,按照“2.6.1”项色谱条件进行测定,结果曲克芦丁微乳含量分别为1.13,1.09,1.07 mg·mL-1,平均为(1.10±0.03) mg·mL-1。
3 讨论
通过比较伪三元相图中微乳区域的大小,笔者选择大豆磷脂/无水乙醇/肉豆蔻酸异丙酯/纯化水作为最终处方,制备了W/O型曲克芦丁微乳。大豆磷脂是一种非离子型表面活性剂,毒副作用较小,且具有良好的生物相容性和乳化能力,文献报道大豆磷脂可以作为吸收促进剂提高药物的跨膜吸收[6]。单独使用磷脂形成界面膜的刚性很大,易形成凝胶态,乙醇的加入降低了水相的极性增加界面膜的流动性和弹性,有利于微乳的形成[7]。W/O型微乳提高水溶性药物生物利用度主要通过促进淋巴转运[8]。曲克芦丁微乳可以提高其生物利用度有一定的理论基础,药动学评价及体外渗透性实验仍在后续进行。
综上,曲克芦丁作为临床常用的抗凝血药及溶栓药,将其制备成W/O型微乳,性质稳定,粒径大小均匀,有望改善曲克芦丁的吸收现状,提高生物利用度,具有广阔的应用前景和临床应用价值。
[1] 付远清.曲克芦丁的药理性质及临床应用概况[J].中国医药指南,2012,10(7):59-60.
[2] LIU F,XU Y,RUI L,et al.Liquid chromatography/tandem mass spectrometry assay for the quantification of troxerutin in human plasma[J].Rapid Commun Mass Spectrom,2006,20(23):3522-3526.
[3] CUI X Y,ZHANG M L,GUAN X,et al.LC-MS-MS deter-mination of troxerutin in plasma and its application to a pharmacokinetic study[J].Chromatographia,2011,73:165-169.
[4] LI Y,SONG J,TIAN N,et al.Improving oral bioavailability of metformin hydrochloride using water-in-oil microemulsions and analysis of phase behavior after dilution[J].Int J Pharm,2014,473(1-2):316-325.
[5] 李磊,王长远,蔡芸,等.羟丝肽口服微乳的制备与体内药动学研究[J].医药导报,2014,33(2):135-139.
[6] LIN C C,LIN H Y,CHI M H,et al.Preparation of curcumin microemulsions with food-grade soybean oil/lecithin and their cytotoxicity on the HepG2 cell line[J].Food Chem,2014,154:282-290.
[7] LEE P J,LANGER R,SHASTRI V P.Novel microemulsion enhancer formulation for simultaneous transdermal delivery of hydrophilic and hydrophobic drugs [J].Pharm Res,2003,20(2):264-269.
[8] TANG T T,HU X B,LIAO D H,et al.Mechanisms of micro-emulsion enhancing the oral bioavailability of puerarin:comparison between oil-in-water and water-in-oil microemulsions using the single-pass intestinal perfusion method and a chylomicron flow blocking approach[J].Int J Nanomedicine,2013,8:4415-4426.
Formulation Screening and Determination of Troxerutin Microemulsion
XU Man, YU Qing, ZHAO Qianru, CHEN Wei, LIN Yuanjie, JIN Yong
(SchoolofPharmacy,AnhuiMedicalUniversity,Hefei230032,China)
Objective To optimize a W/O microemulsion formulation of troxerutin and evaluate its physical properties such as morphology, droplet size, stability and content of troxerutin. Methods The W/O microemulsion was optimized using a pseudoternary phase diagram and the area of the microemulsion region was used to screen and determine microemulsion components.HPLC assay was used for determination of the loading content. Results The optimal formulation contained lecithin, ethanol, isopropyl myristate and water (23.30:11.67:52.45:12.59).The microemulsion was physicochemically stable with round shape and uniform size, and the mean droplet size was about 50.20 nm. Conclusion Microemulsion was developed successfully.It will expect to be the new preparation for troxerutin.
Troxerutin; Pseudoternary phase diagram; Microemulsion; Quality evaluation
2014-12-11
2015-01-26
*安徽省高校自然科学基金重点项目(KJ2013A153)
许曼(1990-),女,安徽六安人,在读硕士,主要从事生物药剂学研究。电话:0564-3338512,E-mail:xuman947527836@126.com。
金涌(1969-),男,安徽休宁人,教授,博士,硕士生导师,主要从事生物药剂学和体内药物分析研究。电话:0551-65177769,E-mail:aydyjs@163.com。
R973.2;R927.2
B
1004-0781(2015)12-1627-06
10.3870/j.issn.1004-0781.2015.12.020

