替米沙坦在牵张刺激导致的心室肌细胞延迟整流钾通道改变中的作用
杨 君 杨 龙 唐 倩 郑亚西 何炯红 胥亚楠 夏桂玲 田 水 叶 芸
替米沙坦在牵张刺激导致的心室肌细胞延迟整流钾通道改变中的作用
杨 君 杨 龙 唐 倩 郑亚西 何炯红 胥亚楠 夏桂玲 田 水 叶 芸
目的:探讨替米沙坦在牵张刺激导致的心室肌细胞延迟整流钾离子通道改变中的作用。 方法:将体外培养的乳鼠心室肌细胞分为对照组、牵张组、替米沙坦组、牵张+替米沙坦组。定量分析细胞蛋白/DNA比值及细胞培养上清中N-末端B型利钠肽原(NT-proBNP)水平以鉴定牵张有效性。实时荧光定量PCR检测延迟整流钾离子通道基因KCNH2、KCNQ1、KCNE1和KCNE2的mRNA水平;Western blot检测KCNH2和KCNQ1蛋白表达水平。 结果:牵张刺激导致心室肌细胞蛋白/DNA比值增大和细胞培养上清中NT-proBNP水平升高。与对照组相比,牵张组KCNH2、KCNQ1、KCNE1和KCNE2 mRNA水平上调;替米沙坦可明显抑制牵张刺激引起的KCNH2、KCNQ1和KCNE1变化,而对KCNE2基因无显著抑制效应。与对照组相比,牵张组KCNH2和KCNQ1蛋白表达下调;与牵张组相比,牵张+替米沙坦组KCNH2和KCNQ1蛋白水平明显上调。 结论:阻断血管紧张素受体可以抑制牵张刺激引起的心室肌细胞延迟整流钾通道改变。
充血性心力衰竭;牵张刺激;心室重构;延迟整流钾离子通道
心室肥大是心脏长期负荷过重状况下产生的一种有效代偿方式,但这种代偿可导致心室重构,是充血性心力衰竭(心衰)、心律失常等发生的基础[1]。临床上约50%的心衰患者死于恶性心律失常[2]。心衰患者心肌细胞动作电位时程(APD)的延长是恶性心律失常发生的基础[3]。延迟整流钾离子通道电流(IK)作为心室肌细胞复极相的主要外向电流,其性能的变化对APD的改变起重要作用。肾素-血管紧张素系统(RAS)是心室重构主要的调控子之一,其主要通过血管紧张素Ⅱ1型受体(AT1R)发挥作用。研究发现,机械牵张刺激可直接激活心肌细胞膜的AT1R,将机械力刺激转变为电-化学信号传入细胞,激活细胞外信号调节激酶(ERK)通路,诱导细胞基因及蛋白表达,促使心室重构[4]。然而,由牵张刺激诱导的心室肌细胞离子通道改变及细胞内信号转导机制至今尚未阐明[5]。本研究拟通过牵张刺激体外培养的心室肌细胞,用血管紧张素受体阻断剂(ARB)替米沙坦干预,探讨替米沙坦在牵张刺激导致的心室肌细胞延迟整流钾通道改变中的作用。
1 材料与方法
1.1 主要材料
胎牛血清(FBS)和DMEM高糖培养基由Gbico公司生产,胰酶和Ⅱ型胶原酶购自Sigma公司,免疫组化试剂盒购自碧云天公司,蛋白质-DNA-mRNA共提取试剂盒购自Omega生物技术公司,N-末端B型利钠肽原(NT-proBNP) ELISA检测试剂盒、KCNH2抗体和KCNQ1抗体购自Abcam公司,SYBR Premix Ex Taq购自Takara公司,α-横纹肌肌动蛋白(α-SCA)单克隆抗体购自博士德生物工程有限公司,辣根过氧化物酶及FITC标记的山羊抗兔IgG购自中杉金桥公司,其他试剂均为国产分析纯以上级别。
1.2 心室肌细胞培养与鉴定
出生1 d的清洁级SD大鼠用乙醚气雾麻醉。取近心尖中下2/3的心室组织,洗去血液,剪至约1 mm×1 mm的组织块。用含0.05%胰酶和80 mol/L Ⅱ型胶原酶的消化液消化,结合差速贴壁法获得心室肌细胞,置于37℃、5%CO2培养箱中,用含10%FBS的DMEM培养基培养。通过细胞形态和α-SCA阳性染色情况鉴定心室肌细胞。
1.3 实验分组与处理
细胞于牵张装置硅胶膜上贴壁培养24 h,更换含5%FBS的DMEM培养基,分为4组。(1)对照组:不予干预;(2)牵张组:较基础培养状态增加20%硅胶膜面积;(3)替米沙坦组:在培养液中加入替米沙坦 10 μmol/L;(4)牵张+替米沙坦组:在培养液中加入替米沙坦10 μmol/L干预1h后,增加20%硅胶膜面积。各组细胞培养48 h后进行下游检测。
1.4 牵张有效性鉴定
按照试剂盒说明检测细胞培养上清中的NT-proBNP水平;测定细胞DNA和蛋白含量,计算蛋白/DNA比值。
1.5 基因mRNA水平的检测
利用Oligo 6.0软件设计引物(序列见表1)。Trizol法提取细胞总mRNA,按SYBR Premix Ex Taq试剂盒说明检测基因mRNA相对表达量。
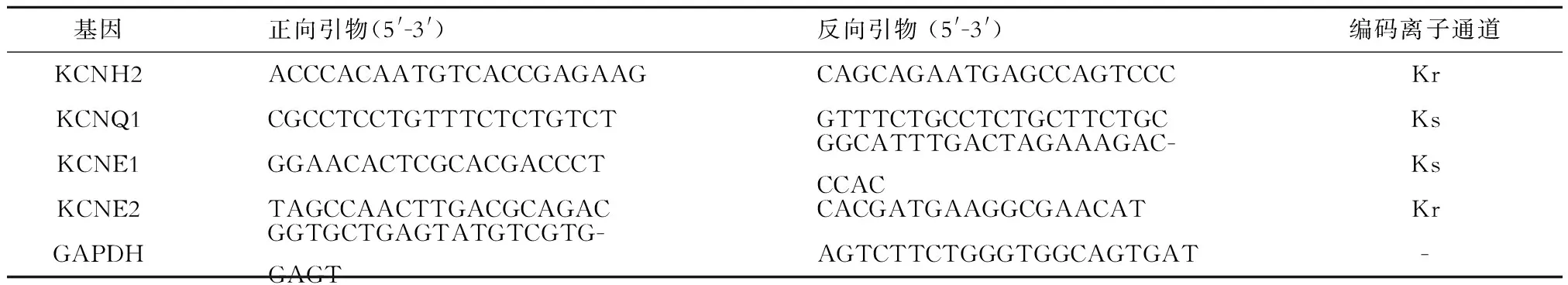
表1 延迟整流钾离子通道基因实时荧光定量PCR引物序列
1.6 Western blot
提取细胞总蛋白,测定蛋白浓度。取60 μg总蛋白上样,电泳后转移蛋白至硝酸纤维素膜上,5%脱脂牛奶封闭1 h,加入相应一抗4℃孵育过夜。充分漂洗后,加入辣根过氧化酶标记的二抗室温孵育1 h。充分漂洗后显影、摄片并进行条带灰度定量测定。
1.7 统计学分析
采用Graphpad Prism 6软件进行统计分析。计量资料用均数±标准差表示,应用单因素方差分析(One Way-ANOVA)进行多组间两两比较。以P<0.05为有统计学差异。
2 结果
2.1 心室肌细胞培养与鉴定
倒置显微镜下可见心室肌细胞呈长梭形、三角形或不规则形,核仁清晰可见,单个细胞贴壁后可见节律性舒缩搏动,细胞搏动频率随着培养时间延长呈现由慢到快再变慢的规律。心室肌细胞α-SCA抗体免疫荧光染色阳性(见图1)。

注:上为α-SCA抗体染色;下为同视野细胞核DAPI染色
图1 心室肌细胞免疫荧光染色
2.2 牵张有效性
与对照组相比,牵张组心室肌细胞蛋白/DNA比值明显增大,细胞培养上清中NT-proBNP水平明显升高,显示牵张刺激导致心室肌细胞肥大,促使心室肌细胞合成分泌NT-proBNP;与牵张组相比,牵张+替米沙坦组蛋白/DNA比值及NT-proBNP水平降低(P<0.05,见表2)。
2.3 延迟整流钾离子通道基因表达情况
与对照组相比,牵张组KCNH2、KCNQ1、KCNE1和KCNE2 mRNA水平明显增高;与牵张组相比,牵张+替米沙坦组KCNH2、KCNQ1和KCNE1 mRNA水平明显降低(P<0.05),而KCNE2无明显变化(见图2)。

表2 牵张刺激有效性
2.4 KCNH2和KCNQ1蛋白表达情况
与mRNA检测结果不同,与对照组相比,牵张组心室肌细胞KCNH2和KCNQ1蛋白水平显著下调;与牵张组相比,牵张+替米沙坦组KCNH2和KCNQ1蛋白水平明显上调(P<0.05,见图3及表3)。
3 讨论
3.1 牵张刺激致心室肌细胞肥大模型的评价
制备原代心室肌细胞肥大模型可用药物刺激,但不除外药物通过其他途径激活相关信号通路。采用牵张装置可排除神经-体液因素的影响。研究证实,培养心室肌细胞时增加20%硅胶膜面积牵张48 h,细胞蛋白/DNA比值增大,促进细胞肥大改变[7]。心室壁张力升高刺激B型利钠肽前体合成、分泌,其分解产生的B型利钠肽和NT-proBNP随之增多[8]。因此,本研究通过检测细胞上清中NT-proBNP的水平及细胞蛋白/DNA比值变化,证明牵张刺激的有效性。
3.2 延迟整流钾离子通道
延迟整流钾离子通道电流包括超快激活电流(IKur)、快速激活电流(IKr)和缓慢激活电流(IKs)3种。大鼠心室肌细胞仅包括IKr和IKs[9-10]。钾离子通道由功能亚基(α亚基)和辅助亚基(β亚基)构成。β亚基可调节α亚基的表达、分布及通道开放-关闭的动力学和药理学特性[11],但决定离子通道主要功能的是α亚基。KCNH2和KCNE2分别编码Kr通道的α亚基和β亚基。Ks通道α亚基和β亚基则由KCNQ1和KCNE1编码。研究发现,衰竭心肌细胞瞬时外向钾电流(Ito)通道β亚基的KCNE1基因表达明显增加,但KCNE2没有明显改变[12]。

注:与对照组相比,(1)P<0.01,(2)P<0.05;与牵张组相比,(3)P<0.05,(4)P<0.01
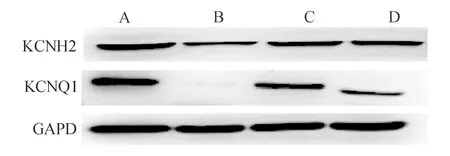
注:A为对照组,B为牵张组,C为替米沙坦组,D为牵张+替米沙坦组

表3 各组KCNH2和KCNQ1蛋白相对表达量
本研究发现,牵张刺激导致心室肌细胞膜上延迟整流钾离子通道(Kr和Ks)的α亚基KCNH2和KCNQ1蛋白表达明显下调,与文献报道肥大心室肌细胞这两种蛋白表达水平受抑制相一致[13-15],但KCNH2和KCNQ1 mRNA水平与蛋白水平相反,呈显著升高趋势。这可能是因为本研究采用的干预条件下,该通道基因与蛋白表达水平间存在负反馈调节。此外,牵张刺激后延迟整流钾离子通道β亚基KCNE1和KCNE2基因表达显著上调,替米沙坦可明显抑制牵张刺激引起的KCNH2、KCNQ1和KCNE1表达变化,但对KCNE2无明显作用。
本研究发现,替米沙坦可明显抑制牵张所引起的延迟整流钾离子通道主要基因的表达变化。ARB不但能改善心肌结构重构,还可能逆转心肌电重构中延迟整流钾离子通道的改变,影响APD,抑制心律失常的发生[16]。这一方面提示AT1R信号的激活可能参与了心室肌延迟整流钾离子通道重构的调控;另一方面,这为应用ARB治疗心衰或心肌肥厚、抑制室性心律失常等提供了理论依据。
[1] 许旭东,秦永文.microRNAs在心肌肥厚中的作用[J].国际心血管病杂志,2010, 37(6):342-345.
[2] Tomaselli GF, Zipes DP. What causes sudden death in heart failure[J]. Circ Res,2004,95(8): 754-763.
[3] Coronel R, Wilders R, Verkerk AO, et al. Electrophy-siological changes in heart failure and their implications for arrhythmogenesis[J]. Biochim Biophys Acta,2013,12(12):2432-2441.
[4] Zou Y, Akazawa H, Qin Y, et al. Mechanical stress activates angiotensin Ⅱ type 1 receptor without the involvement of angiotensin Ⅱ[J]. Nat Cell Biol, 2004, 6(6): 499-506.
[5] Bisping E, Wakula P, Poteser M, et al. Targeting cardiac hypertrophy: toward a causal heart failure therapy [J]. J Cardiovasc Pharmacol, 2014, 64(4):293-305.
[6] 李红霞,韩莲花,赵 欣,等.乳鼠心室肌肌细胞分离培养及鉴定方法的改良[J].苏州大学学报,2007, 27(1):63-65.
[7] Sharif-Naeini R, Folgering JH, Bichet D, et al. Sensing pressure in the cardiovascular system: Gq-coupled mechanoreceptors and TRP channels[J]. J Mol Cell Cardiol, 2010, 48(1): 83-89.
[8] Rana OR, Zobel C, Saygili E, et al. A simple device to apply equibiaxial strain to cells cultured on flexible membranes[J]. Am J Physiol Heart Circ Physiol, 2008, 294(1): H532- H540.
[9] Zobel C, Rana OR, Saygili E, et al. Mechanisms of Ca2+-dependent calcineurin activation in mechanical stretch-induced hypertrophy[J]. Cardiology, 2007, 107(4): 281-290.
[10] 肖剑锋, 王 勇, 沈建新. 心肌钾通道的研究进展[J].医学综述, 2008, 14(4): 512-515.
[11] 刘水平, 陈玉川. 心脏钾离子通道的电生理和分子多样性[J].湖北民族学院学报(医学版),2001, 18(2): 38-40.
[12] Tsuji Y, Opthof T, Kamiya K, et al. Pacing-induced heart failure causes a reduction of delayed rectifier potassium currents along with decreases in calcium and transient outward currents in rabbit ventricle[J]. Cardiovasc Res, 2000, 48(2): 300-309.
[13] Tsuji Y, Zicha S, Qi XY, et al. Potassium channel subunit remodeling in rabbits exposed to long-term bradycardia or tachycardia: discrete arrhythmogenic consequences related to differential delayed-rectifier changes[J]. Circulation, 2006, 113(3): 345-355.
[14] Tsuji Y, Opthof T, Yasui K, et al. Ionic mechanisms of acquired QT prolongation and torsades de pointes in rabbits with chronic complete atrioventricular block[J]. Circulation, 2002, 106(15): 2012-2018.
[15] Radicke S, Cotella D, Graf EM, et al. Functional modulation of the transient outward current Ito by KCNE beta-subunits and regional distribution in human non-failing and failing hearts[J]. Cardiovasc Res, 2006, 71(4): 695-703.
[16] 顾 俊,胡 伟,刘 旭. 心房重构研究进展[J].国际心血管病杂志, 2014,41(6): 398-401.
(收稿:2014-07-29 修回:2014-12-04)
(本文编辑:梁英超)
Effects of telmisartan on delayed rectifier potassium channel induced by stretch in ventricular myocytes
YANGJun1,YANGLong1,TANGQian2,ZHENGYaxi1,HEJionghong1,XUYanan1,XIAGuiling1,TIANShui1,YEYun1.
1.DepartmentofCardiovascularMedicine,theAffiliatedGuizhouPeople′sHospitalofGuiyangMedicalCollege,Guizhou550004,China; 2.DepartementofCardiovascularMedicine,theAffiliatedHospitalofGuiyangMedicalCollege,Guizhou550004,China
Objective:To explore the effects of telmisartan on delayed rectifier potassium ion channel stimulated by stretch in ventricular myocytes from neonatal rats. Methods:Ventricular myocytes isolated from neonatal rats were divided into control group, stretch group, telmisartan group and stretch+telmisartan group. Alterations of protein-to-DNA ratio and N-terminal pro-brain natriuretic peptide(NT-proBNP)levels in the cell culture supernatant were used to determine the effectiveness of in vitro stretch model. The mRNA expression of delayed rectifier potassium channel genes, such as KCNH2, KCNQ1, KCNE1 and KCNE2 were assayed by real-time PCR. The protein levels of KCNH2 and KCNQ1 were analyzed by Western blot. Results:Stretch significantly increased the protein-to-DNA ratio and NT-proBNP . Compared with control group, the transcription of KCNH2, KCNQ1, KCNE1 and KCNE2 mRNA were significantly increased in stretch group. Telmisartan inhibited stretch-induced alterations in KCNH2, KCNQ1 and KCNE1 mRNA expression, but had no inhibiting effect on KCNE2. However, compared with control group, the expressions of KCNH2 and KCNQ1 proteins were significantly decreased in stretch group, which could be attenuated by telmisartan markedly. Conclusion:Blockade of angiotensin receptor can attenuate changes of delayed rectifier potassium channels induced by stretch.
Congestive heart failure; Stretch; Ventricular remodeling; Delayed rectifier potassium channel
550004 贵阳医学院附属贵州省人民医院心血管内科(杨 君,杨 龙,郑亚西,何炯红,胥亚楠,夏桂玲,田 水,叶 芸);
贵阳医学院附属医院心血管内科(唐 倩)
杨 龙, Email: yanglong1001@163.com
10.3969/j.issn.1673-6583.2015.01.016

