ACOSOG Z0011试验标准用于中国前哨淋巴结阳性乳腺癌患者以避免腋窝淋巴结清扫的可行性研究
北京大学人民医院乳腺中心,北京 100044
ACOSOG Z0011试验标准用于中国前哨淋巴结阳性乳腺癌患者以避免腋窝淋巴结清扫的可行性研究
刘淼,王殊,彭媛,刘鹏,郭嘉嘉,王思源,张嘉庆
北京大学人民医院乳腺中心,北京 100044
背景与目的:美国外科医师学会肿瘤学组(American College of Surgeons Oncology Group,ACOSOG)Z0011试验的结果改变了乳腺癌前哨淋巴结(sentinel lymph node,SLN)阳性患者的传统治疗模式。本研究的目的在于探讨ACOSOG Z0011试验标准用于中国前哨淋巴结阳性乳腺癌患者以避免腋窝淋巴结清扫(axillary lymph node dissection,ALND)的可行性。方法:连续收集194例SLN阳性的乳腺癌患者,根据Z0011的标准分为可以只做前哨淋巴结活检(sentinel lymph node biopsy,SLNB)组和仍需做ALND组。将SLNB组患者的临床病理学特征与Z0011试验标准的原始入组人群进行比较,再将SLNB组与ALND组患者的临床病理学特征进行比较。结果:194例患者中有77例符合Z0011标准可以只做SLNB,117例患者不符合Z0011标准,需要做ALND;SLNB组患者与Z0011标准原始入组人群比较,T1期肿瘤、ER阳性肿瘤、淋巴结转移数目少的肿瘤、非前哨淋巴结(non-sentinel lymph node,NSLN)阴性的肿瘤都显著多于Z0011标准原始人群,差异有统计学意义(P<0.05)。本研究ALND组患者与SLNB组患者比较,T2、T3期肿瘤较多,但差异无统计学意义(P>0.05)。ALND组腋窝淋巴结转移数目多的患者比例要明显多于SLNB组,NSLN阳性患者比例也高于SLNB组,差异均有统计学意义(P<0.05)。结论:将Z0011试验标准用于SLN阳性乳腺癌患者,能够筛选出较Z0011标准研究中预后更好、更为低危的患者,使得该部分患者可以更为安全的只接受SLNB。
乳腺癌 ;前哨淋巴结; 腋窝淋巴结清扫
对于乳腺癌前哨淋巴结(sentinel lymph node,SLN)阳性的患者,腋窝淋巴结清扫(axillary lymph node dissection,ALND)一直是标准的治疗手段[1]。但是ACOSOG Z0011试验标准的结果对上述治疗模式提出了挑战。该临床试验结果显示对于临床T1-2期,1~2个阳性SLN,接受保乳手术和术后全乳放疗及全身辅助治疗的患者,前哨淋巴结活检(sentinel lymph node biopsy,SLNB)和ALND两组患者局部控制率和总生存率没有差别,而SLNB组患者术后上肢并发症的发生率显著低于ALND组[2-3]。
但是国内、外对于该试验结果的临床应用还存在很多争议。国外有一些癌症中心对Z0011试验标准进行了验证研究,多数研究结果显示根据Z0011试验标准筛选出的患者人群特征与Z0011入组人群有良好的吻合性,进而支持Z0011试验标准的结果,但国内还未见相关报道[4-6]。
本研究通过根据Z0011标准对SLN阳性患者进行筛选和分类,比较符合Z0011标准和不符合Z0011标准两组人群与Z0011标准原始研究人群的临床病理学特点,分析Z0011试验标准在中国应用于乳腺癌治疗实践的可行性,从而对中国前哨淋巴结阳性乳腺癌患者的腋窝处理方式进行更为深入的探索。
1 资料和方法
1.1 研究对象
连续收集2008年12月—2014年4月北京大学人民医院乳腺中心收治的符合以下条件的患者共194例:①经病理证实为乳腺癌;②未接受过新辅助化疗;③临床腋窝阴性;④冰冻或石蜡苏木精-伊红(hematoxylin and eosin,HE)染色证实前哨淋巴结阳性(除外免疫组织化学诊断的前哨淋巴结阳性患者);⑤接受ALND。
1.2 研究方法
1.2.1 SLN手术方法
使用蓝染料法或蓝染料结合荧光示踪法定位前哨淋巴结。
1.2.2 SLN转移诊断方法和腋窝淋巴结处理方法
术中病理诊断以冰冻切片法对前哨淋巴结转移进行检测,如果冰冻切片检查诊断为前哨淋巴结阳性,则同期行ALND术。前哨淋巴结冰冻取材后的剩余组织经4%甲醛固定,常规石蜡包埋,连续4 μm切片,HE染色后采用光学显微镜进行观察,并由2位病理医师读片,判定其内是否有肿瘤细胞转移,如冰冻切片检查阴性的前哨淋巴结在此阶段又发现有肿瘤转移,则行二期ALND术。清扫的腋窝淋巴结组织经4%甲醛固定,常规石蜡包埋,连续4 μm切片,HE染色后采用光学显微镜进行观察,并由2位病理医师读片,判定其内是否有肿瘤细胞转移。
1.2.3 数据收集及分组标准
收集入组患者的临床病理学资料,包括患者年龄、肿瘤大小、病理类型、组织学分级、肿瘤雌激素受体(estrogen receptor,ER)状态、阳性SLN个数、阳性非前哨淋巴结(non-sentinel lymph node,NSLN)个数、乳腺手术方式(保乳或全切)、有或无术后全身辅助治疗(化疗和或内分泌治疗)、有或无术后全乳放疗。根据Z0011试验入组标准:①临床T1或T2期肿瘤;②个阳性SLN≤2个;③接受保乳手术;④接受术后全乳放疗及全身辅助治疗。将本研究的全部患者分成两组:全部符合Z0011标准可以只做SLNB的为SLNB组;不符合Z0011标准需要做ALND的为ALND组。
1.3 统计学处理
所有数据采用SPSS 16.0统计学软件进行分析。由于符合Z0011试验标准的SLNB和ALND两组人群的临床病理学特征完全匹配,差异无统计学意义(P>0.05),因而我们将本研究SLNB组与Z0011标准的ALND组两组患者的临床病理学特征进行比较,采用χ2检验或Fisher’s精确检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者分组
2008年12月—2014年4月北京大学人民医院乳腺中心收治的符合以下条件:①经病理证实为乳腺癌;②未接受过新辅助化疗③临床腋窝阴性;④冰冻或石蜡HE染色证实前哨淋巴结阳性(除外免疫组织化学诊断的前哨淋巴结阳性患者)。共计194例患者接受ALND,其中有77例患者符合Z0011试验标准纳入SLNB组,占全部患者的39.7%;另外117例纳入ALND组,这117例患者不符合Z0011标准是因为有105例行乳房全切术,18例SLN阳性数目>2个,3例肿瘤直径>5 cm。
2.2 SLNB组患者与ALND组患者临床病理学特征的比较
根据Z0011标准,本研究中符合只做SLNB的患者(中位年龄49岁)与ALND组的患者(中位年龄51岁)比较,在肿瘤的临床分期ER表达、组织学分级、阳性淋巴结数目和NSLN状态方面差异均有统计学意义(P<0.05)。前者的T1期肿瘤比例更高,ER阳性的肿瘤比例更高,组织学分级为Ⅱ级的肿瘤比例更高,同时腋窝淋巴结转移数目为1个的更多,≥3个的更少,而NSLN有转移的比例更小(表1)。
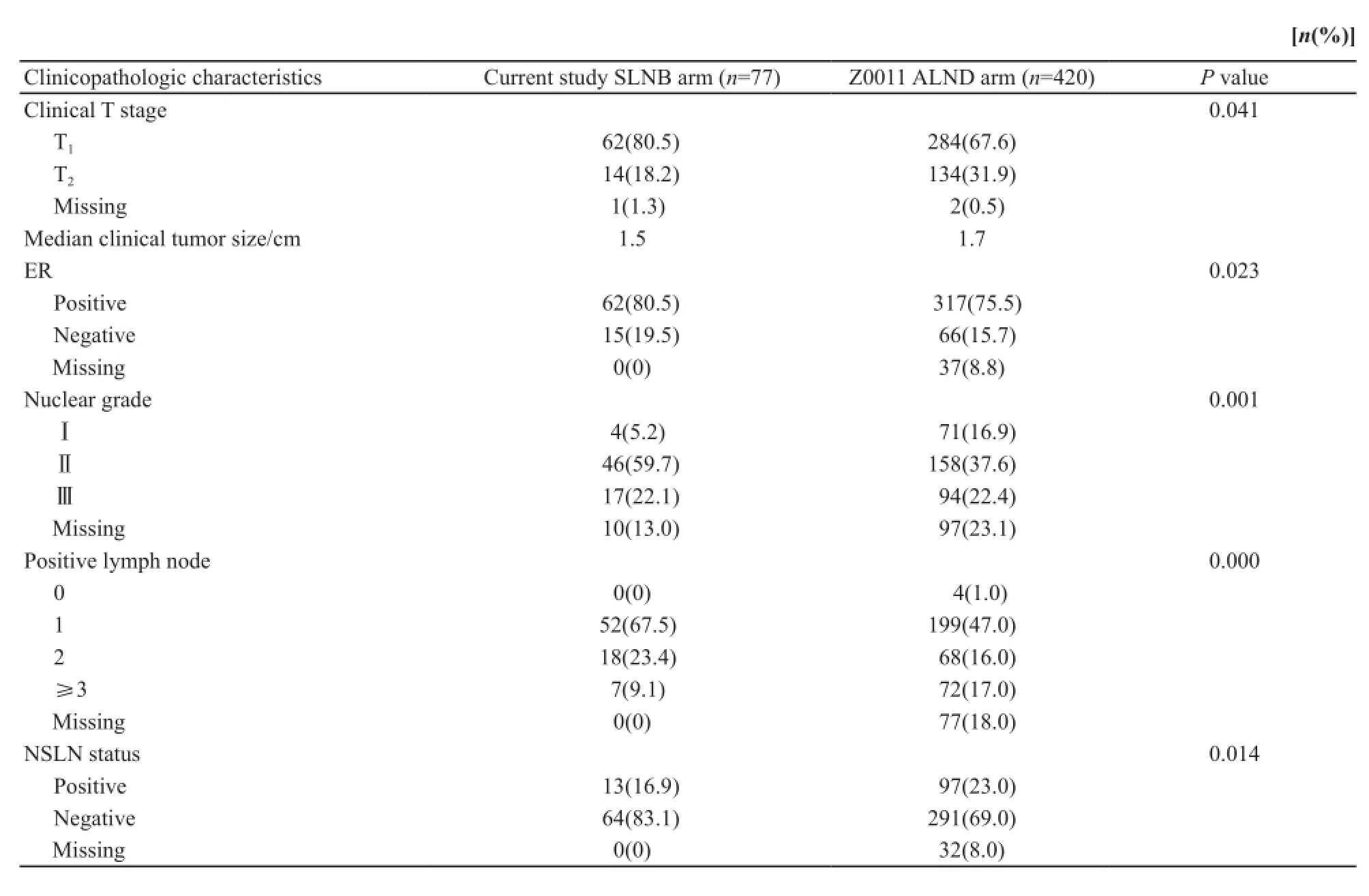
表1 SLNB组患者与ALND组患者临床病理学特征的比较Tab. 1 The clinical characteristics of patients eligible for avoiding ALND according to ACOSOG Z0011 criteria in the current study and in the ALND arm of the Z0011 trial
2.3 SLNB组患者与ALND组患者临床病理学特征的比较
将SLNB组和ALND组患者进行比较发现,在肿瘤临床分期、ER表达和肿瘤组织学分级方面,差异无统计学意义(P>0.05),但ALND组的T2、T3期肿瘤患者数多于SLNB组。并且ALND组腋窝淋巴结转移数目多的患者比例要明显多于SLNB组,NSLN阳性患者比例也高于SLNB组,差异有统计学意义(P<0.05,表2)。
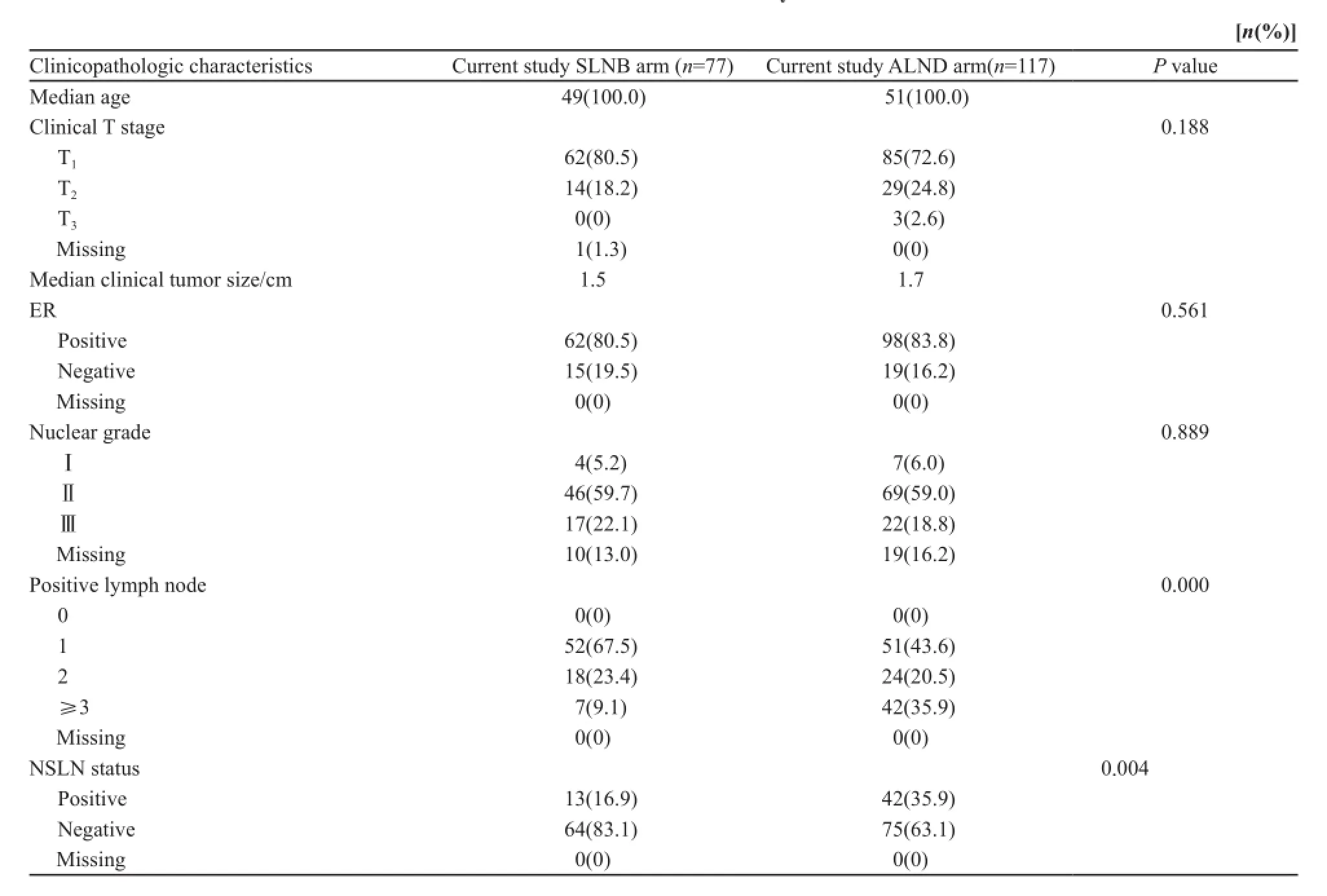
表2 SLNB组患者与ALND组患者临床病理学特征的比较Tab. 2 The clinical characteristics of patients eligible for avoiding ALND and ineligible for omitting ALND according to ACOSOG Z0011 criteria in the current study
3 讨 论
对于SLN阳性的患者,是否能够有选择的在部分患者中避免ALND一直是存在争论的。在Z0011标准研究结果公布之前,有一些回顾性的研究发现对于SLN阳性的患者不做ALND与做ALND在局部和区域复发率上是没有显著差异的[7-11],还有几项前瞻性但非随机的研究也显示同样的结果[12-13],但这些研究样本量都较小,且随访时间不足3年。
Z0011试验是目前为止对于SLN阳性乳腺癌比较ALND和SLNB两种手术方式的局部控制率和总生存率最大的前瞻性、随机对照研究,该试验结果明确界定了SLN阳性而可以安全免于ALND手术的乳腺癌患者特征:①临床T1或T2期肿瘤;②阳性SLN≤2个;③接受保乳手术;④接受术后全乳放疗;⑤术后接受全身辅助治疗。
该试验结果对于乳腺外科的临床实践具有很大的影响,美国国家综合癌症网(The National Comprehensive Cancer Network,NCCN)乳腺癌指南2012年版据此结果进行了更改[14]。美国乳腺外科医师协会(The American Society of Breast Surgeons,ASBrS)对会员进行调查问卷结果发现,有56.9%的医师同意对于符合Z0011标准的乳腺癌患者不再行ALND[15],国外许多大型的癌症中心也都根据Z0011标准相应的对本中心的治疗原则进行了调整[16-17]。
但是国内、外对于Z0011试验标准本身还存在争议,例如试验在事件数连预设的50%都没有达到就提前关闭,失访率偏高,放射剂量及方法没有描述,对HER-2表达、患者年龄、肿瘤的组织学类型这些指标没有进行界定等,尤其是有观点认为Z0011试验标准在入组人群时有较强的选择偏倚,预后好的患者所占比例偏多,以致会影响Z0011试验标准结果在普遍患者人群中的应用效果[18]。但像包括美国纪念斯隆-凯特琳和安德森在内的一些大型癌症中心所做的研究发现,将Z0011标准用于连续的非选择性患者所筛选出的乳腺癌人群其肿瘤的临床病理学特征与Z0011试验标准原始入组人群差异无统计学意义,并且按照Z0011标准的标准对筛选出的SLN阳性患者不行ALND,经随访其局部、区域复发率及总生存率与Z0011的随访结果也类似,进而肯定了Z0011试验结果的临床应用价值[16-17,19-20]。
目前没有循证学的证据证实Z0011试验结果是否同样适用于中国的乳腺癌患者标准,因而在《中国抗癌协会乳腺癌诊治指南与规范(2013版)》中建议对于SLN阳性的乳腺癌患者仍要行ALND[21]。我们前期关于乳腺癌SLN与NSLN的相关研究提示,中国乳腺癌患者的临床病理学特征与欧美国家是存在着不同的[22],因而用我们自己的患者人群来验证Z0011试验标准是非常重要的。
本研究发现,用Z0011标准筛选出的77例符合只做SLNB的这一组患者,与Z0011原始入组人群相比,患者年龄中位数提前,而肿瘤临床大小、ER状态、组织学分级、阳性淋巴结数目及NSLN转移这几个方面差异有统计学意义(P<0.05)。并且这些差异体现为我们的患者T1期肿瘤更多,ER阳性肿瘤更多,淋巴结转移数目少的肿瘤更多,NSLN阴性的肿瘤更多。该研究结果提示,经Z0011标准筛选出的可以只做SLNB的患者可能比Z0011原始研究中只做SLNB的患者更加低危,预后更好,更为安全。
本研究再将用Z0011标准筛选出的不适合只做SLNB,而需要做ALND的117例患者与前77例患者进行比较,结果发现,两组患者的肿瘤大小、ER表达和组织学分级差异无统计学意义(P>0.05),但ALND组的T2、T3期肿瘤还是要多于SLNB组。ALND组淋巴结转移数目多的患者要明显多于SLNB组,NSLN转移的患者比例也明显高于SLNB组,差异有统计学意义(P<0.05)。这提示我们Z0011标准可能可以将本研究中SLN阳性的患者较好的区分为低危和高危2组,低危组可以更安全的只做SLNB,而高危组仍需做ALND。
通过本研究我们发现,应用ZOO11标准可以筛选出77例患者免于ALND,占全部194例患者的39.7%。Dengel等[16]的研究结果显示,应用Z0011标准可以有84%的患者不用做ALND,Delpech等[20]的研究结果显示,在SLN阳性的患者中有69.6%的患者符合Z0011不做ALND的标准。本研究中不符合Z0011标准的117例患者中有105例是因为做了乳房全切术而不符合Z0011标准,这可能是造成我们的SLNB阳性患者中符合Z0011标准的比例要远低于国外患者的主要原因。从这一结果我们也可以看出,中国乳腺癌患者保乳的指征可能较国外的要求更严,主要体现在肿瘤的临床T分期上更早,这也可以在一定程度上解释本研究中符合Z0011标准的患者的肿瘤较Z0011标准的原始人群还要低危的原因。
综上所述,将Z0011试验的标准用于本研究中的中国SLN阳性乳腺癌患者,能够筛选出较Z0011标准的研究预后更好、更为低危的患者,使得该部分患者可以更为安全的只接受SLNB。
本研究的主要缺陷在于研究为单中心以致患者数较少,而且只能反应本中心的乳腺癌患者特点,因而我们更期待能够开展多中心的研究,积累我们中国乳腺癌患者的数据,也许将来能够总结出较Z0011标准更为适合中国乳腺癌特点,更为准确的筛选标准,从而使得更多适合的乳腺癌患者免于ALND。
[参 考 文 献]
[1] GOLDHIRSCH A, WOOD W C, COATES A S, et al. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St. Gallen international expert consensus on the primary therapy of early breast cancer 2011 [J]. Ann Oncol, 2011, 22(8): 1736-1747.
[2] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial [J]. JAMA, 2011, 305(6): 569-575.
[3] GIULIAO A E, MCCALL L, BEITSCH P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial [J]. Ann Surg, 2010, 252(3): 426-433.
[4] CAUDLE A S, HUNT K K, KUERER H M, et al. Multidisciplinary considerations in the implementation of the findings from the American College of Surgeons Oncology Group (ACOSOG) Z0011 study: a practice-changing trial[J]. Ann Surg Oncol, 2011, 18(9): 2407-2412.
[5] KUMAR A, PURI R, GADGIL P V, et al. Sentinel lymph node biopsy in primary breast cancer: window to management of the axilla [J]. World J Surg, 2012, 36(7): 1453-1459.
[6] GAINER S M, HUNT K K, BEITSCH P, et al. Changing behavior in clinical practice in response to the ACOSOG Z0011 trial: a survey of the American Society of Breast Surgeons [J]. Ann Surg Oncol, 2012, 19(10): 3152-3158.
[7] FANT J S, GRANT M D, KNOX S M, et al. Preliminary outcome analysis in patients with breast cancer and a positive sentinel lymph node who declined axillary dissection. Ann[J]. Surg Oncol, 2003, 10(2):126-130.
[8] YI M, GIORDANO S H, MERIC-BERNSTAM F, et al. Trends in and outcomes from sentinel lymph node biopsy (SLNB) alone vs. SLNB with axillary lymph node dissection for nodepositive breast cancer patients: experience from the SEER database [J]. Ann Surg Oncol, 2010, 17(suppl): 343-351.
[9] BILIMORIA K Y, BENTREM D J, HANSEN N M, et al. Comparison of sentinel lymph node biopsy alone and completion axillary lymph node dissection for node-positive breast cancer [J]. Clin Oncol, 2009, 27(18): 2946-2953.
[10] HWANG R F, GONZALEZ-ANGULO A M, YI M, et al. Low locoregional failure rates in selected breast cancer patients with tumor-positive sentinel lymph nodes who do not undergo completion axillary dissection [J]. Cancer, 2007, 110(4): 723-730.
[11] FRANCISSEN C M T P, DINGS P P J M , VAN DALEN T, et al. Axillary recurrence after a tumor positive sentinel lymph node biopsy without axillary treatment: a review of the literature [J]. Ann Surg Oncol, 2012, 19(13): 4140-4149.
[12] GUENTHER J M, HANSEN N M, DIFRONZO L A, et al. Axillary dissection is not required for all patients with breast cancer and positive sentinel nodes [J]. Arch Surg, 2003, 138(1): 52-56.
[13] JERUSS J S, WINCHESTER D J, SENER S F, et al. Axillary recurrence after sentinel node biopsy [J]. Ann Surg Oncol, 2005, 12(1): 34-40.
[14] National Comprehensive Cancer Network (NCCN) Clinical practice guidelines in oncology:breast,version1.2012[EB/ OL]. Http://www.nccn.org/professionals/physician_gls/pdf/ breast.pdf (2012). Accessed 20 Feb 2012.
[15] CARETTA H, GREENBERG C G, WILKE L G, et al. Impact of the American College of Surgeons Oncology Group (ACOSOG) Z0011 trial on clinical management of the axilla in older breast cancer patients: A SEER-medicare analysis[J]. Ann Surg Oncol, 2013, 20(13): 4145-4152.
[16] DENGEL L T, VAN ZEE K J, KING T A, et al. Axillary dissection can be avoided in the majority of clinically nodenegative patients undergoing breast-conserving therapy [J]. Ann Surg Oncol, 2014, 21(1): 22-27.
[17] CAUDLE A S, HUNT K K, TUCKER S L, et al. American College of Surgeons Oncology Group (ACOSOG) Z0011: Impact on surgeon practice patterns [J]. Ann Surg Oncol, 2012, 19(10): 3144-3151.
[18] JATOI I. Axillary vs sentinel lymph node dissection for invasive breast cancer [J]. JAMA, 2011, 305(22): 2288.
[19] YI M, KUERER H M, MITTENDORF E A, et al. Impact of the American College of Surgeons Oncology Group Z0011 criteria applied to a contemporary patient population [J]. J Am Coll Surg, 2013, 216(1): 105-113
[20] DELPECH Y, BRICOU A, LOUSQUV R, et al. The exportability of the ACOSOG Z0011 criteria for omitting axillary lymph node dissection after positive sentinel lymph node biopsy findings: A multicenter study [J]. Ann Surg Oncol, 2013, 20(8): 2556-2561.
[21] 中国抗癌协会乳腺癌诊治指南与规范(2013版). 中国抗癌协会乳腺癌专业委员会[J]. 中国癌症杂志, 2013, 23(8): 639-696.
[22] 曹迎明, 刘淼, 周波, 等. MSKCC 和SOC 模型预测中国乳腺癌患者非前哨淋巴结转移的验证比较研究[J].中国肿瘤临床, 2014, 41(8): 508-512.
The exportability of the criteria defined by Z0011 trial for selecting patients who are eligible foromitting ALND after a positive SLNB result in China
LIU Miao, WANG Shu, PENG Yuan, LIU Peng,GUO Jiajia, WANG Siyuan, ZHANG Jiaqing (Breast Disease Center, Peking University, People's Hospital, Beijing 100044, China)
WANG Shu E-mail: dr.wangshu@263.net
Background and purpose:The American College of Surgeons Oncology Group (ACOSOG) Z0011 trial has been described as practice-changing of sentinel lymph node (SLN) positive breast cancers. The goal of this study was to determine the exportability of the criteria defned by Z0011 trial for selecting patients who are eligible for avoiding axillary lymph node dissection (ALND) after a positive sentinel lymph node biopsy (SLNB) result in China.Methods:We collected 194 breast cancer patients with positive SLNs and classifed them into two groups according to Z0011 criteria. One group was consisted of patients who were eligible for omitting ALND and with SLNB only. The other one was ALND group. Then the patients of SLNB group were compared with cohort included in the Z0011 trial and the ALND group of this study separately.Results:Seventy-seven patients were potentially eligible for omitting ALND and 117 patients were still needed to have ALND. Compared with Z0011 cohort, the SLNB group in this research had signifcantly more T1stage and ER positive tumors (P<0.05). More patients in SLNB group had positive LNs with the number less than 3 and negative NSLNs (P<0.05). The ALND group had more T2and T3stage tumors than the SLNB group but the difference was not signifcantly. The number of positive LNs in ALND group washigher than the SLNB group signifcantly (P<0.05). More patients in the ALND group had positive non-sentinel lymph node (NSLN) than the SLNB group and the difference was also signifcantly (P<0.05).Conclusion:Applied to the SLN positive patients in this study, Z0011 criteria could make patients with better prognosis and lower risk than Z0011 cohort be selected and let these patients avoiding ALND more safely.
Breast cancer; Sentinel lymph node; Axillary lymph node dissection
10.3969/j.issn.1007-3969.2015.02.009
R737.9
A
1007-3639(2015)02-0135-06
2014-09-12
2015-01-08)
王殊 E-mail:dr.wangshu@263.net

