hsa-miRNA27a和hsa-miRNA451通过调控MDRl/P-gp的表达和功能参与卵巢癌和乳腺癌细胞耐药
李智敏,罗喜平,曾俐琴,彭秀红,王意,王泽华
1. 广州医学院附属广东省妇幼保健院妇科,广东 广州 510010;
2. 华中科技大学同济医学院附属协和医院妇产科, 湖北 武汉 430022
hsa-miRNA27a和hsa-miRNA451通过调控MDRl/P-gp的表达和功能参与卵巢癌和乳腺癌细胞耐药
李智敏1,罗喜平1,曾俐琴1,彭秀红1,王意1,王泽华2
1. 广州医学院附属广东省妇幼保健院妇科,广东 广州 510010;
2. 华中科技大学同济医学院附属协和医院妇产科, 湖北 武汉 430022
背景与目的:肿瘤细胞耐药是临床化疗失败的主要原因,微小RNA(microRNA,miRNA)在肿瘤细胞中的异常表达与耐药关系密切。本研究旨在探讨卵巢癌及乳腺癌细胞中hsa-miRNA27a和hsa-miRNA451的表达差异及其与耐药的关系。方法:用浓度递增法建立卵巢癌耐紫杉醇细胞系A2780/Taxol;颈环状引物实时定量聚合酶链反应(stem-loop quantitative real-time PCR,stem-loop RT-PCR)检测卵巢癌耐紫杉醇细胞A2780/Taxol和亲本细胞A2780以及乳腺癌耐阿霉素细胞MCF-7/ADM和亲本细胞MCF-7中hsa-miRNA27a和hsa-miRNA451的表达;利用LipofectamineTM2000分别将成熟miRNA27a的模拟物、阻遏物及阴性对照(negative control,NC)RNA转染A2780和A2780/Taxol细胞,将成熟miRNA451的模拟物及NC转染MCF-7/ADM细胞;RT-PCR技术检测细胞MDR1 mRNA表达;蛋白[质]印迹法(Western blot)检测细胞中P-糖蛋白(P-glycoprotein,P-gp)的表达;采用四甲基偶氮唑蓝(MTT)法检测细胞增殖情况。结果:miRNA27a在A2780/Taxol细胞中高表达,与A2780细胞相比,表达增高2.2±0.30倍,差异有统计学意义(P<0.05);miRNA451在MCF-7/ADM细胞中低表达,与MCF-7细胞相比,表达降低84%,差异有统计学意义(P<0.05)。A2780/Taxol细胞转染miRNA27a阻遏物后,MDR1 mRNA表达明显下降,与转染NC组相比,表达下降(39±0.14)%,差异有统计学意义(P<0.05)。P-gp相对表达量[(26±5.3)%)]与转染NC组的P-gp相对表达量[(43±6.7)%]比较,下降39%,差异有统计学意义(P<0.05)。对紫杉醇的敏感性增加,半数抑制浓度(IC50)为0.53 μmol/L,与转染NC组IC50(6.8 μmol/L)相比,差异有统计学意义(P<0.05)。A2780细胞转染miRNA27a模拟物后,细胞的MDR1 mRNA表达升高,与转染NC组相比,升高(121±0.11)%,差异有统计学意义(P<0.05);细胞对紫杉醇的敏感性下降,IC50为0.2 μmol/L,与转染NC组IC50(0.06 μmol/L)相比,差异有统计学意义(P<0.05)。MCF-7/ADM细胞转染miRNA451模拟物后,MDR1 mRNA表达明显下降,与转染NC组细胞相比,表达下降(65±12)%,差异有统计学意义(P<0.05);P-gp相对表达量[(31±19)%)]与转染NC组细胞P-gp相对表达量[(83±12)%]相比,下降62%,差异有统计学意义(P<0.05);对阿霉素的敏感性增加,IC50为4.61 μmol/L,与转染NC组细胞IC50(26 μmol/L)相比,差异有统计学意义(P<0.05)。结论:在卵巢癌耐紫杉醇细胞A2780/Taxol和乳腺癌耐阿霉素细胞MCF-7/ADM中,miRNA27a和miRNA451分别异常表达,它们可能分别通过间接或直接作用于MDR1/P-gp,参与肿瘤细胞耐药的发生、发展。
卵巢癌;乳腺癌;紫杉醇;阿霉素;微小RNA;耐药
卵巢癌和乳腺癌是女性常见恶性肿瘤,严重危害妇女生命健康。目前,手术切除、放疗和化疗是治疗恶性肿瘤的常规方法。其中,化疗在治疗恶性肿瘤中占有重要地位,对于可以行手术切除的早期恶性肿瘤,化疗的辅助治疗可以预防或延缓肿瘤复发及转移。对于中晚期不能行手术治疗的恶性肿瘤,化疗则是主要的治疗手段,可以提高患者的生存率和生存质量。然而,肿瘤细胞对化疗药物产生耐药是临床化疗失败的主要原因,患者一旦出现耐药,临床无有效干预手段,预后较差,有资料显示90%恶性肿瘤患者死于耐药[1]。
近年来,一类新的非蛋白质编码微小RNA (microRNA,miRNA)的发现,为肿瘤耐药机制的研究提供了新的思路。miRNA是一类内源性,长约19~23个核苷酸的非编码单链RNA分子,与RNA诱导的沉默复合物(RNA-induced siencing complex,RISC)结合后,通过与靶mRNA的3’非翻译区(3’UTR)完全或不完全配对,促进目标mRNA降解或者翻译抑制[2-3]。通过这种负性调控靶基因的表达,miRNA不仅参与细胞增殖、分化、凋亡及新陈代谢等过程,而且还与肿瘤的发生、发展、转移及耐药密切相关[4-7]。目前已确认人类基因组中的miRNA约500种,至少有200多种miRNA序列与肿瘤密切相关[8]。随着研究的深入,在多种肿瘤耐药细胞中发现miRNA表达异常。例如在卵巢癌耐药细胞中发现miRNA214、miRNA27a、miRNA335,miRNA30c和miRNA130a表达异常;在乳腺癌耐药细胞中发现miRNA221、miRNA222、miRNA328和miRNA451表达异常。这些表达异常的miRNA可能以癌基因或抑癌基因角色参与耐药的发生、发展[9]。本研究旨在通过分析卵巢癌和乳腺癌耐药细胞中hsa-miRNA27a和hsa-miRNA451的表达差异及其与耐药相关蛋白之间的调控关系,进一步探讨恶性肿瘤细胞耐药机制,有利于临床采取有效措施逆转耐药,提高肿瘤患者的生存率。建立
1 材料和方法
1.1 主要试剂
卵巢癌亲本细胞株A2780由本实验室保存,耐药细胞株A2780/Taxol通过紫杉醇诱导,浓度递增法获得。乳腺癌细胞株MCF-7和耐阿霉素细胞株MCF-7/ADM均购自中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)。RPMI 1640及胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;紫杉醇(浓度为6 mg/mL)购自美国百时美施贵宝公司;阿霉素(10 mg)购自意大利法玛西亚公司;鼠抗人P-糖蛋白(P-glycoprtein,P-gp)单克隆抗体购自美国Calbiochem公司;羊抗鼠抗体购自美国Santa Cruz公司;CelLyticTMM 细胞裂解液购自美国Sigma公司;ECL化学发光试剂盒购自美国Pierce公司;LipofectamineTM2000购自美国Invitrogen公司;miRNA纯化试剂盒,miRNA定量PCR试剂盒,成熟miRNA27a的模拟物、阻遏物、miRNA451的模拟物及阴性对照(negative control,NC)RNA均购自上海吉玛制药技术有限公司;四甲基偶氮唑蓝(MTT)购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养
亲本细胞株A2780和MCF-7以及耐药细胞株A2780/Taxol和MCF-7/ADM分别于含10%胎牛血清、100 µg/mL链霉素和100 IU/mL青霉素的RPMI-1640培养基中,在37 ℃、CO2体积分数为5%、相对湿度为90%的培养箱中培养,细胞贴壁生长。向A2780/Taxol细胞和MCF-7/ADM细胞培养液中分别加入终浓度为12 nmol/L的紫杉醇和0.34 μmol/L的阿霉素以维持细胞耐药性,在进行实验的前两周,细胞脱离药物。
1.2.2 卵巢癌耐紫杉醇细胞株A2780/Taxol的
首先将指数生长期的卵巢癌亲本细胞A2780培养于含有10 nmol/L紫杉醇的RPMI 1640培养基中,连续作用24 h后,换不含药新鲜培养基,敏感细胞逐渐死亡,待存活细胞恢复正常生长,融合达80%后,以10、20、40、80、160、320、640 nmol/L浓度梯度逐渐加大紫杉醇诱导浓度,如此反复持续诱导10个月,挑选出经640 nmol/L紫杉醇作用后存活的A2780细胞克隆,培养此细胞克隆,筛选出能在含12 nmol/L紫杉醇培养基中稳定生长的单细胞克隆,即A2780/Taxol细胞,并扩大培养该细胞克隆,即得到卵巢癌耐紫杉醇细胞株A2780/Taxol。
1.2.3 颈环状引物实时定量聚合酶链反应(stem-loop quantitative real-time PCR,stemloop RT-PCR)检测肿瘤细胞中hsa-miRNA27a和hsa-miRNA451表达
用Trizol试剂提取对数生长期的细胞总RNA,随后用miRNA纯化试剂盒分离,纯化小RNA,即miRNA。用Hairpin-itTMmiRNA RTPCR试剂盒检测miRNA表达水平,包括茎环结构的逆转录反应和RT-PCR检测两个步骤。逆转录反应体积为20 μL,主要包含stem-loop miRNART primers 60 nmol/L及纯化的miRNA 20 ng等,反应条件为16 ℃ 30 min,42 ℃30 min,85 ℃ 10 min。RT-PCR体系中主要包含10 μL的2×SYBR Green RT-PCR master mix及miR特异引物0.40 μL(表1)等共20 μL。扩增反应在ABI 7300 RT-PCR仪上进行,反应条件:95 ℃预变性3 min后,以95 ℃ 12 s,62 ℃ 60 s进行40个循环,在62 ℃检测荧光强度。U6 snRNA为检测miRNA27a和miRNA451的内参照。结果分析采用2−△△CT方法,△△CT=(CTmiRNA–CTU6)实验组–(CTmiRNA–CTU6)对照组。每组实验重复3次。
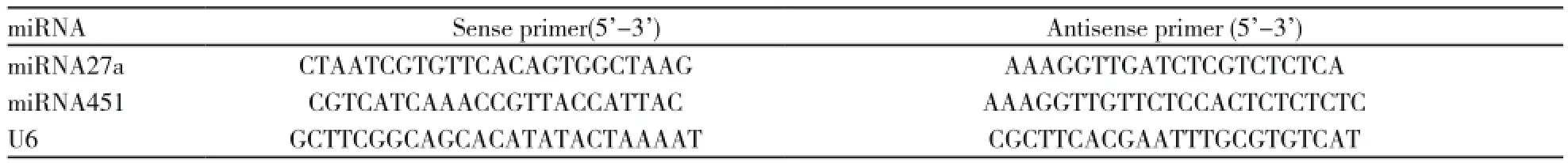
表1 miRNA27a、miRNA451和U6正反向引物序列Tab. 1 List of primers sequences for miRNA27a, miRNA451 and U6
1.2.4 细胞转染
将对数生长期的细胞以3.5×105/孔接种于6孔培养板上。待细胞贴壁生长汇合至50%时,分别取成熟miRNA27a的模拟物、阻遏物、NC各100 pmol和LipofectamineTM2000 5 μL混匀后转染A2780和A2780/Taxol细胞;取成熟miRNA451的模拟物、NC各100 pmol和LipofectamineTM2000 5 μL混匀后转染MCF-7/ADM细胞。以转染NC作为阴性对照,具体操作按LipofectamineTM2000说明书进行。
1.2.5 RT-PCR技术检测细胞MDR1 mRNA表达Trizol提取转染48 h细胞的总RNA,用RevertAidTMFirst Strand cDNA Synthesis Kit行逆转录反应,具体操作按说明书进行。RT-PCR的体积为25 μL,体系主要包括2×SYBR Green RT-PCR Master Mix 12.5 μL,模板cDNA 2 μg和上、下游引物各0.3 μmol/L(表2)。RT-PCR在ABI 7300 RT-PCR仪上进行,反应条件:95 ℃3 min;95 ℃ 20 s,60 ℃ 30 s,70 ℃ 30 s,40个循环;每1个样品重复3次。结果分析采用2−△△CT方法。
1.2.6 蛋白[质]印迹法(Western blot)检测细胞P-gp的表达

表2 MDR1和β-actin上、下游引物序列Tab. 2 List of primers sequences for MDR1 and β-actin
用CelLyticTMM细胞裂解液,裂解对数生长期的细胞及转染72 h后的细胞,将60 μg蛋白质经8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转聚至硝酸纤维素膜,封闭2 h后,加入鼠抗人P-gp一抗(1:200)温育过夜,加入与辣根过氧化物酶偶联的羊抗鼠抗体(1:5 000),室温温育1 h后,用增强电化学发光(electrochemical luminescence,ECL)试剂盒显色,压片显影。用Quantity One软件对各条带进行灰度分析,计算P-gp/β-actin比值,以此表示P-gp的表达水平,实验重复3次。1.2.7 MTT法检测细胞增殖情况
将转染miRNA27a阻遏物、模拟物及NC 24 h后的A2780和A2780/Taxol细胞,及转染miRNA451的模拟物及NC 24 h后的M C F-7/A D M细胞,以8.0×1 03个/孔接种至9 6孔板,细胞贴壁后A 2 7 8 0细胞加入终浓度为0.01、0.05、0.25、1.25和7.5 μmol/L的紫杉醇;A2780/Taxol细胞加入终浓度为0.04、0.2、0.9、5和23 μmol/L的紫杉醇;MCF-7/ADM细胞加入终浓度为0、0.5、2.7、13.7、68.9和344.8 μmol/L的阿霉素,每个浓度设3个复孔,并设空白组对照。培养48 h后每孔加入20 μL MTT(5 mg/mL),37 ℃温育4 h后弃上清液,加入150 μL DMSO,振荡10 min,用自动酶标平板阅读仪以570 nm波长读取吸光度(D)值。计算细胞存活率=(实验组各浓度细胞孔D值/空白对照组细胞孔D值)×100%,并绘制药物剂量反应曲线,以Bliss法计算半数抑制浓度(IC50)。
1.3 统计学处理
采用SPSS 13.0软件进行统计学分析,计量资料的结果用x±s表示,两组数据的比较采用成组t检验,两组以上数据的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miRNA27a和miRNA451在卵巢癌和乳腺癌细胞中的表达
Stem-loop RT-PCR结果显示,miRNA27a在卵巢癌耐紫杉醇细胞A2780/Taxol中高表达,与卵巢癌亲本细胞A2780相比,表达增高2.2±0.30倍,差异有统计学意义(P<0.05,图1A)。miRNA451在乳腺癌耐阿霉素细胞MCF-7/ADM中显著低表达,与乳腺癌亲本细胞MCF-7相比,表达降低84%,差异有统计学意义(P<0.05,图1B)。同时,miRNA27a在乳腺癌细胞MCF-7和MCF-7/ADM中表达无差异,miRNA451在卵巢癌细胞A2780和A2780/Taxol中表达无差异。
2.2 卵巢癌和乳腺癌细胞中MDR1 mRNA的表达
2.2.1 转染后卵巢癌A2780和A2780/Taxol细胞MDR1 mRNA表达
RT-PCR检测结果显示,A2780/Taxol细胞转染miRNA27a阻遏物后,MDR1 mRNA表达水平明显下降,与转染NC组相比,表达下降(39±0.14)%,差异有统计学意义(P<0.05,图2A)。A2780细胞转染miRNA27a模拟物后,MDR1 mRNA表达水平明显升高,与转染NC组相比,表达增高(121±0.11)%,差异有统计学意义(P<0.05,图2B)。
2.2.2 转染前、后MCF-7/ADM细胞MDR1 mRNA的表达
RT-PCR检测结果显示,转染miRNA451模拟物组细胞的MDR1 mRNA表达明显下降,与转染NC组细胞相比,差异有统计学意义(P<0.05)。转染NC组细胞与转染前MCF-7/ADM组细胞相比,MDR1 mRNA表达无明显变化,差异无统计学意义(P>0.05,图3)。

图1 miRNA27a和miRNA451在卵巢癌和乳腺癌细胞中的表达Fig. 1 The expressions of miRNA27a and miRNA451 in ovarian cancer and breast cancer cell
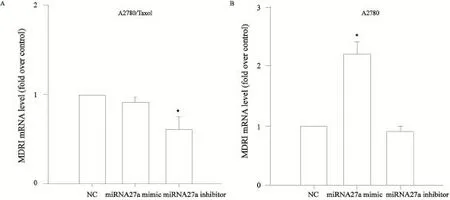
图2 RT-PCR检测转染miRNA27a模拟物、阻遏物和NC后A2780/Taxol和A2780细胞中MDR1 mRNA的表达变化Fig. 2 Expression levels of MDR1 mRNA in A2780/Taxol and A2780 cells transfected with mimics or inhibitors of miRNA27a or NC as control were detected by RT-PCR
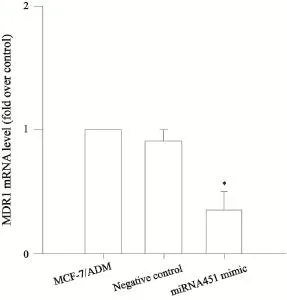
图3 RT-PCR检测MCF-7/ADM细胞和转染miRNA451模拟物、NC的MCF-7/ADM细胞MDR1 mRNA的表达变化Fig. 3 Expression levels of MDR1 mRNA in MCF-7/ADM cells and MCF-7/ADM cells transfected with mimics of miRNA451 or NC as control were detected by RT-PCR
2.3 卵巢癌细胞和乳腺癌细胞中P-gp表达的表达
2.3.1 P-gp在卵巢癌A2780和A2780/Taxol细胞中的表达
Western blot检测结果显示,P-gp在A2780/Taxol细胞中高表达,而在A2780细胞中未检测出P-gp蛋白的表达(图4A)。A2780/ Taxol细胞转染NC后,P-gp表达为(43±6.7)%,转染miRNA27a阻遏物后,P-gp表达下降为(26±5.3)%,差异有统计学意义(P<0.05)。转染miRNA27a模拟物后,P-gp表达与转染NC的差异无统计学意义(P>0.05,图5)。
2.3.2 P-gp在乳腺癌MCF-7和MCF-7/ADM细胞中的表达
Western blot检测结果显示,在MCF-7细胞中未检测出P-gp表达,而在MCF-7/ADM细胞中P-gp高表达(图4B)。MCF-7/ADM细胞在转染NC后,P-gp表达为(83±12)%,转染miRNA451模拟物后,P-gp蛋白表达下降为(31±19)%,差异有统计学意义(P<0.05,图6)。
2.4 转染后卵巢癌和乳腺癌细胞增殖的改变
2.4.1 转染后卵巢癌A2780/Taxol和A2780细胞增殖的改变
MTT法检测结果显示,转染miRNA27a 阻遏物后A2780/Taxol细胞存活率随紫杉醇浓度的增加明显降低,对紫杉醇的敏感性增加,IC50为0.53 μmol/L,与转染NC组(6.8 μmol/L)相比,差异有统计学意义(P<0.05,图7A);转染miRNA27a模拟物后A2780细胞对紫杉醇的敏感性下降,IC50为0.2 μmol/L,与转染NC组(0.06 μmol/L)相比,差异有统计学意义(P<0.05,图7B)。
2.4.2 转染后乳腺癌MCF-7/ADM细胞增殖的改变
MTT法检测结果显示,转染miRNA451模拟物后MCF-7/ADM细胞存活率随阿霉素浓度的增加明显降低,对阿霉素的敏感性增加,IC50为4.61 μmol/L,与转染NC组(26 μmol/L)相比,差异有统计学意义(P<0.05,图8)。

图4 P-gp在卵巢癌和乳腺癌细胞中的表达Fig. 4 Expression levels of P-gp in ovarian cancer and breast cancer cells
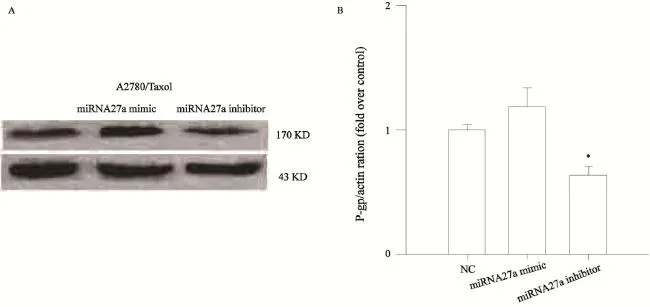
图5 A2780/Taxol细胞转染miRNA27a阻遏物、模拟物及NC后的P-gp的表达Fig. 5 Expression of P-gp in A2780/Taxol cells transfected with mimics or inhibitors of miRNA27a or NC

图6 MCF-7/ADM细胞转染miRNA451模拟物及NC后P-gp的表达Fig. 6 Expression of P-gp in MCF-7/ADM cells transfected with mimics of miRNA451 or NC
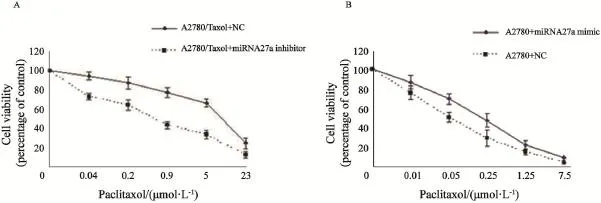
图7 转染后A2780/Taxol和A2780细胞对紫杉醇敏感性的改变Fig. 7 Effects of miRNA27a on sensitivity of A2780/Taxol and A2780 cells to paclitaxel

图8 转染后MCF-7/ADM细胞对阿霉素耐药性的改变Fig. 8 Effects of miRNA451 on sensitivity of MCF-7/ADM cells to adriamycin
3 讨 论
恶性肿瘤的耐药是影响肿瘤化疗成功的重要障碍,其耐药的具体机制还不十分清楚,可能包括以下因素:①ABC型膜载体蛋白表达增高,ABC家族成员包括P-gp、多药耐药相关蛋白、肺耐药蛋白等;②p53基因突变,p53蛋白具有抑制DNA修复、诱导细胞凋亡等作用,突变的p53基因还可以选择性上调MDR1基因的表达;③细胞凋亡通路受阻,如Bcl-2凋亡抑制基因表达增强,肿瘤细胞凋亡受抑制;④DNA损伤修复系统失调等[10-11]。其中,P-gp是Biedler于1970年发现,Juliano于1976年首次命名,是由MDR1基因编码的分子量为170 KD的糖蛋白,具有药泵功能,当药物进入细胞后,与P-gp结合,同时P-gp的ATP位点结合ATP后释放能量将药物转运出细胞外,降低了细胞内的药物浓度,P-gp对药物的特异性较小,能够将多种结构和机制不同的抗肿瘤药物如紫杉醇、阿霉素和长春新碱等排出细胞外,使肿瘤细胞逃逸化疗药物的毒杀作用,从而产生耐药[12-13]。在本实验中,我们在卵巢癌耐紫杉醇细胞A2780/ Taxol和乳腺癌耐阿霉素细胞MCF-7/ADM中均检测到P-gp高表达,而在卵巢癌和乳腺癌亲本细胞A2780和MCF-7中均未检测到P-gp的表达。现有的研究已证明,P-gp过表达是导致肿瘤细胞耐药的重要机制之一,是引起肿瘤细胞对紫杉醇和阿霉素耐药的主要原因。而这两种化疗药是目前临床上抗恶性肿瘤的一线药物,因此,对肿瘤耐药细胞中P-gp调控的研究,为临床克服耐药,提高肿瘤患者的生存率和生活质量,有极为重要的意义。
在本实验中,我们检测了卵巢癌A2780/ Taxol和乳腺癌MCF-7/ADM细胞及其亲本细胞中miRNA27a和miRNA451的表达,结果显示,miRNA27a在A2780/Taxol细胞中高表达,与A2780细胞相比,表达增高2.2倍。miRNA451在MCF-7/ADM细胞中低表达,与MCF-7细胞相比,表达降低84%。miRNA27a和miRNA451分别在P-gp高表达的A2780/Taxol和MCF-7/ADM细胞中表达异常,可能与耐药相关。
随后,我们将miRNA27a 模拟物转染卵巢癌A2780细胞后,发现其MDR1 mRNA明显升高,细胞对紫杉醇的敏感性下降。而将miRNA27a抑制物转染A2780/Taxol细胞,发现A2780/Taxol细胞中MDR1基因和P-gp表达均下降,细胞对紫杉醇的敏感性增加,这一研究结果表明,抑制miRNA27a表达可以下调P-gp表达和功能,增强A2780/Taxol细胞对紫杉醇的敏感性,部分逆转耐药,也进一步表明,miRNA27a可能通过直接作用某些下游靶基因,间接调控MDR1/P-gp表达和功能。同时,我们将miRNA451模拟物转染乳腺癌MCF-7/ADM细胞,48和72 h后分别检测细胞中MDR1 mRNA和P-gp表达情况,结果显示转染miRNA451模拟物后,MCF-7/ADM细胞的MDR1 mRNA和P-gp表达明显下降,这证明miRNA451负性调控P-gp的表达,当细胞内miRNA451表达下降时,这种负性调控消失,P-gp表达增加。将miRNA451模拟物转染MCF-7/ADM细胞,恢复miRNA451表达后,P-gp受到负性调控,表达下降。为了研究miRNA451与MCF-7/ADM细胞耐阿霉素的关系,将miRNA451模拟物转染MCF-7/ADM细胞后,加入不同浓度的阿霉素后用MTT法检测细胞增殖情况,结果发现转染miRNA451模拟物后细胞对阿霉素的敏感性增加,部分逆转了耐药。
综上所述,miRNA27a和miRNA451分别在卵巢癌耐紫杉醇细胞A2780/Taxol和乳腺癌耐阿霉素细胞MCF-7/ADM中异常表达,在抑制或恢复miRNA27a和miRNA451的表达后,可以部分逆转肿瘤细胞的耐药。miRNA27a和miRNA451可能分别通过间接或直接作用于MDR1/P-gp,参与肿瘤细胞耐药的发生、发展,其具体调节过程有待进一步研究。
[1] SZAKÁCS G, PATERSON J K, LUDWIG J A, et al. Targeting multidrug resistance in cancer [J]. Nat Rev Drug Discov, 2006, 5(3): 219-234.
[2] PASQUINELLI A E, REINHART B J, SLACK F, et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA [J]. Nature, 2000, 408(6808): 86-89.
[3] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell, 2004, 116(2): 281-297.
[4] 李荣国, 王剑, 杨少陵. miR-22通过靶向MTDH抑制胶质瘤细胞的生长[J]. 中国癌症杂志, 2014, 24(6): 401-405.
[5] SORRENTINO A, LIU C G, ADDARIO A, et al. Role of microRNAs in drug-resistant ovarian cancer cells [J]. Gynecol Oncol, 2008, 111(3): 478-486.
[6] BARBAROTTO E, SCHMITTGEN T D, CALIN G A. MicroRNAs and cancer: profile, profile, profile [J]. Int J Cancer, 2008, 122(5): 969-977.
[7] XIA Z S, WANG L, YU T, et al. miR-5000-3p, miR-5009-3P and miR-552: Potential microRNA biomarkers of side population cells in colon cancer [J]. Oncol Rep, 2014, 32(2): 589-596.
[8] 沈月兰, 蒋义国. microRNA与癌症发生相关性研究的现状[J]. 中华肿瘤防治, 2008, 15(1): 68-71.
[9] ZHENG T, WANG J, CHEN X, et al. Role of microRNA in anticancer drug resistance [J]. Int J Cancer, 2010, 126(1): 2-10.
[10] GADDUCCI A, COSIO S, MURACA S, et al. Molecular mechanisms of apoptosis and chemosensitivity to platinum and paclitaxel in ovarian cancer: biological data and clinical implications [J]. Eur J Gynaecol Oncol, 2002, 23(5): 390-396.
[11] ROBERTI A, LA SALA D, CINTI C. Multiple genetic and epigenetic interacting mechanisms contribute to clonally selection of drug-resistant tumors: current views and new therapeutic prospective [J]. J Cell Physiol, 2006, 207(3): 571-581.
[12] GOTTESMAN M M, LING V. The molecular basis of multidrug resistance in cancer: the early years of P-glycoprotein research[J]. FEBS Lett, 2006, 580(4): 998-1009.
[13] KOLTAI Z, VAJDOVICH P. Expression of multidrug resistance membrane transporter (Pgp) and p53 protein in canine mammary tumours [J]. Acta Vet Hung, 2014, 62(2): 194-204.
·更正声明·
刊登于第25卷第1期上的《白蛋白结合型紫杉醇联合替吉奥治疗吉西他滨治疗失败进展期胰腺癌的临床观察》一文的通信作者原为彭小波,现更改为傅强。
本刊编辑部
Expressions of miRNA27a and miRNA451 in ovarian cancer and breast cancer cells and its correlation with drug resistance by targeting MDR1/P-glycoprotein
LI Zhimin1, LUO Xiping1, ZENG Liqin1, PENG Xiuhong1, WANG Yi1, WANG Zehua2(1.Department of Gynecology, Guangdong Women and Children Hospital, Guangzhou Guangdong 510010, China; 2.Department of Obstetrics and Gynecology, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei 430022, China)
LUO Xiping E-mail: lilyzhimin@sina.com
Ovarian cancer; Breast cancer; Paclitaxel; Doxorubicin; MicroRNA; Drug resistance
]Background and purpose:Resistance of cancer cells to chemotherapy is a major clinical obstacle to successful treatment and leads to poor prognosis for the patients. MicroRNA (miRNA) plays a vital role in tumor cells response to chemotherapeutic agents. This study plans to investigate the expressions of miRNA27a and miRNA451 in ovarian cancer and breast cancer cells and its correlation with drug resistance.Methods:A2780/Taxol cells were established using stepwise selection; Stem-loop quantitative real-time PCR (stem-loop RT-PCR) was used to detect expression of miRNA27a and miRNA451 in ovarian cancer and breast cancer cells. The A2780 and A2780/Taxol cells were transfected with the mimics or inhibitors of miRNA27a or negative control (NC) RNA and the mimics of miRNA451 or NC were transfected into MCF-7/ADM cells by LipofectamineTM2000. The expression levels of MDR1 mRNA and P-glycoprotein (P-gp) were examined using RT-PCR and Western blot respectively. MTT method was used to analyze drug sensitivity.Results:The expression of miRNA27a was an average of (2.2±0.30) times higher in A2780/ Taxol cells than in A2780 cells, with a significant difference between the two groups (P<0.05). The expression of miRNA451 was lower by 84% in MCF-7/ADM cells than in MCF-7 cells, with a signifcant difference between the two groups (P<0.05). A2780/Taxol cells transfection with inhibitors of miRNA27a showed that the levels of MDR1 mRNA was decreased by (39±0.14)%, P-gp level [(26±5.3)%] decreased compared with the NC group [(43±6.7)%], the IC50(0.53 μmol/L) was less than the NC group (6.8 μmol/L), and there was a signifcant difference between two groups (P<0.05). Transfection of A2780 cells with mimics of miRNA27a led to increase MDR1 mRNA expression by (121±0.11)% and decrease the sensitivity to paclitaxel (IC50: 0.2 μmol/L vs 0.06 μmol/L). There was a signifcant difference between two groups (P<0.05). Transfection of MCF-7/ADM cells with mimics of miRNA451 showed that expression of MDR1 mRNA was decreased by (65±12)%, P-gp [(31±19)%] was less than the NC group [(83±12)%], the sensitivity of cells to adriamycin enhanced and the IC50of adriamycin (4.61 μmol/L) was less than the NC group (26 μmol/L), and there was a signifcant difference between two groups (P<0.05).Conclusion:The expressions of miRNA27a and miRNA451 are deregulated in A2780/Taxol and MCF-7/ADM cells respectively, which may play vital roles in drug resistance by regulating MDR1/P-gp expression directly or indirectly.
2014-05-13
2014-08-13)
罗喜平 E-mail:lilyzhimin@sina.com
10.3969/j.issn.1007-3969.2015.03.006
R737.31;R737.9
A
1007-3639(2015)03-0190-09
[

