魔芋不可逆凝胶的流变学性质
宋 倩,王 敏,邓利玲,钟 耕,2,*
魔芋不可逆凝胶的流变学性质
宋 倩1,王 敏1,邓利玲1,钟 耕1,2,*
(1.西南大学食品科学学院,重庆 400716;2.西南大学 国家食品科学与工程实验教学中心,重庆市特色食品工程技术研究中心,重庆 400716)
对魔芋不可逆凝胶的流变学特性进行研究,考察不同品种魔芋粉、魔芋粉添加量、加热温度以及胶凝剂的种类和添加量对魔芋不可逆凝胶强度的影响。通过动态黏弹性实验测定魔芋不可逆凝胶的各项流变学参数。结果表明:花魔芋、白魔芋、珠芽魔芋干法加工(干粉)和花魔芋湿法加工(湿粉)的4 种魔芋粉形成的凝胶中,白魔芋干粉品质最佳。魔芋不可逆凝胶化过程中,随着魔芋粉添加量的增大,凝胶化时间缩短,储能模量的平台值也随之增大,升高温度也能加快魔芋粉凝胶化的速率。在温度为80 ℃、pH值为11~13之间,体系的储能模量达到最大值,即可形成品质较好的凝胶。当凝胶剂Na2CO3、Ca(OH)2、Na3PO4添加量分别为0.6%、0.5%、1.0%时,凝胶体系储能模量达到最大值,与损耗模量差值相应也最大,最利于凝胶的形成,且形成凝胶体系所需的时间短。
魔芋不可逆凝胶;流变特性;凝胶强度;胶凝剂
魔芋(Amorphophallus konjac)俗称蒟蒻,是天南星科魔芋属多年生宿茎草本植物,是自然界仅有的几种含天然魔芋葡甘聚糖(konjac glucomannan,KGM)的植物之一,也是唯一分布广泛、适应性强、可大量提取KGM的植物[1-2]。全球商品化的魔芋品种仅有花魔芋(A. rivieri)、白魔芋(A. albus)和珠芽魔芋(A. bulbifer),其中我国以花魔芋分布和利用最广泛,白魔芋也是我国特有的商品化优质魔芋品种,而珠芽魔芋则生长在低纬度地区,如缅甸、泰国、印度尼西亚和我国的云南等地[3]。鲜魔芋加工成魔芋粉的技术有干法和湿法两种,干法生产的魔芋粉占魔芋粉总产量的95%以上,而湿法生产的魔芋粉品质较优[4]。
KGM是一种含量较为丰富的可再生天然高分子资源,具有生物可降解性,其水凝胶具有很高的黏度和增稠、凝胶、成膜等优良特性[5],是一种优质的可溶性膳食纤维,在食品、医药、化工、纺织、石油钻探等领域均有很好的应用价值[6-8]。KGM是由物质的量比为1∶1.7~1∶1.5的葡萄糖和甘露糖残基通过β-1,4糖苷键聚合而成,在某些糖残基C3位上存在由β-1,3糖苷键组成的支链[9]。邓利玲等[10]证明,珠芽魔芋中的KGM糖苷键的构型与花魔芋、白魔芋KGM的构型十分相似。KGM相对分子质量因魔芋种类、品种、加工方法及原料的贮藏时间不同而变化,一般为2×105~2×106[11]。
魔芋粉是KGM的主要应用形态,在充分溶胀的情况下魔芋粉能吸收自身质量80~100 倍的水分,其中的大分子与水分子之间通过氢键、分子偶极、诱导偶极、瞬间偶极等作用力聚集成庞大而难以自由运动的巨型分子[12-13],形成一种水溶性胶体,称为魔芋胶[14]。KGM具有独特而优良的凝胶性能,在一定条件下可以形成热不可逆即热稳定凝胶[15],其应用领域广泛。Maekaji[16]指出,在强碱性溶液中,KGM经过一定的诱导期发生脱乙酰基反应,KGM分子链变为裸状,部分分子间形成氢键而产生结晶作用,以这种结晶为结节点形成了网状结构体,即形成魔芋凝胶。该凝胶热稳定性好,即使在100 ℃条件下重复加热,其凝胶强度变化也不大,即使加热到200 ℃以上也仍然保持稳定,凝胶强度与魔芋粉品种、魔芋粉添加量、胶凝剂的种类和添加量以及加热温度密切相关。
本实验选取4 种常见的魔芋,制取花魔芋、白魔芋、珠芽魔芋干法加工魔芋粉(干粉)和花魔芋湿法加工魔芋粉(湿粉),在初步研究不同种类魔芋粉凝胶形成难易程度和储能模量G’、损耗模量G”的变化趋势后,优选品质最佳的魔芋粉深入研究其在不同温度、胶凝剂作用下形成凝胶的黏弹性,为魔芋不可逆凝胶 的加工条件及模拟加工过程和魔芋胶的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
魔芋粉(花魔芋、白魔芋、珠芽魔芋干粉,花魔芋湿粉),由中国园艺学会魔芋协会提供,质量满足NY/T 494—2010《魔芋粉》标准要求。
本实验所使用化学试剂除特殊说明外,均为分析纯。
1.2 仪器与设备
DHR-1TA流变仪 美国TA公司;PHS-3C pH计上海盛磁仪器有限公司;电动搅拌器 常州澳华仪器有限公司。
1.3 魔芋凝胶的制备[17]
室温条件下,将一定量的魔芋粉均匀混合于100 ℃的去离子水中,在电动搅拌器搅拌下溶胀2 h,冷却至室温。
1.4 魔芋凝胶的动态黏弹性测定
采用流变仪进行魔芋凝胶的流变学性质分析[18-19]。用平板法(平板直径25 mm、平板距离10 mm)在振动模式下,以应变5%(线性黏弹区内)的条件进行小变形振荡扫描,测定弹性模量。在不同温度条件下(60~100 ℃),将碱性胶凝剂加入到魔芋凝胶中迅速搅拌混匀,并取少量魔芋凝胶注入流变仪的金属板上,在恒定的振动频率(1 rad/s)下测定凝胶形成过程中的动态储能剪切模量G’、损耗剪切模量G”。
1.4.1 魔芋粉品种对魔芋凝胶强度的影响
根据1.4节的操作方法,在预实验的基础上,分别选取花魔芋、白魔芋、珠芽魔芋干粉,花魔芋湿粉,固 定Na2CO3的添加量(质量分数,下同)为0.6%,加热温度为80 ℃,分别测定4 种魔芋凝胶的G’、G”。
1.4.2 魔芋粉添加量对魔芋凝胶强度的影响
根据1.4.1节的实验结果,选择品质最佳的魔芋粉为原料,分别配制魔芋粉添加量(质量分数,下同)为1.5%、2.0%、2.5%、3.0%、3.5%的凝胶,固定Na2CO3的添加量为0.6%,加热温度为80 ℃,根据1.4节方法测定其G’及G”。
1.4.3 加热温度对魔芋凝胶强度的影响
根据1.4.2节的实验结果,选择最适宜的魔芋粉添加量配制魔芋凝胶,固定Na2CO3的添加量为0.6%,按照1.4节方法分别测定在60、70、80、90、100 ℃条件下魔芋凝胶的G’及G”。
1.4.4 胶凝剂的种类及添加量对魔芋凝胶强度的影响
根据上述实验的结果的优化条件配制魔芋凝胶,完全溶胀后分别加入3 种不同的胶凝剂(Ca(OH)2、Na2CO3、Na3PO4),混匀后注入到流变仪的金属板上,保持测定温度80 ℃。在恒定频率(1 rad/s)下测定魔芋凝胶的G’及G”。
胶凝剂的添加量:Ca(OH)2、Na2CO3均为0.4%、0.5%、0.6%、0.7%,Na3PO4为0.8%、1.0%、1.2%、1.4%。
2 结果与分析
2.1 不同品种魔芋粉的凝胶强度
图1为4 种魔芋粉在相同条件(魔芋粉添加量3.0%、Na2CO3添加量0.6%、加热温度80 ℃)下形成凝胶的动态黏弹性流变曲线。从达到平台区的时间来看,花魔芋干粉所需时间最长,为10 min;花魔芋湿粉所需时间最短,为4 min;白魔芋和珠芽魔芋干粉均在5 min左右达到平台区。从平台区凝胶的G’和G”来看,白魔芋干粉的G’值最大,为62 794.8 Pa,G”值较小,为14 947.0 Pa,二者之差最大,为47 847.8 Pa,最利于凝胶和高强度凝胶的形成。产生差异的原因可能在于魔芋粉本身性质的不同,如黏度、分子质量[20]、分子链形态等[21]的不同,也可能由加工方式、贮藏时间等外在因素引起,还有待进一步开展结构与性能的深入研究。根据所形成凝胶强度的不同以及形成凝胶体系的难易程度,选择白魔芋干粉为原料,进行进一步动态黏弹性流体的流变学性质研究。
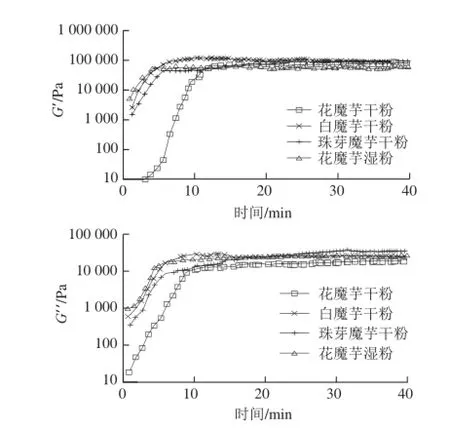
图1 不同品种魔芋粉对凝胶强度的影响Fig.1 Effect of different varieties of konjac flour on gel strength
2.2 不同添加量白魔芋干粉对凝胶强度的影响

图2 不同添加量白魔芋干粉对魔芋凝胶强度的影响Fig.2 Effect of different concentrations of konjac (A. albus) on gel strength
如图2所示,当白魔芋干粉添加量达到1.5%时,G’基本始终大于G”。在保持温度为80 ℃的条件下,凝胶在加碱性胶凝剂后达到平台区所需的时间随着白魔芋干粉添加量的增大而缩短,且当白魔芋干粉添加量为3.0%时,所需时 间最短,为5 min,G’的平台值也随之增大。这是由于随着白魔芋干粉添加量的增大,KGM分子数增多,分子间的交联作用增强,形成的螺旋结构越来越稳定,凝胶性能就越好,凝胶的形成速率也越快。因此,当温度保持在80 ℃时,白魔芋干粉添加量为3.0%形成的凝胶强度较好。
2.3 温度对凝胶强度的影响

图3 加热温度对白魔芋干粉形成凝胶强度的影响Fig.3 Effect of heating temperature on konjac (A. albus) gel strength
如图3所示,当温度达到60 ℃及以上时,魔芋凝胶的G’大于G”,表明白魔芋干粉在此温度下即可形成凝胶结构。当温度为60、70 ℃时,魔芋凝胶达到平台区所需时间为12.5、10 min;当温度为80 ℃及以上时,魔芋凝胶达到平台区所需时间为5 min,且随着温度的升高,G’的平台值也随之增大。这是由于在较低温度时,KGM分子并没有完全呈卷曲状结构,形成的双螺旋结构较少,而高于80 ℃时,随着温度的升高,KGM分子在水溶液中逐渐形成卷曲状结构,在形成凝胶过程中,分子从卷曲状结构向螺旋结构转变,进而螺旋发生聚集,形成物理交联,最终形成宏观的三维网络结构。因此,温度对凝胶形成的影响表现在升高温度能加速凝胶化、缩短凝胶达到平台区所需的时间。当温度为80 ℃时,即可形成强度较高的凝胶。
2.4 胶凝剂的种类及添加量对凝胶强度的影响
2.4.1 Na2CO3添加量对凝胶强度的影响
考察在温度为80 ℃、白魔芋干粉添加量为3.0%时,凝胶在Na2CO3不同添加量下G’和G”随时间变化的关系。魔芋凝胶的初始pH值为7.86,加入0.4%、0.5%、0.6%、0.7%的Na2CO3后,凝胶体系的pH值不断增加,并在30 min后基本达到稳定,分别为11.25、11.36、11.51、11.56。如图4所示,随着Na2CO3添加量的增大,魔芋凝胶达到平台区所需的时间缩短,当Na2CO3添加量为0.6%时,魔芋凝胶达到平台区所需时间最短,为5 min,平台区的G′值最大,为154 941.0 Pa,且在此时与G”的差值达到最大,为100 285.1 Pa,最利于凝胶的形成。这是由于随着Na2CO3添加量的增大,KGM脱乙酰基反应进行得越来越完全,分子间的相互作用力增强,凝胶强度逐渐增大[22]。因此,当Na2CO3添加量为0.6%时,魔芋凝胶强度达到最大。
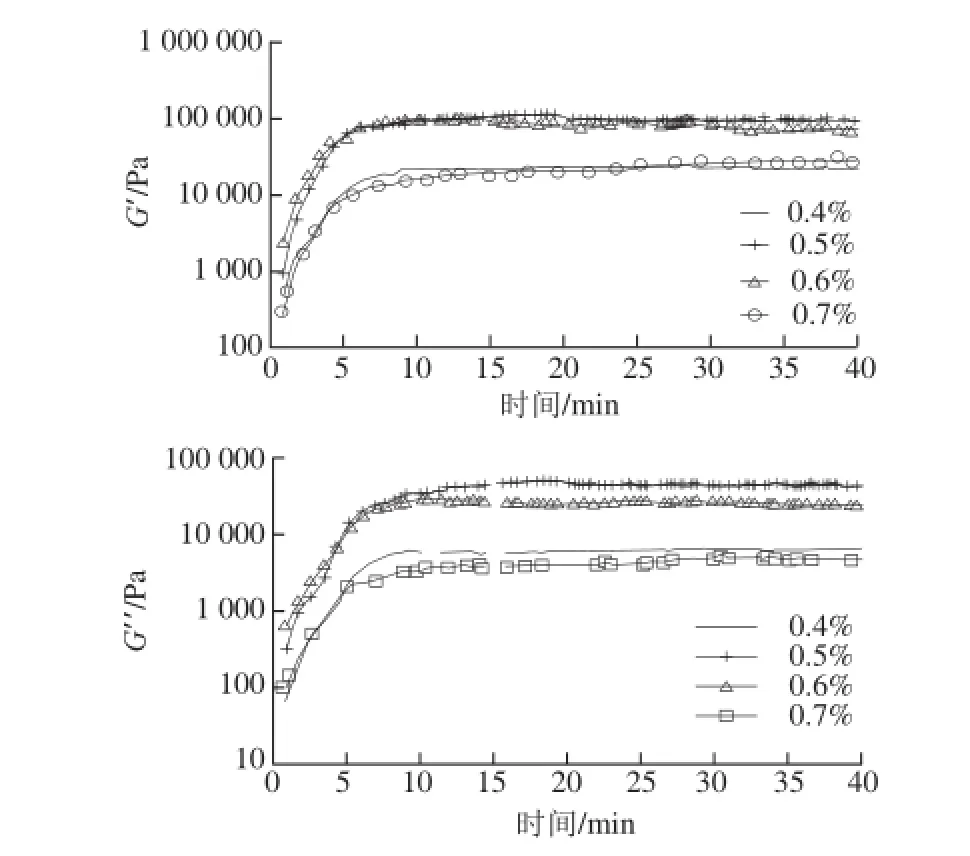
图4 NaCO3添加量对凝胶强度的影响Fig.4 Effect of different concentrations of Na2CO3on konjac (A. albus) gel strength
2.4.2 Ca(OH)2添加量对凝胶强度的影响

图5 Ca(OOHH))2添加量对凝胶强度的影响Fig.5 Effect of different concentrations of Ca(OH)2on konjac(A. albus) gel strength
考察在温度为80 ℃、白魔芋干粉添加量为3.0%时,凝胶在Ca(OH)2不同添加量下G’、G”随时间变化的关系。魔芋凝胶的初始的pH值为7.86,加入0.4%、0.5%、0.6%、0.7%的Ca(OH)2后,凝胶体系的pH值不断增加,并在30 min后基本达到稳定,均在12.5左右。如图5所示,随着Ca(OH)2添加量的增大,凝胶化速率加快,凝胶化时间缩短,凝胶平台区的G’值和G″值在Ca(OH)2添加量为0.5%时达到最大,分别为358 268.0、147 575.0 Pa,且在此时两者差值最大,为210 693.0 Pa,最利于凝胶的形成。当Ca(OH)2添加量为0.6%、0.7%时,凝胶平台区的G’值和G”值均有所减小。这是由于随着Ca(OH)2添加量的增加,KGM脱乙酰基反应进行得越来越完全,凝胶强度逐渐增大,但KGM在强碱的作用下,随着时间的延长会出现部分降解[23],G’值和G”值减小,凝胶强度下降。因此,当Ca(OH)2添加量为0.5%时,魔芋凝胶强度达到最大,形成凝胶所需的时间最短。
2.4.3 Na3PO4添加量对凝胶强度的影响

图6 Na 6 Na3POPO4添加量对凝胶强度的影响Fig.6 Effect of different concentrations of Na3PO4on konjac (A. albus) gel strength
考察在温度为80 ℃、白魔芋干粉添加量为3.0%时,凝胶在Na3PO4不同添加量下G’、G”随时间变化的关系。魔芋凝胶的初始的pH值为7.86,加入0.8%、1.0%、1.2%、1.4%的Na3PO4后,体系的pH值不断增加,并在30 min后基本达到稳定,体系均在11.5左右。如图6所示,魔芋凝胶在不同Na3PO4添加量下达到平台区所需时间差异不大,均为5 min左右;当Na3PO4添加量为1.0%时,凝胶的G’值最大,为129 779.0 Pa,且在此时与G″的差值达到最大,为117 984.6 Pa,最利于凝胶的形成。但添加Na3PO4的成本较高,且欲得到相同强度的凝胶,其添加量要大于Na2CO3及Ca(OH)2,因此在一般情况下,不选用Na3PO4作为魔芋凝胶制品的胶凝剂。
3 结 论
在相同条件下,从形成凝胶所需时间和凝胶强度两方面考察4 种魔芋粉形成凝胶的品质,其中以白魔芋干粉的品质最佳。在魔芋不可逆凝胶化过程中,随着魔芋粉添加量的增加,凝胶化时间缩短,G’的平台值也随之增大;升高温度也能加速凝胶化,在温度为80 ℃、pH值为11~13之间时,G’达到最大值,即可形成较好的凝胶;Na2CO3添加量为0.6%时,凝胶的G’值最大,且与G”的差值达到最大,最利于凝胶的形成,且形成凝胶体系所需的时间短;Ca(OH)2添加量为0.5%时,凝胶达到平台期所需时间最短,G’值最大,G”值较小,最利于凝胶的形成;Na3PO4添加量为1.0%时,凝胶的G’值最大,与G”的差值达到最大,最利于凝胶的形成,但其添加量较大,所需成本高,生产上宜优选Ca(OH)2和Na2CO3作为魔芋粉的胶凝剂。
[1]CHUA M, BALDWIN T C, HOCKING T J, et al. Traditional uses and potential health ofAmorphophallus konjacK. Koch ex N.E.Br.[J]. Journal of Ethnopharmacology, 2010, 128(2): 268-278.
[2] KHANNA S, TESTER R F. Infl uence of purifi ed konjacglucomannan on the gelatinisation and retrogradation properties of maize and potato starches[J]. Food Hydrocolloids, 2006, 20(5): 567-576.
[3] 陈葳. 魔芋种植利用与加工技术[D]. 福州: 福建农林大学, 2013: 8-11.
[4] 王洪伟, 钟耕, 张盛林. 我国魔芋粉加工技术和设备的研究与应用[J].食品工业科技, 2009, 30(4): 337-340.
[5] 孙远明, 吴青, 谌国莲, 等. 魔芋葡甘聚糖的结构、食品学性质及保健功能[J]. 食品与发酵工业, 1999, 25(5): 47-51.
[6] LIU Pu, YANG Yonghuan, LIU Ye, et al. Konjac glucomannan supported palladium complex: an efficient and recyclable catalyst for Heck reaction[J]. Reactive and Functional Polymers, 2008, 68(1): 384-388.
[7]DU Jian, DAI Jing, LIU Junlong, et al. Novel pH-sensitive polyelectrolyte carboxymethyl konjac glucomannan-chitosan beads as drug carriers[J]. Reactive and Functional Polymers, 2006, 66(10): 1055-1061.
[8]CHEN Ligui, LIU Zhilan, ZHUO Renxi. Synthesis and properties of degradable hydrogels of konjac glucomannan grafted acrylic acid for colon-specific drug delivery[J]. Polymer, 2005, 46(16): 6274-6281.
[9] NISHINARI K, WILLIAMS P A, PHILLIPS G O. Review of the physico-chemical characteristics and properties of konjac mannan[J]. Food Hydrocolloids, 1992, 6(2): 199-222.
[10] 邓利玲, 徐小青, 杨延迅, 等. 珠芽魔芋精粉的理化性质[J]. 食品科学, 2013, 34(17): 120-125. doi: 10.7506/spkx1002-6630-201317027.
[11] 李斌, 谢笔钧. 魔芋葡甘聚糖分子链形态研究[J]. 中国农业科学, 2004, 37(2): 280-284.
[12]VANDERBEEK P B, FASANO C, O’MALLEY G, et al. Esophageal obstruction from a hygroscopic pharmacobezoar containing glucomannan[J]. Clinical Toxicology, 2007, 45(1): 80-82.
[13] ALONSO-SANDE M, TEIJEIRO-OSORIO D, REMUFLDNLOPEZ C, et al. Glucomannan, a promising polysaccha ride for biopharmaceutical purposes[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2009, 72(2): 453-462.
[14] 李坚斌, 陈小云, 梁慧洋, 等. 魔芋胶的性质研究[J]. 食品科学, 2009, 30(19): 93-95.
[15]XIAO Chaobo, GAO Shanjun, WANG Heng, et al. Blend films from chitosan and konjac glucomannan solutions[J]. Journal of Applied Polymer Science, 2000, 76(4): 509-515.
[16]MAEKAJI K. The mechanism of gelation of konjac mannan[J]. Agricultural and Biological Chemistry, 1974, 38(2): 315-321.
[17] GÓMEZ M, RONDA F, BLANCO C A, et al. Effect of dietary fi bre on dough rheology and bread quality[J]. European Food Research and Technology, 2003, 216(1): 51-56.
[18] KISHIDA N. Relationship between the quality of konjac flour and the molecular matter nature of konjac mannan[J]. Agricultural and Biological Chemistry, 1979, 43(11): 2391-2392.
[19] KOBAYASHI S, TSUJIHATA S, HIBI N, et al. Preparation and rheological characterization of carboxymethyl konjac glucomannan[J]. Food Hydrocolloids, 2002, 16(4): 289-294.
[20] SHEN Dan, WAN Chao, GAO Shanjun. Molecular weight effects on gelation and rheological properties of konjac glucomannan-xanthan mixtures[J]. Journal of Polymer Science Part B: Polymer Physics, 2010, 48(3): 313-321.
[21] 彭述辉, 温成荣, 姚闽娜, 等. 不同分子质量魔芋葡甘聚糖凝胶性质研究[J]. 西南大学学报: 自然科学版, 2010, 32(11): 151-157.
[22] DU Xuezhu, LI Jing, CHEN Jian, et al. Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J]. Food Research International, 2012, 46(1): 270-278.
[23] WILLIAMS M A K, FOSTER T J, MARTIN D R, et al. A molecular description of the gelation mechanism of konjac mannan[J]. Biomacromolecules, 2000, 1(3): 440-450.
Rheological Properties of Irreversible Konjac Gel
SONG Qian1, WANG Min1, DENG Liling1, ZHONG Geng1,2,*
(1. College of Food Science, Southwest University, Chongqing 400716, China; 2. Chongqing Special Food Programme and Technology Research Center, National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400716, China)
In this work, the rheological properties of irreversible konjac gel were studied, and the effects of konjac powders from different varieties, konjac powder concentration, heating temperature and gelling agent type and concentration on irreversible konjac gel strength were investigated. The rheological parameters of konjac irreversible gel were obtained by measurement of the storage modulus G′ and the loss modulus G″. The results showed that the gel formed from A. albus fl our was the best among four samples. In the irreversible gelation process, with increasing konjac powder concentration, gelation time became shorter, and the platform value of shear modulus was enhanced. Elevated temperature could accelerate the rate of gelation. It was found that better gelation could be formed at 80℃and in the pH range of 11 to 13. The storage modulus and the difference in loss modulus reached their maximum values when 0.6%, 0.5% and 1.0% of the gelling agents Na2CO3, Ca(OH)2and Na3PO4were added respectively, and the time for the formation of gels was shortened.
irreversiblekonjac gel; rheological properties; gel strength; gelling agents
TS219
A
10.7506/spkx1002-6630-201511017
2014-10-11
重庆市“121”科技支撑示范工程高校学生创新项目(cstc2014zktjccxyyB0022)
宋倩(1991—),女,硕士研究生,主要从事食品科学研究。E-mail:songqian3469@163.com
*通信作者:钟耕(1964—),男,教授,博士,主要从事粮油食品加工及天然产物开发研究。E-mail:gzhong@swu.cq.cn

