微波协同酶法提取刺玫叶总黄酮工艺研究
王晓林,钟方丽,薛健飞,单雪娜
(吉林化工学院 化学与制药工程学院,吉林 吉林132022)
山刺玫(Rosa davurica)系蔷薇科蔷薇属植物,广泛分布于东北、山西、内蒙古等地。其果实富含皂苷、黄酮、多糖等活性成分[1-3],具有降血糖、降血压、除血栓、抗衰老及保肝等众多药理作用[4-6],是一种经济价值极高的食、药同源的宝贵资源。有关山刺玫果已有详细研究[7-10],目前关于刺玫叶研究的很少,而刺玫叶与果相比资源更丰富,价廉易得,本课题组采用HPLC法和UV法对刺玫叶中金丝桃苷和总黄酮含量进行了测定[11],为了进一步提高刺玫叶的应用价值,对微波协同酶法提取刺玫叶总黄酮的工艺进行了初步探索,酶法提取是近年来应用较广泛的一种植物有效成分提取新技术,具有高效、无毒、条件温和、易于控制、能保持生物活性等优点[12-13],如酶法辅助提取沙棘果渣、枸杞、银杏叶总黄酮等[14-16]。本研究将为刺玫叶的进一步开发提供了基础依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂 刺玫叶采自吉林市丰满区小白山,经吉林化工学院药学系薛健飞博士鉴定为蔷薇科蔷薇属植物山刺玫(Rosa davurica),秋季采收,除去杂质,晾干,置干燥处保存;芦丁,中国食品药品检定研究院(供含量测定用);木瓜蛋白酶,江苏锐阳生物科技有限公司;纤维素酶,湖南红鹰祥生物股份有限公司;果胶酶,上海金穗生物科技有限公司;三氯化铝、醋酸、醋酸钠、无水乙醇均为分析纯,天津市大茂化学试剂厂;水为重蒸馏水;其余所用试剂均为化学纯。
1.1.2 仪器与设备 微波辐射萃取仪,MAS-Ⅱ型,上海新仪微波化学科技有限公司;紫外可见分光光度计,TU-1810型,北京普析通用仪器有限责任公司。
1.2 试验方法
1.2.1 标准曲线的制备 精密称取干燥至恒重的芦丁对照品23.2mg于100mL容量瓶中,60%乙醇溶解并定容。精密量取芦丁对照品溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5mL于25mL容量瓶中,加60%乙醇至6mL,再加入5mL 0.1moL·L-1的三氯化铝溶液及2.5mL 0.2moL·L-1pH值为5.2的醋酸-醋酸钠缓冲溶液,60%乙醇溶液定容,摇匀,置于40℃水浴中加热15min,冷却至室温,以显色剂为空白对照,在405nm处测定吸光度值。以芦丁对照品浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,进行直线回归,回归方程:A=27.147C-0.022 6,R=0.999 6。结果表明在4.64~32.48μg·mL-1范围内呈良好的线性关系。
1.2.2 样品含量测定 精密吸取刺玫叶提取液适量于25mL容量瓶中,按“1.2.1”项下所述方法进行测定,以相应刺玫叶提取液为空白,在405nm波长处测吸光度,计算出总黄酮提取率,计算公式如下:
刺玫叶总黄酮提取率(mg·g-1)=总黄酮的质量/刺玫叶的质量
1.2.3 酶法提取刺玫叶总黄酮的试验 取刺玫叶粗粉适量,称取2.5g,放入到提取烧瓶中,加入25倍量的75%乙醇,加入适宜的酶,在合适的温度、pH值等条件下酶解,过滤,合并提取液,按1.2.2节方法测定刺玫叶提取液中总黄酮含量,以总黄酮提取率为指标,分别考察酶种类及其用量、提取时间、提取液pH值、提取温度、提取次数对总黄酮提取率的影响,并在单因素试验基础上,对主要影响因素进行正交试验[17-20]。
2 结果与分析
2.1 酶法提取刺玫叶总黄酮的单因素试验
2.1.1 酶种类及其用量对总黄酮得率的影响
2.1.1.1 纤维素酶 取刺玫叶粗粉适量,称取2.5 g,酶解温度控制在45℃,料液比为1∶25,提取溶剂为75%乙醇,pH 5.0条件下,选择不同用量的纤维素酶(20、30、40、50、60、70、80mg·g-1)酶解120 min,90℃、30s灭酶,过滤,记录提取液体积,吸取提取液适量于25mL容量瓶中,按1.2.2节方法测定提取液总黄酮含量,计算总黄酮提取率,确定最佳纤维素酶用量。
2.1.1.2 果胶酶 取刺玫叶粗粉适量,称取2.5g,选择不同用量的果胶酶(20、30、40、50、60、70、80 mg·g-1)酶解120min,其他条件同2.1.1.1节。
2.1.1.3 复合酶(纤维素酶∶果胶酶=1∶1) 取刺玫叶粗粉适量,称取2.5g,选择不同用量的复合酶(纤维素酶∶果胶酶=1∶1、20、30、40、50、60、70、80mg·g-1)酶解120min,其他条件同2.1.1.1。
2.1.1.4 复合酶(纤维素酶∶果胶酶=1∶2) 取刺玫叶粗粉适量,称取2.5g,选择不同用量的复合酶(纤维素酶∶果胶酶=1∶2、20、30、40、50、60、70、80mg·g-1)酶解120min,其他条件同2.1.1.1。
2.1.1.5 复合酶(纤维素酶∶果胶酶=2∶1) 取刺玫叶粗粉适量,称取2.5g,选择不同用量的复合酶(纤维素酶∶果胶酶=2∶1、20、30、40、50、60、70、80mg·g-1)酶解120min,其他条件同2.1.1.1(图1)。

图1 酶种类及用量的影响Fig.1 The influence of varieties and amount of the enzyme
由图1得知,随着纤维素酶用量的增加,刺玫叶总黄酮提取率逐渐提高,当纤维素酶用量为60mg·g-1时,刺玫叶总黄酮提取率达到19.48mg·g-1,继续增加纤维素酶用量提取率提高幅度较小,因此,纤维素酶用量确定为60mg·g-1。果胶酶用量对刺玫叶总黄酮提取率影响趋势与纤维素酶相似,但提取率低于纤维素酶。当复合酶(纤∶果=1∶1)用量由20mg·g-1增加到60mg·g-1时,刺玫叶总黄酮提取率随之提高,当复合酶用量>60 mg·g-1时,提取率略有下降。随复合酶(纤∶果=1∶2)用量的增加,刺玫叶总黄酮提取率逐渐提高,对刺玫叶总黄酮提取率影响趋势与纤维素酶相似,但提取率低于纤维素酶。当复合酶(纤∶果=2∶1)用量由20mg·g-1增加到60mg·g-1时,总黄酮提取率逐步提高,达到22.02mg·g-1,继续增加复合酶用量提取率提高幅度较小。根据对酶种类及用量的单因素试验结果可知,使用复合酶(纤∶果=2∶1)辅助提取刺玫叶总黄酮其提取率高于其他酶,所以选择复合酶(纤∶果=2∶1)辅助提取刺玫叶总黄酮,其最佳用量为70mg·g-1。
2.1.2 提取时间对总黄酮提取率的影响 取刺玫叶粗粉适量,称取2.5g,酶解温度控制在45℃,料液比为1∶25,提取溶剂为75%乙醇,复合酶(纤∶果=2∶1)用量70mg·g-1,pH 5.0条件下,分别酶解提取(0.5、1.0、1.5、2.0、2.5h),其他操作同2.1.1.1节(图2)。
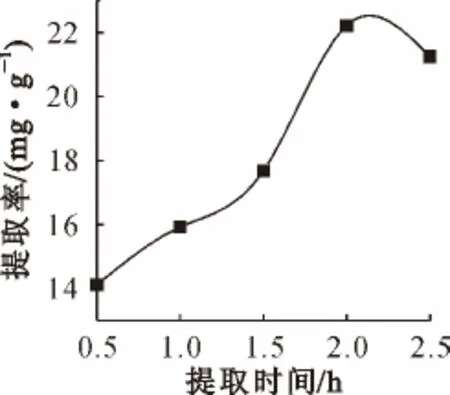
图2 提取时间的影响Fig.2 The influence of extraction time
由图2可知,随着酶解时间的延长,刺玫叶总黄酮提取率逐渐提高,在酶解时间达到2.0h时提取率达到最高值,再延长酶解时间,提取率反而下降,因此选择最佳酶解时间为2.0h。
2.1.3 pH对总黄酮得率的影响 取刺玫叶粗粉适量,称取2.5g,酶解温度控制在45℃,料液比为1∶25,提取溶剂为75%乙醇,复合酶(纤∶果=2∶1)用量70mg·g-1,分别于pH(2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)条件下酶解提取2.0 h,其他操作同2.1.1.1节(图3)。
由图3可知,随着pH值的升高,刺玫叶总黄酮提取率逐渐增大,当pH=4.5时提取率达到最高值,pH值再提高时,提取率开始逐渐下降,因此确定酶解的最佳pH值为4.5。
2.1.4 温度对总黄酮得率的影响 取刺玫叶粗粉适量,称取2.5g,料液比为1∶25,提取溶剂为75%乙醇,复合酶(纤∶果=2∶1)用量70mg·g-1,pH4.5条件下分别在30、35、40、45、50、55、60℃酶解提取2.0h,其他操作同2.1.1.1节(图4)。

图3 pH值的影响Fig.3 The influence of pH

图4 提取温度的影响Fig.4 The influence of extraction temperature
由图4可知,随着酶解温度的升高,刺玫叶总黄酮提取率逐渐提高,当温度达到55℃时,提取率上升到最高值,温度再提高,提取率开始下降,说明此条件下55℃是最佳酶解温度。
2.1.5 提取次数对总黄酮得率的影响 取刺玫叶粗粉适量,称取2.5g,料液比为1∶25,提取溶剂为75%乙醇,复合酶(纤∶果=2∶1)用量70mg·g-1,pH4.5条件下在55℃酶解提取2.0h,然后将提取残渣按上述条件(不加酶)分别进行第2、3、4、5次提取,其他操作同2.1.1.1节(图5)。

图5 提取次数的影响Fig.5 The influence of extraction times
2.2 酶法提取刺玫叶总黄酮的正交试验
2.2.1 因素及水平的考察 在上述单因素试验的基础上,以刺玫叶总黄酮提取率为考察指标,选择复合酶(纤∶果=2∶1)用量、提取时间、pH值和提取温度作为考察因素进行正交试验,优化刺玫叶总黄酮的酶解提取工艺。按四因素三水平进行正交试验设计L9(34)(表1),在此条件下对刺玫叶总黄酮进行酶解提取,按1.2.2节方法测定提取液的吸光度,计算总黄酮提取率。

表1 正交试验Table 1 Factors and levels of orthogonal tests
2.2.2 正交试验结果 取刺玫叶粗粉适量,称取2.5g,放入到提取烧瓶中,按正交试验表进行试验,每组试验的提取溶剂均为75%乙醇,料液比为1∶25,提取2次(表2)。
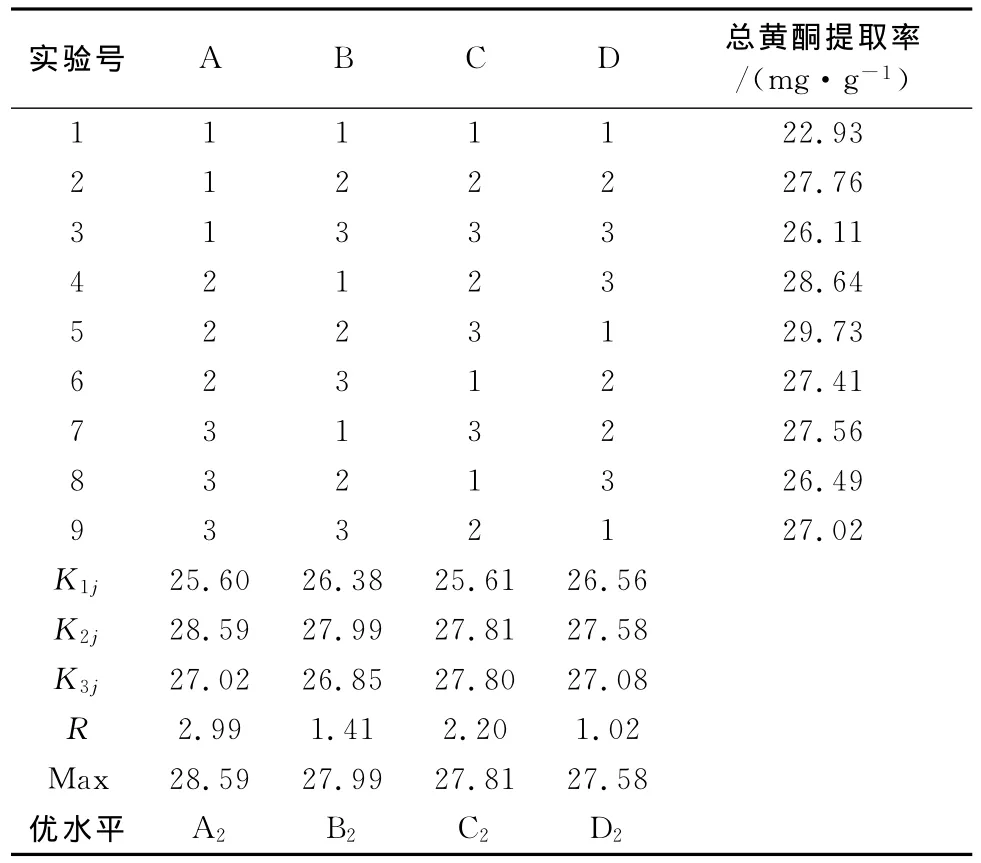
表2 正交试验结果Table 2 Experimental data of orthogonal tests
正交试验结果表明,复合酶(纤∶果=2∶1)辅助提取刺玫叶总黄酮各因素的影响大小为:复合酶(纤∶果=2∶1)用量>酶解时间>pH值>酶解温度,刺玫叶总黄酮的最佳酶解提取工艺条件为A2B2C2D2,即料液比为1∶25,提取溶剂为75%乙醇,复合酶(纤∶果=2∶1)用量70mg·g-1,pH值为4.5,提取温度为55℃,酶解提取时间为120min,提取次数2次。
2.3 酶法提取刺玫叶总黄酮工艺稳定性验证试验
取刺玫叶粗粉适量,称取2.5g,放入到提取烧瓶中,加入25倍生药量的75%乙醇和0.175g复合酶(纤∶果=2∶1),酶解温度控制在55℃,控制提取液于pH值4.5条件下酶解提取2次,每次120min,其他操作同2.1.1.1。按上述工艺条件重复试验3次。结果刺玫叶总黄酮提取率分别为29.67、30.32、30.41 mg·g-1,平均为30.13mg·g-1,结果表明优选的刺玫叶总黄酮酶解提取工艺比较稳定。
2.4 微波协同酶法提取刺玫叶总黄酮试验
取刺玫叶粗粉适量,称取2.5g,放入提取烧瓶中,按酶解提取最佳条件提取,然后在微波功率600 W,控制微波温度60℃条件下提取2次,每次15 min,3次试验刺玫叶总黄酮提取率分别为31.87、32.64、32.12mg·g-1,平均为32.21mg·g-1,结果表明微波协同后刺玫叶总黄酮提取率比酶法提高2.08mg·g-1。
3 结论
本试验采用单因素和正交试验法对微波协同酶法提取刺玫叶总黄酮的工艺进行了优化。其最佳工艺条件为:提取溶剂为75%乙醇、料液比1∶25、复合酶(纤∶果=2∶1)用量70mg·g-1、酶解温度55℃、酶解时间120min、酶解提取2次、酶解体系pH4.5、微波功率600W,微波处理时间15min、微波温度60℃、微波提取2次,在此工艺条件下,刺玫叶总黄酮提取率为32.21mg·g-1。
[1] 王领弟,李艳荣,张晓峰,等.刺玫果的研究近况[J].承德医学院学报,2011,28(4):416-417.
[2] 黄成钢,苑春升,魏峰,等.刺玫果化学成分研究[J].中草药,1991,22(6):285.
[3] 王光函,姜鸿,张振秋,等.刺玫果药材中黄酮类成分测定[J].中成药,2011,33(4):710-712.
[4] 张远.刺玫果提取物对心血管系统的作用[J].中草药,1985,16(1):20-24.
[5] 俞作仁,王文莉,吕娟涛.刺玫果化学成分及药理作用研究进展[J].中草药,2002,33(2):188-190.
[6] 焦淑萍,陈彪,姜虹.山刺玫果实清除羟自由基及抗DNA损伤作用的实验研究[J].北华大学学报:自然科学版,2002,3(4):307-308.JIAO S P,CHEN B,JIANG H.On scavenge of hydroxyl radical and protection of anti-DNA damage by Rosa davurica Pall[J].Journal of Beihua University:Natural Science,2002,3(4):307-308.(in Chinese)
[7] 钟方丽,陈帅,关晓侠.微波法提取刺玫果总黄酮工艺研究[J].江苏农业科学,2010(6):449-451.ZHONG F L,CHEN S,GUAN X X.Study on extraction process of total flavonoids fromRosedavuricaPall.by microwave[J].Jiangsu Agricultural Sciences,2010(6):449-451.(in Chinese)
[8] 庄志军,钟方丽,杨英杰,等.刺玫果中总黄酮的提取与分析[J].中成药,2007,29(9):1394-1395.
[9] 钟方丽,王晓林,敬采月.高效液相色谱法测定刺玫果中金丝桃苷的含量[J].食品科学,2010,31(24):281-284.ZHONG F L,WANG X L,JING C Y.Determination of hyperin in Rosa davurica Pall.by HPLC[J].Food Science,2010,31(24):281-284.(in Chinese)
[10] 王晓林.高效液相色谱法测定刺玫果中槲皮素的含量[J].食品工业科技,2011,32(4):370-372.WANG X L.Determination of quercetin in Rosa davurica Pall by HPLC[J].Science and Technology of Food Industry,2011,32(4):370-372.(in Chinese)
[11] 王晓林,钟方丽,孙晓雨,等.刺玫叶中金丝桃苷和总黄酮含量的测定[J].食品科学,2013,34(2):231-235.WANG X L,ZHONG F L,SUN X Y,et al.Determination of hyperoside and total flavonoids in leaves of Rosa davurica Pall.[J].Food Science,2013,34(2):231-235.(in Chinese)
[12] 申彦晶,赵树进.酶工程在中药有效成分提取及转化中的应用[J].中国医药工业杂志,2007,38(4):309-312.SHEN Y J,ZHAO S J.Application of enzyme engineering in extraction and transformation of active components from traditional Chinese Medicine[J].Chinese Journal of Pharmaceuticals,2007,38(4):309-312.(in Chinese)
[13] 章斌,侯小桢.复合酶法提取广佛手总黄酮的工艺[J].食品研究与开发,2010,31(10):188-191.ZHANG B,HOU X Z.Study on extraction of total flavonoids from bergamot by compound enzymolysis[J].Food Research and Development,2010,31(10):188-191.(in Chinese)
[14] 韩爱霞,任彦蓉.果胶酶对枸杞中总黄酮的提取效果研究[J].食品科技,2009,34(8):138-141.HAN A X,REN Y R.Study on pectinase assisted extraction of total flavonoids from matrimony vine[J].Food Science and Technology,2009,34(8):138-141.(in Chinese)
[15] 焦岩,王振宇.响应面法优化纤维素酶辅助提取大果沙棘果渣总黄酮工艺研究[J].林产化学与工业,2010,30(1):85-91.JIAO Y,WANG Z Y.Optimization of technology using response surface analysis for extracting flavonoids from seabuckthorn residue assisted by cellulase[J].Chemistry and In-dustry of Forest Products,2010,30(1):85-91.(in Chinese)
[16] 艾自明,任慧霞.纤维素酶在银杏叶黄酮生产中的应用[J].食品与药品,2010,12(1):60-62.AI Z M,REN H X.Application of cellulase in production of flavonoids from Ginkgo biloba leaves[J].Food and Drug,2010,12(1):60-62.(in Chinese)
[17] 韩爱芝,白红进,耿会玲,等.响应面法优化超声辅助提取黑果枸杞叶片总黄酮的工艺研究[J].西北林学院学报,2013,28(1):114-118.HAN A Z,BAI H J,GENG H L,et al.Optimization of ultrasound-assisted extraction of total flavonoids fromLyciumruthenicum leaves by Response Surface Methodology[J].Journal of Northwest Forestry University,2013,28(1):114-118.(in Chinese)
[18] 张红俊,常振国,杨建,等.超声辅助提取蚕沙中总黄酮的工艺研究[J].西北林学院学报,2010,25(6):155-157.ZHANG H J,CHANG Z G,YANG J,et al.Study on the method for ultrasonic assisted extraction of flavonoids from silkworm excrement[J].Journal of Northwest Forestry University,2010,25(6):155-157.(in Chinese)
[19] 乔东东,张云,尤新军,等.星点设计-效应面法优化梓树果实总黄酮的超声提取工艺[J].西北林学院学报,2010,25(3):170-174.QIAO D D,ZHANG Y,YOU X J,et al.Optimization of the ultrasonic wave aided extraction of flavoniods from the fruits of Catalpa ovata by central composite design-response surface methodology[J].Journal of Northwest Forestry University,2010,25(3):170-174.(in Chinese)
[20] 杨云裳,蒋旺,张应鹏,等.酶法提取槐角中总黄酮的工艺优化[J].食品工业科技,2012,33(13):277-280.YANG Y S,JIANG W,ZHANG Y P,et al.Optimization of enzyme-assisted extraction technology for total flavones from pagodatree pod[J].Science and Technology of Food Industry,2012,33(13):277-280.(in Chinese)

