基于改进C-V模型乳腺癌MR图像分割
尤伟峰,叶少珍,2
(1.福州大学数学与计算机科学学院,福建福州 350116;2.福建省医疗器械与医药技术重点实验室,福建福州 350002)
0 引言
医学图像分割是医学图像处理中的一项关键技术,是三维重构,定量分析的前提和基础[1].目前应用于医学图像分割的方法主要包括人工智能算法及基于偏微分方程的图像处理算法,主流方法包括参数活动轮廓模型和几何活动轮廓模型.但前者在分割图像时演化曲线无法进行拓扑结构变化,无法分割出目标中的空洞区域;后者主要包括基于区域能量的C-V模型和基于边界能量的GAC模型.GAC模型的分割精度受限于初始化零水平集曲线的位置,具有较大的局限性,C-V模型基于区域能量进行图像分割,对初始化水平集曲线较不敏感,而医学乳腺癌MR图像在成像过程中由于部位的特殊性,有些边缘往往较为模糊,因此C-V模型常用于乳腺癌MR图像分割.但传统的C-V方法具有局限性,没有充分利用图像梯度曲率信息,需要重新初始化水平集函数使其保持为一个符号距离函数(SDF)等[2].这些问题导致C-V模型分割图像速度比较慢,而且在能量泛函最小化的过程中,对亮度不均匀的区域敏感,容易造成目标区域过度分割[3],图像分割精确度较低.
针对上述缺点,许多研究者对传统的C-V模型进行改进.针对C-V模型需重新初始化水平集的缺点,Zhao等[4]提出了改进的方法,对初始零水平集曲线常数化,避免重新初始化;Zhu和Song等[5]提出基于梯度的C-V模型算法,将梯度信息融入C-V模型,充分考虑边界能量和区域能量对图像分割的影响,取得了较好的分割效果.
本文把文献[6]提出的无需重新初始化水平集函数的思想应用在C-V分割模型上,在传统的C-V模型中加入补偿能量项,避免图像分割过程中水平集函数需要重新初始化的问题,加快了图像分割速度;同时引入梯度曲率能量项,在一定程度上克服了对亮度不均匀的目标区域过度分割的缺点,提高了图像分割精确度.
1 图像分割C-V模型
C-V模型最早是由Chan和Vese基于简化的Mumford-shah泛函共同提出的一种基于区域最小方差的几何主动轮廓模型[7-8].C-V模型对图像的分割并不依赖于目标边缘梯度,而是使用基于区域能量,可以自动地检测目标中间的空洞.C-V模型自提出以来,已经成为非纹理图像分割中被广泛研究和应用的模型之一.基于简化Mumford-Shah泛函的C-V图像分割模型图像域划分如图1所示.

图1 C-V模型图像域的划分Fig.1 C -V model image domain division
图像域Ω是R2的一个有界子集,Ω1是Ω里面的目标区域,Ω2是背景部分,曲线C将背景域和目标域分开.C-V模型对图像I0进行分割是通过寻找一条光滑闭合曲线,把原来图像I0分为若干部分,使分割得到的图像I与原图I0之间的区域方差最小[9].
C-V能量泛函模型如式(1)、式(2)所示:

式(1)中第一项表示原图与分割得到的目标区域Ω1的区域方差;第二项表示原图与分割得到的背景区域Ω2区域方差;第三项是分割曲线的长度.式(2)表示的是分割的目标区域和背景区域灰度均值.通过最小化能量泛函ECV,使用最短的分割曲线得到与原图像最接近的分割结果[10].
2 改进图像分割C-V模型
在传统C-V模型基础上加入惩罚能量和边界曲率能量,构造一个改进的C-V分割模型,在一定程度上克服了传统C-V模型容易对亮度不均匀的目标区域产生过度分割的缺点,同时加快了图像分割的速度,其能量泛函如式(3)所示:
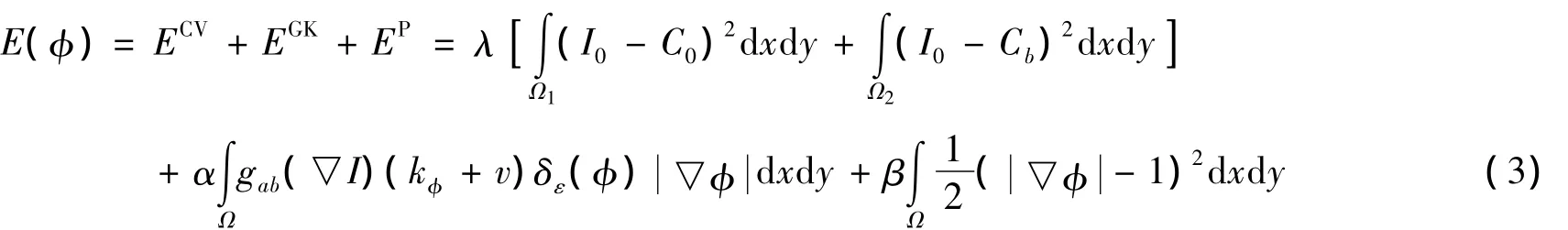
式中:EGK是结合尺度变换的停止函数能量项,使得分割曲线在图像的同质区域加快演化速度,同时防止弱边缘区域出现边界泄露现象.EGK中的停止函数g(s)必须满足:①∀s,都有g(s)>0,即g(s)=0;②g(s)是一个单调递减函数,这里采用尺度变化的停止函数,如式(4)所示:

其中:a>1,0<b<1.a>1是为了使g(s)比较大,能够在同质区域进行较快的演化.0<b<1是为了减慢停止函数在边界区域的下降速度,防止边界泄露.经过一定迭代次数后,不同的系数a,b对应的ga,b(s)有不同的变化情况,如图2所示.改进C-V模型图像的分割流程如图3所示.
从图2中可以看出,a=3,b=0.5时,停止函数初值较大,在图像梯度较小的地方快速演化,在边界梯度较大的地方停止函数迅速下降,最后趋于0.结合尺度变换停止函数的梯度曲率能量项如下所示:

图2 不同系数a,b对尺度变化函数的影响Fig.2 The influence of different coefficients a,b to the scale changing function
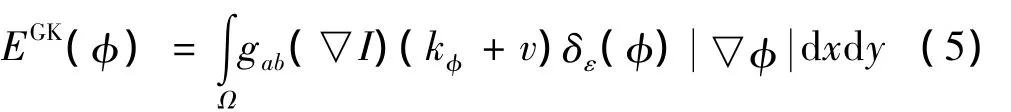
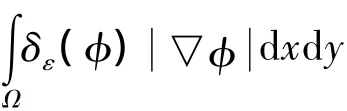
Ep是一个补偿能量项,可避免重新初始化水平集函数.在水平集方法实现分割的过程中,水平集函数必须保持为一个符号距离函数(SDF)才能保证演化曲线的稳定性和数值的准确性,所有的SDF满足一下性质:=1,反过来,任何一个满足=1的函数φ都等于符号距离函数加上一个常数.结合Li等提出的补偿能量思想,定义Ep如下:
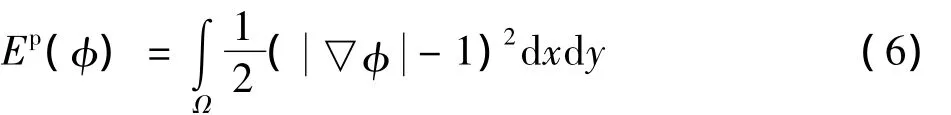
式(6)表示水平集函数与SDF的接近程度,在能量泛函最小化过程中,保持水平集函数紧靠SDF,维持分割曲线稳定演化.
为了最小化(3)式中的能量泛函,采用梯度下降法求取使能量泛函最小化的梯度下降流,得到水平集曲线演化的偏微分方程如下所示:

上面两式中,δε(φi)是正则化的 H(φi)函数的导数,H(φi)和δε(φi)分别定义如下:
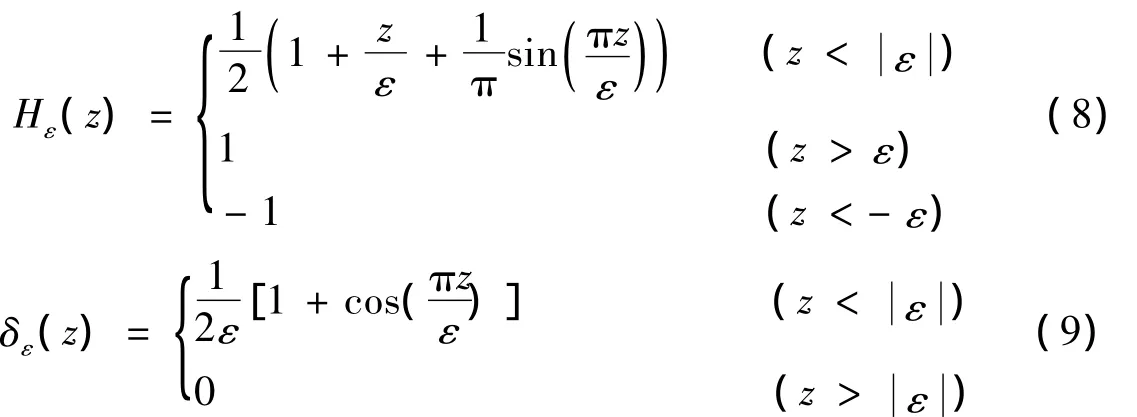
梯度算子div()和曲率kφ采用离散化的方法得到:
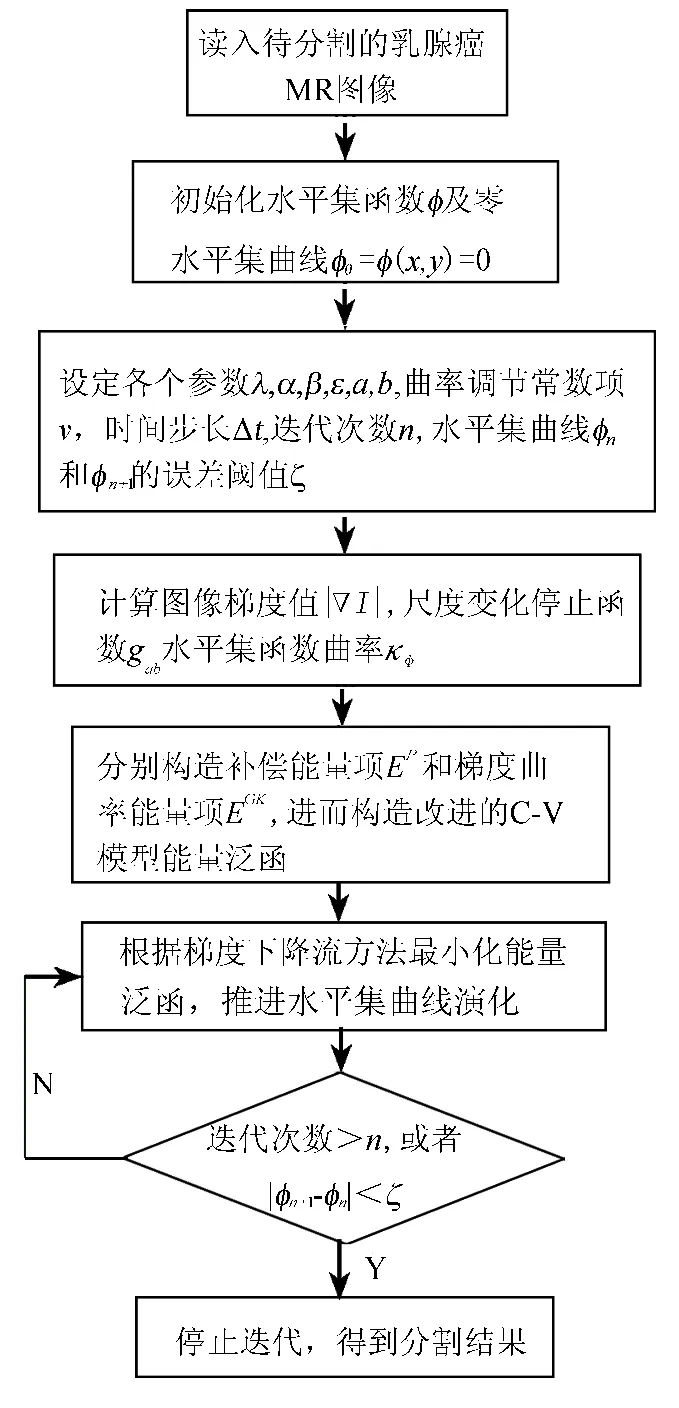
图3 改进C-V模型图像分割流程图Fig.3 Improved C - V model image segmentation flowchart
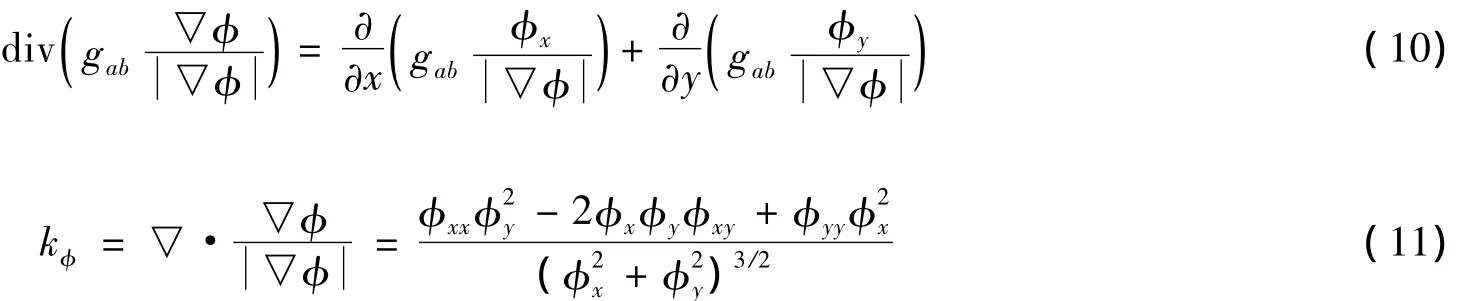
其中:空间偏导φx,φy用中心差分来近似计算:
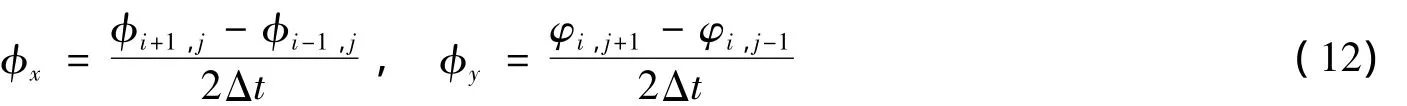
Δφ采用显式的数值方案得到:

在分割的过程中,较大的时间步长可加快分割速度,但是容易引起边界越界,出现误分割;采用较小的时间步长可保分割迭代过程的稳定性,但是分割速度较慢.为了兼顾分割速度和迭代的稳定性,分割时间步长 Δt要满足[11]:Δt≤,u为惩罚能量的加权因子.
3 实验结果与分析
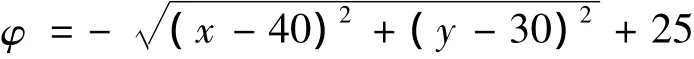

图4 第一组实验数据分割结果Fig.4 The experimental data segmentation results of the first group
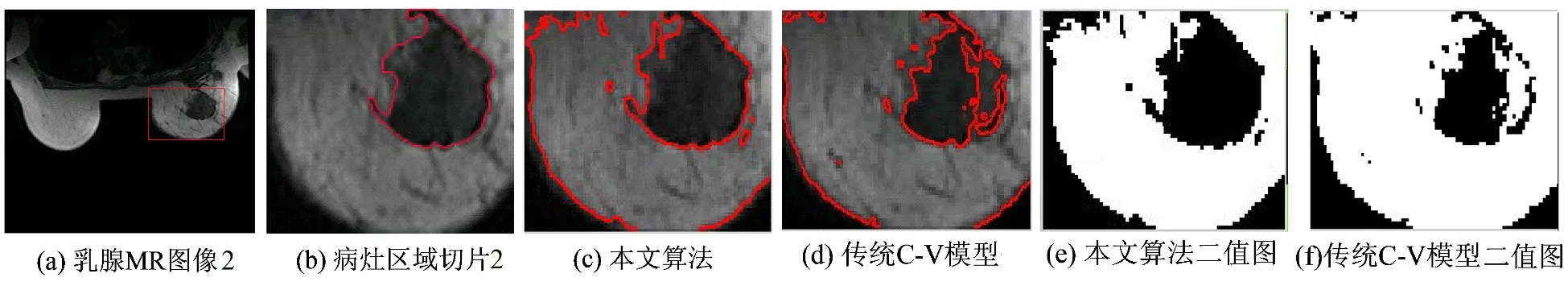
图5 第二组实验数据分割结果Fig.5 The segmentation results of the second experimental data
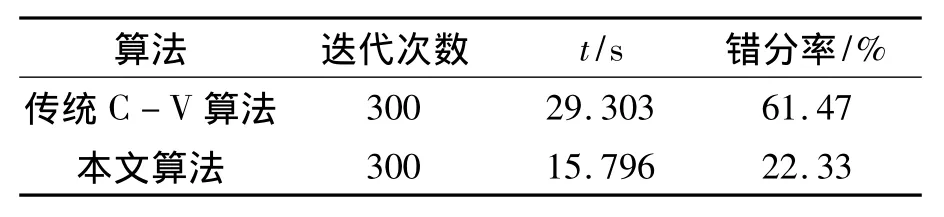
表1 病灶切片1分割结果的比较Tab.1 The comparison of segmentation results of slice 1

表2 病灶切片2分割结果的比较Tab.2 The comparison of segmentation results of slice 2
以医学图像分割结果的匹配百分比PM和匹配相对百分比CR两个评价参数对实验结果进行分析.其定义见式(14)和(15):
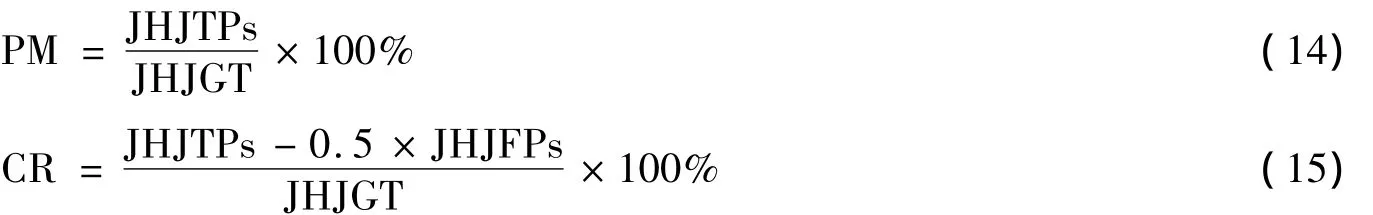
上式中:JHJ代表像素点集合;JHJTPs是正确分割的区域像素点个数;JHJFPs代表错误分割的区域像素点个数.PM的值越高说明分割正确率比较高;CR的值越高说明在正确分割的前提下,错误分割的区域比较小.在程序里设定医生手动勾勒出的肿瘤区域为模板,分割结果肿瘤区域跟模板肿瘤区域匹配的像素点为正确分割像素点,不匹配的为错误分割像素点.实验1和实验2分割结果评价参数如图6所示,图中横坐标表示分割模型的两个评价参数:PM和CR,纵坐标表示两个参数的取值.

图6 分割结果评价参数图Fig.6 The evaluation parameter map of segmentation results

图7 改进C-V模型分割结果Fig.7 The segmentation result of improved C -V model
图4(b)、图5(b)的肿瘤区域是医生手动勾勒的结果,作为实验分割结果的比较模板.从图4和图5可以看出,改进C-V模型对乳腺癌动态增强MR图像的肿瘤区域具有较好的分割效果,演化曲线停留在肿瘤区域和周围正常组织的边界上,没有对目标肿瘤区域产生过度分割;而传统C-V模型对肿瘤区域产生了过度分割,分割精确度较低.从表1、表2中可以看出,在相同的迭代次数下,本文改进C-V模型比传统C-V模型算法运行的时间明显减少,同时错分率较低.从图6中可以看出,改进模型的PM值和CR值较传统C-V模型均比较高,实验1里的PM和CR值分别为77.6%和59.2%;实验2里的PM和CR值分别为84.8%和40.0%.
取几组肿瘤医院病人的乳腺癌MR图像的ROI区域进行分割,参数设定与实验1、实验2一致,将改进模型的分割结果与医生手动勾勒结果作比较,结果如图7所示.
图7第一行为8个乳腺癌MR图像ROI(感兴趣区域)切片,第二行为医生手动分割的结果,第三行为改进C-V模型分割的结果,第四行是分割结果的二值图.分割结果的评价参数PM、CR见图8所示.
从图8可以看出,本文分割方法对病例2的分割结果正确率最高,对病例8的分割结果正确率最低.临床上病例2的肿瘤是良性肿瘤,并未扩散,病例8是恶性肿瘤,已经扩散,这说明本文分割模型对未扩散的肿瘤具有较好的分割效果,对已经扩散的肿瘤分割效果较差.从分割原理上分析,病例8肿瘤已经扩散,周围一些区域跟肿瘤区域的亮度较为相近,这些区域容易被误分割,导致在正确分割的前提下,错误分割的区域比较大.在病例1中和病例5中,虽然PM值比较高,但是CR的值比较低,这也是由于边缘一些和肿瘤区域亮度较相似的区域被误分割的原因.这些影响分割CR值的区域在某种意义上可看作图像噪声,由此看出本文分割方法对图像噪声鲁棒性不是很强,有待改进.

图8 分割结果评价参数Fig.8 The evaluation parameters of segmentation results
