高脂所致肥胖对大鼠骨髓脂肪细胞大小与数量的影响
刘宗智,张君,许彭,李伟,王铁鹏,张志威,王艳杰,王翠喆,谢建新
(新疆地方病与民族高发病教育部重点实验室,石河子 832000)
肥胖(obesity)已成为世界性的健康问题,近年来肥胖的发病率逐年增加,由其所引发的代谢综合征威胁着人类健康[1]。目前认为肥胖是一种慢性炎症状态,目前可诱发多种慢性疾病[2]。已有报道表明[3-6],肥胖状态下,脂肪细胞脂解增加,导致血液中游离脂肪酸 (Free fatty acid,FFA)和各种炎症因子水平升高,使机体处于一种慢性低炎症状态。
骨骼为动态器官,由骨吸收与骨重塑两个对立的过程维持平衡,破骨细胞(Osteoclast,OC)介导的骨吸过程,成骨细胞(Osteoblast,OB)介导的骨基质合成过程,OC与OB之间功能的失衡将导致骨骼形态结构异常[7-8]。骨髓中同时具有脂肪细胞,幼年时骨髓主要由血细胞填充骨髓时称为红骨髓,老年时脂肪细胞大量填充称为黄骨髓[9]。
当前认为脂肪细胞产生的细胞因子会对骨骼产生影响,因此骨髓脂肪细胞成为近年来该领域的研究热点,认为骨髓脂肪细胞可能也会对骨骼微环境有一定影响,同时肥胖对骨髓脂肪细胞的影响也目前尚不明晰。因此本文将就肥胖对骨髓脂肪细胞的影响进行初步探究。
1 材料与方法
1.1 分组及肥胖大鼠模型建立
5~6周龄雄性wistar大鼠购自新疆乌鲁木齐市疾病控制中心,饲养于石河子大学医学院实验动物中心。适应性喂养一周后,分为正常维持饲料喂养组(100只)和高脂饲料喂养组(100只),大鼠维持饲料及高脂饲料由北京科奥协力饲料有限公司提供(饲料主要组成成分为:玉米、豆粕、鱼粉、面粉、麸皮、食盐、磷酸氢钙、石粉、多种维生素等,高脂饲料为40%脂肪比),实验大鼠每笼8只,每天更换饮水,隔日清理粪便,每周进行动物房消毒。饲养14周后,正常组死亡5只,肥胖组死亡14只,同时,肥胖组中未肥胖15只。
1.2 实验动物的处理
实验大鼠每周测量体重1次,每两周眼底采血1次(肥胖组、正常组各8只),所取血液离心后取血清置于-20℃保存,采血后颈椎脱臼处死大鼠,收集大鼠双侧股骨,为保持一致,大鼠均选取左侧股骨上1/3用于HE染色,置于5%甲醛溶液中固定保存。
1.3 实验动物血脂检测
利用奥林巴斯AU2700生化仪(日本)检测血清中血糖、游离脂肪酸、甘油三酯、总胆固醇、低密度脂蛋白、高密度脂蛋白水平,试剂盒购自中生北控生物科技股份有限公司。
1.4 HE染色检测
使用LEICA1150型全自动石蜡包埋机 (德国)进行股骨包埋。使用石蜡切片将蜡块进行股骨横断面连续切片,切片厚度为3.5μm,捞片、烘干后再进行二甲苯脱蜡,梯度酒精 (100%、95%、85%、75%),水洗后进行苏木-伊红染色,经梯度酒精脱水,二甲苯透明后,中性树胶封片。
脂肪细胞数目采取每组大鼠随机选取8个视野,进行数目统计,脂肪细胞直径采取每组大鼠随机选取8个脂肪细胞,进行直径统计。
1.5 统计学分析
应用SPSS17.0统计软件包进行统计学分析,计量资料用X±S表示,两组间均数采用t检验,P<0.05为两组间存在显著性差异。
2 结果与分析
2.1 大鼠体重及血清生化指标比较
大鼠体重及血清生化指标比较见图1。
由图1可知,高脂喂养4周后,肥胖大鼠体重显著大于正常组大鼠,差异有统计学意义。10周后两组大鼠体重均进入平台期,不再继续增加,但两组差异仍有统计学意义(P<0.01)(图1)。
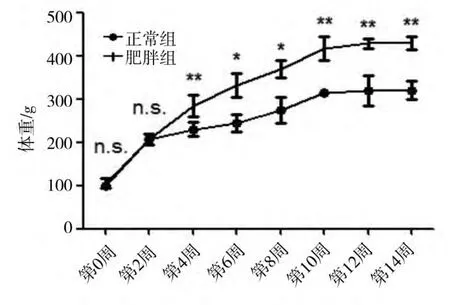
图1 正常大鼠与肥胖大鼠体重比较Fig.1 Weight comparison between normal rats and obesity rats
两组大鼠血清生化检测结果显示(表1),两组大鼠血糖水平在第8、10周差异有统计学意义(P<0.05),游离脂肪酸和甘油三酯在第4、6、8、10周差异均有统计学意义(P<0.05),总胆固醇和低密度脂蛋白在第4、6周有统计学意义(P<0.05),高密度脂蛋白差异无统计学意义(表1)。
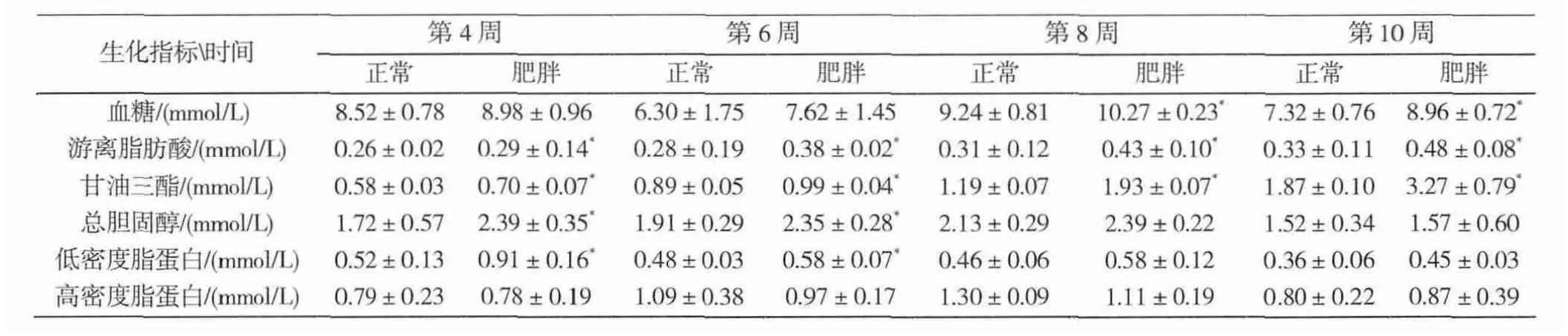
表1 各时间点大鼠血脂水平比较Tab.1 Comparison of serum lipid level at different time points
2.2 正常大鼠与肥胖大鼠骨髓脂肪细胞数目及直径的比较
HE染色镜下结果(图2)显示:第0-2周肥胖组大鼠和正常组大鼠均出现了脂肪细胞数量的减少,从第2周到第10周,正常组大鼠骨髓腔脂肪细胞数目随着大鼠周龄的增加而增多。在高脂喂养2-6周,肥胖组大鼠骨髓腔内几乎未发现脂肪细胞,6周后开始出现脂肪细胞。
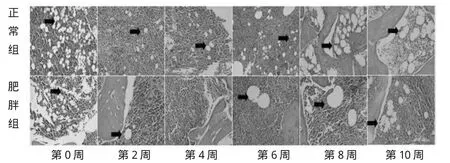
图2 正常大鼠与肥胖大鼠骨髓脂肪细胞HE染色Fig.2 Comparison of bone adipocyte betweennormal rats and obesity rats by HE staining
通过比较不同时间点HE染色镜下大鼠骨髓腔脂肪细胞的数目及直径(图3)后发现,与第0周相比,两组大鼠在后续检测点(2-10周)脂肪细胞数目均出现了的减少,而从第2周开始两组大鼠脂肪细胞数目逐渐增多,以正常组增加尤为明显。肥胖组大鼠骨髓腔脂肪细胞数目在后续检测点(2-10周)均显著少于正常组,差异有统计学意义(P<0.05)(图3)。脂肪细胞直径测量结果显示,肥胖组大鼠脂肪细胞直径出现了双峰趋势,从第0周到第2周逐渐增大,且直径均大于正常组大鼠,差异有统计学意义(P<0.05)。第4周到6周降低,且低于正常组大鼠,差异有统计学意义(P<0.05)。从第6周到第8周再次逐渐增加,此时显著高于正常组大鼠,差异有统计学意义(P<0.01),而第8周后,再次下降,直径显著低于正常组大鼠,具有统计学意义(P<0.05)。
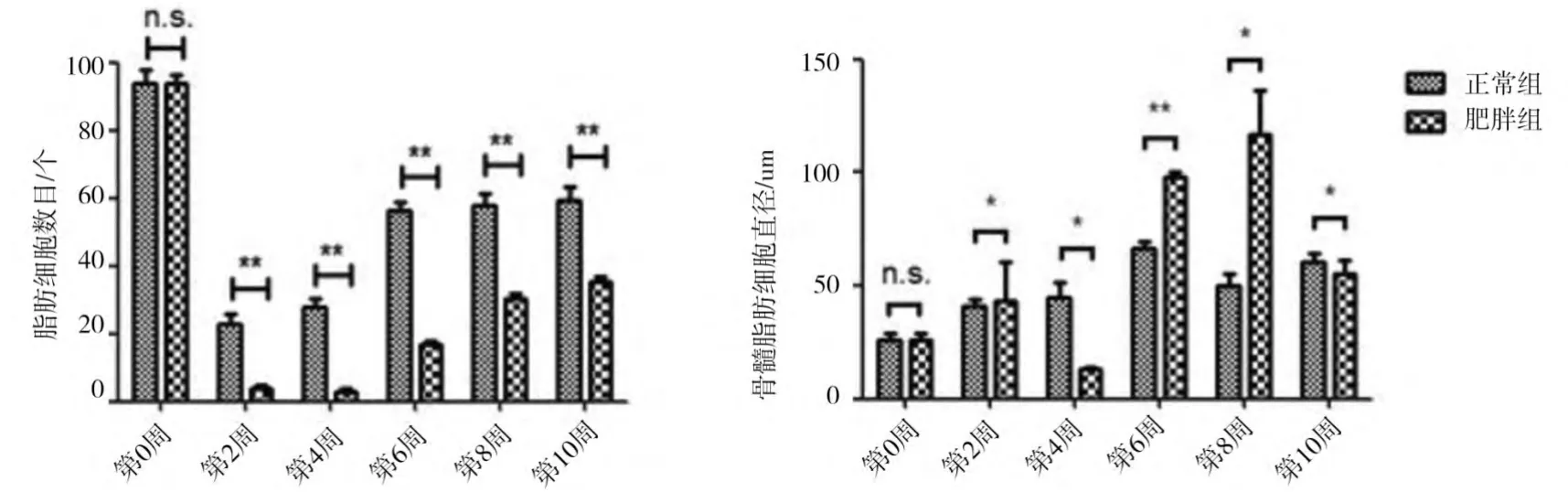
图3 各时间点正常大鼠与肥胖大鼠骨髓脂肪细胞数目(a)及直径(b)的比较Fig.3 Comparison of bone adipocyte number and diameter between normal and obesity rats
3 讨论
本研究选用雄性wistar大鼠,排除了雌激素水平对骨代谢的影响。依据体重差异(肥胖大鼠体重超过正常大鼠体重20%为准)和生化结果可判定建模是否成功[10]。本实验中,大鼠体重及血脂水平从第4周开始出现差异,表明建模成功。从第10周后体重不再变化且为排除长期肥胖引发并发症干扰实验结果,不用于研究。
本研究结果显示,在第0-2周,虽然肥胖大鼠和正常大鼠骨髓内脂肪细胞数量均有骤降的现象,但其直径却在增大,提示此时是发育过程中小脂滴向大脂滴转换的过程,无特殊意义;而第2-4周,肥胖大鼠骨髓内的脂肪细胞数目骤减,且直径也逐渐下降,同时呈现随着周数增加下降的趋势,考虑是由于肥胖导致的负重增加,机体需要大量成骨,进而引起间充质干细胞向成骨细胞分化增加,脂肪细胞分化减少造成的。已有大量文献证明,骨髓成骨细胞和骨髓脂肪细胞是相同起源的细胞,骨髓腔内的脂肪细胞和成骨细胞存在着动态平衡,当负重增加或者运动增强时,机体需要大量成骨来保证骨骼的力学结构进而间充质干细胞向成骨细胞分化增加,向脂肪细胞分化减少;若负重减少或者其他原因导致机体不需要成骨,则间充质干细胞向脂肪细胞分化增加,成骨细胞分化减少[11-14],本实验结果符合这种规律。对于第6-10周,肥胖组大鼠脂肪数量增加,同时脂肪细胞直径大幅度增加,提示肥胖后期,由于过多的FFA引发机体脂代谢紊乱,肥胖大鼠长期处于慢性炎症状态[15-16],引起的骨髓内脂肪分化成熟,直径均增加。有文献报道,炎症因子可以促使前脂肪细胞向脂肪细胞分化成熟[17-18],同时又有文献报道肥胖后期随着骨质疏松的发生,大量的脂肪细胞进入到骨髓中,用以填充骨髓腔[19],在我们的实验中也可以看到随着肥胖大鼠体重的持续增加,脂肪细胞数目显著增加,其直径也大幅增加,脂滴容量大幅增加。
对于肥胖大鼠第10周出现的脂肪细胞直径降低的情况,我们猜测可能是肥胖后期并发症-骨质疏松开始对骨髓腔微环境起到初步影响,由图2可见第10周肥胖组大鼠骨髓腔内脂肪细胞数目有明显增加,而如前文所述,肥胖引发的骨质疏松会导致大量脂肪细胞浸润到骨髓腔内,进而填充骨髓腔,推测此时骨质疏松对肥胖大鼠骨髓腔微环境产生影响,具体情况需要进一步研究。
综上所述,我们认为,肥胖早期由于体重增加,骨骼的力学结构要维持并平衡增加的体重,造成骨髓腔内间充质干细胞向成骨细胞分化增加,脂肪细胞分化减少,造成骨髓内脂肪细胞数量,直径减少。而肥胖后期,由FFA增加引发的慢性炎症状态,使得前脂肪细胞向成熟脂肪分化,骨髓腔内的大量脂肪细胞成熟,故其数量、直径均增加,同时由于持续肥胖会引发大量脂肪细胞侵入骨髓腔进一步促进了脂肪细胞数目的增加。
[1]Kopelman PG.Obesity as amedical problem[J].Nature,2000,404(6778):635-643.
[2]Hotamisligil G S.Inflammation and metabolic disorders[J].Nature,2006,444(7121):860-867.
[3]Marseglia L,Manti S,D'Angelo G,et al.Oxidative stress in obesity:A critical component in human diseases[J].Int JMol Sci,2014,16(1):378-400.
[4]Hartstra A V,Bouter K E,Bckhed F,et al.Insights into the role of the microbiome in obesity and type 2 diabetes[J].Diabetes Care,2015,38(1):159-165.
[5]Bergman R N,Mittelman S D.Central role of the adipocyte in insulin resistance[J].JBasic Clin Physiol Pharmacol,1998,9(25):205-221.
[6]Arslan N.Obesity,fatty liver disease and intestinal microbiota[J].World J Gastroenterol,2014,20(44):16452-16463.
[7]Walsh M C,Choi Y.Biology of the ranklrankopg System in immunity,bone,and beyond[J].Front Immunol,2014,20:511.
[8]Jakab L.Bone tissue:rebuilding and inflammation[J].Orv Hetil.,2014,155(40):1575-1583.
[9]Ma H T,Rong Ren,Yang Chen,et al.A simulation study of marrow fat effect on bone biomechanics[J].Conf Proc IEEE Eng Med Biol Soc,2014,14:4030-4033.
[10]Gaur A,Pal G K,Ananthanarayanan P H,et al.Role of ventromedial hypothalamus in high fat diet induced obesity in male rats:association with lipid profile,thyroid pro file and insulin resistance[J].Ann Neurosci,2014,21(3):104-107.
[11]Adler B J,Kaushansky K,Rubin C T.Obesitydriven disruption of haematopoiesis and the bone marrow niche[J].Nat Rev Endocrinol,2014,10(12):737-748.
[12]Endo I,Mastumoto T.Bone and stem cells,regulatory mechanism ofmesenchymal stem cell differentiation to osteoblasts[J].Clin Calcium,2014,24(4):555-564.
[13]Bruno C Huber,Ulrich Grabmaier,Stefan Brunner.Impact of parathyroid hormone on bonemarrow-derived stem cell mobilization and migration[J].WJSC,2014,26,6(5):637-643.
[14]Silvia Bradamante,Livia Barenghi,Jeanette A.Stem cells toward the future:the space challenge[J].Life,2014,4(2):267-280.
[15]Weisberg S P,Mccann D,Desai M.Obesity is associated with macrophage accumulation in adipose tissue[J].The Journal of Clinical Investigation,2003,112(12):1796-1808.
[16]Harwood H J Jr.The adipocyte as an endocrine organ in the regulation of metabolic homeostasis[J].Neuropharmacology,2012,63(1):57-75.
[17]Haim Shapiro,Aviv Lutaty,Amiram Arie.Meta Inflammation,and immuno-metabolism[J].The Scientific World Journal,2011,11:2509-2529.
[18]Tamar R,Aprahamian,Flora Sam.Adiponectin in cardiouascular inflammation and obesity[J].Int J Inflam.,2011,37:6909.
[19]Devlin M J,Rosen C J.The bone-fat interface:basic and clinical implications of marrow adiposity[J].Lancet Diabetes Endocrinol,2014,21(14):70005-70007.
