4个杨树新无性系的抗旱性研究
邱 兴,吕小锋,李晓东,樊军锋*,赵文木,史禹博
(1.西北农林科技大学 林学院,陕西 杨陵712100;2.陇县八渡林场,陕西 陇县721200;3.玉屏侗族自治县林业局,贵州 玉屏554000;4.浙江省常山油茶研究所,浙江 常山324200)
杨树生长迅速,适应范围广,纤维形态较好,是中国“三北”(东北、华北和西北)防护林体系、速生丰产林基地建设最主要的造林树种,也是目前迅猛发展的工业纸浆用材及林纸一体化产业的首选树种[1-4]。
干旱是影响植物分布和生长发育的主要环境因子之一,其危害程度在诸多非生物胁迫中占首位[5]。由于杨树的分布区域大部分属于干旱半干旱地区,水分缺乏是其主要遭受的逆境之一[6-7],因此选育出速生、抗旱的杨树品种也就成为育种研究的重要内容。
本研究采用人工盆栽控水试验,以美洲黑杨×青杨派的4个杂交新无性系06-57×川1、07-69×青1、06-69×卜1、07-西大寨×卜1和2个对照品种陕林4号、中绥12杨为研究对象,探讨水分胁迫对6个杨树无性系(种)的生长及生理指标影响,综合分析其幼苗对干旱的适应和抵抗能力,以期为选育出优良抗旱杂种新无性系及后续的栽培管理提供理论依据。
1 材料与方法
1.1 材料及处理
供试材料06-57×川1、07-69×青1、06-69×卜1、07-西大寨×卜1杨是西北农林科技大学林学院杨树良种选育课题组从美洲黑杨×青杨派杂交无性系中选育出来的4个新无性系,对照种选取抗旱性较好的陕林4号、中绥12杨。各无性系(种)穗条均于2014年3月中旬取自西北农林科技大学周至渭河林场实验站1年生杨树对比试验林。
6个无性系(种)穗条于2014年3月中旬扦插于塑料盆中,盆高30cm,内径30cm,盆中装土12kg,所用土壤为关中平原杨凌地区垆土,田间持水量为25%。将盆栽苗木放置于校园防雨棚中(保证四周通风,使生长环境除降雨外,与自然环境接近),在充足水分条件下正常生长,选择生长健壮、长势基本一致的幼苗于6月初进行控水处理。设置3种土壤含水量水平:水量分别为田间持水量的100%(CK)、60%~50%(Ⅰ)、40%~30%(Ⅱ),每个水分处理设置6次重复。每天8:00和19:00采用人工称重控水的方法补充消耗水量,使土壤水分保持在设定范围内,在控水处理30d后测定幼苗的相关指标。
1.2 测定方法
1.2.1 生长量测定 用刻度尺测定幼苗株高,游标卡尺测定幼苗地径。
1.2.2 净光合速率测定 采用Li-6400型光合仪测定。天气晴朗无云,测定时间为8:30-11:00,在每一植株向阳面中上部标记功能叶,每个叶片重复3次记录,结果取平均值。
1.2.3 叶片相对含水量 采用烘干称重法测定[8]。
1.2.4 叶片相对电导率 采用电导率仪法测定[8]。
1.2.5 叶片游离脯氨酸含量测定 采用酸性茚三酮显色法测定[9]。
1.2.6 叶片可溶性蛋白含量测定 采用考马斯亮蓝 G-250法测定[8]。
1.2.7 叶片丙二醛(MDA)含量测定 采用硫代巴比妥酸(TBA)比色法测定[9]。
1.2.8 叶片超氧化物歧化酶(SOD)活性 用氮蓝四唑(NBT)比色法测定[9],SOD 酶活性以抑制50%NBT反应为1个酶活性单位。
1.2.9 叶片过氧化物酶(POD)活性 用愈创木酚显色法测定[9],每隔30s记录1次,吸光度以每分钟内A470每下降0.1为1个活性单位。
1.3 数据分析
采用EXCEL2003和SPSS17.0软件对试验数据进行统计分析,不同水分处理之间采用单因素方差分析和最小显著差异法比较,表格均用EXCEL2003软件绘制。6个杨树无性系(种)的抗旱性评价采用模糊数学的隶属函数法,隶属函数的计算公式如下:

式中:U(xij)为隶属函数值,Xij为i无性系j指标的变化值,Xjmin和Xjmax为所有供试无性系中j指标的最小和最大变化值。如果某一指标与抗旱性评价为负相关,可用反隶属函数进行计算,反隶属函数的计算公式如下:

2 结果与分析
2.1 干旱胁迫下杨树无性系(种)的生长量变化
由表1和表2可知,随着水分胁迫程度的加深,6个杨树无性系(种)苗高和地径的生长量均呈逐渐下降的趋势,但下降的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的生长量均显著低于对照CK,并且水分胁迫Ⅱ的生长量显著低于水分胁迫Ⅰ。
由表1可知,水分胁迫Ⅰ中6个无性系(种)苗高生长量的变幅在12.7~27.3cm之间,陕林4号生长量最大,达到27.3cm;07-西大寨×卜1生长量最小,为12.7cm。苗高生长量降幅在33.33%~56.62%之间,降幅最低的为07-西大寨×卜1,较对照CK下降了33.33%;降幅最大的为06-69×卜1,较对照CK下降了56.62%。水分胁迫Ⅱ中6个无性系(种)苗高生长量的变幅在7.3~15.9cm之间,陕林4号生长量最大,达到15.9cm;07-西大寨×卜1生长量最低,为7.3cm。苗高生长量降幅在59.89%~72.06%之间,降幅最小的为07-69×青1,较对照CK下降了59.89%;降幅最大的为06-69×卜1,较对照CK下降了72.06%。
由表2可知,水分胁迫Ⅰ中6个无性系(种)地径生长量变幅在0.95~1.29mm之间,07-69×青1生长量最大,达到1.29mm;中绥12生长量最小,为0.95mm。地径生长量降幅在36.97%~50.86%之间,降幅最小的为07-69×青1,较对照CK下降了36.97%;降幅最大的为中绥12,较对照CK下降了50.86%。水分胁迫Ⅱ中地径生长量变幅在0.35~1.00mm之间,07-69×青1生长量最大,达到1.00mm;06-69×卜1生长量最小,为0.35 mm。地径生长量降幅在51.30%~79.64%之间,降幅最小的为07-69×青1,较对照CK下降了51.30%;降幅最大的为06-69×卜1,较对照CK下降了79.64%。

表1 水分胁迫下6个杨树无性系(种)的苗高生长量Table 1 Seedling height under water stress in six poplar clones

表2 水分胁迫下6个杨树无性系(种)的地径生长量Table 2 Ground diameter under water stress in six poplar clones
2.2 干旱胁迫下杨树无性系(种)的净光合速率变化
由表3可知,随着水分胁迫程度的加深,6个杨树无性系(种)的净光合速率均呈逐渐下降的趋势,但下降的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的Pn均显著低于对照CK,并且水分胁迫Ⅱ的Pn显著低于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)Pn变幅在10.09~17.24μmol·m-2·s-1之间,Pn最高的是07-69×青1,达到17.24μmol·m-2·s-1;Pn最低的是06-69×卜1,为10.09μmol·m-2·s-1。Pn降幅在21.14%~45.50%之间,降幅最小的为06-57×川1,较对照CK下降了21.14%;降幅最大的为06-69×卜1,较对照CK下降了45.50%。
水分胁迫Ⅱ中6个无性系(种)Pn变幅在7.38~10.62μmol·m-2·s-1之间,Pn最高的是07-69×青1,达到10.62μmol·m-2·s-1;Pn最低的是中绥12,为7.38μmol·m-2·s-1。Pn降幅在49.48%~61.87%之间,降幅最小的为陕林4号,较对照CK下降了49.48%;降幅最大的为中绥12,较对照CK下降了61.87%。
2.3 干旱胁迫下杨树无性系(种)叶片的相对含水量变化
由表4可知,随着水分胁迫程度的加深,6个杨树无性系(种)的相对含水量均呈逐渐下降的趋势,但下降的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的相对含水量均显著低于对照CK,并且水分胁迫Ⅱ的相对含水量显著低于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)相对含水量的变幅在63.47%~80.53%之间,相对含水量最高的是06-57×川1,达到80.53%;最低的是06-69×卜1,仅为63.47%。相对含水量的降幅在13.86%~28.73%之间,降幅最小的是06-57×川1,较对照CK下降了13.86%;降幅最大的是06-69×卜1,较对照CK下降了28.73%。
水分胁迫Ⅱ中6个无性系(种)相对含水量的变幅在55.97%~72.18%之间,相对含水量最高的是06-57×川1,达到72.18%;最低的是中绥12,仅为55.97%。相对含水量的降幅在22.79%~37.67%之间,降幅最小的是06-57×川1,较对照CK下降了22.79%;降幅最大的是中绥12,较对照CK下降了37.67%。

表3 水分胁迫下6个杨树无性系(种)的净光合速率Table 3 Net photosynthetic rate under water stress in six poplar clones

表4 水分胁迫下6个杨树无性系(种)叶片的相对含水量Table 4 Leaf relative water content under water stress in six poplar clones leaves
2.4 干旱胁迫下杨树无性系(种)叶片的相对电导率变化
由表5可知,随着水分胁迫程度的加深,6个杨树无性系(种)的相对电导率均呈逐渐上升的趋势,但上升的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的相对电导率均显著高于对照CK,并且水分胁迫Ⅱ的相对电导率显著高于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)相对电导率的变幅在11.21%~17.45%之间,相对电导率最高的是07-西大寨×卜1,达到17.45%;最低的是07-69×青1,仅为11.21%。相对电导率的增幅在10.27%~24.74%之间,增幅最小的是07-69×青1,较对照CK上升了10.27%;增幅最大的是07-西大寨×卜1,较对照CK上升了24.74%。
水分胁迫Ⅱ中6个无性系(种)相对电导率的变幅在13.09%~20.76%之间,相对电导率最高的是07-西大寨×卜1,达到20.76%;最低的是07-69×青1,仅为13.09%。相对电导率的增幅在23.57%~48.46%之间,增幅最小的是陕林4号,较对照CK上升了23.57%;增幅最大的是07-西大寨×卜1,较对照CK上升了48.46%。

表5 水分胁迫下6个杨树无性系(种)叶片的相对电导率Table 5 Leaf relative electrical conductivity under water stress in six poplar clones leaves
2.5 干旱胁迫下杨树无性系(种)叶片的丙二醛含量变化
由表6可知,随着水分胁迫程度的加深,6个杨树无性系(种)的丙二醛含量均呈逐渐上升的趋势,但上升的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的丙二醛含量均显著高于对照CK,并且水分胁迫Ⅱ的丙二醛含量显著高于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)丙二醛含量的变幅在9.372~16.180μmol·g-1之间,丙二醛含量最高的是06-69×卜1,达到16.180μmol·g-1;最低的是06-57×川1,仅为9.372μmol·g-1。丙二醛含量的增幅在115.97%~143.36%之间,增幅最小的是06-57×川1,较对照CK上升了115.97%;增幅最大的是07-西大寨×卜1,较对照CK上升了143.36%。
水分胁迫Ⅱ中6个无性系(种)丙二醛含量的变幅在12.464~25.430μmol·g-1之间,丙二醛含量最高的是06-69×卜1,达到25.430μmol·g-1;最低的是06-57×川1,仅为12.464μmol·g-1。丙二醛含量的增幅在154.23%~199.12%之间,增幅最小的是06-57×川1,较对照CK上升了154.23%;增幅最大的是06-69×卜1,较对照CK上升了199.12%。
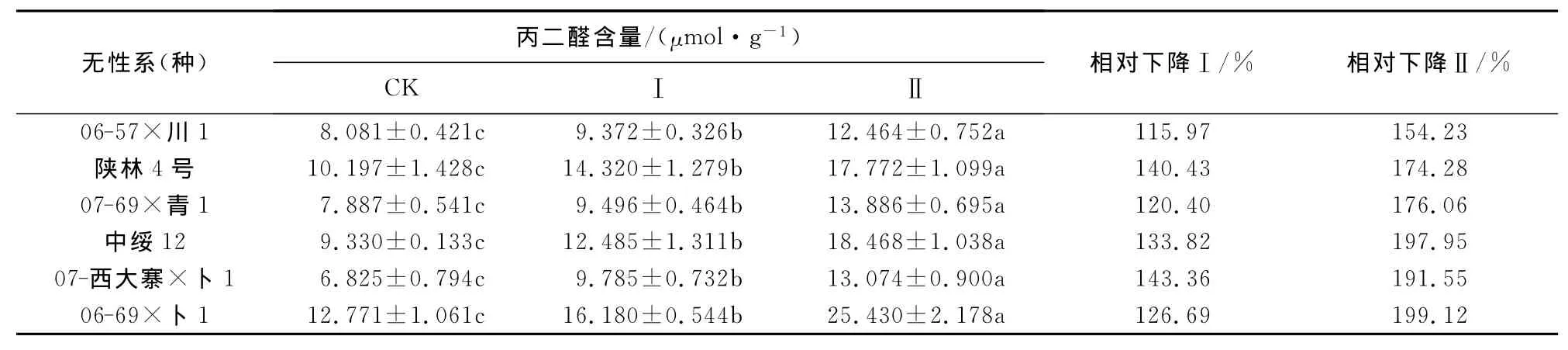
表6 水分胁迫下6个杨树无性系(种)叶片的丙二醛含量Table 6 MDA content under water stress in six poplar clones leaves
2.6 干旱胁迫下杨树无性系(种)叶片的脯氨酸含量的变化
由表7可知,随着水分胁迫程度的加深,6个杨树无性系(种)的脯氨酸含量均呈逐渐上升的趋势,但上升的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的脯氨酸含量均显著高于对照CK,并且水分胁迫Ⅱ的脯氨酸含量显著高于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)脯氨酸含量的变幅在50.000~89.216μg·g-1之间,脯氨酸含量最高的是07-69×青1,达到89.216μg·g-1;最低的是07-西大寨×卜1,仅为50.000μg·g-1。脯氨酸含量的增幅在127.68%~161.06%之间,增幅最小的是陕林4号,较对照CK上升了127.68%;增幅最大的是07-69×青1,较对照CK上升了161.06%。
水分胁迫Ⅱ中6个无性系(种)脯氨酸含量的变幅在67.157~113.235μg·g-1之间,脯氨酸含量最高的是07-69×青1,达到113.235μg·g-1;最低的是07-西大寨×卜1,仅为67.157μg·g-1。脯氨酸含量的增幅在167.68%~209.18%之间,增幅最小的是06-57×川1,较对照CK上升了167.68%;增幅最大的是06-69×卜1,较对照CK上升了209.18%。
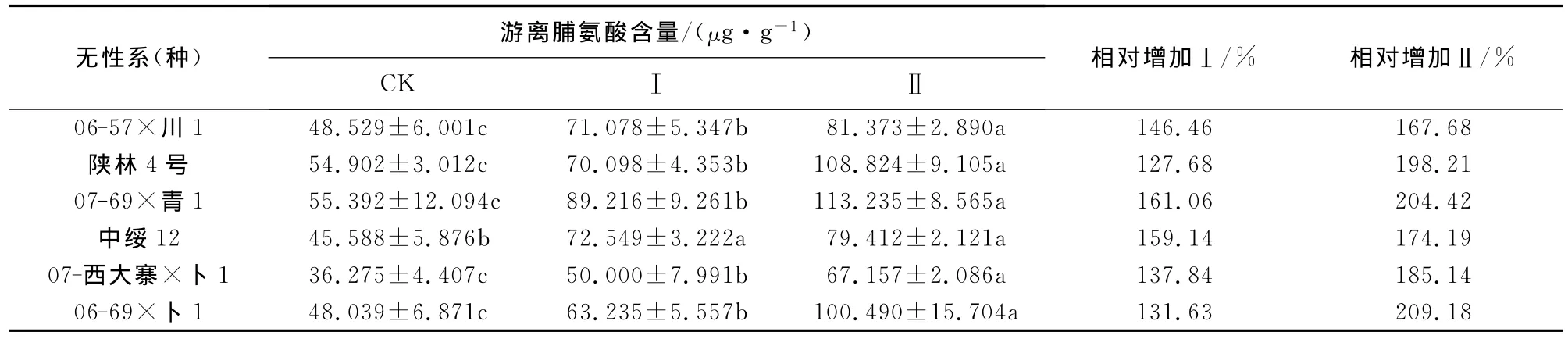
表7 水分胁迫下6个杨树无性系(种)叶片的脯氨酸含量Table 7 Proline content under water stress in six poplar clones leaves
2.7 干旱胁迫下杨树无性系(种)叶片的可溶性蛋白含量变化
由表8可知,随着水分胁迫程度的加深,6个杨树无性系(种)的可溶性蛋白含量均呈逐渐下降的趋势,但下降的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的可溶性蛋白含量均显著低于对照CK,并且水分胁迫Ⅱ的可溶性蛋白含量显著低于水分胁迫Ⅰ。
水分胁迫Ⅰ中6个无性系(种)可溶性蛋白含量的变幅在8.000~16.694mg·g-1之间,可溶性蛋白含量最高的是陕林4号,达到16.694mg·g-1;最低的是06-69×卜1,仅为8.000mg·g-1。可溶性蛋白含量的降幅在8.94%~23.35%之间,降幅最小的是陕林4号,较对照CK下降了8.94%;降幅最大的是07-西大寨×卜1,较对照CK下降了23.35%。
水分胁迫Ⅱ中6个无性系(种)可溶性蛋白含量的变幅在6.444~13.000mg·g-1之间,可溶性蛋白含量最高的是陕林4号,达到13.000mg·g-1;最低的是06-57×川1,仅为6.444mg·g-1。可溶性蛋白含量的降幅在23.90%~40.10%之间,降幅最小的是07-69×青1,较对照CK下降了23.90%;降幅最大的是07-西大寨×卜1,较对照CK下降了40.10%。

表8 水分胁迫下6个杨树无性系(种)叶片的可溶性蛋白含量Table 8 Soluble protein content under water stress in six poplar clones leaves
2.8 干旱胁迫下杨树无性系(种)叶片的保护酶活性变化
由表9和表10可知,随着水分胁迫程度的加深,6个杨树无性系(种)的)SOD和POD活性均呈先上升后下降的趋势,但变化的幅度各不一样。总体上水分胁迫Ⅰ和Ⅱ的SOD和POD活性均显著高于对照CK,并且水分胁迫Ⅰ的SOD和POD活性显著高于水分胁迫Ⅱ。
由表9可知,水分胁迫Ⅰ中6个无性系(种)SOD活性的变幅在624.01~786.89U·g-1之间,SOD活性最高的是07-69×青1,达到786.89U·g-1;最低的是陕林4号,仅为624.01U·g-1。SOD活性的增幅在128.56%~173.72%之间,增幅最小的是中绥12,较对照CK上升了128.56%;增幅最大的是07-69×青1,较对照CK上升了173.72%。水分胁迫Ⅱ中6个无性系(种)SOD活性的变幅在585.43~722.17U·g-1之间,SOD活性最高的是陕林4号,达到722.17U·g-1;最低的是06-57×川1,仅为585.43U·g-1。SOD活性的增幅在117.40%~164.51%之间,增幅最小的是06-57×川1,较对照CK上升了117.40%;增幅最大的是陕林4号,较对照CK上升了164.51%。
由表10可知,水分胁迫Ⅰ中6个无性系(种)POD活性的变幅在150.03~262.44U·g-1·min-1之间,POD活性最高的是陕林4号,达到262.44U·g-1·min-1;最低的是06-69×卜1,仅为150.03U·g-1·min-1。POD活性的增幅在195.57%~393.58%之间,增幅最小的是06-69×卜1,较对照CK上升了195.57%;增幅最大的是陕林4号,较对照CK上升了393.58%。水分胁迫Ⅱ中6个无性系(种)POD活性的变幅在111.69~203.37U·g-1·min-1之间,POD活性最高的是07-西大寨×卜1,达到203.37U·g-1·min-1;最低的是06-69×卜1,仅为111.69U·g-1·min-1。POD活性的增幅在140.00%~290.00%之间,增幅最小的是中绥12,较对照CK上升了140.00%;增幅最大的是陕林4号,较对照CK上升了290.00%。

表9 水分胁迫下6个杨树无性系(种)叶片的SOD活性Table 9 The activities of SOD under water stress in six poplar clones leaves
2.9 干旱胁迫下杨树无性系(种)的综合抗旱能力
为了消除不同计算单位对综合评价的影响,本研究以各无性系(种)处理苗比对照苗在各指标上的变化率来进行隶属函数分析[10]。由表11可知,在水分胁迫Ⅰ下6个杨树无性系(种)的抗旱能力排序为:07-69×青1>06-57×川1>陕林4号>中绥12>06-69×卜1>07-西大寨×卜1。由表12可知,在水分胁迫Ⅱ下6个杨树无性系(种)的抗旱能力排序为:陕林4号>07-69×青1>06-57×川1>06-69×卜1>07-西大寨×卜1>中绥12。综上所述,将水分胁迫Ⅰ和Ⅱ下的隶属函数值加权取平均值,可得出6个杨树无性系(种)的综合抗旱能力从大到小依次为:07-69×青1>陕林4号>06-57×川1>06-69×卜1>中绥12>07-西大寨×卜1(表13)。

表10 水分胁迫下6个杨树无性系(种)叶片的POD活性Table 10 The activities of POD under water stress in six poplar clones leaves
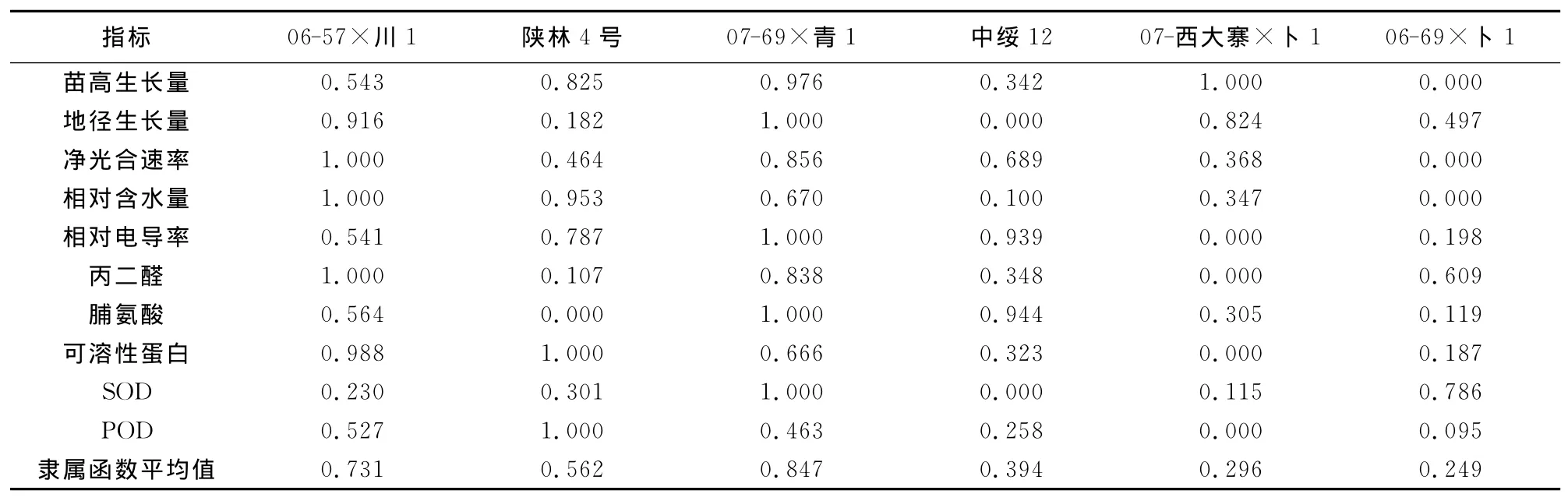
表11 水分胁迫Ⅰ下6个杨树无性系(种)的隶属函数值Table 11 Membership function values of six poplars under water stressⅠ

表12 水分胁迫Ⅱ下6个杨树无性系(种)的隶属函数值Table 12 Membership function values of six poplars under water stressⅡ

表13 6个杨树无性系(种)抗旱能力的综合评价Table 13 Comprehensive evaluation results on drought resistance of six poplars
3 结论与讨论
本研究结果表明,6个杨树无性系(种)的综合抗旱能力从大到小依次为:07-69×青1>陕林4号>06-57×川1>06-69×卜1>中绥12>07-西大寨×卜1,说明新选无性系07-69×青1和06-57×川1对干旱环境的适应和抵抗能力要优于06-69×卜1和07-西大寨×卜1。不同程度的水分胁迫显著抑制了6个杨树无性系(种)幼苗的生长,并对其相对含水量、光合作用、相对电导率、脯氨酸含量和保护酶活性等生理生化指标产生显著影响。对盆栽苗木进行水分胁迫,测得各无性系处理苗比对照苗在各指标上增加或减少的百分数,可以说明各杨树无性系(种)对干旱的反应及适应性方面的差别。
3.1 干旱胁迫对杨树无性系(种)生长、光合和水分的影响
植物生长对水分亏缺最为敏感,最直观的反映通常就是生长量的变化[11]。在水分胁迫条件下植物仍维持较正常的生理过程,保持相对较高的生长,是抗旱品种选育的根本目的所在[12]。本研究中,随着水分胁迫程度的加深,6个杨树无性系(种)苗高、地径的生长量均显著降低,说明水分胁迫下各无性系(种)幼苗的苗高和地径生长受到明显的抑制,间接反映了水分处理下的杨树幼苗细胞扩展受到显著的抑制,体内的生命活动受到干扰。但下降的幅度各不一样,显示了各无性系(种)的生长量对干旱敏感程度不一致。水分胁迫Ⅰ和Ⅱ下生长量降幅最大的是06-69×卜1,说明其生长受干旱影响较高;降幅最小的是07-69×青1,说明其生长受干旱影响较低。
干旱条件下植物叶片光合速率降低,光合强度下降,同化产物减少,主要有两方面原因:一是气孔导度的降低使CO2供应受阻;二是叶肉细胞中RUBP羧化酶活性降低。一般认为:水分胁迫时叶片光合作用被抑制是气孔和非气孔因素共同作用的结果[13]。本研究中,随着水分胁迫程度的加深,6个杨树无性系(种)的净光合速率显著下降,说明水分胁迫下可以导致杨树幼苗光合作用受到抑制,使光合有效面积降低,从而降低生长量和生物量积累。长期严重干旱会使生长受抑严重,最终导致叶片枯萎无法进行光合作用,进而促使植株死亡。但下降的幅度各不一样,显示了各无性系(种)在干旱条件下表现出明显的生态型差异。水分胁迫Ⅰ和Ⅱ下净光合速率降幅最大的是07-西大寨×卜1,说明其光合作用受干旱影响较大;降幅最小的是陕林4号,说明其光合作用受干旱影响较小。
叶片相对含水量的变化速率是植物抗旱性的重要指标之一。一般情况下,植物在受到干旱胁迫时叶片水分亏缺,相对含水量会呈下降趋势,通常其下降的程度与抗旱能力呈负相关关系[14]。本研究中,随着水分胁迫程度的加深,6个杨树无性系(种)叶片相对含水量显著下降,但下降的幅度各不一样,说明水分胁迫下各无性系(种)的叶片持水力不一致,可能与叶片的组织结构和根系吸水力有关。水分胁迫Ⅰ和Ⅱ下叶片相对含水量降幅最大的是07-西大寨×卜1,说明其在干旱条件下叶片持水力较弱;降幅最小的是06-57×川1,说明其在干旱条件下叶片持水力较强。
3.2 干旱胁迫对杨树无性系(种)膜脂过氧化的影响
细胞膜具有选择透性,逆境下会造成膜透性的改变或破坏,结果造成了大量电解质(离子)向组织外渗漏,从而使组织浸出液的相对电导率上升[15]。植物在逆境条件下引发膜脂过氧化作用,造成膜系统的损伤,严重时会导致植物细胞的死亡。膜脂过氧化的最终产物丙二醛(MDA)可与细胞膜上的蛋白质、酶等结合、交联,从而使之失活,破坏了生物膜的结构与功能。因此,常以MDA含量作为判断膜脂过氧化作用的重要指标[16]。本研究中,随着水分胁迫程度的加深,6个杨树无性系(种)的相对电导率和MDA含量显著升高,说明水分胁迫下杨树幼苗代谢发生一定程度的紊乱,膜脂过氧化作用加剧,细胞膜受到伤害,膜结构发生变化,导致大量离子外渗。但上升的幅度各不一样,显示了各无性系(种)在干旱条件下的膜脂过氧化防御系统能力不一致。水分胁迫Ⅰ和Ⅱ下叶片相对电导率增幅最大的是07-西大寨×卜1,说明其在干旱条件下膜透性较大;增幅最小的是07-69×青1,说明其在干旱条件下膜透性较小。水分胁迫Ⅰ和Ⅱ下叶片丙二醛含量增幅最大的是07-西大寨×卜1,说明其在干旱条件下膜脂过氧化程度较重;增幅最小的是06-57×川1,说明其在干旱条件下膜脂过氧化程度较轻。
3.3 干旱胁迫对杨树无性系(种)渗透调节物质的影响
干旱条件下植物体内积累游离氨基酸,对降低渗透势均有一定的贡献。其广泛存在于植物体内,主要作为一种亲和性渗透物质,累积于细胞质中。但是关于对脯氨酸的研究,目前存在一定的争议,在国外部分学者认为脯氨酸积累数量与抗旱性有关,但是也有研究表明二者之间关系并不显著[17-20]。本研究中,随着水分胁迫程度的加深,6个杨树无性系(种)的脯氨酸含量显著升高,说明杨树体内脯氨酸对干旱胁迫有明显反应,这与范苏鲁[21]在大丽花中的研究结果基本一致。脯氨酸含量升高是杨树体内细胞主动积累溶质的一种信号,可以使渗透势降低,从外界低水势介质中继续吸水,保持一定程度的细胞膨压,维持代谢活动的进行。但上升的幅度各不一样,显示了各无性系(种)在干旱条件下积累溶质和维持膨压的能力不一致。水分胁迫Ⅰ和Ⅱ下叶片脯氨酸增幅最大的是07-69×青1,说明其在干旱条件下细胞维持膨压能力较强;增幅最小的是06-57×川1,说明其在干旱条件下细胞维持膨压能力较弱。
植物体内的可溶性蛋白质大多是参与各种代谢的酶类,在受到干旱胁迫时,它们会发生一定的变化,测定其含量是了解植物抗逆性的一个重要指标[22]。研究发现干旱促进蛋白质降解或抑制蛋白质合成,导致总蛋白含量下降[10]。本研究中,随着水分胁迫的加剧,6个杨树无性系(种)的可溶性蛋白含量逐渐降低,说明蛋白质可能合成受阻或者发生了降解,部分转化为氨基酸,用于增加渗透物质从而降低渗透势。这与杜金伟[23]等在山杏上研究结果基本一致。但下降的幅度各不一样,显示了各无性系(种)在干旱条件下蛋白质的调节能力不一致。对于本研究中6个无性系(种)幼苗在水分胁迫下是否合成了新的蛋白质,有待进一步探索。水分胁迫Ⅰ和Ⅱ下可溶性蛋白质降幅最大的是07-西大寨×卜1,说明其蛋白质调节能力受干旱影响较大;降幅最小的是陕林4号,说明其蛋白质调节能力受干旱影响较小。
3.4 干旱胁迫对杨树无性系(种)保护酶活性的影响
研究表明,SOD、POD活性与植物抗逆性相关。在适度逆境诱导下,SOD、POD活性增加,以提高植物适应力。在胁迫试验中,酶活性一般随胁迫增加而增加,或者呈先增加后降低的趋势[24-25]。本研究中,水分胁迫下6个杨树无性系(种)的2种保护酶活性先上升后下降,说明在一定干旱胁迫范围内,通过酶活性增加来提高适应干旱胁迫的能力,但是当胁迫超出忍耐范围后,保护酶活性开始下降,无法有效地清除活性氧,从而造成了膜脂过氧化使膜系统受到了破坏,MDA含量升高,同时MDA累积又抑制了SOD、POD的活性,从而逐渐丧失保护酶系统的功能,使膜系统损伤严重,间接证明杨树忍耐干旱胁迫的能力是有限的。但是变化的幅度不一样,显示在干旱胁迫下酶促保护体系清除活性氧的能力不一致。水分胁迫Ⅰ和Ⅱ下叶片酶活性增幅最大的是陕林4号,说明其在干旱胁迫下清除活性氧的能力较强;增幅最小的是中绥12,说明其在干旱胁迫下清除活性氧的能力较弱。
[1] 苏晓华,黄秦军,张冰玉,等.中国杨树良种选育成就及发展对策[J].世界林业研究,2004,17(1):46-49.SU X H,HUANG Q J,ZHANG B Y,et al.The achievement and developing strategy on variety selection and breeding of poplar in China [J].World Forestry Research,2004,17(1):46-49.(in Chinese)
[2] 樊军锋,周永学,高建社,等.陕西杨树育种历史及展望[J].西北林学院学报,2004,19(2):77-81.FAN J F,ZHOU Y X,GAO J S,et al.Historical review of populus breeding achievements of Shaanxi Province and its future breeding strategy[J].Journal of Northwest Forestry U-niversity,2004,19(2):77-81.(in Chinese)
[3] 冯玉龙,巨关升,朱春全.杨树无性系幼苗光合作用和PV水分参数对水分胁迫的响应[J].林业科学,2003,39(3):30-36.FENG Y L,JU G S,ZHU C Q.Responses of photosynthesis and PV-Parameters water stress in poplar clone seedings[J].Scientia Silvae Sinicae,2003,39(3):30-36.(in Chinese)
[4] 尹春英,李春阳.杨树抗旱性研究进展[J].应用与环境生物学报,2003,9(6):662-668.YIN C Y,LI C Y.Advance in research on drought resistance of populus[J].China J.Appl.Environ.Biol.,2003,9(6):662-668.(in Chinese)
[5] 何承忠,张志毅,安新民,等.我国杨树育种现状及其展望[J].西南林学院学报,2006,26(4):86-89.HE C Z,ZHANG Z Y,AN X M,et al.Present situation and prospect to poplar breesding in China[J].Journal of Southwesr Forestry College,2006,26(4):86-89.(in Chinese)
[6] 杨建伟,韩蕊莲,刘淑明,等.不同土壤水分下杨树的蒸腾变化及抗旱适应性研究[J].西北林学院学报,2004,19(3):7-10.YANG J W,HAN R L,LIU S M,et al.Transpiration and drought resistance of poplar under different soil drought[J].Journal of Northwest Forestry University,2004,19(3):7-10.(in Chinese)
[7] 杨敏生,裴保华,朱之悌.白杨双交杂种无性系抗旱性鉴定指标分析[J].林业科学,2002,38(6):36-42.YANG M S,PEI B H,ZHU Z T.Index analysis on comprehensive judgement of drought resistance ability of white poplar hybrid clones[J].Scientia Silvae Sinicae,2002,38(6):36-42.(in Chinese)
[8] 高俊凤.植物生理学试验技术[M].北京:高等教育出版社,2000:137-202.
[9] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000:258-260.
[10] 周媛,徐冬云,董艳芳,等.9种轻型屋顶绿化景天属植物的抗旱性研究[J].中国农学通报,2012,28(25):294-301.ZHOU Y,XU D Y,DONG Y F,et al.Study on drought resistance of 9 Sedums for light roof greening[J].Chinese Agricultural Science Bulletin,2012,28(25):294-301.(in Chinese)
[11] 高建社,王军,周永学,等.5个杨树无性系抗旱性研究[J].西北农林科技大学学报:自然科学版,2005,33(2):112-116.GAO J S,WANG J,ZHOU Y X,et al.Studies on droughtresistance of five poplar clones [J].Journal of Northwest A&F University:Nat.Sci.Ed.,2005,33(2):112-116.(in Chinese)
[12] 杨敏生,梁海永,王进茂,等.水分胁迫下白杨双交杂种无性系苗木生长研究[J].河北农业大学学报,2002,25(4):1-6.YANG M S,LIANG H Y,WANG J M,et al.Study on seedling growth of white poplar hybrid clones under the conditions of water stress[J].Journal of Agricultural University of Hebei,2002,25(4):1-6.(in Chinese)
[13] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.PEI B,ZHANG G C,ZHANG S Y,et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoides Linn.seesdings[J].Acta Ecological Sinica,2013,33(5):1386-1396.(in Chinese)
[14] 王莺璇,雷江丽,王有国.7种百合科园林地被植物抗旱性研究[J].安徽农业科学,2012,40(26):12979-12983,13007.WANG Y X,LEI J L,WANG Y G.Study on the drought resistance of seven ground-cover plants of Liliaceae[J].Journal of Anhui Agri.Sci.,2012,40(26):12979-12983,13007.
[15] 胡新生,王世绩.树木水分胁迫生理与耐旱性研究进展及展望[J].林业科学,1998,34(2):79-91.HU X S,WANG S J.A review of studies on water stress and drought tolerance in tree species[J].Scientia Silvae Sinicae,1998,34(2):79-91.(in Chinese)
[16] HODGES D M,DELONG J M,FOMEY C F,et al.Improving the thiobarbituric acid-reactive-substance assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207:604-611.
[17] 陈敏,陈亚宁,李卫红,等.塔里木河中游地区3种植物的抗旱机理研究[J].西北植物学报,2007,27(4):4747-4754.CHEN M,CHEN Y N,LI W H,et al.Drought resistance mechanism of three plant species in the middle reaches of Tarim River China [J].Acta Bot.Boreal.-Occident.Sin.,2007,27(4):4747-4754.(in Chinese)
[18] 曹帮华,张明如,翟明普,等.土壤干旱胁迫下刺槐无性系生长和渗透调节能力[J].浙江林学院学报,2005,22(2):161-165.CAO B H,ZHANG M R,ZHAI M P,et al.Growth and osmotic adjustment of Robinia pseudoacacia clones under drought stress [J].Journal of Zhejiang Forestry College,2005,22(2):161-165.(in Chinese)
[19] 赵瑞雪,朱慧森,程钰宏,等.植物脯氨酸及其合成酶系研究进展[J].草业科学,2008,25(2):90-97.ZHAO R X,ZHU H S,CHENG Y H,et al.Research pro-gress on proline and its biosynthesis enzymes in plant[J].Pratacultural Science,2008,25(2):90-97.(in Chinese)
[20] ZHANG J X,NGUYEN HT,BLUM A.Genetic analysis of osmotic adjustment in crop plants[J].Journal of Experimental Botany,1999,50:291-302.
[21] 范苏鲁,苑兆和,冯立娟,等.干旱胁迫对大丽花生理生化指标的影响[J].应用生态学报,2011,22(3):651-657.FAN S L,YUAN Z H,FENG L J,et al.Effects of drought stress on physiological and biochemical parameters of Dahlia pinnata [J].Chinese Journal of Applied Ecology,2011,22(3):651-657.(in Chinese)
[22] 王海珍.黄土高原四个乡土树种耗水规律与抗旱特性的研究[D].杨陵:西北农林科技大学,2003.
[23] 杜金伟,崔世茂,金丽萍,等.水分胁迫对山杏渗透调节物质积累及保护酶活性的影响[J].内蒙古农业大学学报:自然科学版,2009,30(2):88-93.DU J W,CUI S M,JIN L P,et al.Effects of water stress on activity of cell protective enzymes and osmotic adjustment in Ameniaca sibirica [J].Journal of Inner Mongolia Agricultural University:Nat.Sci.Ed.,2009,30(2):88-93.(in Chinese)
[24] 陈少瑜,郎南军,贾利强,等.干旱胁迫对坡柳等抗旱树种幼苗膜脂过氧化及保护酶活性的影响[J].植物研究,2006,26(1):89-93.CHEN S Y,LANG N J,JIA L Q,et al.Effects of drought stress on lipid peroxidation and activity of defense enzymes of Dodonaea viscosa,Leucaena leucocephala and Tephrosia candida seedlings[J].Bulletin of Botanical Research,2006,26(1):89-93.(in Chinese)
[25] 张文辉,段宝利,周建云,等.不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J].植物生态学报,2004,28(4):483-490.ZHANG W H,DUAN B L,ZHOU J Y,et al.Water relations and activity of cell defense enzymes to water stress in seesling leaves of different provenances of Quercus Variabiis[J].Acta Phytoecologica Sinica,2004,28(4):483-490.(in Chinese)

