草地藏系绵羊生长激素释放激素基因部分cDNA的克隆及生物信息学分析
王金玲, 王 永, 刘鲁蜀, 陶永平
(1.绵阳师范学院,四川 绵阳 621000;2.西南民族大学青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都610041;3.西南民族大学 生命科学与技术学院,四川 成都 610041;4.四川省若尔盖县畜牧局,四川 若尔盖 624500)
动物生长是一个复杂的生物代谢过程,这个过 程受基因型、激素、营养和环境等因素的共同影响。激素作为生物体内的一种化学信息,对机体的生长发育、代谢、繁殖和衰老等生命过程起着重要的调控作用。神经内分泌生长轴,又称脑垂体生长轴,在动物的生长发育过程中发挥重要的调节作用。下丘脑分泌的生长抑素(Somatostatin,SS)和生长激素释放激素(Growth hormone releasing hormone,GHRH)、垂体分泌的生长激素(Growth hormone,GH)、调节靶器官(如肝脏)分泌的生长激素受体(Growth hormone receptor,GHR)如胰岛素样生长因子(Insulinlike growth factor-I,IGF-I)等构成了动物下丘脑-垂体-靶器官作用通路的基本内容[1]。
作为垂体生长激素(Growth hormone,GH)的正向调控因子,GHRH能促进垂体合成和分泌生长激素GH[2]。目前,已有多例关于GHRH基因克隆的报道。Meng等[3]构建了羊生长激素释放激素的肌肉注射表达质粒,通过一次性简单肌肉注射这种质粒可以提高羊的生长速度,促进体质量增加。汪以真等[4]用反转录-聚合酶链式反应(RT-PCR)对猪下丘脑促生长激素释放激素(GHRH)cDNA扩增,得到猪GHRH基因cDNA编码区序列。Kazmer等[5]对普通牛GHRH全基因测序得到全长9 356 bp的片段。欧江涛等[6]对牦牛GHRH基因进行PCR产物T-A克隆测序。马志杰[7]等克隆了欧拉型藏羊GHRH基因内含子2的部分序列并进行了HaeIII-RFLP分析。另外,人、金地鼠、猪、马、鸡、南方鲇鱼、斑马鱼等物种的 GHRH基因也相继得到克隆[8-9]。藏系绵羊是我国青藏高原特有的畜种之一,也是中国粗毛羊中的一个地方原始品种,具有耐高寒、耐粗饲料、适应性强等特点[10]。国内一些学者对其已有较为系统的研究,但多数集中于传统生物学及遗传多样性方面[11-13]。草地藏系绵羊 GHRH基因的cDNA克隆还未见报道。
本研究以草地藏系绵羊生长激素释放激素基因(GHRH)作为研究目标,通过组织提取RNA反转录cDNA进行克隆、测序并对其核苷酸序列进行比较分析,为进一步从分子水平上阐明草地藏系绵羊生长特性提供理论依据。
1 材料与方法
1.1 试验动物及样品采集
提取总RNA所用的成年藏系绵羊的下丘脑组织采自四川省阿坝藏族自治州若尔盖县,屠宰后30 min内采集3头藏系绵羊的下丘脑组织,迅速放入液氮中保存,带回实验室,-80℃冰箱保存备用。
1.2 主要试剂
Trizol,TaKaRa RNA PCR Kit(AMV)Ver.3.0,Taq DNA 聚合酶、dNTPs、DNA Marker,pMD18-T Vector,IPTG,X-gal,胶回收(小量)试剂盒。
1.3 藏系绵羊下丘脑组织总RNA的提取和检测
采用Trizol试剂提取下丘脑组织总RNA,用琼脂糖凝胶电泳检测所获得的RNA。用紫外分光光度计分析RNA浓度和质量。
1.4 引物设计
根据NCBI数据库中普通牛的基因(NCBI Genbank登陆号:NM178325),应用primer5.0软件设计引物,该引物为:上游引物:5'-GCTAAGTGTCTACAGCCTTGCAG-3',下 游 引 物:5'-CAGCCCTTATCACTCTCTGGA-3',预期扩增片段长度340 bp。引物由大连宝生物工程有限公司合成。
1.5 藏系绵羊GHRH基因的RT-PCR
RT-PCR 反应体系:反应总体积10.00 μl,MgCl2(25 mmol/L)2.00 μl,10 × RT-Buffer 1 μl,dNTP(10 mmol/L)1 μl,RNase free dH2O 2.75 μl,RNase Inhibitor(40 U/μl)0.25μl,AMV(5 U/μl)0.50 μl,Oliglt dT-Adaptor Primer(2.5 U/μl)0.50 μl,RNA样品2.00 μl。RT-PCR反应条件:50℃ 30 min;99℃ 5 min;5℃ 5 min,所获得的cDNA在4℃下保存。
PCR反应体系:反应总体积为40 μl:5×Buffer 10.00 μl,灭菌水23.75 μl,Ex Taq HS(5 U/μl)0.25 μl,上 游 引 物 (20 pmol/L)0.50 μl,下 游 引 物 (20 pmol/L)0.50 μl,cDNA 5.00 μl。PCR 反应条件:95℃ 2 min;95 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min 10 s,30个循环;72℃ 4 min,4℃保存。产物用1%的琼脂糖凝胶电泳,EB染色,凝胶成相系统拍照检测。
1.6 藏系绵羊GHRH基因扩增片段的克隆测序
PCR产物用琼脂糖凝胶电泳,电泳条带经割胶并回收纯化,取1.5 μl加入到0.5 μl载体 PMD-18 Vector中,然后加入 SolutionⅠ 5.0 μl,灭菌水 3.0 μl,混匀,反应总体积 10.00 μl,16 ℃水浴 3 h。将10 μl连接产物转化到200 μl E.coli.JM109 感受态宿主菌中。取100 μl转化产物涂在含氨苄、IPTG和X-Gal LB平板上,挑取白色菌斑培养,同时用未转化的菌液作阴性对照。用试剂盒抽提质粒,送上海基康生物技术有限公司进行测序。
2 结果
2.1 藏系绵羊下丘脑总RNA的提取
对提取的藏系绵羊下丘脑总RNA样品进行测定,其中1号样品 RNA OD260=0.231,OD280=0.132,OD260/OD280=1.750;2号样品 RNA OD260=0.220,OD280=0.132,OD260/OD280=1.667。电泳分析显示,用Trizol试剂提取的藏系绵羊下丘脑总RNA的28S和18S条带清楚,可用于RT-PCR(图1)。

图1 草地藏系绵羊下丘脑组织总RNA琼脂糖电泳图Fig.1 Total RNA from Tibetan sheep hypothalamus revealed by agarose gel electrophoresis
2.2 藏系绵羊GHRH基因RT-PCR
因未见报道绵羊GHRH基因mRNA的CDS全序列,故根据普通牛GHRH基因序列设计的引物期望能很好地扩增出藏系绵羊GHRH基因,获得的基因目的片段为200 bp左右,没有杂带(图2)。
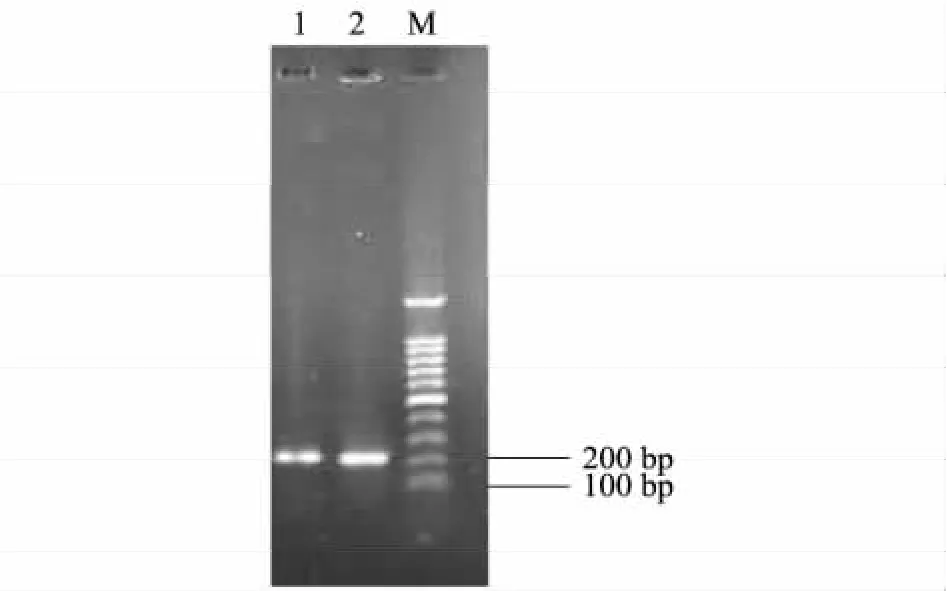
图2 草地藏系绵羊下丘脑组织GHRH基因RT-PCR琼脂糖电泳结果Fig.2 GHRH cDNA from Tibetan sheep hypothalamus by RT-PCR
2.3 藏系绵羊下丘脑组织GHRH基因重组子PCR结果
用重组子PMD18-T Vecter-GHRH转化后的重组子进行PCR扩增,鉴定目的片段是否已经连接到载体上,并用未转化的重组子做阴性对照,结果如图3。

图3 草地藏系绵羊下丘脑组织GHRH基因重组子PCR扩增琼脂糖电泳鉴定结果Fig.3 Ⅰdentification of GHRH cDNA from Tibetan sheep hypothalamus by PCR
2.4 藏系绵羊下丘脑组织GHRH基因测序结果及生物信息学分析
将连接到载体上的目的片段进行测序。结果显示,目的cDNA片段全长207 bp,编码了69个氨基酸残基。cDNA片段的序列为:5'-ATGCTGCTCT GGGTGTTCTTCCTCGTGACCCTCACCCTCAGCAGCGGCTCCCAAGGTTCCCTGCCCTCCCAGCCTCTCAGGATCCCAAGGTACGCAGATGCCATCTTCACTAACAGCTACCGGAAGATTCTGGGCCAGCTGTCTGCCCGCAAGCTACTCCAGGATATCATGAACAGGCAGCAGGGAGAGAGAAACCAGGAGCAAGGAA-3'。氨基酸残基序列分别为:MLLWVFFLVTLTLSSGSQGSLPSQPLRIPRYADAI FTNSYRKILGQLSARKLLQDIMNRQQGERNQEQG
2.4.1 草地藏系绵羊与绵羊生长激素释放激素基因(GHRH)部分序列比较 通过NCBI中的Blast程序分析,将草地藏系绵羊GHRH基因部分片段测序结果与GenBank中注册的绵羊GHRH基因(XM_004014558)相应序列进行比对分析。结果(图4)表明,草地藏系绵羊编码起始位置(86位)到292位区域与绵羊的该段序列间高度同源,共发现1处序列碱基差异,为1次碱基颠换(即A—C颠换)。
2.4.2 草地藏系绵羊生长激素释放激素基因(GH-RH)部分序列编码的氨基酸序列分析 通过Vectoer-NT1软件分析发现,该cDNA片段编码的氨基酸残基序列与其比对基因序列所编码的部分氨基酸序列一致,这里体现了密码子的简并性。
对所得氨基酸残基序列进行信号肽预测,发现在此区域存在信号肽,可推测若获得完整的CDS框编码的蛋白应属于分泌蛋白,且剪切位点位于第20个氨基酸残基位置(图5)。利用SMART程序对推导的氨基酸序列进行功能结构域在线分析,表明在该序列的31~57位具有典型的 GLUCA结构域(图6),GLUCA具有典型的胰高血糖素类似激素的特征。

图4 利用Blast程序所预测的草地藏系绵羊GHRH基因核苷酸序列与绵羊GHRH基因(XM_004014558)的同源性比较Fig.4 The alignment of the nucleotide sequence of GHRH gene from Tibetan sheep and the putative GHRH gene from sheep(XM_004014558)

图5 草地藏系绵羊GHRH基因编码的氨基酸残基序列中含有信号肽Fig.5 The signal peptide in the predicted amino acid residues
3 讨论
本试验应用RT-PCR技术,根据已报道的牛GHRH基因cDNA序列设计引物(在本试验设计之初还未见GenBank中注册绵羊GHRH基因cDNA全序列),首次从草地藏系绵羊下丘脑中克隆了GHRH基因部分cDNA,长度为207 bp。通过Blast比较分析发现,草地藏系绵羊与已报道普通绵羊GHRH cDNA序列间仅有1个碱基的差异,与普通牛序列也只有5个碱基的差异;将草地藏系绵羊GHRH基因部分片段与GenBank中登陆的人、鼠、马、猪、黑猩猩等物种GHRH基因cDNA成熟肽编码区序列进行比较。人与黑猩猩间GHRH基因的同源性为99.56%;黑猩猩和金地鼠间GHRH基因同源性为78.26%;草地藏系绵羊GHRH基因部分cDNA与人和黑猩猩的同源性为96.62%,与猪和金地鼠的同源性97.1%,与马的同源性为98.1%。可见,GHRH基因在物种内品种间和近缘种间有较高的同源性,而在关系较远的物种间也存在变异。关于GHRH氨基酸序列比对的结果发现,其无论是在种内还是种间都是高度保守的。一系列的Blast比较分析结果表明,GHRH基因在物种间和物种内既存在保守性也存在变异性,反映了其在起源进化过程中的一些特点。

图6 利用SMART程序推导出草地藏系绵羊GHRH基因编码的氨基酸序列含有GLUCA结构域Fig.6 The deduced GLUCA domain in amino acid sequence using SMART program
对草地藏系绵羊经济性状功能基因的研究,目前还处于刚起步阶段。同时,鉴于GHRH基因在影响动物生长发育速度、瘦肉率等方面具有重要作用,本研究认为,还应对草地藏系绵羊GHRH基因的结构、表达调控和定位等方面做大量的分析研究。草地藏系绵羊GHRH基因的部分cDNA序列的获得,为我们进一步对该基因cDNA全长的克隆奠定了基础,今后计划通过3'-RACE和5'-RACE技术获得草地藏系绵羊GHRH基因cDNA全长序列,进而研究其功能。
[1] 刘建文,施用晖,乐国伟.动物生长轴的激素调控[J].中国饲料,2003(14):7-9.
[2] SHALLY A V.Struture of the porcine LH and FSH-releasing hormone confirmation of the proposed structure by conventional sequential analyses[J].Biochem BioPhy Res Commun,1971,44(1):459-463.
[3] MENG Q Y,CHEN Z Q,YU Z Q,et al.Increased body weight viamyogenic expression of injectable growth hormone-releasing hormone(GHRH)plasmid with bupivacaine as adjuvant in sheep[J].Animal Biotechnology,2004,15(2):175-192.
[4] 汪以真,颜新春,余东游.猪下丘脑促生长激素释放激素(GHRH)基因克隆及序列分析[J].浙江大学学报,2000,26(3):277-279.
[5] KAZMER G W,ZINN S A,STRAUSBAUGH L D.Short communication:growth hormone response to somatostatin-28 and growth hormone-releasing factor in dairy heifers[J].Journal of Dairy Science,2000 ,83(10):2282-228.
[6] 欧江涛,钟金城,赵益新.牦牛生长激素释放激素基因的克隆及序列分析[J].四川畜牧兽医,2003,29(2):9-12.
[7] 马志杰,魏雅萍,钟金城,等.藏绵羊GHRH基因部分片段的克隆及 HaeⅢ-RFLP分析[J].河南农业科学,2008(2):95-98.
[8] 魏 玲,程道军,王志坚.南方鲇促生长激素释放激素基因部分cDNA克隆及序列分析[J].西南师范大学学报,2008,33(3):57-62.
[9] FRADINGER E A,SHERWOOD N M.Characterization of the gene encoding both growth hormone-releasing hormone(GRF)and pituitary adenylate cyclase-activating polypeptide(PACAP)in the zebra fish[J].Molecular and Cellular Endocrinology,2000,165:211-219.
[10]王 杰,王 永.草地养羊学[M].成都:四川教育出版社,1993.
[11]赵亚力.藏系绵羊染色体的显带研究[J].畜牧兽医学报,1989,20(4):315-316.
[12]卫学承,徐振帮.藏系绵羊染色体的研究[J].青海畜牧兽医杂志,1991,20(4):4-6.
[13]冯 政.藏羚、藏绵羊、藏山羊mtDNA D-Loop区序列变异与系统发生关系的研究[D].武汉:华中农业大学,2004.

